《镁铝及其化合物》PPT课件
合集下载
高中化学专题复习-镁和铝的单质及其化合物.ppt

一、镁和铝的性质
镁
铝
结
周期表 中位置
第三周期ⅡA族
第三周期ⅢA族
金属性
镁强于铝
构 单质的 还原性
镁强于铝
共性:密度小熔点较低,硬度较小银
物理性质 白色金属.
不同点:Al的上述性质都比镁略高.
1.跟O2及 其它非金
2Mg+O2=2MgO
属反应 3Mg+N2=Mg3N2
4Al+3O2=2Al2O3 2Al+3S=Al2S3
Al(OH)3显酸性.
▪ Al(OH)3溶解度很小,无论酸式或碱式电离 的程度都很小,其碱性略强于酸性,故仍
属于弱碱.
重要的铝盐:
▪ 明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O] ▪ 结构:硫酸铝钾是由两种不同的金属离子和一种
酸根离子组成的化合物,它电离时能产生两种金 属的阳离子,是一种复盐。
▪
Al3++3AlO2-+6H2O = 4Al(OH)3↓
③有关图像:
n(沉淀)
O
n(AlCl3)
五、课堂练习:
2.跟某些 2Mg + CO2 =
2Al+Fe2O3=2Fe+Al2O3
化 氧化物
2MgO + C
(铝热反应)
学 3.跟水反 Mg + 2H2O =
性
应 Mg(OH)2 + H2↑
质
(冷水慢,沸水快)
很难反应
4.跟酸的 Mg + 2H+ =
反应
Mg2+ + H2↑
2Al+6H+=3Al3++3H2↑ (在浓H2SO4、浓HNO3 中钝化)
镁
铝
结
周期表 中位置
第三周期ⅡA族
第三周期ⅢA族
金属性
镁强于铝
构 单质的 还原性
镁强于铝
共性:密度小熔点较低,硬度较小银
物理性质 白色金属.
不同点:Al的上述性质都比镁略高.
1.跟O2及 其它非金
2Mg+O2=2MgO
属反应 3Mg+N2=Mg3N2
4Al+3O2=2Al2O3 2Al+3S=Al2S3
Al(OH)3显酸性.
▪ Al(OH)3溶解度很小,无论酸式或碱式电离 的程度都很小,其碱性略强于酸性,故仍
属于弱碱.
重要的铝盐:
▪ 明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O] ▪ 结构:硫酸铝钾是由两种不同的金属离子和一种
酸根离子组成的化合物,它电离时能产生两种金 属的阳离子,是一种复盐。
▪
Al3++3AlO2-+6H2O = 4Al(OH)3↓
③有关图像:
n(沉淀)
O
n(AlCl3)
五、课堂练习:
2.跟某些 2Mg + CO2 =
2Al+Fe2O3=2Fe+Al2O3
化 氧化物
2MgO + C
(铝热反应)
学 3.跟水反 Mg + 2H2O =
性
应 Mg(OH)2 + H2↑
质
(冷水慢,沸水快)
很难反应
4.跟酸的 Mg + 2H+ =
反应
Mg2+ + H2↑
2Al+6H+=3Al3++3H2↑ (在浓H2SO4、浓HNO3 中钝化)
高考化学一轮复习-镁、铝及其化合物课件(109张)

课
科 素 养
⑤_F_e_2_O_3_+__2_A_l_=_高=_=_温=_=__2_F_e_+__A_l_2O__3____
后 限
应
时
用 创 新
⑥_2_A_l_+__3_C_u__S_O_4_=_=_=_3__C_u_+__A__l2_(_S_O_4_)_3 __
集 训
·
返 首 页
24
3.铝热反应实验探究
真 题 验 收
__2_M_g_O__+__C__。现象为:剧烈燃烧,发出强烈的光,同时有白色固
学
课
科 素
体和黑色固体生成。
后
养
限
应 用
时
创
集
新
训
返 首 页
·
7
·
必 备
2.从海水中提取镁
课 堂
知
反
识 关
(1)工艺流程
·
馈 真
键
题
能
验
力
收
学
课
科 素
后
养
限
应 用
时
创
集
新
训
返 首 页
·
8
(2)基本步骤及主要反应
课 后
养
限
应 用 创 新
①2Mg+O2=点==燃==2MgO、②Mg+Cl2=点==燃==MgCl2、
时 集 训
③3Mg+N2=点==燃==Mg3N2。
返
首
页
·
5
·
必 备 知
(2)与水或酸的反应
课 堂 反
识
馈
关 键
①镁与水的反应:镁不易与冷水反应,能与沸水反应,反应的 真 题
·
镁铝及其化合物1.ppt
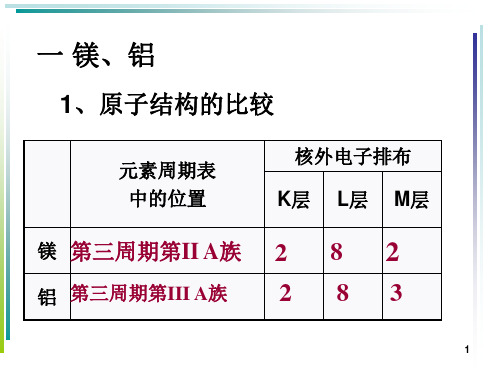
一 镁、铝
1、原子结构的比较
元素周期表 中的位置
核外电子排布 K层 L层 M层
镁 第三周期第II A族 2 8 2
铝 第三周期第III A族
2 83
1
2、物理性质的比较
相似点:均为 银白色 ;均为 轻金属 ; 熔点均 较低 ;硬度均 较小。都具有金属的 通性 不同点:镁在密度、熔点、沸点、硬度上 均 小于(或低于) 铝。
D.反应速率之比为2∶3
【解析】由关系式:Mg~H2,2Al~3H2,可知产生 等量H2时,消耗Mg、Al物质的量之比为3∶2,故A 项 正 确 。 二 者 质 量 之 比 为 4∶3 , 摩 尔 质 量 之 比 为
8∶9,反应速率之比为3∶2。
25
二、“铝三角”及其应用
1.“铝三角”是指Al3+、Al(OH)3和AlO2-相 互转化的三角关系(如下图)
分析依据:
2Al+6HCl === 2AlCl3+3H2↑ 2Al~6HCl~3H2↑
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2Al~2NaOH~3H2↑
【思考】
1.等质量的铝分别与足量的盐酸、氢氧化钠溶液反应,
所得H2的体积之比是多少? VHCl(H2):VNaOH(H2)=1:1
共存
②AlO2-不能与 H+、HCO3-(直接反应); Al3+、NH4+、 Fe3+(双水解)大量共存 28
即时巩固
4、某无色溶液中加入铝粉只产生氢气,则下列离子
组中可能大量共存的是 ( C D )
A.K+ 、NH4+、Cl- 、NO3- B.K+、Na+、Cl-、HCO3C.K+、NH4+、Cl-、SO42- D.K+、CO32-、Cl-、SO325、某无色透明溶液跟金属Al反应,放出H2。试判断 下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、 OH-、 CO32-、HCO3-、NO3-,下列两种情况能存在此溶液中。 当生成Al3+时,可能存在 __H_+_、__M__g_2_+_、__S_O_4_2- 当生成AlO2-时,可能存在_O__H_-_、__B__a_2_+、__N_ O3_-_ 29
1、原子结构的比较
元素周期表 中的位置
核外电子排布 K层 L层 M层
镁 第三周期第II A族 2 8 2
铝 第三周期第III A族
2 83
1
2、物理性质的比较
相似点:均为 银白色 ;均为 轻金属 ; 熔点均 较低 ;硬度均 较小。都具有金属的 通性 不同点:镁在密度、熔点、沸点、硬度上 均 小于(或低于) 铝。
D.反应速率之比为2∶3
【解析】由关系式:Mg~H2,2Al~3H2,可知产生 等量H2时,消耗Mg、Al物质的量之比为3∶2,故A 项 正 确 。 二 者 质 量 之 比 为 4∶3 , 摩 尔 质 量 之 比 为
8∶9,反应速率之比为3∶2。
25
二、“铝三角”及其应用
1.“铝三角”是指Al3+、Al(OH)3和AlO2-相 互转化的三角关系(如下图)
分析依据:
2Al+6HCl === 2AlCl3+3H2↑ 2Al~6HCl~3H2↑
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2Al~2NaOH~3H2↑
【思考】
1.等质量的铝分别与足量的盐酸、氢氧化钠溶液反应,
所得H2的体积之比是多少? VHCl(H2):VNaOH(H2)=1:1
共存
②AlO2-不能与 H+、HCO3-(直接反应); Al3+、NH4+、 Fe3+(双水解)大量共存 28
即时巩固
4、某无色溶液中加入铝粉只产生氢气,则下列离子
组中可能大量共存的是 ( C D )
A.K+ 、NH4+、Cl- 、NO3- B.K+、Na+、Cl-、HCO3C.K+、NH4+、Cl-、SO42- D.K+、CO32-、Cl-、SO325、某无色透明溶液跟金属Al反应,放出H2。试判断 下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、 OH-、 CO32-、HCO3-、NO3-,下列两种情况能存在此溶液中。 当生成Al3+时,可能存在 __H_+_、__M__g_2_+_、__S_O_4_2- 当生成AlO2-时,可能存在_O__H_-_、__B__a_2_+、__N_ O3_-_ 29
化学课件《镁和铝的重要化合物》优秀ppt 人教课标版

无色晶体,易溶于水,在空气中易吸潮,味 苦。氯化镁的六水合物晶体MgCl2·6H2O是制 取镁的原料。
从海水中提取镁的过程是: 在海水中加入石灰,过滤,沉淀中加入盐酸, 反应完成后进行结晶,晶体在熔融状态下进 行电解,得到镁。
请写出以上过程的化学反应方程式。
练习:
1.氧化镁常用来制耐火材料,这是利用上氧化镁:
(2)氢氧化铝与酸碱反应时,弱酸弱 碱是不能把氢氧化铝溶解的。
3、硫酸铝钾( KAl(SO4)2 )
复盐的概念: 由两种不同的金属离子和一种酸根离子组
成的盐叫复盐。
思考:复盐是纯净物还是混和物?
硫酸铝钾的电离: KAl(SO4)2 = K++ Al3+ + 2SO42溶液中有三种自由移动的离子,两种阳离
A.是碱性氧化物
B.与水化合成碱
C.高熔点
D.不易分解
2.用海水加石灰来提取Mg(OH)2是利用了Mg(OH)2的 性质:
A.溶解度比Ca(OH)2的小 B.不稳定受热分解生成MgO
C.碱性比Ca(OH)2的弱 D.白色粉末状固体
二、铝的重要化合物
1、氧化铝(Al2O3) (1)物理性质:
白色固体、熔点高、不溶于水,不与水化合。 (2)化学性质: ①与酸反应:Al2O3+6HCl=AlCl3+3H2O ②与碱反应:Al2O3+2NaOH=2NaAlO2+H2O
镁和铝的重要化合物
一、镁的重要化合物
镁在自然界的化合态存在主要矿物有光卤石 (KCl·MgCl·6H2O)菱镁矿(MgCO3)、白云石 (CaCO3·MgCO3)、橄榄石(Mg2SiO4)硫酸镁、 滑石、石棉等。海水里含有大量的MgCl2、 MgSO4。
1、氧化镁(MgO)
高中化学第三章第3讲镁铝及其化合物课件新人教.ppt

化的三角关系。根据“铝三角”完成对应的离 子方程式。
(1)Al3+
Al(OH)3
① Al3++3NH3·H2O
Al(OH)3↓+N3H
4
② Al3++A3 lO2 +6H2O
4Al(OH)3↓
③ Al3++3OH-
Al(OH)3↓
(2)Al(OH)3
Al3+
Al(OH)3+3H+
Al3++3H2O
Mg(OH)2↓
Al3++3OH-
Al(OH)3↓
Al(OH)3+OH- A lO2 +2H2O 不能,因为在Al3+与氨水反应生成Al(OH)3后,
Al(OH)3不能与氨水继续反应,从而不能将
Al(OH)3与Mg(OH)2分开
(2)Cl-、K+、A lO2 、H+、OH-、Na+ 因为
氢氧化铝能与强酸反应,所以在加入盐酸使A lO2
C.3∶4
D.4∶3
思路导引
解答本题时需明确以下三点:①Fe、Al均能与
盐酸反应产生H2;②只有Al能与NaOH溶液反 应产生H2;③根据金属与酸、碱反应生成H2的
解析 设每份Fe、Al合金样品中含铁、铝的物质
的量分别为x、y,则由Fe2HCl
H2↑,Al3HCl
3 2
H2↑N, aAOl H23
(3)Al3+
A lO2
Al3++4OH-
A lO2 +2H2O
• A lO2 A lO2 +4H+
Al3+ Al3++2H2O
(1)Al3+
Al(OH)3
① Al3++3NH3·H2O
Al(OH)3↓+N3H
4
② Al3++A3 lO2 +6H2O
4Al(OH)3↓
③ Al3++3OH-
Al(OH)3↓
(2)Al(OH)3
Al3+
Al(OH)3+3H+
Al3++3H2O
Mg(OH)2↓
Al3++3OH-
Al(OH)3↓
Al(OH)3+OH- A lO2 +2H2O 不能,因为在Al3+与氨水反应生成Al(OH)3后,
Al(OH)3不能与氨水继续反应,从而不能将
Al(OH)3与Mg(OH)2分开
(2)Cl-、K+、A lO2 、H+、OH-、Na+ 因为
氢氧化铝能与强酸反应,所以在加入盐酸使A lO2
C.3∶4
D.4∶3
思路导引
解答本题时需明确以下三点:①Fe、Al均能与
盐酸反应产生H2;②只有Al能与NaOH溶液反 应产生H2;③根据金属与酸、碱反应生成H2的
解析 设每份Fe、Al合金样品中含铁、铝的物质
的量分别为x、y,则由Fe2HCl
H2↑,Al3HCl
3 2
H2↑N, aAOl H23
(3)Al3+
A lO2
Al3++4OH-
A lO2 +2H2O
• A lO2 A lO2 +4H+
Al3+ Al3++2H2O
镁、铝及其化合物1 人教课标版精选教学PPT课件

镁、铝及其化合物
一、金属的通性
1.金属的晶体结构 金属具有一些共同性质,是由它们的原子 结构和晶体结构的相似性决定的。金属的价电子 较少,容易失去价电子变成金属离子,这些释放 出的价电子,在整个晶体内自由移动,人称“自 由电子”。金属晶体内的实际情况是“金属离子 沉浸在自由电子的海洋中”。换言之,是金属离 子和自由电子之间存在着较强的电性作用,使许 多金属离子和自由电子相互结合在一起形成晶体。
另外,加热并蒸干AlCl3的水溶液,由于AlCl3
+ 3H2O
Al(OH)3 + 3HCl 为 一 吸 热 反 应 , 且
HCl易挥发,加热会使平衡不断向右移动,AlCl3最
终 变 成 Al(OH)3 , 再 灼 烧 , 2Al(OH)3
Al2O3 +
3H2O , 最 后 留 下 的 物 质 为 Al2O3 。 而 加 热 并 蒸 干
是无色晶体,易溶于水,在水中电离的方程式
为KAl(SO4)2=K++Al3++2SO,同时发生水解
反应:Al3++3H2O
Al(OH)3+3H+,使
其水溶液显酸性。明矾水解所产生的胶状
Al(OH)3吸附能力很强,能吸附水里的杂质,并 形成沉淀,使水澄清,所以明矾常用作净水剂。
向KAl(SO4)2溶液中滴加Ba(OH)2生成的沉淀 的量判断:
铝热反应的应用:焊接钢轨,冶炼熔点 较高的金属,如:钒、铬、锰等。
4.有关Al(OH)3沉淀的图象规律
①向一定量的AlCl3溶液中逐滴加入NaOH溶液至 过量。见图(a)
有关离子方程式为Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=
+2H2O
②向一定量的NaOH溶液中逐滴加入AlCl3溶液至
一、金属的通性
1.金属的晶体结构 金属具有一些共同性质,是由它们的原子 结构和晶体结构的相似性决定的。金属的价电子 较少,容易失去价电子变成金属离子,这些释放 出的价电子,在整个晶体内自由移动,人称“自 由电子”。金属晶体内的实际情况是“金属离子 沉浸在自由电子的海洋中”。换言之,是金属离 子和自由电子之间存在着较强的电性作用,使许 多金属离子和自由电子相互结合在一起形成晶体。
另外,加热并蒸干AlCl3的水溶液,由于AlCl3
+ 3H2O
Al(OH)3 + 3HCl 为 一 吸 热 反 应 , 且
HCl易挥发,加热会使平衡不断向右移动,AlCl3最
终 变 成 Al(OH)3 , 再 灼 烧 , 2Al(OH)3
Al2O3 +
3H2O , 最 后 留 下 的 物 质 为 Al2O3 。 而 加 热 并 蒸 干
是无色晶体,易溶于水,在水中电离的方程式
为KAl(SO4)2=K++Al3++2SO,同时发生水解
反应:Al3++3H2O
Al(OH)3+3H+,使
其水溶液显酸性。明矾水解所产生的胶状
Al(OH)3吸附能力很强,能吸附水里的杂质,并 形成沉淀,使水澄清,所以明矾常用作净水剂。
向KAl(SO4)2溶液中滴加Ba(OH)2生成的沉淀 的量判断:
铝热反应的应用:焊接钢轨,冶炼熔点 较高的金属,如:钒、铬、锰等。
4.有关Al(OH)3沉淀的图象规律
①向一定量的AlCl3溶液中逐滴加入NaOH溶液至 过量。见图(a)
有关离子方程式为Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=
+2H2O
②向一定量的NaOH溶液中逐滴加入AlCl3溶液至
镁、铝及其重要化合物精品课件2021届高考化学创新复习(95张PPT)

(× )
错因:Al(OH)3 胶粒具有吸附性,可用于净水,但不能消毒。
(5)相同质量的镁条分别在足量的 CO2 和 O2 中完全燃烧,所得固体的质 量相同。( × )
错因:Mg 与 CO2 反应除 MgO 外还有固体 C 生成,得到的固
体质量大。 (6)工业上制造镁粉时,可将镁蒸气在 N2 中冷却。( × ) 错因:热的镁蒸气可与 N2 发生反应。
2.铝的化学性质
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
写出图中标号反应的化学方程式或离子方程式:
② 02 2Al+3Cl2=点==燃==2AlCl3
④ 04 ⑤ 05
2Al+2OH-+2H2O===2AlO- 2 +3H2↑ 2Al+Fe2O3=高==温==Al2O3+2Fe (铝热反应)
解析 答案
考点二 铝的性质及应用
答案
[解析] 其反应原理分别为 2Al+6HCl===2AlCl3+3H2↑,2Al+ 2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的 HCl 和 NaOH 的 物质的量一样多时,产生 H2 的体积比是 1∶3,而题设条件体积比为 1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于 NaOH 来说是
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
基础自测
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)工业电解熔融 MgCl2 得到的镁需在 CO2 气体中冷却。( × ) 错因:镁在高温下与 CO2 发生反应。 (2)常温下将铝片放入到浓硝酸或浓硫酸中没有明显现象,说明铝与这 两种溶液不能发生化学反应。( × ) 错因:铝片与浓硝酸(或浓 H2SO4)迅速反应,表面形成一层致密的
错因:Al(OH)3 胶粒具有吸附性,可用于净水,但不能消毒。
(5)相同质量的镁条分别在足量的 CO2 和 O2 中完全燃烧,所得固体的质 量相同。( × )
错因:Mg 与 CO2 反应除 MgO 外还有固体 C 生成,得到的固
体质量大。 (6)工业上制造镁粉时,可将镁蒸气在 N2 中冷却。( × ) 错因:热的镁蒸气可与 N2 发生反应。
2.铝的化学性质
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
写出图中标号反应的化学方程式或离子方程式:
② 02 2Al+3Cl2=点==燃==2AlCl3
④ 04 ⑤ 05
2Al+2OH-+2H2O===2AlO- 2 +3H2↑ 2Al+Fe2O3=高==温==Al2O3+2Fe (铝热反应)
解析 答案
考点二 铝的性质及应用
答案
[解析] 其反应原理分别为 2Al+6HCl===2AlCl3+3H2↑,2Al+ 2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的 HCl 和 NaOH 的 物质的量一样多时,产生 H2 的体积比是 1∶3,而题设条件体积比为 1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于 NaOH 来说是
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
基础自测
第10讲 镁、铝及其重要化合物 课件 2021届高考化学创新复习(共95张PPT)
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)工业电解熔融 MgCl2 得到的镁需在 CO2 气体中冷却。( × ) 错因:镁在高温下与 CO2 发生反应。 (2)常温下将铝片放入到浓硝酸或浓硫酸中没有明显现象,说明铝与这 两种溶液不能发生化学反应。( × ) 错因:铝片与浓硝酸(或浓 H2SO4)迅速反应,表面形成一层致密的
镁、铝及其化合物课件(78张)

(5)Al(OH)3 既能与稀硫酸反应又能与 NaOH 溶液反应( √ ) (6)明矾的化学式为 Al2(SO4)3·12H2O( × ) (7)下列物质的转化在给定条件下能够实现: Al2O3―NaO―H→aq NaAlO2(aq)―C―O2→Al(OH)3( √ )
题组一 Al2O3 和 Al(OH)3 的性质
应
能在 CO2 中燃烧:2Mg+ CO2=点==燃==2MgO+C
[深化] 1.铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保 护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。 2.铝与酸、碱反应的实质都是:A0l ―失―3e→- Al3+,2H+―得―2e→- H2, 只不过碱中的 H+来源于水的电离。氧化剂分别为酸和水。
[考纲要求] 1.了解镁、铝及其重要化合物的制备方法。 2.掌握镁、铝的主要性质及应用。 3.掌握镁、铝的重要化合物的主要性质及应用。
基础讲练 考点一 镁、铝的性质及应用
1.镁、铝的结构 镁和铝分别位于第三周期的ⅡA 族和ⅢA 族。它们的原子核外
均 有 3 个 电 子 层 , 其 原 子 结 构 示 意 图 分 别 为 Mg
1.下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是
() ①Ca(OH)2 ②Al2O3 ③Ca(HCO3)2 ④Al(OH)3 ⑤NaHSO4 ⑥Al ⑦(NH4)2S A.②④⑥ B.②③⑤⑥ C.①③④⑥ D.②③④⑥⑦
答案:A
3.铝对生物有毒害作用,尤其对人体的毒害更加严重。下列 说法不正确的是( )
A.不吃或少吃使用了含铝食品添加剂的食品 B.不能用铝制器皿长期存放酸性或碱性食品 C.杜绝铝制品在生产、生活中的应用 D.铝不属于重金属,它使人体中毒的原理与铅不同
解析:铝在生物体内长期积累会对神经系统等造成危害,故 A 正确;无论是铝还是其氧化物都能与酸或碱反应,故 B 正确;作为 金属材料,铝的优良性能比较多,比如导电性好、导热率高、轻便 易加工等,不能因其缺点而否定其优点,故 C 不正确;重金属使人 体中毒的原理是使蛋白质变性失活,与铝不同,故 D 正确。
题组一 Al2O3 和 Al(OH)3 的性质
应
能在 CO2 中燃烧:2Mg+ CO2=点==燃==2MgO+C
[深化] 1.铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保 护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。 2.铝与酸、碱反应的实质都是:A0l ―失―3e→- Al3+,2H+―得―2e→- H2, 只不过碱中的 H+来源于水的电离。氧化剂分别为酸和水。
[考纲要求] 1.了解镁、铝及其重要化合物的制备方法。 2.掌握镁、铝的主要性质及应用。 3.掌握镁、铝的重要化合物的主要性质及应用。
基础讲练 考点一 镁、铝的性质及应用
1.镁、铝的结构 镁和铝分别位于第三周期的ⅡA 族和ⅢA 族。它们的原子核外
均 有 3 个 电 子 层 , 其 原 子 结 构 示 意 图 分 别 为 Mg
1.下列物质既能与盐酸反应,又能与氢氧化钠溶液反应的是
() ①Ca(OH)2 ②Al2O3 ③Ca(HCO3)2 ④Al(OH)3 ⑤NaHSO4 ⑥Al ⑦(NH4)2S A.②④⑥ B.②③⑤⑥ C.①③④⑥ D.②③④⑥⑦
答案:A
3.铝对生物有毒害作用,尤其对人体的毒害更加严重。下列 说法不正确的是( )
A.不吃或少吃使用了含铝食品添加剂的食品 B.不能用铝制器皿长期存放酸性或碱性食品 C.杜绝铝制品在生产、生活中的应用 D.铝不属于重金属,它使人体中毒的原理与铅不同
解析:铝在生物体内长期积累会对神经系统等造成危害,故 A 正确;无论是铝还是其氧化物都能与酸或碱反应,故 B 正确;作为 金属材料,铝的优良性能比较多,比如导电性好、导热率高、轻便 易加工等,不能因其缺点而否定其优点,故 C 不正确;重金属使人 体中毒的原理是使蛋白质变性失活,与铝不同,故 D 正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
镁、铝及其化合物
课标要求:
1、了解铝等金属及其化合物的主要性质 2、能列举合金材料的重要应用
具体要求:
1、了解镁的性质 2、掌握铝的化学性质,了解铝的重要化合物 3、了解金属的通性,金属冶炼的一般原理 4、初步了解合金的概念和常见的金属材料
精选ppt
1
1、镁和铝的原子结构
元素
镁
原子结构示 意图
+12 2 8 2
到金属单质的一类反应,其反应原理是利用了铝的还原性
反应放出的热量。铝热剂是指铝粉和被还原的金属氧化物
的混合物,铝热反应主要用于冶炼稀有金属、野外焊接钢
轨等。
精选ppt
6
4、镁、铝的制备及用途
元素
镁
铝
存在形式 主要存在于
化合态 地壳和海水中
化合态 铝土矿中
制备
电解
冰晶石
MgCl2===Mg+Cl2↑ 2Al2O3=电=解=4Al+3O2↑
乙:Al →NaAlO2 → Al(OH)3
丙: Al→Al2(SO4)3 Al →NaAlO2
→ Al(OH)3
精选ppt
11
5、若要得到等质量的Al(OH)3,则(BD)
A 三者消耗的原料相等 B 甲消耗的原料最多 C 乙消耗的原料最少 D 丙消耗的原料最少
6、不用其他仪器和试剂,仅用试管和胶
与OH反应
不反应
_
_
Al2O3+2OH =2AlO2 +H2O
精选ppt
8
6、氢氧化镁和氢氧化铝
(1)Mg(OH)2是一种难溶于水的中强碱,能使酚酞 溶液变为浅红色
① ②跟热酸稳反定应性差MMg(Og(HO)H2+)22△=HM+g=OM+gH2+2+O2H2O ③可溶于铵盐溶液中
Mg(OH)2+2NH4+=Mg2++2NH3↑+2H2O
铝
+13 2 8 3
电子排布式 1S22S22P63S2 1S22S22P63S23P1
轨道表示式 1S 2S 2P 3S 1S 2S 2P 3S 3P
电子式 化合价
Mg . . +2
.Al .. +3
精选ppt
2
2、镁和铝的物理性质
颜色和 硬度 密度 熔点 沸点 传导
单质 状态
(g/cm3)
性
镁 银白色 很软 1.74 645 1090 良好 铝 固体 较软 2.7 660.4 2467 良好
用途
制合金
制合金、导线等
镁
精选ppt
铝
7
5、氧化镁和氧化铝
工业 制备
MgO
△
MgCO3=MgO+CO2↑
AI2O3
从铝土矿中提取
重要物 理性质
白色固体,熔点高,密度小
与水 反应
MgO+H2O=Mg(OH)2↓
反应很慢
不溶解,也不反应
与H+ 反应 MgO+2H+=Mg2++H2O Al2O3+6H+=2Al3++3H2O
织物、造纸等方面。其溶液与氧化镁混合,可成为坚硬 耐磨的镁质水泥。
英文名称为magnesium chloride。化学
式MgCl2,是由74.54%的氯和25.48% 的镁组成的,式量95.22。呈无色六角晶
体。密度2.316—2.33g/cm3。熔点714℃。
(2)铝在常温下,遇浓硫酸、浓硝酸时,表面生成一层 致密的氧化膜,阻止金属与酸的继续反应即钝化。
(3)在与氧化物反应时,镁侧重于与CO2、SO2等非金 属氧化物反应,而铝侧重于与金属氧化物反应。
(4)在与酸性盐溶液反应时,镁侧重于生成氢气;铝侧 重于发生置换反应。
(5)铝热反应是指工业上用铝粉来还原金属氧化物,得
(酞2)A变Al3I+色(+O3,H它O)H3是是- 典一型种的难A两溶l(O性的H氢)白3 氧色化胶物状物H+质+A,不lO2能-+H使2O酚
AI(OH)3+3H+=AI3++3H2O
AI(OH)3+OH-=AIO2-+2H2O
精选ppt
9
练习:
1、为除去镀在铝表面的铜镀层,可选用的试
剂是
( B)
镁
铝
与非金 属反应
点燃 2Mg+O2 ===2MgO
点燃 Mg+N2 ===Mg3N2
与沸水 反应 Mg+2H2O=Mg(OH)2+H2↑
△ 4Al+3O2 =△= 2AI2O3 2Al+3Cl2 =△= 2AICl3
2Al+3S == AI2S3 不反应
与酸反 应
Mg+2H+= Mg2++H2↑
2Al+6H+= 2Al3++3H2↑
注:镁的硬度比铝小,熔、沸点比铝低,
是由于金属镁中金属键比金属铝中的金属键 弱的缘故。
精选ppt
3
练习:
铝镁合金因坚硬、轻巧、美观、洁净、易于
加工而成为新型建筑装潢材料,主要用于
制作窗框、卷帘门、防护栏等。下列与这
些用途开关的性质是
( D)
A 强度大
B 不易生锈
C 密度小
D 导电性好
精选ppt
4
3、镁和铝的化学性质
A 稀硝酸
B 浓硝酸
C 浓硫酸
D 浓盐酸
2、用铝盐制取氢氧化铝最好加氨__水__或__偏_铝__酸__盐,
离子反应方程式为_A_l3_+_+_3_N_H_3_H__2O__=_A_l_(O__H_)3_↓_+_3_NH4+ 用偏铝酸盐制氢氧化铝最好通入_C_O__2或__铝__盐___,
离子反应方程式为_2A__lO_2_-+_C__O_2+__2H__2O__=_2_A_l(_O_H_)_3_↓+__C_O_3_2-。
精选ppt
10
3、将氯化铝和氢氧化钠溶液等体积混合,得到的
沉淀物中铝元素的质量与溶液中所含铝元素的质
量相等,则氯化铝和氢氧化钠溶液的物质的量浓
度之比可能为
( BD)
A 1:3
B 2:3
C 1:4 D 2:7
4、用稀硫酸、氢氧化钠溶液和铝为原料制取氢氧 化铝,甲、乙、丙三个学生制备途径分别是:
甲:Al→Al2(SO4)3 →Al(OH)3
头滴管无法鉴别的两种溶液是(D)
A Al2(SO4)3、KOH C NH3·H2O、AgNO3
B Na2CO3、HCl D NaCl、AgNO3
精选ppt
12
7、镁盐——氯化镁
氯化镁是工业制镁的原料,存在于海水晒盐后留下的苦
卤、光卤石(KCl·MgCl2 ·6H2O)中,与碱反应生成沉淀。
用于制金属镁、消毒剂、冷冻盐水、陶瓷,并用于填充
与氧化
点燃
高温
物反应 2Mg+CO2 === 2MgO+C 2Al+Fe2O3===Al2O3+2Fe
与强碱 反应
与盐溶 液反应
不反应
Mg+2NH4+=Mg2++H2↑+
2NH3 ↑
精选ppt
2Al+2OH-+2H2O = 2AlO2-+3H2↑
2Al+3Cu2+=2Al3++3Cu 5
注意:
(1)镁、铝与非氧化性酸反应,生成氢气;与氧化性酸 反应时,不生成氢气,生成非金属氧化物。
课标要求:
1、了解铝等金属及其化合物的主要性质 2、能列举合金材料的重要应用
具体要求:
1、了解镁的性质 2、掌握铝的化学性质,了解铝的重要化合物 3、了解金属的通性,金属冶炼的一般原理 4、初步了解合金的概念和常见的金属材料
精选ppt
1
1、镁和铝的原子结构
元素
镁
原子结构示 意图
+12 2 8 2
到金属单质的一类反应,其反应原理是利用了铝的还原性
反应放出的热量。铝热剂是指铝粉和被还原的金属氧化物
的混合物,铝热反应主要用于冶炼稀有金属、野外焊接钢
轨等。
精选ppt
6
4、镁、铝的制备及用途
元素
镁
铝
存在形式 主要存在于
化合态 地壳和海水中
化合态 铝土矿中
制备
电解
冰晶石
MgCl2===Mg+Cl2↑ 2Al2O3=电=解=4Al+3O2↑
乙:Al →NaAlO2 → Al(OH)3
丙: Al→Al2(SO4)3 Al →NaAlO2
→ Al(OH)3
精选ppt
11
5、若要得到等质量的Al(OH)3,则(BD)
A 三者消耗的原料相等 B 甲消耗的原料最多 C 乙消耗的原料最少 D 丙消耗的原料最少
6、不用其他仪器和试剂,仅用试管和胶
与OH反应
不反应
_
_
Al2O3+2OH =2AlO2 +H2O
精选ppt
8
6、氢氧化镁和氢氧化铝
(1)Mg(OH)2是一种难溶于水的中强碱,能使酚酞 溶液变为浅红色
① ②跟热酸稳反定应性差MMg(Og(HO)H2+)22△=HM+g=OM+gH2+2+O2H2O ③可溶于铵盐溶液中
Mg(OH)2+2NH4+=Mg2++2NH3↑+2H2O
铝
+13 2 8 3
电子排布式 1S22S22P63S2 1S22S22P63S23P1
轨道表示式 1S 2S 2P 3S 1S 2S 2P 3S 3P
电子式 化合价
Mg . . +2
.Al .. +3
精选ppt
2
2、镁和铝的物理性质
颜色和 硬度 密度 熔点 沸点 传导
单质 状态
(g/cm3)
性
镁 银白色 很软 1.74 645 1090 良好 铝 固体 较软 2.7 660.4 2467 良好
用途
制合金
制合金、导线等
镁
精选ppt
铝
7
5、氧化镁和氧化铝
工业 制备
MgO
△
MgCO3=MgO+CO2↑
AI2O3
从铝土矿中提取
重要物 理性质
白色固体,熔点高,密度小
与水 反应
MgO+H2O=Mg(OH)2↓
反应很慢
不溶解,也不反应
与H+ 反应 MgO+2H+=Mg2++H2O Al2O3+6H+=2Al3++3H2O
织物、造纸等方面。其溶液与氧化镁混合,可成为坚硬 耐磨的镁质水泥。
英文名称为magnesium chloride。化学
式MgCl2,是由74.54%的氯和25.48% 的镁组成的,式量95.22。呈无色六角晶
体。密度2.316—2.33g/cm3。熔点714℃。
(2)铝在常温下,遇浓硫酸、浓硝酸时,表面生成一层 致密的氧化膜,阻止金属与酸的继续反应即钝化。
(3)在与氧化物反应时,镁侧重于与CO2、SO2等非金 属氧化物反应,而铝侧重于与金属氧化物反应。
(4)在与酸性盐溶液反应时,镁侧重于生成氢气;铝侧 重于发生置换反应。
(5)铝热反应是指工业上用铝粉来还原金属氧化物,得
(酞2)A变Al3I+色(+O3,H它O)H3是是- 典一型种的难A两溶l(O性的H氢)白3 氧色化胶物状物H+质+A,不lO2能-+H使2O酚
AI(OH)3+3H+=AI3++3H2O
AI(OH)3+OH-=AIO2-+2H2O
精选ppt
9
练习:
1、为除去镀在铝表面的铜镀层,可选用的试
剂是
( B)
镁
铝
与非金 属反应
点燃 2Mg+O2 ===2MgO
点燃 Mg+N2 ===Mg3N2
与沸水 反应 Mg+2H2O=Mg(OH)2+H2↑
△ 4Al+3O2 =△= 2AI2O3 2Al+3Cl2 =△= 2AICl3
2Al+3S == AI2S3 不反应
与酸反 应
Mg+2H+= Mg2++H2↑
2Al+6H+= 2Al3++3H2↑
注:镁的硬度比铝小,熔、沸点比铝低,
是由于金属镁中金属键比金属铝中的金属键 弱的缘故。
精选ppt
3
练习:
铝镁合金因坚硬、轻巧、美观、洁净、易于
加工而成为新型建筑装潢材料,主要用于
制作窗框、卷帘门、防护栏等。下列与这
些用途开关的性质是
( D)
A 强度大
B 不易生锈
C 密度小
D 导电性好
精选ppt
4
3、镁和铝的化学性质
A 稀硝酸
B 浓硝酸
C 浓硫酸
D 浓盐酸
2、用铝盐制取氢氧化铝最好加氨__水__或__偏_铝__酸__盐,
离子反应方程式为_A_l3_+_+_3_N_H_3_H__2O__=_A_l_(O__H_)3_↓_+_3_NH4+ 用偏铝酸盐制氢氧化铝最好通入_C_O__2或__铝__盐___,
离子反应方程式为_2A__lO_2_-+_C__O_2+__2H__2O__=_2_A_l(_O_H_)_3_↓+__C_O_3_2-。
精选ppt
10
3、将氯化铝和氢氧化钠溶液等体积混合,得到的
沉淀物中铝元素的质量与溶液中所含铝元素的质
量相等,则氯化铝和氢氧化钠溶液的物质的量浓
度之比可能为
( BD)
A 1:3
B 2:3
C 1:4 D 2:7
4、用稀硫酸、氢氧化钠溶液和铝为原料制取氢氧 化铝,甲、乙、丙三个学生制备途径分别是:
甲:Al→Al2(SO4)3 →Al(OH)3
头滴管无法鉴别的两种溶液是(D)
A Al2(SO4)3、KOH C NH3·H2O、AgNO3
B Na2CO3、HCl D NaCl、AgNO3
精选ppt
12
7、镁盐——氯化镁
氯化镁是工业制镁的原料,存在于海水晒盐后留下的苦
卤、光卤石(KCl·MgCl2 ·6H2O)中,与碱反应生成沉淀。
用于制金属镁、消毒剂、冷冻盐水、陶瓷,并用于填充
与氧化
点燃
高温
物反应 2Mg+CO2 === 2MgO+C 2Al+Fe2O3===Al2O3+2Fe
与强碱 反应
与盐溶 液反应
不反应
Mg+2NH4+=Mg2++H2↑+
2NH3 ↑
精选ppt
2Al+2OH-+2H2O = 2AlO2-+3H2↑
2Al+3Cu2+=2Al3++3Cu 5
注意:
(1)镁、铝与非氧化性酸反应,生成氢气;与氧化性酸 反应时,不生成氢气,生成非金属氧化物。
