20个机理
自由基聚合反应机理

一、自由基聚合反应的基元反应 ⒈ 链引发反应(chain initiation)
⒉ 链增长反应(chain propagation)
⒊ 链终止反应(chain termination) ⑴ 偶合终止(coupling termination) ⑵ 歧化终止(disproportion termination ) ⒋ 链转移反应(chain transfer) 二、 自由基聚合反应的特征 ⒈自由基聚合反应可以明显地区分为四个基元反应 ⒉自由基聚合反应具有瞬时高速度特性 ⒊自由基聚合反应具有诱导期
影响CI的因素:引发剂的种类、单体种类和聚合温度。 链自由基向偶氮类引发剂的转移常数以前认为一般为0,但近 来研究表明ABIN的CI也有小的数值。 氢过氧类引发剂是引发剂中最易转移的一类引发剂。 因为引发剂在自由基聚合体系中浓度是很低的 , 约为 10-2 ~ 10-4 (mol/L),转移反应的机会也是不太大的,因而不占重要地位。 ⑶ 链自由基向溶剂的转移反应 溶液聚合时,聚合体系中存在溶剂,链自由基可能向溶剂(包括 分子量调节剂)发生转移反应
R
CH2 CH Cl + CH2 CH Cl
其原因可能是由于氯乙烯分子不仅含有容易转移的H 原子,而且C-Cl键较弱,Cl原子也容易转移的缘故。
2.6 自由基聚合反应的机理
⑵ 链自由基向引发剂的转移反应
自由基聚合体系中存在着引发剂。链自由基可能向引发剂 分子夺取一个基团 ,结果,链自由基终止为一个大分子 ,引发剂变 为一个初级自由基。
St
St St MMA MMA MMA
0
25 60 0 25 60
100
常用农药作用机理
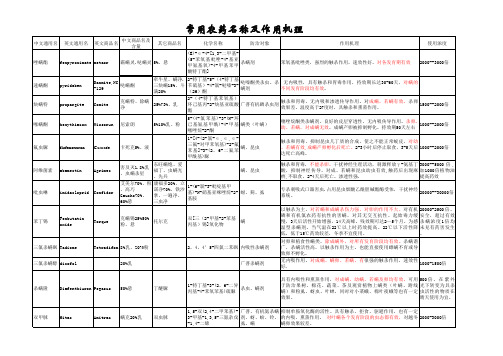
扑虱灵
buprofezin
环烷脲;1%, 触杀和胃毒作用。抑制昆虫几丁质的合成,干扰新陈代谢,使幼 优乐得、 2-特-丁亚胺-3-异丙基Applaud,NN 1.5%粉;2% 虫、若虫不能形成新皮而死亡。药后 l ~ 3 天才死亡,持效期长 10%,25%, 苯基 -1 , 3 , 5- 噻二嗪 - 螨、虱、蚧.特效 I-750 粒;10%乳; (30~40天),不杀成虫,能抑制成虫产卵和卵的孵化。与常规 50%粉 4-酮 40%悬。 农药无交互抗性。
1000--2000倍
四螨嗪 敌敌畏 乐果 氧化果 辛硫磷
clofentezine
50%、25%、20% 阿波罗、螨死 3 , 6- 双( 2- 氯苯基) 悬,10%、20% 杀螨剂 净 1,2,4,5-四嗪 粉 50%、80%乳油 40%乳油 40%乳油 50%乳油 氧化乐果 蚜、螨、介、蛾 蚜、螨、介 同上
持效期长,主要用作杀卵剂,对幼龄期有一定的防效。2-3周达高 1000-2500倍 峰 广谱高效,速残、残效短。具胃毒、触杀和熏蒸作用 广谱内吸杀虫杀螨剂,具触杀胃毒作用 同上。可低温使用. 1000—1500倍 1000—1500倍 同上 1500倍
对鳞翅目幼虫高 具胃毒、触杀作用,但易光解 效,
双[三(2-甲基-2-苯基 螨 丙基)锡]氧化物
三氯杀螨砜 Tadiome 三氯杀螨醇 dicofol
Tetradifom 8%乳、20%粉 20%乳
2,4,4'5-四氯二苯砜 内吸性杀螨剂 广普杀螨剂
对卵和植食性螨类,除成螨外,对所有发育阶段均有效。杀螨谱 广,杀螨活性高,以触杀作用为主。也能直接使用雌螨不育或导 致卵不孵化。 无内吸作用。对成螨、螨卵、若螨,有很强的触杀作用,速效性 1000-1500倍 好. 具有内吸性和熏蒸作用,对成螨、幼螨、若螨及卵均有效。可用 于防治果树、棉花、蔬菜、茶及观赏植物上螨类(叶螨、跗线 螨)和粉虱、蚜虫、叶蝉,同时对小菜蛾、棉叶夜蛾等也有一定 效果。 500 倍 、 在 紫 外 光下转变为具杀 虫活性的物质在 晴天使用为宜。
重氮化反应机理[优质内容]
![重氮化反应机理[优质内容]](https://img.taocdn.com/s3/m/58869a4daa00b52acfc7cad6.png)
(17) 对-甲氧基, 间-氨基苯磺酸
NH2 H3CO
SO3H
(20) 邻-X基联苯胺 [X=H,Cl,OCH3]
X H2N
SO3H X NH2
(18) 对-硝基, 邻-氨基苯甲醚 NH2
H3CO
NO2
(19) 间-硝基, 邻-氨基苯磺酸 NO2
SO3H NH2
精制课件
51
4、苯系中间体的合成途径
SO3H HO3S
SO3H
SO3H
(19) SS-酸
(20) γ-酸
(21) 2D-酸
(22) M-酸
(23) 加买酸
OH NH2 SO3H
SO3H
HO3S
OH
NH2 HO3S
OH
NH2 HO3S SO3H
NH2
OH
HO3S
NH2
OH
(24) J-酸
HO3S
(2)可以进一步合成其他化合物 试剂:脂肪酸、酸酐、酰氯、酯类
精制课件
42
三、氧化反应
两类氧化反应:
在氧化剂存在下,分子中引入氧原子,形成新 的含氧基团;
使有机分子失去部分氢。
CH3 [O]
CH2OH [O]
CHO [O]
COOH
精制课件
43
4,4‘-二氨基二苯乙烯-2,2’-二磺酸(DSD酸)
先引入氨基,然后转化成羟基,常用方法为酸性水 解,重氮盐水解
精制课件
39
(四)异丙基芳烃的氧化-酸解
主要用于生产苯酚。
精制课件
40
第四节 其他反应
一、考尔培反应
酚类化合物的钠盐与二氧化碳反应,在芳环上引 入羧基的反应。
精制课件
20个重要有机反应机理

合成中常用的反应以及机理Baeyer----Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-0-0-基团中与羰基碳原子直接相连的氧原子上,同时发生 0-0键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持 不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定 的选择性,按迁移能力其顺序为:R 3c- > R a CH-,O- > ©-CH}- >> RCH a - > CHj-醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
样 •静 • M ■ 弄 • 弄 •理 •洋 •够 •解 • 种 • * •• 寿 •弄 •桦 •解 • 解 • 静 ■+ C 6H ^O 3HOMC0 H"□-C-CxHsC S H 5CO 3HII RCO 田R —C-H ----------------RCO [H+ 0HII RO —C —R 1C R —反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40C之间,产率高。
4090%OII G出—COGH》—C-OCM + CgHjCX^sH 82%CH-CH-COC*H3CH3C5乩出6CH=CH-OCOCH3Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺 酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作 用下重排生成己内酰胺:H • 歼 ■ 幷 ■ 挪 ■ 秽 ■ W ■ W ■ W 1 ■ M ■ 好 ■ 仔 ■ W ■■静 • 彼 ■ 存 ■ W W ■ 歼 ■ 旳 ■ W反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于 反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
粘接机理

粘接方案粘接是一项比较复杂的技术,需要深入的学习。
首先对粘接的机理进行说明。
粘接就是指同质或异质物体表面用胶粘剂连接在一起的技术。
粘接力的产生包括胶粘剂与被粘物之间的物理作用、化学作用和机械作用。
物理作用指分子间力即范德华力、氢键力,它们广泛存在于粘接中。
化学作用指胶粘剂与被粘物之间的形成牢固的化学键结合,即离子键力、共价键力、金属键力、配位键力。
机械作用指由于被粘物表面存在大量细小的孔隙,胶粘剂分子由于扩散、渗透作用而进入被粘物内部,形成了机械的“钩键”、“锚键”,即所谓机械力。
粘合技术现在的理论主要有:机械理论、吸附理论、扩散理论、静电理论、弱边界理论、化学键理论等,每种理论都只能解释一部分,各个理论的定义为:1、机械理论:胶粘剂必须渗入被粘物表面的空隙内,并排除其界面上吸附的空气,才能产生粘接作用。
胶粘剂粘接表面打磨的骨架效果要比表面光滑骨架好,这是因为(1)机械镶嵌、(2)形成清洁表面、(3)生成反应性表面、(4)表面积增加。
常用的金属表面处理法有:物理机械法、化学处理法。
物理机械方法有①车削加工②喷砂③超声波处理④机械打磨;化学处理方法有①酸洗②碱洗③氧化还原④磷化处理。
2、吸附理论:粘接是由两材料间分子接触和界面力产生所引起的。
粘接力的主要来源是分子间作用力包括氢键力和范德华力。
胶粘剂与被粘物连续接触的过程叫润湿,要使胶粘剂润湿固体表面,胶粘剂的表面张力应小于固体的临界表面张力,胶粘剂浸入固体表面的凹陷与空隙就形成良好润湿。
如果胶粘剂在表面的凹处被架空,便减少了胶粘剂与被粘物的实际接触面积,从而降低了接头的粘接强度。
通过润湿使胶粘剂与被粘物紧密接触,主要是靠分子间作用力产生永久的粘接。
在粘附力和内聚力中所包含的化学键有四种类型:离子键、共价键、金属键、范德华力。
3、扩散理论:粘接是通过胶粘剂与被粘物界面上分子扩散产生的。
当胶粘剂和被粘物都是具有能够运动的长链大分子聚合物时,扩散理论基本是适用的。
交换作用的物理机理

交换作用的物理机理一、静电力静电力是交换作用的一种常见机制。
当两个带有电荷的物体靠近时,它们之间会产生静电力。
根据电荷的性质,静电力可以是吸引力或排斥力。
这种力的大小与电荷的量和距离的平方成反比。
静电力在许多现象中起着重要的作用,例如电子在电路中的运动和静电吸附。
二、引力引力是交换作用的另一种常见机制。
根据万有引力定律,两个物体之间的引力与它们的质量成正比,与它们之间的距离的平方成反比。
引力是地球吸引物体的力量,也是行星围绕太阳运动的力量。
此外,引力还可以解释物体在斜面上滑动的原因,以及天体之间的相互吸引。
三、电磁力电磁力是一种交换作用,它是电荷和磁场之间的相互作用。
根据库仑定律,两个电荷之间的电磁力与它们的电荷量成正比,与它们之间的距离的平方成反比。
电磁力可以是吸引力或排斥力,取决于电荷的性质。
此外,电磁力还可以解释磁体之间的相互作用,以及电流在导体中的传输。
四、核力核力是原子核内部粒子之间的交换作用。
核力是一种非常强大的力量,它能够保持原子核的稳定性。
尽管原子核内部的质子相互排斥,但核力能够克服这种排斥力,使质子和中子保持在一起。
核力的作用使原子核稳定,同时也是核反应和核聚变的基础。
五、弱力弱力是一种相对较弱的交换作用,它是质子和中子之间的相互作用。
弱力是一种短程力,只在非常小的距离内起作用。
弱力在核反应中起着重要的作用,例如放射性衰变和核聚变。
此外,弱力还参与了一些基本粒子的相互作用,例如质子和中子之间的转换。
通过以上几种物理机制和原理,交换作用在自然界中起着重要的作用。
这些机制和原理解释了许多自然现象,并对科学研究和技术应用产生了重要影响。
深入理解这些物理机理有助于我们更好地理解世界的运作方式。
化学物质的化学反应

化学物质的化学反应化学反应是化学变化的一种形式,它涉及到物质之间的相互作用,导致原有物质的性质和组成发生变化,生成新的物质。
化学反应是化学科学的核心内容之一,也是中学生需要掌握的重要知识点。
1.化学反应的基本概念–化学反应的定义–化学反应的类型(如:合成反应、分解反应、置换反应、复分解反应等)–化学反应的实质(原子、离子、分子之间的重新组合)2.化学反应的基本规律–质量守恒定律(化学反应中,参加反应的物质的质量等于反应后生成的物质的质量)–能量守恒定律(化学反应中,参加反应的物质的能量等于反应后生成的物质的能量)–化学反应的化学计量法则(反应物与生成物之间的化学计量关系)3.化学反应的速率–化学反应速率的定义(单位时间内反应物浓度的减少或生成物浓度的增加)–影响化学反应速率的因素(反应物浓度、温度、催化剂、固体表面积等)4.化学平衡–化学平衡的概念(在封闭系统中,正反两个化学反应的速率相等,各种物质的浓度保持不变的状态)–化学平衡的原理(勒夏特列原理)–化学平衡的移动(外界条件变化导致平衡位置的移动)5.化学反应的化学方程式–化学方程式的表示方法–化学方程式的平衡(化学方程式中反应物与生成物的化学计量数相等)–化学方程式的简化(合并同类项、消除系数等)6.氧化还原反应–氧化还原反应的定义–氧化还原反应的基本概念(氧化剂、还原剂、氧化数、电子转移等)–氧化还原反应的类型(如:单一置换反应、歧化反应、合成反应等)7.化学反应的应用–化学反应在生产生活中的应用(如:燃烧反应、酸碱中和反应等)–化学反应在科学研究中的应用(如:催化剂的设计、新材料的合成等)以上是关于化学物质的化学反应的知识点介绍,希望对您有所帮助。
习题及方法:1.习题:判断以下反应类型,并写出化学方程式。
a)2H2 + O2 -> 2H2Ob)CaCO3 -> CaO + CO2c)Zn + H2SO4 -> ZnSO4 + H2d)该反应是合成反应,因为两种物质反应生成了一种新物质。
有机合成——反应机理-1

1a
1a 1a 1b[d] 1c 1d 1d 1d
CHCl3
CH2Cl2 Dioxane Neat Neat Neat Neat Neat
47
34 0 46 39 49 37 34
[a] Reaction conditions: catalyst (0.004 mmol), 2a (1.5 mmol), 3a (1.0 mmol), 90 oC, 8 h, 2.0 mL solvent was added if noted. [b] Based on 3a used, determined by 1H NMR using CH3NO2 as the internal standard. [c] In reflux. [d] 1b contains trace of impurity (see experimental section). [e] Reaction temperature 80 oC. [f] Reaction conditions: catalyst (0.002 mmol), 2a (3.0 mmol), 3a (2.0 mmol), 100 oC, 16 h.
O
O
R2
+
H2O
Angew. Chem. Int. Ed. 2006, 45, 2605-2609
背景:
O O R1 O R2 + AuCl3/AgOTf Solvent R1 O R2
J. Am. Chem. Soc. 2004, 126, 6884-6885 J. Org. Chem. 2005, 70, 5752-5755 Org. Lett., 2005, 7, 673-675
Endo-产物
Exo-产物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇:醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
反应实例Claisen 酯缩合反应含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见Dieckmann缩合反应。
乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲基钠、二异丙氨基锂(LDA)和Grignard试剂等。
反应实例如果酯的α-碳上只有一个氢原子,由于酸性太弱,用乙醇钠难于形成负离子,需要用较强的碱才能把酯变为负离子。
如异丁酸乙酯在三苯甲基钠作用下,可以进行缩合,而在乙醇钠作用下则不能发生反应:两种不同的酯也能发生酯缩合,理论上可得到四种不同的产物,称为混合酯缩合,在制备上没有太大意义。
如果其中一个酯分子中既无α-氢原子,而且烷氧羰基又比较活泼时,则仅生成一种缩合产物。
如苯甲酸酯、甲酸酯、草酸酯、碳酸酯等。
与其它含α-氢原子的酯反应时,都只生成一种缩合产物。
实际上这个反应不限于酯类自身的缩合,酯与含活泼亚甲基的化合物都可以发生这样的缩合反应,这个反应可以用下列通式表示:Claisen—Schmidt 反应一个无氢原子的醛与一个带有氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到不饱和醛或酮:反应机理反应实例Claisen 重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
Favorskii 重排a-卤代酮在氢氧化钠水溶液中加热重排生成含相同碳原子数的羧酸;如为环状a-卤代酮,则导致环缩小。
如用醇钠的醇溶液,则得羧酸酯:此法可用于合成张力较大的四员环。
反应机理反应实例Fries 重排酚酯在Lewis酸存在下加热,可发生酰基重排反应,生成邻羟基和对羟基芳酮的混合物。
重排可以在硝基苯、硝基甲烷等溶剂中进行,也可以不用溶剂直接加热进行。
邻、对位产物的比例取决于酚酯的结构、反应条件和催化剂等。
例如,用多聚磷酸催化时主要生成对位重排产物,而用四氯化钛催化时则主要生成邻位重排产物。
反应温度对邻、对位产物比例的影响比较大,一般来讲,较低温度(如室温)下重排有利于形成对位异构产物(动力学控制),较高温度下重排有利于形成邻位异构产物(热力学控制)。
反应机理反应实例Hofmann 重排(降解)酰胺用溴(或氯)在碱性条件下处理转变为少一个碳原子的伯胺:反应机理反应实例Knoevenagel 反应含活泼亚甲基的化合物与醛或酮在弱碱性催化剂(氨、伯胺、仲胺、吡啶等有机碱)存在下缩合得到a,b-不饱和化合物。
反应机理反应实例Gabriel 合成法邻苯二甲酰亚胺与氢氧化钾的乙醇溶液作用转变为邻苯二甲酰亚胺盐,此盐和卤代烷反应生成N-烷基邻苯二甲酰亚胺,然后在酸性或碱性条件下水解得到一级胺和邻苯二甲酸,这是制备纯净的一级胺的一种方法。
有些情况下水解很困难,可以用肼解来代替:反应机理邻苯二甲酰亚胺盐和卤代烷的反应是亲核取代反应,取代反应产物的水解过程与酰胺的水解相似。
Mannich 反应含有a-活泼氢的醛、酮与甲醛及胺(伯胺、仲胺或氨)反应,结果一个a-活泼氢被胺甲基取代,此反应又称为胺甲基化反应,所得产物称为Mannich碱。
反应机理反应实例Oppenauer 氧化仲醇在叔丁醇铝或异丙醇铝和丙酮作用下,氧化成为相应的酮,而丙酮则还原为异丙醇。
这个反应相当于Meerwein-Ponndorf反应的逆向反应。
反应机理反应实例Pinacol-Pinacolone Rearrangement 重排当片呐醇类在稀H2SO4存在下加热脱水时发生特殊的分子内部的重排反应生成片呐酮。
如用盐酸、草酸、I2/CH3COOH、CH3COOH等脱水-转位剂以代替H2SO4可得相同的结局:反应机理反应的关键是生成碳正离子:反应实例Reformatsky 反应醛或酮与a-卤代酸酯和锌在惰性溶剂中反应,经水解后得到b-羟基酸酯。
反应机理首先是a-卤代酸酯和锌反应生成中间体有机锌试剂,然后有机锌试剂与醛酮的羰基进行加成,再水解:反应实例Reimer-Tiemann 反应酚与氯仿在碱性溶液中加热生成邻位及对位羟基苯甲酸。
含有羟基的喹啉、吡咯、茚等杂环化合物也能进行此反应。
常用的碱溶液是氢氧化钠、碳酸钾、碳酸钠水溶液,产物一般以邻位为主,少量为对位产物。
如果两个邻位都被占据则进入对位。
不能在水中起反应的化合物可吡啶中进行,此时只得邻位产物。
反应机理首先氯仿在碱溶液中形成二氯卡宾,它是一个缺电子的亲电试剂,与酚的负离子(Ⅱ)发生亲电取代形成中间体(Ⅲ),(Ⅲ)从溶剂或反应体系中获得一个质子,同时羰基的α-氢离开形成(Ⅳ)或(Ⅴ),(Ⅴ)经水解得到醛。
反应实例酚羟基的邻位或对位有取代基时,常有副产物2,2-或4,4-二取代的环己二烯酮产生。
例如:Sandmeyer 反应重氮盐用氯化亚铜或溴化亚铜处理,得到氯代或溴代芳烃:这个反应也可以用新制的铜粉和HCl或HBr来实现(Gattermann反应)。
反应机理反应实例Wittig 反应Wittig 试剂与醛、酮的羰基发生亲核加成反应,形成烯烃:反应机理反应实例Wagner-Meerwein 重排当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原子)时,在酸催化脱水反应中,常常会发生重排反应,得到重排产物:反应机理反应实例。
