双氧水是纯净物吗
双氧水介绍
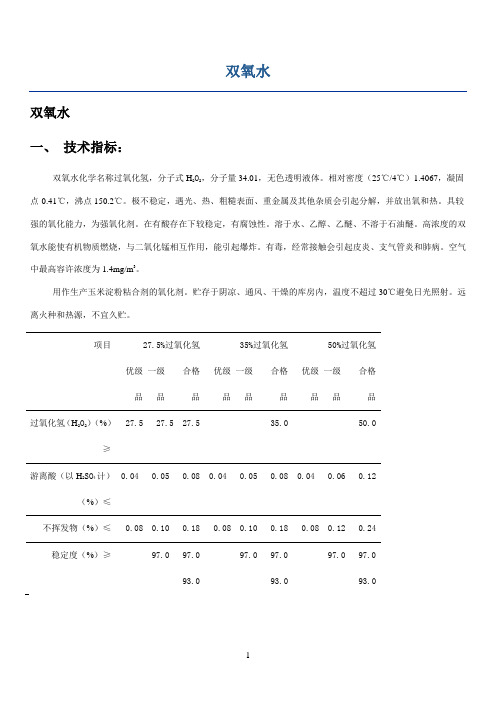
项目 27.5%过氧化氢优级 一级 合格 品 品 品35%过氧化氢 优级 一级 合格 品 品 品 50%过氧化氢 优级一级 合格 品 品 品 过氧化氢(H 2O 2)(%)≥27.5 27.5 27.5 35.0 50.0 游离酸(以H 2SO 4计)(%)≤0.04 0.05 0.08 0.04 0.05 0.08 0.04 0.06 0.12不挥发物(%)≤0.08 0.10 0.18 0.08 0.10 0.18 0.08 0.12 0.24 稳定度(%)≥ 97.0 97.0 93.0 97.0 97.0 93.097.0 97.093.0二、相关新闻:【1】双氧水的广泛用途——防腐、保鲜、杀菌、消毒在国外,食品级双氧水在食品行业中早已得到普遍应用。
在乳品及饮料等食品的无菌包装及啤酒、饮用水、水产保鲜、瓜果蔬菜等食品的生产加工过程都广泛使用食品级双氧水。
我国以前一直没有食品级双氧水,国内食品行业对食品组成双氧的需要也越来越多,尤其是乳品行业,无菌包装的纯牛奶、酸牛奶,其无菌包装的消毒必须要使用食品级双氧水。
由于食品级双氧水的生产具有一定的技术难度,国内一直没有食品级双氧水生产厂家,食品行业要使用食品级双氧水,只有两个途径:一是从国外进口食品级双氧水,二是使用工业级双氧水代替。
双氧水理化性质及食品级双氧水的特点1.双氧水的理化性质双氧水学名过氧化氢,系无色透明液体,溶于水、醇及醚,高浓度时有腐蚀性,敞口放置时,会渐渐分解为氧及水,30%的双氧水的密度为1.1g/cm3,熔点-0.89℃,沸点151.4℃,分子式为H2O2,分子量为34.01。
本品具有强烈的杀菌作用,在碱性条件下,效果更加明显。
2.食品级双氧水的特点食品级双氧水具有纯度高、杂质少、稳定性好,无有毒有害杂质。
工业级双氧水中含有大量的蒽醌类有机杂质以及铅、砷等金属离子、机械杂质等。
这些有毒有害杂质中,像蒽醌、铅砷是致癌物质,因此不能用于食品行业。
过氧化氢

111过氧化氢过氧化氢溶液,化学式为H2O2,其水溶液俗称双氧水,外观为无色透明液体,是一种强氧化剂,适用于伤口消毒及环境、食品消毒。
中文名:过氧化氢外文名:Hydrogen peroxide别名:双氧水化学式:H2O2相对分子质量:34.01化学品类别:无机物--过氧化物管制类型:过氧化氢(*)(易制爆)储存:用瓶口有微孔的塑料瓶装阴凉保存管制信息过氧化氢属于易制爆物品,根据《危险化学品安全管理条例》受公安部门管制。
低浓度医用过氧化氢溶液不受管制。
[1]编码信息CAS号 7722-84-1[1]EINECS号 231-765-0InChI编码 InChI=1/H2O2/c1-2/h1-2H [2]物理性质EINECS登录号:231-765-0英文名称:Hydrogen peroxide分子结构:O原子以sp3杂化轨道成键、分子为共价极性分子。
其立体结构像一本半展开的书一样,两个氧原子在书缝上,两个氢原子各占据书的两页纸。
过氧化氢立体结构H-O-O键角96度52分外观与性状:水溶液为无色透明液体,有微弱的特殊气味。
纯过氧化氢是几乎无色(非常浅的蓝色)的液体。
主要成分:工业级分为27.5%、35%两种。
试剂级常分为30%、40%两种。
分子量:34.02熔点(℃):-0.89℃(无水)沸点(℃):152.1℃(无水)折射率:1.4067(25℃)相对密度(水=1):1.46(无水)饱和蒸气压(kPa):0.13(15.3℃)溶解性:能与水、乙醇或乙醚以任何比¨例混合。
不溶于苯、石油醚。
结构:H-O-O-H 既有极性共价键又有非极性共价键毒性LD50(mg/kg):大鼠皮下700mg/Kg[4]化学性质酸碱H2O2是二元弱酸,具有酸性。
氧化性具有较强的氧化性H2O2 + 2KI + 2HCl = 2KCl + I2+ 2H2O2Fe2+ + H2O2+ 2H+ = 2Fe3+ + 2H2OH2O2 + H2S = S↓+ 2H2OH2O2 + SO2 = H2SO4Cu + H2O2 + 2HCl = CuCl2+2H2O注:在酸性条件下H2O2的还原产物为H2O,在中性或碱性条件其还原产物为氢氧化物。
双氧水(危化品安全技术说明书)

身体防护:穿聚乙烯防毒服。手防护:戴氯丁橡胶手套。
其他防护:工作场所禁止吸烟。工作毕,淋浴更衣。注意个人清洁卫生。
泄漏处理
迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿防酸碱工作服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。小量泄漏:用砂土、蛭石或其它惰性材料吸收。也可以用大量水冲洗,洗水稀释后放入废水系统。大量泄漏:构筑围堤或挖坑收容;喷雾状水冷却和稀释蒸气、保护现场人员、把泄漏物稀释成不燃物。用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法:消防人员必须穿戴全身防火防毒服。尽可能将容器从火场移至空旷处。喷水冷却火场容器,直至灭火结束。处在火场中的容器若已变色或从安全泄压装置中产生声音,必须马上撤离。灭火剂:雾状水、干粉、砂土。
毒性
对人体危害
侵入途径:吸入、食入。
健康危害:吸入本品蒸气或雾对呼吸道有强烈刺激性。眼直接接触液体可致不可逆损伤甚至失明。口服中毒出现腹痛、胸口痛、呼吸困难、呕吐,一时性运动和感觉障碍、体温升高、结膜和皮肤出血。个别病例出现视力障碍、癫痫样痉挛、轻瘫,长期接触本品可致接触性皮炎。
急救
皮肤接触:立即脱去被污染的衣着,用大量流动清水冲洗皮肤。
眼镜接触:立即提起眼睑,用大量流动清水或生理盐水冲洗至少15分钟。就医。
吸入:迅速脱离现场至空气新鲜处,保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:饮足量温水,催吐。
防护
工程控制:生产过程密闭,全面通风。提供安全淋浴和洗眼设备。
临界温度(℃):
临界压力(MPa):
双氧水

过氧化氢Hydrogen Peroxide名称:又名双氧水分子式:H2O2,分子量:34.0性质:基本的化工原料之一,无色、无臭、透明液体,熔点:-0.89℃,沸点:151.4℃,-4℃时过氧化氢固体的密度为1.465g/cm3。
受热153℃以上,会猛烈地发生爆炸性分解。
为防止分解,可加入稳定剂如微量的锡酸钠Na2SnO3、焦磷酸钠Na4P2O7或8-羟基喹啉等来抑制杂质的催化分解作用。
纯H2O2加热到135℃或更高温度时,会猛烈地发生爆炸性分解。
H2O2溶于水、乙醇、乙醚,不溶于石油醚和烃类。
能与水、乙醇、乙醚等以任何比例混合。
1L90% H2O2完全分解后,生成589g氧气、801g水蒸气;绝热条件下,温度升达750℃,相当于1L90% H2O2分解后,在常压下(101.3kPa),体积增大到500L,即过氧化氢分解时释放出的能量是相当大的。
在较低温度下,过氧化氢分解平稳地进行:2 H2O2==2H2O+O2+197kJ在碱性介质中,过氧化氢的分解速度远比在酸性介质中快,如6%的过氧化氢加入到20%的氢氧化钠中,24h分解9%。
影响过氧化氢分解速度的重要因素是重金属离子的催化作用,如Fe2+、Mn2+、Cu2+、Cr3+等及碱性介质都能加速其分解,生成水和氧,并放出热量。
波长为320~380nm的光也能使过氧化氢的分解速度加快,因而瓶装的过氧化氢都用棕色瓶或不透光的瓶,并放置在阴凉处;过氧化氢有很多性质类似于水,也是一种盐类电离溶剂;但它是一种弱酸:H2O2 HOO-+H+。
PH在4左右最稳定。
过氧化氢有两类值得注意的反应特性:1)过氧化氢与其他化合物反应时能转移过氧键,生成过氧化物、加合在其它分子上生成过氧化氢加成化合物或过氧酸。
过氧化氢加入到重铬酸盐的酸性溶液中,生成蓝色的过氧化物溶液,蓝色化合物可用乙醚萃取而得到蓝色的萃取液层。
这一反应可用来检验过氧化氢和过氧化物。
2)过氧化氢在酸性溶液中是强氧化剂,在碱性溶液中则是适中的还原剂。
2023届上海市奉贤区高三二模化学试题及答案

2022学年奉贤区第二学期高中化学练习卷(时间60分钟,满分100分)相对原子质量:H-1C-12O-16一、选择题(共40分,每小题2分,每小题只有一个正确选项)1.奉贤公交巴士引入氢气作为汽车发动机燃料,下列说法正确的是A.氢能不属于新能源B.氢能属于不可再生能源C.氢能是一种热值高、无污染的绿色能源D.氢能已经完全替代了所有的化石能源2.下列物质属于纯净物的是A.汽油B.食醋C.漂白粉D.小苏打3.要除去3FeCl 溶液中少量的2FeCl ,可行的方法是A.滴入KSCN 溶液 B.通入氯气C.加入适量铜粉并过滤D.加入适量铁粉并过滤4.双氧水是一种常见的氧化剂,下列对H 2O 2叙述正确的是A.H 2O 2的摩尔质量为34 B.H 2O 2中只有极性共价键C.22H O 也具有还原性D.H 2O 2的电子式为5.以下物质属于弱电解质的是A.乙醇 B.乙酸C.次氯酸钠D.高锰酸钾6.下列晶体属于分子晶体的是A.SiB.SiO 2C.SiCl 4D.SiC7.下列关于仪器使用的说法正确的是A.a 可用于溶液的蒸发浓缩B.b 可用于物质分离C.c 受热时不需要垫石棉网D.d 通冷凝水的方向是上进下出8.下列事实不能..用元素周期律解释的是A.原子半径:Na>Mg B.非金属性:O>S C.还原性:Cl -<Br -D.酸性:H 2SO 3>H 2CO 39.紫花前胡醇()能提高人体免疫力,下列相关叙述错误..的是A.分子式为C14H14O4B.不能使酸性高锰酸钾溶液褪色C.能够发生水解反应D.能够发生消去反应10.某有机物的结构如图所示,一分子该烯烃与一分子溴发生加成反应的产物理论上最多有(不考虑立体异构)A.2种B.3种C.4种D.5种11.关于反应4CO2+SiH4高温4CO+SiO2+2H2O,下列说法正确的是A.CO是氧化产物B.SiH4发生还原反应C.氧化剂与还原剂的物质的量之比为1∶4D.还原性:SiH4>CO12.“价—类”二维图是研究物质性质的一种方法,下图是a~f表示的是含硫物质。
双氧水理化性质危险有害特性及应急防护措施

爆炸上限(%):
最大爆炸压力(MPa):
引燃温度(℃):
禁忌物:易燃或强氧化剂。过氧化氢本身不燃,但能与可燃物反应放出大量热量和氧气而引起着火爆炸。过氧化氢在PH值为3.5~4.5时最稳定,在碱性溶液中极易分解,在遇强光,特别是短波射线照射时也能发生分解。当加热到100℃以上时,开始急剧分解。它与许多有机物如糖、淀粉、醇类、石油产品等形成爆炸性混合物,在撞击、受热或电火花作用下能发生爆炸。过氧化氢与许多有机化合物或杂质接触后会迅速分解而导致爆炸,放出大量的热量、氧和水蒸气。大多数重金属(如铁、铜、银、铅、汞、锌、钴、镍、铬、锰等)及其氧化物和盐类都是活性催化剂,尘土、香烟灰、碳粉、铁锈等也能加速分解。浓度超过74%的过氧化氢,在具有适当的点火源或温度的密闭容器中,会产生气相爆炸。
贮运
包装标志:11,20 UN编号:2015 包装分类:Ⅰ
包装方法:玻璃瓶、塑料桶外木板箱或半花格箱。
储运条件:储存在阴凉、通风的仓间内。远离火种、热源。仓内温度不宜超过30℃。防止阳光直射。保持容器密封。应与易燃或可燃物、还原剂、酸类、金属粉末等分开存放。搬运时要轻装轻卸,防止包装及容器损坏。夏季应早晚运输,防止日光暴晒。禁止撞击和振荡。
双氧水理化性质、危险有害特性及应急防护措施
标识
中文名:双氧水
英文名:hydrogen peroxide
分子式:H2O2
分子量:34.01
CAS号:7722-84-1
危险化学品顺序号:903
理化性质
性状:无色透明液体,有微弱的特殊气味。
溶解性:微溶于水、醇、醚,不溶于石油醚、苯。
熔点(℃):-2(无水)
呼吸系统防护:可能接触其蒸气时,应佩戴自吸过滤式防毒面具(全面罩)。
双氧水性质

双氧水性质双氧水性质双氧水,学名过氧化氢,系无色透明液体,溶于水、醇及醚,高浓度时有腐蚀性,放置时渐渐分解为氧及水。
30%双氧水密度为1.11g/㎝3,熔点-0.89 ,沸点为151.4 。
分子式H2O2,分子量:34.01。
本品漂白和杀菌作用强,碱性条件下作用更强。
双氧水稳定性双氧水可被催化分解,分解是放热反应,同时产生气体。
2H2O2(液)—→2H2O(液)+ O2(气)2H2O2(气)—→2H2O(气)+ O2(气)影响双氧水分解的因素主要有:温度、pH值和催化杂质等。
1.温度:H2O2在较低温度和较高纯度时还是较稳定的。
纯H2O2如加热到153 。
C或更高温度时,便会发生猛烈爆炸性分解。
较低温度下分解作用平稳进行:2H2O2—→2H2O + O2↑ +46.94kcal。
2.PH:介质的酸碱性对H2O2的稳定性有很大的影响。
酸性条件下H2O2性质稳定,进行氧化速度较慢;在碱性介质中,H2O2很不稳定,分解速度很快。
H2O2作为氧化剂的反应速度,通常在碱性溶液中快。
因此加热碱性溶液可很完全地破坏过量的H2O2。
3.杂质:杂质是影响H2O2分解的重要因素。
很多金属离子如Fe2+、Mn2+、Cu2+、Cr3+等都能加速H2O2分解。
工业级H2O2中因含较多的金属离子杂质,必须加入较大量的稳定剂来抑制杂质的催化作用,其原理是还原和络合。
4.光:波长3200—3800A的光也能使H2O2分解速度加快。
为阻止H2O2的分解,必须对热、光、PH、金属离子四大因素提出措施。
双氧水贮存运输◆贮存H2O2应贮存于阴凉、通风的库房中,避免阳光直射;严禁与碱、金属及金属化合物、易燃品混存;容器应加盖并保持排气,以保持容器内H2O2的纯度,防止污染;如有容器破裂、渗漏,应用大量水冲洗。
本品在符合贮存、运输条件下,一年内浓度下降不超过原来浓度的3%。
◆运输本品按氧化剂运输规则运输,防止剧烈振摇;请勿直接用手接触,操作应配戴塑胶手套;若不慎接触或包装发生泄漏,请用水冲净。
2016高考化学一轮复习 混合物和纯净物考点精练

混合物和纯净物一.选择题(共18小题)1.下列有关物质分类正确的是()①混合物:盐酸、王水、水玻璃、水银②化合物:CaCl2、烧碱、聚苯乙烯、HD③电解质:H2SO4、胆矾、冰醋酸、硫酸钡④同素异形体:C60、C70、金刚石、石墨.A.①③ B.②④ C.②③ D.③④2.下列物质中属于纯净物的是()A.稀盐酸 B.冰水混合物 C.食用醋 D.液化石油气3.下列物质属于纯净物的是()A.医用酒精 B.蒸馏水 C.漂白粉 D.空气4.下列属于混合物的是()A.葡萄糖 B.金刚石 C.冰红茶 D.苛性钠5.按纯净物、混合物、电解质和非电解质顺序排列的一组物质是() A.盐酸、空气、醋酸、干冰B.冰醋酸、海水、硫酸钠、乙醇C.蛋白质、油脂、烧碱、石灰石D.胆矾、漂白粉、氯化钾、硫酸钡6.德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面.下列说法正确的是()A.水、双氧水、水玻璃都是纯净物B.石墨和C60互为同位素C.磷酸钙中所含的元素都是短周期元素D.一定条件下石墨转化为C60是化学变化7.下列分类或归类正确的是()①液氯、氨水、干冰、碘化银均为纯净物②CaCl2、NaOH、HCl、IBr均为化合物③明矾、水银、烧碱、硫酸均为强电解质④C60、C70、金刚石、石墨均为碳的同素异形体⑤碘酒、淀粉、水雾、纳米材料均为胶体.A.①③④ B.②③ C.②④ D.②③④⑤8.家庭日常生活经常用到的下列物质中,属于纯净物的是()A.调味用的食醋 B.纯水降温得到的冰水混合物C.炒菜用的铁锅 D.餐饮用的啤酒9.某合作学习小组讨论辨析以下说法:上述说法正确的是()①粗盐和酸雨都是混合物;②荔枝酿酒和空气液化制取氮气的过程中都只发生物理变化;③冰和干冰既是纯净物又是电解质;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体.A.①②④ B.①④⑦ C.③⑤⑥ D.①⑤⑥10.下列各组物质的分类正确的是()①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉②含有氧元素的化合物叫氧化物③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物④同位素:1H+、2H2、3H⑤同素异形体:C60、C80、金刚石、石墨⑥糖类、油脂、蛋白质都是高分子化合物,它们都能发生水解反应⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯⑧强电解质溶液的导电能力一定强⑨在熔化状态下能导电的化合物为离子化合物⑩有单质参加的反应或有单质产生的反应是氧化还原反应.A.全部正确 B.①②⑤⑦⑨ C.②⑤⑥⑦⑨⑩ D.⑤⑨11.化学与资源、环境、生活关系密切,下列说法不正确的是()A.将镁块与钢铁输水管相连,可防止钢铁腐蚀B.推广使用新能源,可以减少二氧化碳等温室气体的排放 C.焊锡中加铅的目的是降低熔点D.石油是混合物,其分馏产品汽油为纯净物12.下列表中对于相关物质的分类全部正确的一组是()编号纯净物混合物弱电解质非电解质A 明矾蔗糖 NaHCO3 CO2B 天然橡胶石膏 NH3•H2O CH3CH2OHC 冰王水 H2SiO3 Cl2D 胆矾水玻璃 H2CO3 SO2A. A B. B C. C D. D13.某化学学习小组讨论辨析以下说法,其中正确的是()①福尔马林、聚苯乙烯、油脂、生铁、铝热剂、肥皂均是混合物②冰和干冰都是酸性氧化物,固体时是分子晶体③小苏打、硬脂酸钠、BaSO4、Al2O3都是强电解质④CO2,NH3,SO2,H2S,Cl2都是非电解质⑤鸡蛋清溶液,淀粉溶液,空气,雾都是胶体⑥苯酚,纯碱,胆矾和H2O2分别属于酸、碱、盐和氧化物.A.①③⑤ B.①②④⑤ C.①②③⑤ D.①②③④⑤⑥14.下列说法或表达正确的是()A.石油是混合物,其分馏产品汽油也是混合物B. NH4I的电子式:C.糖类、蛋白质和乙酸都是人体必需的营养物质D.陶瓷、水晶、水泥、玻璃都属于硅酸盐15.下列有关物质分类正确的是()A.液氯、冰水混合均为纯净物B. NO2、CO、CO2均为酸性氧化物C.与互为同系物D.淀粉、纤维素和油脂都属于天然高分子化合物16.下列说法正确的是()A.石油经过分馏及裂化等方法得到的物质均为纯净物B.乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应C.化合物是苯的同系物D.异丁烷的八氯代物共有3种(不考虑立体异构)17.化学广泛应用于生活生产,下列说法正确的是()A.青铜器、硬币都属于纯净物B.葡萄糖和银氨溶液发生银镜反应可用作制镜子C.往花生油中加入稀硫酸能发生皂化反应D.鸡蛋清中加入胆矾可以使蛋白质发生盐析18.下列关于物质分类的说法正确的是()A.胆矾、石膏、漂白粉都是纯净物B.氢氧化钙、盐酸、硫酸铜均为强电解质C. CaCl2、烧碱、聚苯乙烯均为化合物D.稀豆浆、硅酸、雾霾均为胶体二.填空题(共5小题)19.地壳中含量最多的元素和含量占第二位的金属元素组成化合物的化学式为、、现有以下几种物质①液氧②二氧化碳③洁净的空气④高锰酸钾加热完全分解后剩余物⑤过氧化氢⑥已经结冰的水⑦食盐水⑧氯酸钾⑨氦气⑩铜其中属于混合物的有(填序号下同)纯净物单质化合物氧化物.20.现有①空气、②蔗糖、③碳酸铵、④铁、⑤硝酸钾、⑥氧气、⑦石墨、⑧氯化钠、⑨石灰水、⑩蒸馏水共10种物质,若根据物质的组成将它们进行分类,则:(1)属于混合物的是.若将铁、氧气、石墨分为一类,其分类依据是.(3)若将碳酸铵、氯化钠、硝酸钾分为一类,其分类依据是.(4)若将蔗糖、碳酸铵、蒸馏水分为一类,你认为分类的依据可能是.21.下图所示为按树状分类法对一组物质进行的分类.请填写下列标注、.22.有下列物质:①空气②O2③NaHSO4④氨水⑤CuSO4•5H2O ⑥NaOH ⑦CO2⑧Fe2O3⑨金刚石⑩H2SO4,请回答下列问题(请在横线上填写序号):(1)属于混合物的有;属于酸性氧化物的有;(3)属于碱的有;(4)属于盐的有.23.有下列物质:①二氧化碳②硝酸钾晶体③液氯④氢气⑤氯水⑥石墨⑦氢氧化钠固体⑧稀硫酸⑨熔融氯化钠⑩铝.请用序号回答下列问题:(1)属于混合物的是;属于非金属单质的是.属于电解质的是;能够导电的是.(3)能与稀盐酸发生氧化还原反应的是;该反应的离子方程式为:.三.解答题(共5小题)24.实验室里常用的干燥剂有:①生石灰,②固体氢氧化钠,③变色硅胶[主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂],④五氧化二磷,⑤无水氯化钙,⑥浓硫酸,⑦碱石灰(主要成分是氢氧化钠、氧化钙)等.(1)上述物质中,属于纯净物的是.A.①②④B.②④⑥C.①②④⑤D.全部上述②、④、⑤、⑥四种干燥剂中,其主要化学成分所属的类别依次为、、、.(填序号)A.酸 B.碱 C.盐 D.氧化物(3)硅胶中无水氯化钴(CoCl2)呈蓝色,吸水后变为粉红色的CoCl2•6H2O,该变化过程属于(填“物理变化”或“化学变化”).(4)下列气体中,能用固体氢氧化钠干燥的是A.CO2 B.HCl C.NO2 D.NH3 E.NO(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为(用化学方程式表示)(6)上述干燥剂中,仅有浓硫酸为液体干燥剂,下列关于浓硫酸的叙述正确的是A.浓硫酸具有吸水性,因而能使蔗糖炭化B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体C.浓硫酸为液体干燥剂,干燥效率高,能用于干燥所有的气体D.浓硫酸在常温下能够使铁、铝等金属钝化.25.现有十种物质,若根据物质的组成将它们进行分类,则:①空气②醋酸③碳酸氢铵④铜⑤硫酸钠⑥氢气⑦石墨⑧食盐水⑨泥浆水⑩蒸馏水(1)属于混合物的有;属于金属单质的有;(3)属于非金属单质的有;(4)属于无机化合物的有.26.(1)下列说法正确的是A.只由一种元素组成的物质一定是纯净物B.金属氧化物一定是碱性氧化物C.酸酐一定是氧化物D.AgI胶体在电场中自由运动E.向Fe(OH)3胶体中逐滴加入稀硫酸会先产生沉淀后沉淀渐渐溶解F.向沸水中滴加饱和FeCl3溶液,继续煮沸至溶液呈现红褐色制备Fe(OH)3胶体G.渗析实验可以证明胶体粒子比溶液中溶质直径大在同温同压下,2gCO2的体积为1120mL,而2gX气体的体积为770mL,则气体X的摩尔质量为.(3)现有A、B、C三种化合物,各取40g相混合,完全反应后,只得B 18g,C49g,还有D生成.已知D的式量为106.现将22gA和11gB混合反应,能生成D的物质的量是.(4)按系统命名法右列有机物的名称是.(5)某化合物的分子式为C5H11Cl,其核磁共振氢谱图中显示三种峰且面积之比为6:4:1,则该物质的结构简式为.27.现有下列10种物质:①H2O ②空气③铝④CaO ⑤H2SO4⑥Ca(OH)2⑦CuSO4•5H2O ⑧碘酒⑨C2H5OH ⑩NaHCO3(11)碳酸钡(12)氨气(13)甲烷(14)稀硝酸,用序号填空:属于混合物的是;属于氧化物的是;属于酸的是;属于碱的是;属于盐的是;属于有机物的是;可以导电的有.28.现有以下物质:①铁②空气③CaCO3固体④CuSO4•5H2O晶体⑤K2SO4溶液⑥酒精(C2H5OH)⑦熔融NaOH.请回答下列问题(填序号):(1)以上物质属于混合物的有;以上物质属于盐的是;(3)以上物质属于电解质的是;(4)写出⑤中溶质的电离方程式.混合物和纯净物参考答案一.选择题(共18小题)1.D 2.B 3.B 4.C 5.B 6.D 7.C 8.B 9.B 10.D 11.D 12.D 13.A 14.A 15.A 16.D 17.B 18.D二.填空题(共5小题)19.FeOFe2O3Fe3O4③④⑦①②⑤⑥⑧⑨⑩①⑨⑩②⑤⑥⑧②⑤⑥ 20.①⑨都是单质都是盐都是由非金属元素组成的化合物21.混合物单质22.①④⑦⑥③⑤23.⑤⑧③④⑥②⑦⑨⑤⑥⑧⑨⑩⑩2Al+6H+=2Al3++3H2↑三.解答题(共5小题)24.CBDCA化学变化DECaO+H2O=Ca(OH)2D 25.①⑧⑨④⑥⑦③⑤⑩26.EG64g/mol0.25mol3,4-二甲基辛烷27.②⑧(14)①④⑤⑥⑦⑩(11)⑨(13)①③(14)28.②⑤③④③④⑦K2SO4=2K++SO42-,。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双氧水是纯净物吗
双氧水是混合物。
物质的分类分成纯净物和混合物。
纯净物指的是只含一种物质,而双氧水指的是过氧化氢的水溶液。
过氧化氢这种物质本身是一种纯净物,其固体为分子晶体,常温下是淡蓝色的粘稠性液体。
纯净物是指由一种单质或一种化合物组成的物质,组成固定,有固定的物理性质和化学性质的物质,有专门的化学符号,能用一个化学式表示。
特点
1.组成固定,有固定的物理性质和化学性质的物质。
2.有专门的化学符号(即有化学式)。
例:氧气、氮气、氯酸钾等都是纯净物。
举例
02、N2、C、Mg、Fe、P205、Fe304、Mg0、P、H20、H2S04、NaOH、Na2C03等。
注意:如果某纯净物中含有某元素的同位素(例如“水”中既有HzO,又有Dz0),那么此物依然是纯净物。
分类:1.化合物:由两种(或以上)元素组成的纯净物。
如:二氧化碳(COz)、氧化铁(Fez03)、高锰酸钾(KMn04)
2.单质:由同种元素组成的纯净物。
如:氢气(H2)、氮气(N2)、氧气(02)
与混合物区别
1.纯净物是由同种物质组成的,它具有一定的组成,可以用一个化学式来表示,纯净物具有一定的性质(如有固定的熔、沸点)。
2.混合物由不同种物质混合而成,没有一定的组成,不能用一个化学式表示。
混合物没有固定的性质,各物质保持其原有性质(如没有固定的熔、沸点)。
