《定量分析简明教程》习题二参考答案
《定量分析简明教程》第二章习题答案

《定量分析简明教程》 第二章习题答案2-2(6) 答:分析纯NaCl 试剂若不作任何处理就用以 标定AgNO 3溶液的浓度,结果会偏高,原因是NaCl 易吸湿,使用前应在500~600︒C 条件下干燥。
如不作上述处理,则NaCl 因吸湿,称取的NaCl 含有水分,标定时消耗AgNO 3体积偏小,标定结果则偏高。
H 2C 2O 4⋅2H 2O 长期保存于干燥器中,标定NaOH 浓度时,标定结果会偏低。
因H 2C 2O 4⋅2H 2O 试剂较稳定,一般温度下不会风化,只需室温下干燥即可。
若将H 2C 2O 4⋅2H 2O 长期保存于干燥器中,则会失去结晶水,标定时消耗NaOH 体积偏大,标定结果则偏低。
2-3(1) H 2C 2O 4⋅2H 2O 和KHC 2O 4⋅ H 2C 2O 4⋅2H 2O 两种物质分别和NaOH 作用时,-△n (H 2C 2O 4⋅2H 2O):-△n (NaOH)=1:2 ;-△n (NaOH): -△n (KHC 2O 4⋅ H 2C 2O 4⋅2H 2O)=3:1 。
(2)测定明矾中的钾时,先将钾沉淀为KB(C 6H 5)4,滤出的沉淀溶解于标准EDTA —Hg(II )溶液中,在以已知浓度的Zn 2+标准溶液滴定释放出来的 EDTA : KB(C 6H 5)4+4HgY 2-+3H 2O+5H +=4Hg(C 6H 5)++4H 2Y 2-+H 3BO 3+K +H 2Y 2-+Zn 2+=ZnY 2-+2H +K +与Zn 2+的物质的量之比为1:4 。
2-4解:m (NaOH)=c (NaOH)v (NaOH)M (NaOH)=0.1mol ·L -1⨯0.500L ⨯40g ·mol -1=2g1-1-142424242L mol 8.17molg 9895%L 1840)SO (H )SO H ()SO H )SO H (⋅=⋅⨯⋅==−g M w c (浓ρ c (H 2SO 4稀)v (SO 4稀)=c (H 2SO 4浓) V (H 2SO 4浓)0.2mol ⋅L -1⨯0.500L=17.8mol ⋅L -1⨯ V (H 2SO 4浓)V (H 2SO 4浓)=5.6mL2-5解:2HCl+Na 2CO 3=2NaCl+H 2O+CO 2-△n (Na 2CO 3)=-(1/2)△n (HCl)Ss m M V c w m V T w V m T )CO Na ((HCl)HCl)(21)CO Na (%30.58g2500.0mL 00.25mL g 005830.0HCl)(HCl)/CO Na ()CO Na (mL g 005830.0mL1mol 106.0g L 001.0L mol 1100.021HCl)()CO Na (HCl)/CO Na (32321-32321-1-13232==⨯⋅==⋅=⋅⨯⨯⋅⨯==−或:2-6解:1-1-24222222422422L mol 05229.0L2500.0mol 126.1g g 6484.1O)H 2O C H (O)H 2C (H O)H 2O C (H )O C H (⋅=⨯⋅=⋅⋅O ⋅=4V M m c 2-7解:(反应式略)-△n(NaOH)=-△n (KHC 8H 4O 4)m (KHC 8H 4O 4)=c (NaOH)v (NaOH)M (KHC 8H 4O 4)=0.1mol ⋅L -1⨯0.020L ⨯204.2g ⋅mol -1=0.4g-△n (H 2C 2O 4⋅2H 2O)=-(1/2)△n (NaOH)m (H 2C 2O 4⋅2H 2O)=(1/2)⨯0.1mol ⋅L -1⨯0.020L ⨯126g ⋅mol -1=0.13g%2.0%15.013.00002.0±=±=±==gg T E RE 2-8解:滴定反应:Na 2B 4O 7⋅10H 2O+2HCl=4H 3BO 3+2NaCl+5H 2O-△ n (Na 2B 4O 7⋅10H 2O)=-(1/2)△n(HCl)-△ n (B)=-2△n (HCl)SSm M V c w w M M w w M M w m M V c w B)((HCl)(HCl)2B)(%81.10%36.95mol 381.4g mol 10.81g 4O)10H O B Na (O)H 10O B (Na (B)4B)(%30.50%36.95mol g 4.381mol 201.2g O)H 10O B (Na O)H 10O B Na ()O B Na ()O B (Na %36.959536.0g000.1mol 381.4g L 02500.0L mol 2000.021O)H 10O B Na ((HCl)(HCl)21O)H 10O B Na (1-1-274227421-1-272227227427421-127422742==⨯⋅⋅⨯=⋅⨯⋅==⨯⋅⋅=⋅⨯⋅===⋅⨯⨯⋅⨯=⋅=⋅−或:2-9解:CO 32-+2H +=CO 2+H 2O-△ n (CO 32-)=-(1/2)△n (HCl)-△ n (BaCO 3)+{-△n (Na 2CO 3)}=-(1/2)△n (HCl)(HCl)(HCl)21)CO (Na )]BaCO (1[)BaCO ()BaCO (32333V c M w m M w m S S =−⋅+⋅L 03000.0L mol 100.021mol106)]BaCO (1[200.0mol 197g )(BaCO g 200.01-131-3⨯⋅⨯=⋅−⨯+⋅⨯=g w g w 解w (BaCO 3)=44.4% w (Na 2CO 3)=55.6%2-10解:Al 3++H 2Y 2-=AlY -+2H +-△ n (Al 3+)=-△n (EDTA) -△n (Al 2O 3)=-(1/2)△n (EDTA)Zn 2++ H 2Y 2-=ZnY 2-+2H +-△n (Zn 2+)=-△n (EDTA)%9.24g2000.0mol g 0.102)L 00550.0L mol 05005.0L 02500.0L mol 05010.0(21)O Al ()]Zn ()Zn ()EDTA (EDTA)([21)O Al (1113232=⋅⨯⨯⋅−⨯⋅=−=−−−Sm M V c V c w 2-11解:ClO 3-+6Fe 2++6H +=Cl -+6Fe 3++3H 2O-△n (ClO 3-)=-(1/6)△n (Fe 2+) -△n [Ca(ClO 3)2]=-(1/12) △n (Fe 2+)Cr 2O 72-+6Fe 2++14H +=2Cr 3++6Fe 3++7H 2On (Fe 2+)=6n (Cr 2O 72-)%08.12g2000.0mol g 0.207)L 01000.0L mol 02000.06L 02600.0L mol 1000.0(121])Ca(ClO [11123=⋅⨯⨯⋅⨯−⨯⋅=−−−w 2-12解:Ca 2++C 2O 42-=CaC 2O 4CaC 2O 4+2H += H 2C 2O 4+ Ca 2+5 H 2C 2O 4+2MnO 4-+6H +=2Mn 2++10CO 2+8H 2O-△n(CaO)=-△n (Ca)=-(5/2)△n (MnO 4-)g 2.0%40mol g 08.56mL 030.0L mol 02.025CaO)()CaO ()KMnO ()KMnO (251144=⋅⨯⨯⋅⨯==−−w M V c m S。
北大《定量化学分析简明教程》

北大《定量化学分析简明教程》第一章定量分析概论1. 为什么用作滴定分析的化学反应必须有确定的计量关系?什么是“化学计量点”?什么是“终点”?为什么滴定分析对化学反应进行的完全程度的要求比重量分析高?解答:滴定分析所依据的化学反应只有具有了确定的计量关系,才能进行准确的计算。
化学计量点是指当加入的滴定剂的量(摩尔)与被测物的量(摩尔)之间,正好符合化学反应式所表示的化学计量关系。
终点:指示剂为指示剂的变色点.2. 若将H 2C 2O 4.·2H 2O 基准物长期保存于保干器中,用以标定NaOH 溶液的浓度时,结果是偏高还是偏低?分析纯的NaCl 试剂若不作任何处理用以标定 AgNO 3溶液的浓度,结果会偏高,试解释之。
解答:H 2C 2O 4.·2H 2O 基准物质长期保存于保干器中易脱水,变成H 2C 2O 4·H 2O 或H 2C 2O 4,若在计算时仍以H 2C 2O 4.·2H 2O 计算,表观的NaOH 浓度为: ='N a O H C N a O HO2H O C H V .22422n N a O H O 2H O C H V M 100022422⨯⨯=∙标W 而实际的NaOH 浓度为:N a O H O C H N a O H V M W C ⨯⨯=42210002标或 N a O H O H O C H N a O H V M W C ⨯⨯=∙242210002标M H2CO4·H2O < M H2CO4·2H2OM H2CO4 < M H2CO+2H2O∴ C’NaOH < C NaOH即标定结果偏高。
同时可对NaCl 标定AgNO 3的情况进行分析。
NaCl 若不作处理含有较多的水分表观的AgNO 3浓度为:C’AgNO3=331000AgNO NaCl AgNO NaCl V M W V n ⨯⨯=标 而实际的AgNO 3浓度为:3231000AgNO O nH NaCl AgNO V M W C ⨯⨯=∙标M NaCl ·nH2O >M NaCl ∴ C ’AgNO3 >C AgNO3即表观浓度偏高。
数值分析简明教程第二课后习题答案 高等教育出社

算法1、 (,题1)用二分法求方程013=--x x 在[1,2]内的近似根,要求误差不超过10-3.【解】 由二分法的误差估计式311*10212||-++=≤=-≤-εk k k a b x x ,得到100021≥+k .两端取自然对数得96.812ln 10ln 3≈-≥k ,因此取9=k ,即至少需2、(,题2) 证明方程210)(-+=x e x f x在区间[0,1]内有唯一个实根;使用二分法求这一实根,要求误差不超过21021-⨯。
【解】 由于210)(-+=x e x f x ,则)(x f 在区间[0,1]上连续,且012010)0(0<-=-⨯+=e f ,082110)1(1>+=-⨯+=e e f ,即0)1()0(<⋅f f ,由连续函数的介值定理知,)(x f 在区间[0,1]上至少有一个零点.又010)('>+=x e x f ,即)(x f 在区间[0,1]上是单调的,故)(x f 在区间[0,1]内有唯一实根.由二分法的误差估计式211*1021212||-++⨯=≤=-≤-εk k k a b x x ,得到1002≥k .两端取自然对数得6438.63219.322ln 10ln 2=⨯≈≥k ,因此取7=k ,即至少需二分误差1.(,题8)已知e=…,试问其近似值7.21=x ,71.22=x ,x 2=,718.23=x 各有几位有效数字?并给出它们的相对误差限。
【解】有效数字:因为11102105.001828.0||-⨯=<=-K x e ,所以7.21=x 有两位有效数字; 因为12102105.000828.0||-⨯=<=-K x e ,所以71.22=x 亦有两位有效数字;因为3310210005.000028.0||-⨯=<=-K x e ,所以718.23=x 有四位有效数字;%85.17.205.0||111=<-=x x e r ε; %85.171.205.0||222=<-=x x e r ε; %0184.0718.20005.0||333=<-=x x e r ε。
定量分析简明教程第二版教学设计 (2)

定量分析简明教程第二版教学设计1. 教学目标本课程的教学目标是使学生能够:•理解定量分析的基本概念和方法;•掌握定量分析常用的数学工具和模型;•熟悉定量分析在不同领域的应用;•能够使用计算机软件进行定量分析并解释分析结果。
2. 教学内容2.1 基本概念和方法•定量分析的概念和基本原理;•定量分析的数据类型和数据处理方法;•定量分析的指标体系和度量方法;•定量分析的常用假设检验和统计推断方法。
2.2 数学工具和模型•概率论和数理统计基础;•回归分析、协方差分析和方差分析等经典模型;•模拟和优化模型等现代定量分析方法。
2.3 应用领域和案例分析•宏观经济分析;•金融市场分析;•生产运作分析;•营销策略分析等。
2.4 计算机软件使用•SPSS、Excel和R等软件的使用;•定量分析结果的解释和呈现。
3. 教学方法本课程采用以下教学方法:•理论授课:讲解定量分析的基本概念和方法,并通过案例分析和课堂讨论加深学生对定量分析的理解。
•实践操作:学生通过使用计算机软件进行实践操作,掌握定量分析的技能。
•课外学习:学生通过阅读相关文献、网上搜索等方式深入了解定量分析的应用领域和最新研究进展。
•个性化辅导:根据学生的差异化需求,提供个性化的辅导和指导,加强学生的学习效果。
4. 教学评估本课程的教学评估包括以下几个方面:•学生课堂出勤率和参与度;•定量分析作业和实践操作的完成情况;•期末考试成绩;•学生的综合能力评估。
5. 教学资源本课程的教学资源包括以下几个方面:•教材:《定量分析简明教程第二版》;•课程资料和案例分析;•计算机软件和数据集。
6. 教学安排本课程的教学安排如下:日期教学内容第1周定量分析基本概念和方法第2周-第4周数学工具和模型第5周-第7周应用领域和案例分析第8周-第10周计算机软件使用第11周期末考试7. 总结定量分析是现代社会不可缺少的分析工具,本课程将针对其基本概念和方法、数学工具和模型、应用领域和案例分析以及计算机软件使用等方面进行系统专业的教学,旨在培养学生对于量化数据的处理和分析能力,并为学生今后从事相关领域的研究和工作奠定坚实的理论基础。
定量分析简明教程

定量分析简明教程在现代社会中,定量分析是一种广泛应用的研究方法。
无论是在学术研究中还是商业领域中,定量分析都被用来收集、处理和解释大量数据。
本文将为您提供一个简明的定量分析教程,帮助您了解定量分析的基本概念和方法。
一、什么是定量分析?定量分析是一种系统的研究方法,通过对数量化数据进行分析和解释来获取实证结果。
它使用数学和统计学方法来处理数据,以便研究者可以从中得出客观可靠且有意义的结论。
定量分析的主要目标是通过定量数据来支持或否定一个假设。
二、定量分析的步骤1.明确研究问题:首先需要明确研究的目的和问题。
确定研究领域和相关文献,然后提出一个明确的研究问题。
2.收集数据:在定量分析中,数据的质量至关重要。
确定合适的数据来源,并确保数据的准确性和完整性。
3.数据预处理:数据预处理包括数据清理、缺失数据处理和异常值处理。
在此阶段,我们需要确保数据的一致性和可靠性。
4.选择适当的统计方法:根据研究问题和数据的性质,选择适当的统计方法进行分析。
常用的统计方法包括描述统计、推断统计和回归分析等。
5.数据分析和解释:通过应用选定的统计方法对数据进行分析,并根据结果对研究问题进行解释和讨论。
6.结果验证和解释:根据研究目的和问题,验证分析结果的可靠性。
如果需要,进行敏感性分析或后续分析。
三、常用的定量分析方法1.描述统计:描述统计是一种对数据进行总结和描述的方法,通过计算平均值、中位数、标准差等统计指标来揭示数据的基本特征。
2.推断统计:推断统计是一种根据样本数据对总体进行推断的方法。
通过样本数据的分析,我们可以对总体进行研究和预测。
3.回归分析:回归分析是一种用来解释因果关系的方法。
它通过建立数学模型来研究自变量和因变量之间的关系,并通过分析模型的系数来解释和预测因变量的变化。
四、定量分析的优点和局限性定量分析具有以下优点:1.客观性:定量分析使用事实和数据来支撑结论,减少主观因素的干扰。
2.可靠性:定量分析使用数学和统计学方法,结果可靠且可复现。
数值分析简明教程第二版课后习题答案(供参考)
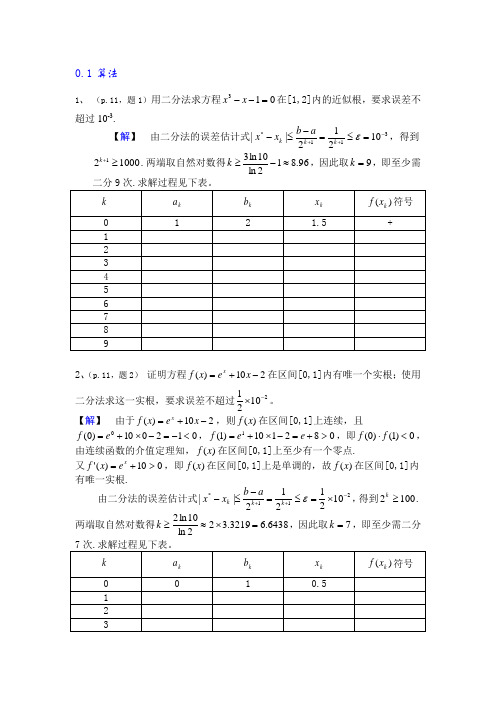
0.1算法1、 (p.11,题1)用二分法求方程013=--x x 在[1,2]内的近似根,要求误差不超过10-3.【解】 由二分法的误差估计式311*10212||-++=≤=-≤-εk k k a b x x ,得到100021≥+k .两端取自然对数得96.812ln 10ln 3≈-≥k ,因此取9=k ,即至少需2、(p.11,题2) 证明方程210)(-+=x e x f x在区间[0,1]内有唯一个实根;使用二分法求这一实根,要求误差不超过21021-⨯。
【解】 由于210)(-+=x e x f x ,则)(x f 在区间[0,1]上连续,且012010)0(0<-=-⨯+=e f ,082110)1(1>+=-⨯+=e e f ,即0)1()0(<⋅f f ,由连续函数的介值定理知,)(x f 在区间[0,1]上至少有一个零点.又010)('>+=x e x f ,即)(x f 在区间[0,1]上是单调的,故)(x f 在区间[0,1]内有唯一实根.由二分法的误差估计式211*1021212||-++⨯=≤=-≤-εk k k a b x x ,得到1002≥k .两端取自然对数得6438.63219.322ln 10ln 2=⨯≈≥k ,因此取7=k ,即至少需二分0.2误差1.(p.12,题8)已知e=2.71828…,试问其近似值7.21=x ,71.22=x ,x 2=2.71,718.23=x 各有几位有效数字?并给出它们的相对误差限。
【解】有效数字:因为11102105.001828.0||-⨯=<=-K x e ,所以7.21=x 有两位有效数字; 因为12102105.000828.0||-⨯=<=-K x e ,所以71.22=x 亦有两位有效数字;因为3310210005.000028.0||-⨯=<=-K x e ,所以718.23=x 有四位有效数字;%85.17.205.0||111=<-=x x e r ε; %85.171.205.0||222=<-=x x e r ε; %0184.0718.20005.0||333=<-=x x e r ε。
定量化学分析简明教程第3版答案

μ的 95%置信区间为:
0.052% 0.052% ⎞ ⎛ ,35.66% + 3.18 × ⎜ 35.66% − 3.18 × ⎟ 4 4 ⎠ ⎝ = (35.58%,35.74%)
1 − α = 0.90 ,则 α = 0.10 , t 0.10 (3) = 2.35
同理:
课 后
μ的 90%置信区间为: (35.60%,35.72%)
ww w.
2+
+ 10CO 2 + 8H 2 O
1 ⎛1 ⎞ c⎜ KMnO 4 ⎟ = 0.050mol ⋅ L−1 2 ⎝5 ⎠
kh da
m 0.3250 × 10 3 = = 0.01988mol ⋅ L−1 M ⋅ V 65.39 × 250.0
w.
1
co
m
⎛1 ⎞ ⎛1 ⎞ c⎜ KMnO 4 ⎟ ⋅ V (KMnO 4 ) ⋅ M ⎜ CaO ⎟ 5 ⎠ ⎝2 ⎠ × 100% w(CaO) = ⎝ 3 m s × 10 5 × 0.020 × 30 × 56.08 40% = × 100% 2m s × 10 3 m s = 0.21g ⎛1 ⎞ K 2 Cr2 O 7 ⎟ = 0.1200mol ⋅ L−1 ,为 ⎝6 ⎠
分析化学习题与部分思考题参考答案
第1章 绪论
1.1 30.0mL 0.150mol·L-1 的 HCl 溶液和 20.0mL 0.150mol·L-1 的 Ba(OH)2 溶液相混合,所 得溶液是酸性、中性、还是碱性?计算过量反应物的浓度。 答案: c(Ba(OH) 2 )(
量) =
2 × 0.150 × 20.0 − 0.150 × 30.0 = 0.015mol ⋅ L−1 (20.0 + 30.0) × 2
定量化学分析简明教程第3版答案

⎛1 ⎞ n⎜ KHC 2 O 4 ⋅ H 2 C 2 O 4 ⎟ = n( NaOH) ⎝3 ⎠
氧化还原反应中:
V (KMnO 4 ) =
第 2 章 习题参考答案
2.2 测定试样中 CaO 的质量分数时,得到如下结果:35.65%、35.69%、35.72%、35.60%。问: (1)统计处理后的分析结果应如何表示? (2)比较 95%和 90%置信度下总体平均值的置信区间。 答案: (1) 结果表示为:n=4, x = 35.66% ,s=0.052% (2) 1 − α = 0.95 ,则 α = 0.05 , t 0.05 (3) = 3.18
4
答
案
2.1 测定某样品中氮的质量分数时,六次平行测定的结果是 20.48%、20.55%、20.58%、20.60%、 20.53%、20.50%。 (1) 计算这组数据的平均值、 中位数、 平均偏差、 标准差、 变异系数和平均值的标准差; (20.54%, 20.54%, 0.12%, 0.037%, 0.046%, 0.22%, 0.019%) (2)若此样品是标准样品,其中氮的质量分数为 20.45%,计算以上测定结果的绝对误差和相对 误差。(+0.09%, 0.44%)
∴σ1 与σ2 无显著差异。 (2)用 t 检验法检验μ1 是否等于μ2 假设μ1=μ2
课 后
(1)用 F 检验法检验σ1=σ2 是否成立(α =0.10) 假设σ1=σ2
F计算
2 s大 0.9 2 = 2 = = 2.2 < F表 = F0.05 (4,3) = 9.12 s小 0.6 2
度(c)的 Na2C2O4 溶液?要配制 100mL 溶液,应称取 Na2C2O4 多少克?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、 选择题1、用同一NaOH 滴定相同浓度和体积的两种弱一元酸,则a K Θ较大的弱一元酸(B ) A 消耗NaOH 多;B 突跃范围大;C 计量点pH 较低;D 指示剂变色不敏锐。
2、滴定分析要求相对误差±0.1%,万分之一的分析天平绝对误差为±0.0001g ,则一般至少称取试样质量为(B )A0.1g ;B0.2g ;C0.3g ;D0.4g.3、以HCl 溶液滴定某碱样,滴定管的初读数为0.25±0.01ml ,终读数为32.25±0.01ml ,则用去HCl 溶液的准确体积为(D )A32.0ml ;B32.00ml ;C32.00±0.01ml ;D32.00±0.02ml 。
4、指示剂的变色范围越窄,则(A )A 滴定越准确;B 选择指示剂越多;C 变色敏锐;D 滴定越不准确。
5、溶液pH 降低,EDTA 的配位能力会(B )A 升高;B 降低;C 不变;D 无法确定。
6、用KMnO 4法测定Ca 2+离子,所采用的滴定方式是(B )法A 直接滴定法;B 间接滴定法;C 返滴定法;D 置换滴定法。
7、不同波长的电磁波,具有不同的能量,其波长与能量的关系为(B )A 波长愈长,能量愈大;B 波长愈长,能量愈小;C 波长无能量无关。
8、在酸性条件下,莫尔法测Cl -,其测定结果(B )A 偏低;B 偏高;C 正好;D 无法确定。
9、下列有关配体酸效应叙述正确的是(B )A 酸效应系数越大,配合物稳定性越大;B 酸效应系数越小,配合物稳定性越大;CpH 越高,酸效应系数越大。
10、酸性介质中,用草酸钠标定高锰酸钾溶液,滴入高锰酸钾的速度为(B )A 同酸碱滴定一样,快速进行;B 开始几滴要慢,以后逐渐加快;C 始终缓慢;D 开始快,然后逐渐加快,最后稍慢。
11、酸碱滴定中,选择指示剂可不考虑的因素是(D )ApH 突跃范围;B 要求的误差范围;C 指示剂的变色范围;D 指示剂的结构。
12在硫酸—磷酸介质中,用17221.061-∙==L mol O Cr K c 的K 2Cr 2O 7滴定121.0)(-+∙≈L m o l Fe c 硫酸亚铁溶液,其计量点电势为0.86V ,对此滴定最适合的指示剂为(C )A 邻二氮菲亚铁V 06.1='Θϕ; B 二苯胺V 76.0='Θϕ;C 二苯胺磺酸钠V 84.0='Θϕ; D 亚甲基蓝V 36.0='Θϕ13、在1mol·L -1HCl 介质中,用FeCl 3(V Fe Fe 77.023/=++Θϕ)滴定SnCl 2(V Sn Sn 14.024/=++Θϕ)终点电势为(D )A0.56V ;B0.54V ;C0.46V ;D0.35V .14、当M+Y 反应时,溶液中有另一配位剂L 存在,若1)(=L M α,则(A )A M 与L 没有副反应;B M 与L 的副反应严重;C M 与L 的副反应较弱。
15、共轭酸碱对K a 的K b 的关系(C )AK a +K b =K w ;B K a /K b =K w ;C K b =K w / K a ;16、pH=5.0,45.6lg )(=H Y α,若用EDTA 直接滴定M 离子,则绝对稳定常数)(MY K f Θ至少为(A )A1014.45;B1012.45;C108;D1012.90;17、定量分析工作中,要求测定结果的误差(D )A 愈小愈好;B 等于0;C 没有要求;D 在允许误差范围之内。
18、0.1mol·L-1Na 2CO 3(K b1=1.8×10-4,K b2=2.4×10-8)溶液的pH 值(B )A2.38;B11.62;C8.00;D6.00。
19、系统误差的性质(A )A 单向性;B 重复性;C 单峰性;D 对称性。
20、某物质的摩尔吸光系数(ε)很大,则说明(C )A 该物质溶液的浓度很大;B 光通过该物质溶液时的光程长;C 该物质对某波长的光吸收能力很强;D 测定该物质灵敏度很高。
二、填空题1、对照实验的目的是(检验系统误差是否存在);2、空白试验的目的是(减小试剂误差);3、F 检验的目的是(检验精密度是否存在显著性差异)4、为检查测定结果与标准值间是否存在显著性差异,应用(t )检验;5、某酸碱指示剂9100.1-⨯=H In K ,则该指示剂的变色范围为(1±=HIn pK pH );6、一氧化还原指示剂V 86.0='Θϕ,电极反应d e Ox Re 2=+,则其理论变色范围为(n059.0+'=Θϕϕ); 7、莫尔法使用的指示剂是(K 2CrO 4);8、EDTA 是(乙二胺四乙酸二钠盐)的简称;9、在吸光光度法,透射光强度I t 与入射光强度I 0之比即为I t /I 0,称为(透光度);10、吸光光度法用于定量测定的理论依据是(朗比定律:A=εbc );11、酸碱反应的实质是(质子转移)过程,反应达平衡时共轭酸碱对(得失质子数相等),表达这种数量关系的数学表达式称为质子(质子条件式);12、准确是指(测定结果)与(真值)之间的符合程度,它可用(误差)来表示;13、影响强碱滴定弱酸的滴定曲线突跃范围的因素为(c )和(k a );14、在用Na 2C 2O 4对KMnO 4,通常用(H 2SO4)调节酸度。
三、判断题1、测定结果精密度高,准确度不一定高(√);2、只要多做几次平行测定,就可避免随机误差对测定结果的影响(×);3、做平行测定的目的是减小系统误差对测定结果的影响(×);4、金属指示剂和酸碱指示剂的变色原理都是一样的,随着c(H +)的变化而发生颜色改变(×);5、指示剂的变色点与滴定反应的化学计量点不符合,产生的误差属于偶然误差(×);6、可疑值的取舍问题实质上是区分偶然误差和过失的问题(×);7、pH=3.05是一个三位有效数字(×);8、用EDTA 法测定某金属离子时,酸度越低,)(MY K f 'Θ值越大,对准确滴定有利(×);9、测定混合酸碱溶液时,若消耗HCl 的体积V1<V2,则混合碱的组成一定是NaOH 和Na 2CO 3(×);10、(NH 4)2S 水溶液的质子条件式为:c(H +)+c(HS -)+2c(H 2S)=c(OH -)+c(NH 3)(√);11、在沉淀滴定法中,由于沉淀的吸附所产生的误差属于偶然误差(×);12、标定KMnO4溶液,为使反应较快进行,可以加入Mn 2+(×);13、以AgNO 3标准溶液滴定NaCl 时,K 2CrO 4多加了一些会产生负误差(√);14、以NaOH 溶液滴定HCl 溶液,用甲基橙作指示剂引起的指示剂误差为正误差(×);15、以FeSO4溶液滴定Ce 4+(V 126=计ϕ)=1.26V 溶液时,用邻苯氨基苯甲酸(V 89.0=Θϕ)作指示剂所引起的指示剂误差为正误差(×)。
四、简答题:1、 EDTA 配位滴定过程中影响突跃范围大小的主要因素?①)(MY K f 'Θ的影响 当c(M)一定时,)(MY K f 'Θ越大,滴定突跃范围越大②浓度的影响 当)(MY K f 'Θ一定时,金属离子的原始浓度c(M)越大,突跃范围越大。
2、用Na 2C 2O 4对KMnO 4标准溶液的标定过程中,需要何种介质?为什么?答:该反应需要在酸性介质中进行,通常用H2SO4控制溶液酸度,避免使用HCl 或HNO 3,因Cl -具有还原性,可与MnO4-作用,而HNO 3具有氧化性,可能氧化被滴定的还原物质。
3、酸碱指示剂选择的原则是什么? -++⇔In H HIn酸式色 碱式色)()()()(HIn c In c H c HIn K -+Θ= )()(lg )(-Θ-=In c HIn c HIn pK pH 1)()(=-In c HIn c )(HIn pK pH Θ=为指示剂的理论变色点,指示剂在变色点所显示的颜色,是酸式型和碱式型等浓度的混合色。
10)()(>-In c HIn c 1)(-<ΘH I n pK pH (只能看到酸式色) 10)()(<-In c HIn c 1)(+>ΘHIn pK pH (只能看到碱式色) 可见,当pH 低于1)(-<ΘHIn pK pH 或超过1)(+>ΘHIn pK pH 时,都看不出指示剂随pH 值改变而变化,只有在1)(±=ΘHIn pK pH 范围内,人们才能觉察到由pH 改变所引起的指示剂颜色的变化,这个可以看到指示剂颜色的变化的pH 区间,叫做指示剂的理论变色范围。
滴定突跃是指示剂选择的依据,只要指示剂的理论变色范围在突跃范围以内(或基本在突跃范围以内),都可用该指示剂指示终点。
4、配合物的绝对稳定常数与条件稳定常数有什么不同?哪些条件影响配合物的条件稳定常数的大小?以EDTA 为例来说明这个问题。
EDTA 与金属离子的配位反应可写成(略去离子电荷)。
MY Y M ⇔+其平衡常数为:c(M)c(Y))MY (c )MY (K f =Θ平衡常数式中:)MY (c 、)(M c 、)(Y c 是指达到平衡时,MY 型体、M 型体、Y 型体的浓度,但不包括EDTA 、金属离子及生成物的其他型体。
)MY (K f Θ是MY 的形成常数,也称为EDTA 配合物的绝对稳定常数。
外界条件对EDTA 配合物的稳定性会产生较大影响。
例如,溶液的酸度和其他配位剂的存在等外界条件的变化会明显影响配合物的稳定性。
若利用M 、Y 、MY 在一定条件下的副反应系数分别将M 、Y 、MY 型体的平衡浓度c(M)、c(Y)、c(MY)校正为)(M c '、)(Y c '、)(Y M c '。
)()(Y c Y c Y '=α、)()(M c M c M '=α、)()(MY c Y M c MY '=α )()()(c(M)c(Y))MY (c )MY (K )()()(f Y c M c Y M c MY Y M '''∙==Θααα )()()(f )MY (K )()()(Y M MY Y c M c Y M c αααΘ=''' 将)()()(Y c M c Y M c '''定义为条件稳定常数)(K f MY ',所以)()()(f )MY (K )(Y M MY f MY K αααΘ=' )(M c ' :未参加主反应的游离金属离子各种存在型体的浓度总和;)(Y c ' :未参加主反应的各种型体EDTA 的浓度总和;)(Y M c ':包括MY 在内的以及MY 其它型体浓度的总和。
