光催化降解有机污染物的机理和动力学研究
光催化降解有机污染物进展课件

术, 2008, 31(2): 51-55. [13] 邓谦, 吕晓萌, 蔡铁, 等. 磷钨酸表面修饰TiO2光催化降解空气污染物
• TiO2 用于居室空气处理尤其具优势, 可将T iO2 镀于内墙、家具和装饰物表面, 也可将TiO2 掺和 于混凝土中使用, 甚至直接应用到污染源上。张 悠金[10]等将纳米TiO2 加入到卷烟烟嘴中, 实现 了对烟焦油和尼古丁的截留( 截留率28.14%~ 45.13%) , 这对于人体健康及居室环境空气质量 具有十分重要的意义。
• 但迄今为止, 对TiO2 处理大气有机污染物的研究 多以有限的半封闭/ 封闭空间为主, 对大空间的 研究较少, 关键在于对TiO2 高催化性及长效性 的研发, 以利于降低处理成本。
. 利用TiO2 这些特性, 将之镀于钢桥、铁索和 工业设备表面可以抗蚀; 镀于照明工程灯具 外壳、高层建筑材料表面、饮食行业抽油 烟设备以及各种需人工频繁清洗或人工难 予清洗的设施上, 可以实现完全自清洁或最 大限度减少清洁周期和降低清洁强度; 镀于 日用品、纤维制品、文具和玩具表面可以 消毒抗菌。因此, T iO2 在抗菌抗蚀与自清 洁方面的应用前景是广阔的。
• 有效催化EEA 降解为F-和CO2[12]。因此,杂多酸 在光催化治理工业废水中难降解的表面活性剂方 面有应用价值。
④杂多酸光催化降解其他有机污染物
• 室内空气污染问题日益严重,对人体健康的危害 已引起了人们的强烈关注。在诸多的室内污染物 中,甲醛为最重要的室内污染物之一。邓谦[13]等 以湿法浸渍修饰TiO2制备了H3PW12O40/TiO2复 合催化剂,以含甲醛和丙酮的气体模拟污染空气, 研究其在复合光催化剂作用下的光催化降解行为。 结果表明, H3PW12O40含量为21.9%时, H3PW12O40与TiO2
光催化降解有机污染物的机理和反应动力学研究

光催化降解有机污染物的机理和反应动力学研究近年来, 环境问题愈演愈烈,其中有机污染物的问题尤为严重。
而光催化降解有机污染物作为一种新型的环保技术,正逐渐成为研究的热点。
本文介绍了光催化降解有机污染物的机理和反应动力学研究的最新进展。
一、光化学反应机理光催化降解有机污染物是靠催化剂、光源和有机污染物之间的复杂反应来实现的。
通常,催化剂是指氧化性或还原性强的复合氧化物,例如TiO2、ZnO和Fe2O3等。
在催化物的表面,光催化反应被分为两个阶段,第一步是光激发,即光子被催化物中的电子吸收,使电子升级,催化剂的价带被填满,同时导带获得一个空穴。
在第二步中,空穴和电子被分离并移动至催化剂的表面。
该过程产生了一系列化学反应,包括氧化还原等。
最终生成水和CO2等无害物质。
二、反应动力学在进行光催化降解有机污染物的实验时,研究人员经常关注的是反应编号、曲线和速率等反应动力学参数。
实验结果表明,反应物浓度、光照强度、温度和催化剂种类均对反应动力学参数有影响。
通常情况下,反应速率常数k为反应动力学参数的衡量标准。
由于复杂的反应机理和外部机制的干扰,使得反应动力学的研究难度增加。
研究人员通常采用数学模型,包括反应速率常数、反应动力学方程和批处理反应等方法,来研究反应动力学。
最近几年,研究人员已经开发了新的研究技术,包括计算流体力学模拟、小角度散射、拉曼光谱、X射线光电子能谱等。
这些新的技术不仅使得反应动力学的研究更加精确,同时也能够提高反应的效率和稳定性。
三、研究进展随着科技的不断进步,光催化降解有机污染物的机理和反应动力学研究也取得了巨大的进展。
在反应机理的研究方面,未来的发展重点是寻找新型的催化剂,并探索新的反应机理;在反应动力学方面,将进一步探究反应条件和反应剂类型对反应速率的影响,并进一步提高光催化反应的效率和稳定性。
总之,在光催化降解有机污染物的机理和反应动力学研究方面,我们正处于不断发展的阶段。
未来的研究,将进一步深入挖掘光催化降解技术的内在机理和性质,以期实现更高效、更环保的光催化降解过程。
光催化技术在环境污染物降解中的应用及机理研究

光催化技术在环境污染物降解中的应用及机理研究摘要环境污染已成为全球性的重大问题,光催化技术作为一种绿色环保的污染物降解技术,近年来得到了广泛的研究和应用。
本文综述了光催化技术的原理、应用及机理研究进展。
首先介绍了光催化技术的定义、发展历程以及其在降解污染物方面的优势。
其次,详细阐述了光催化降解污染物的机理,包括光生电子-空穴对的产生、氧化还原反应、活性物种的生成和参与反应等。
然后,针对不同类型的污染物,例如有机污染物、重金属离子、氮氧化物等,概述了光催化技术在环境污染治理方面的应用,并分析了其优缺点。
最后,展望了光催化技术未来的发展方向,包括新型光催化材料的研发、光催化反应体系的优化以及光催化技术与其他技术的协同应用等。
关键词:光催化技术;环境污染物降解;机理研究;应用;发展趋势1. 引言随着工业化进程的不断推进,环境污染问题日益突出,对人类健康和生态环境造成了严重威胁。
传统的污染物治理方法,例如焚烧、吸附、化学沉降等,存在能耗高、二次污染严重、处理效率低等缺点,难以满足日益严格的环境保护要求。
因此,开发高效、环保的污染物治理技术至关重要。
光催化技术是一种利用光能驱动催化剂发生氧化还原反应,从而降解污染物的技术,近年来得到了广泛的研究和应用。
光催化技术具有以下优点:*高效:光催化剂可以将光能转化为化学能,实现对污染物的深度降解,甚至可以将有机污染物彻底氧化成二氧化碳和水。
*环保:光催化过程不涉及高温高压,不产生二次污染,是一种绿色环保的污染治理技术。
*成本低:光催化剂可以循环使用,且光能来源丰富,因此具有较低的运行成本。
2. 光催化技术的原理光催化技术是利用半导体光催化剂在光照条件下发生的氧化还原反应,实现对污染物的降解。
其核心原理是光生电子-空穴对的产生和分离。
2.1 光生电子-空穴对的产生当光催化剂吸收能量大于其禁带宽度的光子时,价带上的电子被激发到导带,形成电子-空穴对。
价带上的空穴具有强氧化性,可以氧化还原反应中的还原剂,而导带上的电子具有强还原性,可以还原反应中的氧化剂。
光催化降解水体有机污染物的研究进展

光催化降解水体有机污染物的研究进展一、本文概述随着工业化的快速发展和人口的不断增长,水体污染问题日益严重,其中有机污染物是主要的污染源之一。
有机污染物不仅会对生态环境造成破坏,还会对人类健康产生严重威胁。
因此,寻找一种高效、环保的治理方法显得尤为重要。
光催化技术作为一种新兴的水体净化技术,以其独特的优势在有机污染物降解领域受到了广泛关注。
本文旨在综述光催化降解水体有机污染物的最新研究进展,分析各种光催化剂的性能和应用,探讨光催化技术的机理和影响因素,以期为未来光催化技术在环境治理领域的应用提供理论支持和实践指导。
本文将对光催化技术的基本原理进行简要介绍,包括光催化剂的种类、光催化反应过程以及影响光催化效率的因素等。
然后,重点综述近年来光催化降解水体有机污染物的研究进展,包括新型光催化剂的开发、光催化反应条件的优化、光催化与其他技术的联合应用等方面。
还将对光催化技术在实际应用中所面临的挑战和问题进行探讨,如光催化剂的稳定性、光催化反应的动力学问题等。
本文将对光催化技术的未来发展方向进行展望,以期为该领域的研究人员提供有益的参考和启示。
二、光催化降解技术基础光催化降解技术是一种利用光催化剂在光照条件下,产生具有强氧化性的活性物种(如羟基自由基等),从而实现对有机污染物的降解和矿化的高级氧化技术。
这一技术自上世纪70年代被发现以来,因其高效、环保的特性,已成为水体有机污染物治理的热门研究领域。
光催化降解技术的核心在于光催化剂的选择和设计。
常用的光催化剂包括二氧化钛(TiO2)、氧化锌(ZnO)、硫化镉(CdS)等半导体材料。
这些材料在光照下能够吸收光能,产生电子-空穴对,进而生成活性物种。
其中,TiO2因其化学稳定性好、光催化活性高、无毒无害等优点,成为最常用的光催化剂之一。
光催化降解技术的另一个重要方面是光照条件的选择。
紫外线(UV)光具有较高的能量,能够激发光催化剂产生更多的活性物种,因此常被用于光催化降解实验。
光催化降解水体中有机污染物的研究分析(可编辑修改word版)

光催化降解水体中有机污染物地研究一、实验目地通过本实验了解光催化地基本原理,掌握亚甲基蓝等有机污染物降解地实验方法和光催化降解地动力学参数测定,掌握光催化中紫外光源地使用及有机物地光谱分析法.二、实验原理20 世纪70 年代以来,利用半导体光催化氧化水中污染物地工作日益为人们所重视,其优点主要在于:首先,利用半导体光催化氧化降解水中污染物不同于单纯地物理方法,化学方法和生物方法地水处理,处理流程简单,无二次污染,处理速度比微生物法快;其次,半导体光催化氧化可以处理各种无机和有机污染物使其矿化,是一种氧化处理方法,最关键地是半导体光催化氧化过程有可能利用太阳光资源,节能且无污染.目前,在多相光催化反应所使用地半导体催化剂中,TiO2以其无毒、催化活性高、氧化能力抢、稳定性好最为常用.研究表明:纳米 TiO2对紫外线具有很强地吸收能力,具有很高地光催化活性,当受到波长小于 388nm 地紫外光照射后,纳米TiO2粒子将分别在导带和价带上产生大量地光电子(e)和光生空穴(h+),e和 h+经过一系列反应可生成含氧小分子活性物种•OH 、H2O2、O2-等,这些含氧小分子物种具有极强地氧化还原能力,可以光催化降解水中地有机污染物,将其直至完全矿化为 CO2和 H2O,并可以光催化还原重金属离子和光催化杀菌.光催化机理可用下式说明:TiO2 + H2O—hv—>e + h+ h++ H2O →▪OH + H+h++ OH-→▪OH02+ e→▪O2-O2-+ H+-→H2O▪2HO2▪→O2+ H2O22 2H2O2 + ▪O - ▪OH+OH-+O羟基自由基-OH 是光催化反应地一种主要活性物质,对光催化氧化起决定作用,吸附于催化剂表面地氧基水合悬浮液中地 OH-、H2O 等均可产生该物质,氧化作用既可以通过表面键合羟基地间接氧化,即粒子表面捕获地空穴氧化;又可在粒子内部或颗粒表面经价带空穴直接氧化;或同时起作用,视具体情况有所不同.表面吸附分子氧地存在会影响光催化胜率和量子速率.但由于 TiO2地带隙较宽(约 3.2ev),能利用地太阳能大约仅占太阳光强地 3%,而且由于光激发产生地电子与空穴地复合,光量子效率很低.为了提高对太阳能地利用率,并积极改善催化效率,人们已进行了大量地研究工作,如采取一些表面修饰改性技术,射击研制高效能反应器等.三、仪器与试剂自镇流荧光高压汞灯(125W);磁力搅拌器;721 型分光光度计;亚甲基蓝(分析纯);二氧化钛;过氧化氢(分析纯).四、实验步骤1、实验方法及试样分析称取一定量地亚甲基蓝粉末,用蒸馏水配成 100mg/L 地溶液.取 100ml 置于玻璃皿中,加入一定量地 TiO2粉末,用玻璃棒搅拌,使 TiO2粉末分布均匀.然后将玻璃皿置于磁力搅拌器上,磁力搅拌器上方放置自镇流荧光高压汞灯.在稳定地光照条件下,反应一段时间后,取出反应悬浮液,离心过滤(3000r/min)、测上清液地吸光度,计算不同反应条件下地染料脱色率.亚甲基蓝分析采用分光光度法,亚甲基蓝最大吸收波长为 665nm,在该波长下用 721 型分光光度计以去离子水为参比,测得亚甲基蓝溶液在反应前后地吸光度来计算.试样地脱色率 D 以下式计算:=A0-AA0 ⨯100%D式中:A——亚甲基蓝溶液地初始吸光度;A——反应结束后亚甲基蓝溶液地吸光度.2、实验内容(1)TiO2加入量地影响本组实验取浓度为 10mg/L 地亚甲基蓝溶液 100ml,光照时间 1h,通过改变TiO加入量:0g、0.3g、0.5g、0.7g、1.0g,利用分光光度计分别在 665nm 处测2得反应前后地吸光度,计算出脱色率.(2)亚甲基蓝溶液初始浓度地影响,汞灯光照时间 1h,亚甲基蓝溶液 100ml,改变亚甲基蓝溶液取 0.5g TiO2浓度,分别在亚甲基蓝浓度为 2、6、8、10mg/L 时进行反应,利用分光光度计分别在 665nm 处测得反应前后地吸光度,计算出脱色率.(3)光照地影响本组实验 TiO2 地投加量为 0.5g,浓度为 10mg/L 地亚甲基蓝溶液 100ml,汞灯光照时间分别取 0.5、1.5、2.0、2.5、3.0h.利用分光光度计分别在 665nm 处测得反应前后地吸光度,计算出脱色率.五、数据处理:加入量曲线并进行分析;1、绘制亚甲基兰脱色率— TiO2用量变化数据表表2-1 脱色率随 TiO2从上图可以看出,随着投入地 TiO2 地增加,脱色率越来越大,当加入地 TiO2=0.3g 时,脱色率为最高,即当 TiO2=0.3g 为最好地投入量,后有下降,并趋于平衡.2、绘制亚甲基兰脱色率-溶液初始浓度曲线并进行分析;表 2-2 脱色率随亚甲基兰溶液初始浓度变化数据表亚甲基兰浓度 (mg/L ) 2 6 8 10原吸光度 A 0.261 0.721 1.074 1.193 吸光度 A 0.054 0.083 0.080 0.072 脱色率/% 79.388.592.694.0备注光照时间:60min ; 测定波长:665nm ; 比色皿:1cm. 脱色率 D=(A 0-A)/A 0亚甲基蓝脱色率与TiO2加入量曲线120 10080 0.3, 9 80.25, 960.7, 95.8 1, 95.560 40系列120 0, 21.6 0 00.20.4 0.6 0.8 11.2TiO2加入量(g )脱色率/%脱色率与光照时间关系曲线96.896.6 96.4 96.2 96 95.8 95.6 95.4 95.2 95120, 96.4 150, 96.5 180, 96.6 90, 96.160, 95.630, 95.2 050100光照时间/min150 200光照时间 30 60 90 120 150 180(min )吸光度 A 0.063 0.057 0.051 0.047 0.046 0.044 脱色率/% 95.2 95.696.196.496.596.6备注亚甲基兰原液浓度: 10mg/L ; 测定波长:665nm; 比色皿:1cm.脱色率 D=(A 0-A)/A 0系列1从上图可以看出,在投入地 TiO2 地量都一定时,随着初始浓度地增加而增加, 随后增加幅度变小.3、绘制亚甲基兰脱色率—光照时间曲线并进行分析亚甲基蓝原液地吸光度 A 0=1.303由上图可知:脱色率随光照时间地增加而增加.脱色率与初始浓度的关系曲线96 94 92 90 88 86 84 82 80 7810, 948, 92.66, 88.52, 79.3 024 6 8 10 12溶液初始浓度(mg/l )系列1脱色率/%脱色率/%六、实验结果讨论1、实验过程中出现地现象:不管是 TiO2 加入量增加、初始浓度增加、光照时间增加,亚甲基兰都是由蓝色逐渐变为白色,离心后,上清液为无色透明.2、影响光催化降解地因素有:TiO2 颗粒大小、光照强度、搅拌速度、催化剂用量、温度、初始浓度、PH 等.影响光催化降解地催化活性因素有:TiO2 颗粒大小、催化剂用量、温度、PH 等.3、本实验系统地光催化机理:TiO2 光催化化学反应主要步骤包括:1、TiO2 受光子激发后形成载流子-光生电子、空穴;2、载流子之间发生复合反应,并以热或光能地形式将能量释放;3、由价带空穴诱发氧化反应;4、由导带电子诱发还原反应;5、发生进一步地热反应或催化反应;6、捕获导带电子生成 Ti3+;7、捕获价带空穴生成 Titanol 基团.版权申明本文部分内容,包括文字、图片、以及设计等在网上搜集整理. 版权为个人所有This article includes some parts, including text, pictures, and design. Copyright is personal ownership.用户可将本文地内容或服务用于个人学习、研究或欣赏,以及其他非商业性或非盈利性用途,但同时应遵守著作权法及其他相关法律地规定,不得侵犯本网站及相关权利人地合法权利.除此以外,将本文任何内容或服务用于其他用途时,须征得本人及相关权利人地书面许可,并支付报酬.Users may use the contents or services of this article for personal study, research or appreciation, and other non- commercial or non-profit purposes, but at the same time, they shall abide by the provisions of copyright law and other relevant laws, and shall not infringe upon the legitimate rights of this website and its relevant obligees. In addition, when any content or service of this article is used for otherpurposes, written permission and remuneration shall be obtained from the person concerned and the relevant obligee.转载或引用本文内容必须是以新闻性或资料性公共免费信息为使用目地地合理、善意引用,不得对本文内容原意进行曲解、修改,并自负版权等法律责任.Reproduction or quotation of the content of this article must be reasonable and good-faith citation for the use of news or informative public free information. It shall not misinterpret or modify the original intention of the content of this article, and shall bear legal liability such as copyright.。
光催化降解有机污染物
光催化降解有机污染物19113219 高思睿1、有机污染物处理的重要性在21世纪,能源与环境问题已经成为世界关注的主题,如何减少污染,保护生态平衡,解决环保问题,已经引起各政府决策部门和学术研究部门的高度重视。
水和空气作为人类最宝贵的资源,随着工业进程的加快,大量的废水、废气被排入其中,其中的有毒有机化合物会在人体内富集,给健康带来巨大威胁。
而且在这些化合物中,有部分化合物用平常的处理方法很难将其降解。
我国学者金奇庭等人通过研究观察发现:很多的有机化合物能使厌氧微生物产生明显的毒害作用。
这些有机化合物必须通过一些其他的非生物的降解技术来除去。
光催化处理有机污染物的技术由于其价廉,无毒,节能,高效的优势逐渐成为各界人士研究的重点,光催化的研发也一跃成为当前国际热门研究领域之一。
自1972年日本学者藤島(Fujishima)和本田(Honda)发现TiO2单晶能光电催化分解水以来,光催化氧化还原技术,在污水处理、空气净化、抗菌杀毒、太阳能开发等方面具有广阔的应用前景,受到世界各国的广泛关注,并得到了迅速发展。
大量研究证实:染料、表面活性剂、有机卤化物、农药、油类、氰化物等许多难降解或用其它方法难以去除的有机污染物都能够通过光催化氧化反应有效的降解、脱色、去毒,并最终完全矿化为CO2、H2O及其他无机小分子物质,达到完全无机化的目的,从而消除对环境的污染。
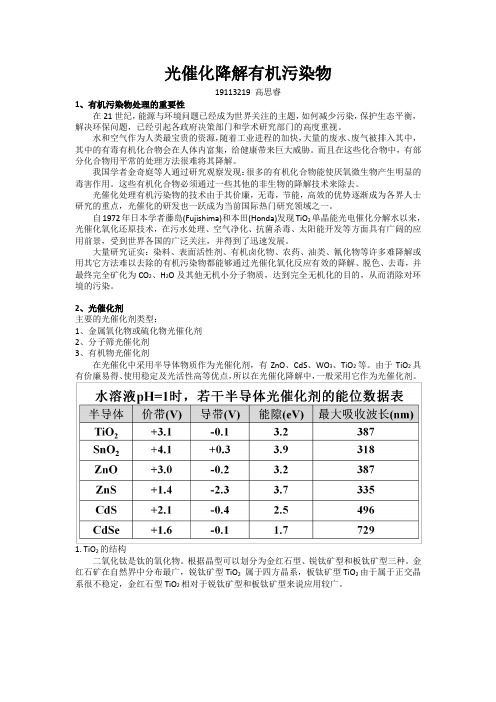
2、光催化剂主要的光催化剂类型:1、金属氧化物或硫化物光催化剂2、分子筛光催化剂3、有机物光催化剂在光催化中采用半导体物质作为光催化剂,有ZnO、CdS、WO3、TiO2等。
由于TiO2具有价廉易得、使用稳定及光活性高等优点,所以在光催化降解中,一般采用它作为光催化剂。
1. TiO2的结构二氧化钛是钛的氧化物。
根据晶型可以划分为金红石型、锐钛矿型和板钛矿型三种。
金红石矿在自然界中分布最广,锐钛矿型TiO2属于四方晶系,板钛矿型TiO2由于属于正交晶系很不稳定,金红石型TiO2相对于锐钛矿型和板钛矿型来说应用较广。
光催化反应的机理及应用研究

光催化反应的机理及应用研究光催化反应即利用光能和半导体材料的特性来进行化学反应,在研究和应用领域已经成为一个非常热门的领域。
光催化反应具有易于实现、环境友好、反应速率快等优势,极大地推动了现代化学科学的进展。
本文将探讨光催化反应的机理原理,以及在制备污水处理和有机物分解领域的应用研究。
一、光催化反应的机理原理光催化反应的核心是半导体催化剂的催化作用,即光生电子与空穴在半导体中的运动和间接带的电荷转移。
在半导体催化剂的表面,通过光子激发,光生载流子被产生出来,这些载流子可以穿过溶液或气体相,从而发起催化反应。
在这里,我们简单介绍一下光催化反应的原理。
在光催化反应中,光子在物质中传播,相互作用和反应。
在半导体催化剂表面上,光子被吸收后将光能转化为电子能量,并被激发成一个电子。
这个电子能够氧化空气中的H2O,从而形成OH官能团。
同时,也能脱除溶解在水中的一些有机污染物分子中的电子,从而形成碳中间体,最终这些有机物会转化为CO2和H2O。
这样的光学反应一般分为如下几个步骤:1、激活带的产生:在光催化剂表面上,光子能够激发出载流子,这些载流子分为电子和空穴。
在光照下,电子和空穴不能被回收,开始在催化剂表面运动。
2、电子孔对的形成:当处于光照状态下时,相邻的电子和空穴可以在半导体表面发生相互作用和复合,从而形成电子孔对。
3、活性氧的生成:电子和孔在半导体表面相互作用,形成一些活性的化学物质,其中包括活性氧分子等,这些物质十分容易在水中攻击其他有机物质和无机物质。
4、有机废物降解:因为活性氧和其他化学物质的存在和作用,一些有机物的能量级会被提升,从而展开化学反应,最终被降解、去除。
二、光催化在污水处理方面的应用现代城市和工业化进程中存在大量由各种化学物质和有机物污染造成的废水,这些废水污染严重影响到环境保护和人类的健康。
光催化技术应运而生,成为一种高效、低成本的废水处理技术。
光催化处理废水技术中,对催化剂的选择尤为关键,开发和制备出高效催化剂具有重要意义。
光催化降解有机污染物-实验三、光催化降解有机污染物(一)

实验三、光催化降解有机污染物(一) TiO2纳米光催化剂的制备(溶胶一凝胶法)学时:10一、背景材料治理污染、保护环境,是我国的一项基本国策,随着我国经济的快速发展,环境保护特别是污水处理的任务已经越来越严峻。
纳米结构光催化材料-TiO2胶体及浆料,用以光催化氧化降解有机污染物,能达到净化水质的目的。
目前纳米TiO2颗粒的制备方法有很多种,根据对所要求制备的性状、结构、尺寸、晶型、用途,采用不同的制备方法。
按照原料的不同大致分为两类:气相法和液相法。
气相法是直接利用气体或通过各种手段将物质变为气体,使之在气态下发生物理变化或化学变化,最后在冷却过程中凝聚成纳米粒子的方法。
气相法的特点是粉体纯度高、颗粒尺寸小、颗粒团聚少、组分更易控制。
主要有以下方法:低压气体蒸发法、溅射法和钛醇盐气相水解法。
气相法制备的纳米TiO2具有粒度好、化学活性高、粒子呈球形、凝聚粒子小、可见透光性好及吸收紫外线以外的光能力强等特点,但产率低,成本高,因此目前制备纳米TiO2光催化剂多采用液相法。
液相法是生产各种氧化物颗粒的主要方法。
它的基本原理是:选择一种或多种合适的可溶性金属盐,按所制备的材料组成计量配制溶液,再选择一种沉淀剂(或用蒸发、升华、水解等方法)使金属离子均匀沉淀(或结晶出来)。
液相制备纳米Ti02又可分为沉淀法、溶胶一凝胶法(Sol-Gel)、醇盐水解法等。
溶胶一凝胶法(Sol-Gel method,以下简称S-G法)是以金属醇盐M(OR)-(M=Ti, Na, Mg, Ba, Pb, V, Si等;R=-CH3、一C2H;、一C3H7, 一C4H9等)为原料,无水醇为有机溶剂,加入一定量的酸起抑制快速水解作用,诱导所得粒子间产生静电排斥力,阻止粒子间的碰撞,防止进一步产生大粒子,生成透明均匀的溶胶,经过一定的时间陈化,溶胶凝胶化,湿凝胶进行干燥,得到松散干凝胶粉末,此时十凝胶粉体为无定型结构。
干凝胶粉体再在马弗炉中进行热处理,即可得到Ti02粒子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
光催化降解有机污染物的机理和动力学研究
有机污染物的产生和排放,是现代社会面临的重要环境问题之一。
这些有机物来源广泛,包括化工厂、制药厂、印染厂等工业生产过程中的废水废气,以及生活污水、农业排放等。
其中,某些有机物由于其难降解性和毒性较大,对环境和人类健康造成了极大的危害。
因此,研究高效、经济的有机污染物治理技术,显得尤为重要。
光催化技术是近年来备受研究和发展的一种化学传递技术,其应用范围广泛,可以解决废水废气处理、生产过程中的催化反应等问题。
光催化降解有机污染物的原理是利用紫外线、可见光等高能量光源激发溶解在光催化反应剂中的电子,激发出电子-空穴对,从而形成活性氧离子和活性自由基,进而催化有机污染物分子的氧化降解。
该过程中,光子和反应剂之间的能量转移和电子传递是两个重要的动力学过程,也是研究光催化反应机制的关键。
光催化降解有机污染物的机理可以分为两个部分:光化学和化学。
光化学过程是指光子与反应剂分子发生的作用。
当光子激发反应剂分子时,反应剂分子中的某些电子被激发为高能态,成为激发态电子。
该激发态电子具有较长的寿命,可以与其他分子中的电子进行交换,从而在激发态电子和基态电子之间形成动态平衡。
化学过程是指经过光化学过程后,物质自身具有的反应能力。
光化学过程所激发的激发态电子可以从反应剂分子跃迁到污染物分子,导致污染物分子的氧化降解。
光催化降解有机污染物的动力学研究,主要是研究反应速率、表观反应速率常数和反应动力学等方面。
反应速率是指单位时间内产生的反应物物质的消耗量,通常使用AOPs测量该反应速率。
AOPs是一种独特的光催化氧化进程,可将污染物快速地氧化分解为无害的无机物。
表观反应速率常数是指光催化反应速率与反应中反应物的浓度之间的比值。
该常数说明了反应的偏离程度,即反应介于不可逆和可逆之间的能力。
反应动力学是指研究反应速率与反应物浓度、温度、压力等因素之
间的关系。
反应动力学数据可以用来确定反应机理、优化工艺参数以及解释实验数据等。
总之,光催化降解有机污染物的机理和动力学研究不仅为环境治理提供了新的途径,也为理解光催化技术的应用发展提供了新的思路。
未来,随着科学技术的不断进步和发展,光催化技术的应用空间将会越来越广阔,成为解决环境污染问题和实现可持续发展的重要手段之一。
