【中国科学技术大学物理化学课件】第6章 - 化学平衡
合集下载
化学平衡讲解-PPT

原模型:无混和 (结果:反应会进行到底)
实际反应:有混和,ΔmixG 0 ,有混和效应
(结果:反应不进行完全,而留下部分反应物参与混和过程。)
只有少数实际反应可以进行到底,例如CaCO3分解 本章重点:化学平衡得热力学本质
2024/1/4
5-1 化学反应得方向和限度
2024/1/4
(1)化学反应的限度 单向反应 H2 + O2 → H2O(电火花) 双向反应 H2 + O2 H2O 一定条件下,反应朝哪个方向进行?
(3) CO(g) + H2O(g) = CO2(g) + H2(g);
(4) C(s) + CO2(g) = 2CO(g)。
[A](1)(2) ;
[B] (1)(3) ;
[C](3)(4) ;
[D] (2)(4 )
2024/1/4
例题
已知反应2SO3(g) 2SO2(g)+ O2(g) 在1000K,2p压力下达成平衡时有25% 得SO3分解成 SO2和O2,试求反应在该温度下得 rGm。
化学平衡讲解
研究化学平衡得意义: 1、用热力学方法研究在反应条件下得反应方
向和极限 产率; 2、改变温度得到更大得平衡转化率,或温度不
变时改 变压力、物料配比等,得到更大得产率; 3、通过理论计算同实际生产对比,估计提高产
率得 幅度,实现最优化得反应工艺条件。
2024/1/4
化学平衡得概念(即化学反应为什么不进行到底)
②实际反应:A和B要混合,若它们都是理想气体,则
t0 tt
A(g) B( g)
1
0
1
mixG RT (nA ln xA nB ln xB )
实际反应:有混和,ΔmixG 0 ,有混和效应
(结果:反应不进行完全,而留下部分反应物参与混和过程。)
只有少数实际反应可以进行到底,例如CaCO3分解 本章重点:化学平衡得热力学本质
2024/1/4
5-1 化学反应得方向和限度
2024/1/4
(1)化学反应的限度 单向反应 H2 + O2 → H2O(电火花) 双向反应 H2 + O2 H2O 一定条件下,反应朝哪个方向进行?
(3) CO(g) + H2O(g) = CO2(g) + H2(g);
(4) C(s) + CO2(g) = 2CO(g)。
[A](1)(2) ;
[B] (1)(3) ;
[C](3)(4) ;
[D] (2)(4 )
2024/1/4
例题
已知反应2SO3(g) 2SO2(g)+ O2(g) 在1000K,2p压力下达成平衡时有25% 得SO3分解成 SO2和O2,试求反应在该温度下得 rGm。
化学平衡讲解
研究化学平衡得意义: 1、用热力学方法研究在反应条件下得反应方
向和极限 产率; 2、改变温度得到更大得平衡转化率,或温度不
变时改 变压力、物料配比等,得到更大得产率; 3、通过理论计算同实际生产对比,估计提高产
率得 幅度,实现最优化得反应工艺条件。
2024/1/4
化学平衡得概念(即化学反应为什么不进行到底)
②实际反应:A和B要混合,若它们都是理想气体,则
t0 tt
A(g) B( g)
1
0
1
mixG RT (nA ln xA nB ln xB )
物理化学化学平衡PPT课件
( pB B )equi.
( p ) B K p
( p ) B
Kp
p
B
B
B
B
B
K p
K
p
B PB
2020/12/29
当 B 0 时, K p 无单位。
Kp:与T有关 16
对于理想气体
K p
K
p
B PB
对于真实气体
K p K
K
f
B PB
ln
pB p
B
B
pB p
B
9
令 r Gm =
B
B
化学反应标准摩尔Gibbs 自由能
∴
r Gm = r Gm +
RT ln
B
pB p
B
令: Qp
B
pB p
B
压力商
rGm rGm RT ln Qp …理想气体反应的等温方程
2020/12/29
10
二、理想气体反应的标准平衡常数
B
对理想气体,pB cRT
B
Kc K p (RT ) B
5.液相反应用活度表示的平衡常数 Ka
Ka
(aB B )equi.
B
2020/12/29
19
总结 说明:
Kp
B
Kx ( p) B
K
n
p n总,equi.
B B
Kc
(RT
) B B
单位:
K p (: 压强)x
Kn (: mol)x Kc (: mol m3)x
了化学反应亲和势的概念。他定义化学亲和势A为:
def
G
A
( )T , p
物理化学PPT化学平衡

* B * B p * B
p
B (T , p, xB ) x,B (T ) RT ln ax,B
如果溶质浓度用质量摩尔浓度表示,得: mB □ B (T , p, mB ) B (T , p) RT ln m □ B (T , p, mB ) B (T , p ) RT ln am,B
(2)在理想稀溶液中,溶质服从Henry定律:
* B (T , p, xB ) B (T , p) RT ln xB
若对Henry定律发生偏差,得
* B (T , p, xB ) B (T , p) RT ln ax,B
(T , p) (T , p ) VBdp (T , p )
显然,
B (T , p, xB ) B (T , p, mB ) B (T , p, cB )
但是
x,B (T ) m,B (T ) c,B (T )
§6.3 平衡常数的表示式
一、气体反应的经验平衡常数
对于理想气体
h H e E
K f Kp
仅是温度的函数。
对于任意反应
dD eE gG hH
g h
( fG / p ) ( fH / p ) r Gm r Gm (T ) RT ln d e ( fD / p ) ( fE / p )
r Gm (T ) RT ln Q f
化学反应等温方程式
Q f 称为“逸度商”。
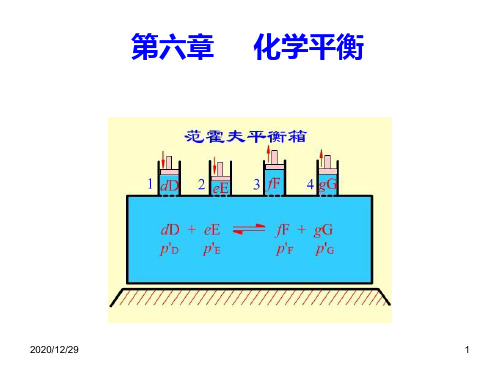
若要使反应进行到底,需在van’t Hoff 平衡箱中 进行,防止反应物之间或反应物与产物之间的任何 形式的混合,才可以使反应从R点直接到达S点。
三、化学反应的亲和势
1922年,比利时热力学专家De donder首先引进了化 学反应亲和势的概念。定义化学亲和势A为:
p
B (T , p, xB ) x,B (T ) RT ln ax,B
如果溶质浓度用质量摩尔浓度表示,得: mB □ B (T , p, mB ) B (T , p) RT ln m □ B (T , p, mB ) B (T , p ) RT ln am,B
(2)在理想稀溶液中,溶质服从Henry定律:
* B (T , p, xB ) B (T , p) RT ln xB
若对Henry定律发生偏差,得
* B (T , p, xB ) B (T , p) RT ln ax,B
(T , p) (T , p ) VBdp (T , p )
显然,
B (T , p, xB ) B (T , p, mB ) B (T , p, cB )
但是
x,B (T ) m,B (T ) c,B (T )
§6.3 平衡常数的表示式
一、气体反应的经验平衡常数
对于理想气体
h H e E
K f Kp
仅是温度的函数。
对于任意反应
dD eE gG hH
g h
( fG / p ) ( fH / p ) r Gm r Gm (T ) RT ln d e ( fD / p ) ( fE / p )
r Gm (T ) RT ln Q f
化学反应等温方程式
Q f 称为“逸度商”。
若要使反应进行到底,需在van’t Hoff 平衡箱中 进行,防止反应物之间或反应物与产物之间的任何 形式的混合,才可以使反应从R点直接到达S点。
三、化学反应的亲和势
1922年,比利时热力学专家De donder首先引进了化 学反应亲和势的概念。定义化学亲和势A为:
《化学平衡的移动》PPT课件

催化剂对化学平衡无影响,但能改变反应 速率。
2024/1/24
6
02 沉淀溶解平衡移动
2024/1/24
7
沉淀生成与溶解过程
01
02
03
沉淀的生成
当溶液中某种离子的浓度 超过其溶度积常数(Ksp )时,就会生成沉淀物。
2024/1/24
沉淀的溶解
当溶液中存在能与沉淀物 发生反应的离子时,沉淀 物会溶解并重新进入溶液 。
电子得失守恒法
适用于较复杂的氧化还原反应。首先分析反应前后元素化合价变化, 找出氧化剂和还原剂,计算得失电子总数,使电子得失总数相等。
2024/1/24
17
氧化还原平衡移动实例分析
沉淀溶解平衡的移动
通过改变离子浓度、温度或加入能与体 系中某些离子反应生成更难溶或更难电 离物质的试剂,使平衡向生成沉淀或溶 解的方向移动。例如,向$AgCl$饱和溶 液中加入$NaI$溶液,由于$AgI$比 $AgCl$更难溶,因此$AgCl$会转化为 $AgI$沉淀。
沉淀溶解平衡的应用
判断沉淀的生成与溶解,计算沉淀的溶解度,以及指导科研和生产实践。
2024/1/24
5
影响化学平衡因素
温度
浓度
升高温度,平衡向吸热方向移动;降低温 度,平衡向放热方向移动。
增大反应物浓度或减小生成物浓度,平衡 向正反应方向移动;反之,平衡向逆反应 方向移动。
压强
催化剂
对于有气体参加的反应,增大压强,平衡 向气体体积减小的方向移动;减小压强, 平衡向气体体积增大的方向移动。
2024/1/24
19
配合物组成和结构特点
01
02
03
04
配合物由中心离子和配 体组成
物理化学第六章化学平衡

rG m (2 9 8 K )= (-3 9 4 -8 7 + 1 3 7 )k Jm o l-1 = -3 4 4 k Jm o l-1
对于反应:CO(g)+H2O(g)→CO2(g)+ H2(g)
rG m (298K )=(-394+137+229)kJm ol-1 =-28kJm ol-1
了一个化学反应,设为:
d D e E fF g G
根据反应进度的定义,可以得到:
d dD n dE n dF n dG n
deΒιβλιοθήκη fg可一般地些为:
d dnB B
dnB Bd
第4页,本讲稿共85页
6.1 化学平衡的条件和反应的亲和势—热 力学基本方程1
d G S d T V d p B d n B
ΔrG =ΔfG (CO)- ΔfG (MnO) =(2686×102-158.37T/K) J·mol-1
ΔrGm=ΔrG +RTlnQp=ΔrG +RTln[p(CO)/p] =(2686×102-270.9 T/K) J·mol-1
在最低还原温度时, ΔrGm=0, 由此可得 T=992 K 当T>992 K时, ΔrGm< 0, 还原反应可以进行, 还原温度为992 K。
物理化学第六章化学 平衡
第1页,本讲稿共85页
第六章 化学平衡
6.1 化学平衡的条件和反应的亲和势
6.2 化学反应的平衡常数和等温方程式 6.3 平衡常数与化学方程式的关系 6.4 复相化学平衡 6.5 平衡常数的测定和平衡转化率的计算
6.6 标准生成吉布斯自由能
6.8 温度、压力及惰性气体对化学平衡的影响 6.9 同时平衡
对于反应:CO(g)+H2O(g)→CO2(g)+ H2(g)
rG m (298K )=(-394+137+229)kJm ol-1 =-28kJm ol-1
了一个化学反应,设为:
d D e E fF g G
根据反应进度的定义,可以得到:
d dD n dE n dF n dG n
deΒιβλιοθήκη fg可一般地些为:
d dnB B
dnB Bd
第4页,本讲稿共85页
6.1 化学平衡的条件和反应的亲和势—热 力学基本方程1
d G S d T V d p B d n B
ΔrG =ΔfG (CO)- ΔfG (MnO) =(2686×102-158.37T/K) J·mol-1
ΔrGm=ΔrG +RTlnQp=ΔrG +RTln[p(CO)/p] =(2686×102-270.9 T/K) J·mol-1
在最低还原温度时, ΔrGm=0, 由此可得 T=992 K 当T>992 K时, ΔrGm< 0, 还原反应可以进行, 还原温度为992 K。
物理化学第六章化学 平衡
第1页,本讲稿共85页
第六章 化学平衡
6.1 化学平衡的条件和反应的亲和势
6.2 化学反应的平衡常数和等温方程式 6.3 平衡常数与化学方程式的关系 6.4 复相化学平衡 6.5 平衡常数的测定和平衡转化率的计算
6.6 标准生成吉布斯自由能
6.8 温度、压力及惰性气体对化学平衡的影响 6.9 同时平衡
化学平衡移动PPT精品课件

原理有助于指导实际生产,提高产品质量和经济效益。
推动相关学科发展
化学平衡移动作为化学热力学和化学动力学的重要组成部分,其研
究有助于推动物理化学、分析化学等相关学科的发展。
未来发展趋势预测
01
深入研究复杂体系的化学平衡移动
随着科技的进步,未来化学平衡移动的研究将更加注重复杂体系和多组
分体系,探讨更多实际应用中的化学平衡问题。
04
氧化还原平衡移
动
氧化还原反应基本概念
氧化反应
还原反应
氧化剂
还原剂
物质与氧化剂反应,失
物质与还原剂反应,得
在反应中得到电子或电
在反应中失去电子或电
去电子或电子对偏离,
到电子或电子对偏向,
子对偏向的物质,被还
子对偏离的物质,被氧
化合价升高的过程。
化合价降低的过程。
原,发生还原反应。
化,发生氧化反应。
缓冲溶液作用及配制方法
缓冲溶液的作用
能够抵抗外来少量强酸、强碱或稍稀释的
缓冲溶液的组成
一般由弱酸及其盐或弱碱及其盐组成。
影响,使溶液pH值基本保持不变。
缓冲溶液的配制方法
缓冲溶液在化学实验中的应用
按一定比例混合共轭酸碱对,调节pH至所
广泛应用于分析测试、生物实验等领域,
需范围即可。
保证实验结果的准确性和稳定性。
感谢观看
可以制备出具有特殊功能的材
料,如荧光材料、磁性材料等
。
06
总结与展望
课程总结回顾
化学平衡移动基本概念
沉淀溶解平衡
阐述化学平衡状态及平衡常数,探讨
平衡移动方向与反应条件的关系。
分析沉淀生成与溶解的条件,讨论溶
推动相关学科发展
化学平衡移动作为化学热力学和化学动力学的重要组成部分,其研
究有助于推动物理化学、分析化学等相关学科的发展。
未来发展趋势预测
01
深入研究复杂体系的化学平衡移动
随着科技的进步,未来化学平衡移动的研究将更加注重复杂体系和多组
分体系,探讨更多实际应用中的化学平衡问题。
04
氧化还原平衡移
动
氧化还原反应基本概念
氧化反应
还原反应
氧化剂
还原剂
物质与氧化剂反应,失
物质与还原剂反应,得
在反应中得到电子或电
在反应中失去电子或电
去电子或电子对偏离,
到电子或电子对偏向,
子对偏向的物质,被还
子对偏离的物质,被氧
化合价升高的过程。
化合价降低的过程。
原,发生还原反应。
化,发生氧化反应。
缓冲溶液作用及配制方法
缓冲溶液的作用
能够抵抗外来少量强酸、强碱或稍稀释的
缓冲溶液的组成
一般由弱酸及其盐或弱碱及其盐组成。
影响,使溶液pH值基本保持不变。
缓冲溶液的配制方法
缓冲溶液在化学实验中的应用
按一定比例混合共轭酸碱对,调节pH至所
广泛应用于分析测试、生物实验等领域,
需范围即可。
保证实验结果的准确性和稳定性。
感谢观看
可以制备出具有特殊功能的材
料,如荧光材料、磁性材料等
。
06
总结与展望
课程总结回顾
化学平衡移动基本概念
沉淀溶解平衡
阐述化学平衡状态及平衡常数,探讨
平衡移动方向与反应条件的关系。
分析沉淀生成与溶解的条件,讨论溶
《化学平衡》课件
[课前练习]
在固定体积的的密闭容器中发生反应: (红棕色)2NO2 2NO(无色)+ O2 该反应达到平衡的标志是: (1)混合气体的颜色不再改变 ( ) (2)混合气体的平均相对分子质量不变( ) (3)混合气体的密度不变 ( ) (4)混合气体的压强不变 ( ) (5)单位时间内消耗2nmolNO2的同时 生成2nmolO2 ( )
强调在平衡状态时存在的
(1)现象与本质:
V正=V逆是达到平衡状态的本质,各组 成成分的含量不变为表面现象; (2)动与静:正反应和逆反应不断进行, 而各组分的含量保持不变; (3)内因和外因:
条件改变时,V正≠V逆,平衡被打破,
外界条件一定时,V正=V逆,平衡建立。
[课前练习]
• 在一定温度下,可逆反应A(g)+3B(g) 2C(g)达 到平衡的标志是(A ) ①C生成的速率与C分解的速率相等; ②单位时间内生成mmolA,同时生成3mmolB; ③A、B、C的浓度不再变化; ④A、B、C的分子数之比为1:3:2; ⑤单位时间内生成3mmolB,同时生成2mmolC; ⑥容器内的总压强不随时间变化 A、 ①③⑤⑥ B、 ①②③⑤⑥ C、①⑤ D、全部
直接的
混合气体的总压、总体积、总物质的量不随时间 的改变而改变;(x+y≠z 即反应前后系数不等) 各物质的浓度不随时间的改变而改变; 间接的 各物质的物质的量不随时间的改变而改变; 各气体的体积不随时间的改变而改变; 反应体系的颜色、温度不再变化。
※VA· 耗是指A物质的消耗速率,VB· 生是指B物质的生成速率。
2、化学平衡的特征
①逆——可逆反应
②动——动态平衡,反应没有停止 ③等——V正 =V逆 V正 =V逆≠0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
被看作理想气体:
i = i(Pi =P, i =1) + RT ln( fi / P )
标准平衡常数:
(f G / P ) (f H / P ) K a b (f A / P ) (f B / P )
f
g
h
(K 只与温度有关)
f
(f G / P ) (f H / P ) K a b (f A / P ) (f B / P )
对于化学反应,上述单位使用较方便; 对于气相反应,最常用的平衡常数是
KP
KP = KP(P) = Kx(P)
= Kc(RT)
当
(理想气体)
= 0 时,
KP = KP = Kx = Kc
三、非理想气体 ( 高压反应 ) 化学平衡
当气相反应是在高压下进行,气体不能
代入关系式:a A
+ b B = g G + h H
i (T, P) = i* (T, P) + RT ln a i a A + b B = g G + h H
g G a A h H b B
a a 1 得:ln (g G h H a A b B) a a RT
(PG / P ) (PH / P ) 常数 K P a b (PA / P ) (PB / P )
理想气体时 i =1,f i
g
h
= Pi ,此时:
Kf = KP
“ ” 表示 Kf、KP 值与气体标准态化学
势 ( i ) 值的大小有关;
式中的
第六章 化学平衡
§6.1 引言
一、单向反应
所有的化学反应都可以认为是既能正向进
行,亦能逆向进行;
但在有些情况下,逆向反应的程度是如此
之小,以致可略去不计;
这种反应我们通常称之为 “单向反应”。
例如:
在通常温度下,将 2 份 H2与 1 份 O2 的
混合物用电火花引爆,就可转化为水。
这时,用通常的实验方法无法检测到所 剩余的氢和氧的数量。 但是当温度高达 1500C 时,水蒸汽却 可以有相当程度地分解为 O2 和 H2。
合物,即使加热到 450 C,氢和碘也不 能全部转化为碘化氢气体。
这就是说,氢和碘能生成碘化氢,同
时碘化氢亦可以在相当程度上分解为
氢和碘。
此种反应的可逆性可表示为:
H2 (g) + I2 (g) 2HI (g)
液相中,乙醇和乙酸的酯化反应也是
典型的可逆反应例子。
三、可逆反应特点
即:
( PG / P ) ( PH / P ) ln a b ( PA / P ) ( PB / P )
g
h
1 (g G h H a A b B ) RT
( PG / P ) ( PH / P ) ln a b ( PA / P ) ( PB / P )
p
g
h
P P ( g h a b) ( P ) P P
g G a A h H b B
令: = ( g + h ) ( a + b)
产物与反应物计量系数之差
P P 令:K P P P
g G a A
h H b B
称作压力平衡常数
• 则理气: Kf = KP = KP(P) • 或: KP = KP (P) (理气)
压力平衡常数 KP 的单位为 (atm) 或
(Pa),气体反应的压力平衡常数通常
简称平衡常数。
P P KP P P
g G a A
h H b B
因为
KP 仅为温度 T 的函数,所以平衡
常数 KP也仅为温度的函数。
n i RT 将:Pi ci RT,代入上式: V
c c KP ( RT) c c
)
= Kx(P) =
Kc(RT)
(理想气体)
KP = KP(P) = Kx(P) = Kc(RT)
常用单位:
(理想气体)
P / atm;P = 1 / atm;c / moldm3; R / 0.08206 atmdm3mol1K1
Kf
在一定温度下不因初始组成的不同
而改变,所以 Kf 数值的大小也就往往
作为反应完成程度的标志:
Kf 数值愈大,表明此反应可以进行 得愈彻底; Kf 数值愈小,表明此反应完成的程 度越低。
二、理想气体气相反应平衡常数的 各种表示法
理气反应的标准平衡常数:
(PG / P ) (PH / P ) K a b (PA / P ) (PB / P )
i = i ( T, Pi = P, i=1) + RT ln ( fi /P)
= i ( T, Pi = P) + RT ln (Pi/P) (理想气体) 代入上式:
a A + b B = g G + h H
a A + a RT ln (PA/P) + b B + b RT ln (PB/P) = g G + g RT ln (PG/P) + h h + h RT ln (PH/P)
所有的可逆反应在进行一定时间以后均会
达到一化学平衡状态,这时在温度和压力
不变的条件下,混合物的组成不随时间而
改变。
从宏观上看,达到化学平衡时化学反应似
乎已经停止,但实际上这种平衡是动态平
衡,即正向反应和逆向反应的速度相等。
应该注意的是,本章可逆反应概念中的
“可逆” 一词,已不是热力学意义上的
(非理气)
• 在 Kf、KP、KP 中,只有 Kf 只是 温度的函数,定温下为常数。 • 所以对于非理想气体反应平衡常数计
算,只能用 Kf 。
四、液相反应
aA+bBgG+hH
如果参加反应物质所构成的溶液为非理
想溶液,那末根据一般互溶物中组分化
学势表示式:
i (T, P) = i*(T, P) + RT ln a i
f
g
h
设: f i = Pi i
(PG / P ) (PH / P ) 则:K a b (PA / P ) (PB / P )
f g G a A g h h H b B
或:Kf = KP K
(其中:K 与压力有关)
Pi 若用大气压单位,则
P = 1 (atm)
(PG / P ) (PH / P ) 常数 K P (理想气体) a b (PA / P ) (PB / P )
g
h
上式表明:
1. 理想气体化学反应在一定温度达到平衡
时,产物分压 (atm数) 的计量系数次方
的乘积与反应物分压 (atm数) 的计量系 数次方的乘积之比为一常数 Kf ( 或 KP )。
P P KP P P
g G a A
h H b B
对于理想气体,分压与总压有关系式:Pi = Pxi,代入 KP 定义式:
x x KP P x x
g G a A h H b B
x x 令:K x x x
g G a A
h H b B
称作摩尔分数平衡常数
则: 或:
无疑地,如上问题的解答将使人们有可能
运用这些知识,通过调节外界条件,控制 反应限度以解决提高产量的问题;
以及解决如何选择新的合成途径等问题,
避免不必要的浪费;
这对化学工业、冶金工业及其他工业有着
重要意义。
本章的目的就是用热力学方法阐述、解决
上述问题。
§6.2 平衡常数
一、气相反应的标准平衡常数
可
逆过程(即无限缓慢的准静态过程),
而仅指反应物、产物转化的可逆性。
可逆化学反应本身与其他化学反应一样, 也可以是自发进行的,只是达到化学平
衡时正向反应与逆向反应速度相等。
四、化学反应限度
从上述讨论可以看出,在一定的条件下,
化学反应有单向反应,也有可逆反应;
即在一定条件下不同的化学反应所能进行
g
h
1 (g G h H a A b B ) RT
• 式中,PG , PH , P A , P B 分别为理想气体
G, H, A, B 在平衡时的分压。
• 因为等式右边各项只是温度的函数,因 此一定温度下等式右边为一常数,可用 KP 表示此常数(压力幂乘积之比):
g h (PG / P ) ( PH / P ) 常数 K P (理想气体) a b (PA / P ) (PB / P )
这样的比例式称为此反应的 “标准平衡
常数” 或 “热力学平衡常数 ”。
“标准” 两字源于该常数与组分的标准
态化学势 (i) 有关,标准平衡常数Kf 无量纲。
g G a A h H b B
P P KP K P (P ) P P
g G a A h H b B
K (P ) K
f
1
由于 K 与压力有关
∴ KP、KP 也与压力有关
KP
K
f
K
(P )
K (P )
P
这个事实告诉我们:
在通常条件下,氢和氧燃烧反应的 逆向进行的程度是很小的; 而在高温条件下,反应逆向进行的 程度就相当明显(由此引出可逆反
