非洲猪瘟ELISA抗体检测报告 - 副本
抗体监测报告
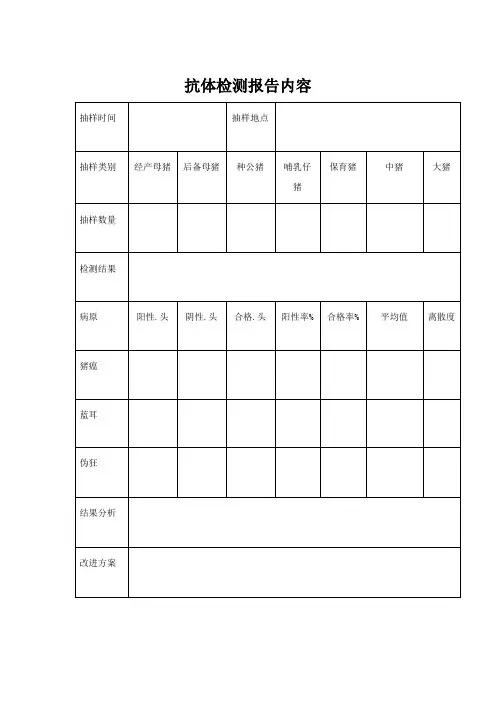
抗体检测报告内容抗体监测报告样本1、第一次检测:2011年9月29日,采样量40份(母猪)。
1.1、检测结果:1.2、检测结果分析:良好猪场猪瘟抗体阳性率100%,合格率90%。
离散度25左右。
猪瘟疫苗种猪正常免3次后抗体水平范围:普通细胞苗45-75;高效细胞苗/组织苗55-95;脾淋苗65-100。
结合实际免疫所用疫苗种类,样本平均值要求在参考范围内,高于参考值提示已经感染猪瘟,低于参考值提示该种疫苗免疫效果不好。
根据检测结果,以及本猪场使用猪瘟疫苗情况,我们判断目前使用猪瘟疫苗免疫效果欠佳。
良好猪场蓝耳抗体阳性率70%-80%。
离散度25左右。
S/P值在0.8-1.2之间最为理想,并且保证S/P值大于2.5的猪只占猪群5%以下。
从结果可见,本猪场发过蓝耳病,并且目前处于蓝耳病稳定期,抗体水平参差不齐。
良好猪场伪狂抗体阳性率100%,合格率90%。
离散度25左右。
S/N值均小于0.4最为理想。
结果显示,本猪场伪狂疫苗免疫操作到位。
1.3处理意见:立即换用市场评价好的猪瘟疫苗全群补免一次,4-6周后采血送检以评价补免效果。
做好猪群的保健。
2、第二次检测:2011年11月03日,采样量70份(母猪52头、保育猪18头)2.1、检测结果:2.2、检测结果分析:比较9月份检测结果我们发现猪场母猪猪瘟抗体水平明显提高,补免效果得到保证。
保育阶段猪猪瘟抗体水平不理想,可能原因是母源抗体水平降低到一个低的水平,并且没有及时免苗产生抗体。
蓝耳抗体检测结果本场正在发蓝耳病。
本猪场伪狂疫苗免疫操作到位。
2.3、处理意见:对仔猪做好超免,对于这部分保育猪补免猪瘟苗。
建议猪场对于猪瘟抗体不合格,蓝耳抗体S/P值大于2.5,并且生产不稳定的猪只酌情考虑淘汰。
部分蓝耳阴性的后备母猪和断奶母猪我们建议进行驯化,具体做法如下:将这部分蓝耳抗体阴性猪与猪瘟抗体检测合格并且蓝耳S/P值0.8-1.2之间的猪混群饲养至少一个月以上。
非洲猪瘟的抗体检测

非洲猪瘟的抗体检测非洲猪瘟:抗体检测的重要应用近年来,非洲猪瘟在全球范围内爆发,给养猪业带来了巨大的经济损失。
为了有效控制疫情,科研人员不断深入研究非洲猪瘟的传播途径和预防措施。
其中,抗体检测在非洲猪瘟中的应用受到了广泛。
抗体检测是基于免疫学原理,通过检测动物体内是否产生针对非洲猪瘟病毒的特异性抗体,来判断动物是否感染过非洲猪瘟病毒。
这种检测方法可以分为多个步骤,包括样本采集、血清分离、抗原抗体反应以及结果判定等。
在抗体检测过程中,需要注意一些常见问题。
首先,样本采集的时机和部位至关重要。
采集血清样品时,应选择健康的猪只,并在猪只未接种疫苗或接种疫苗一段时间后采集,以避免抗体检测出现假阳性结果。
其次,抗原抗体的反应温度和时间也需要严格控制。
此外,抗体检测的结果需要结合猪只的临床表现和其他检测方法进行综合判断,以避免出现误判。
抗体检测在非洲猪瘟防控中具有重要作用。
首先,抗体检测可以用于疫情监测和预警,帮助养猪业及时发现疫情并采取措施控制疫情扩散。
其次,抗体检测可以评估疫苗接种效果,指导养猪业制定更加科学的免疫程序。
此外,抗体检测还可以用于评估猪只的免疫状态,帮助养猪业确定猪只的健康状况和生长性能。
总之,抗体检测在非洲猪瘟防控中具有重要意义。
随着科研技术的不断进步,抗体检测方法将不断完善,为养猪业提供更加准确、便捷的检测方案。
为了保证抗体检测的准确性,养猪业应选择可靠的检测机构和适合的检测方法,并遵循科学的采样和检测流程。
养猪业还应加强与科研机构、政府部门的合作,共同推动非洲猪瘟防控事业的发展。
非洲猪瘟是一种高度传染的动物疾病,给全球养猪业带来了巨大的经济损失。
本文主要探讨了非洲猪瘟流行病学的研究现状、方法及研究结果,并展望未来的研究方向,以期为相关领域的研究提供参考。
研究现状非洲猪瘟病毒传播途径广泛,包括直接接触感染、虫媒传播、污染物传播等。
感染机理方面,非洲猪瘟病毒通过口鼻或皮肤破损处进入猪体内,在淋巴结、脾脏和骨髓等组织中增殖,最终导致病毒血症。
非洲猪瘟病毒阻断ELISA_抗体检测试剂盒在不同温度保存下对实验结果的影响

2024年第02期非洲猪瘟(A f r i can s wi ne f ever,A SF)是一种由非洲猪瘟病毒(A SFV)引起家猪和野猪(非洲野猪、欧洲野猪等)的热性、接触性传染病,其临床表现为高热(达40~42℃)、心跳加快、呼吸困难、皮肤充血发绀及淋巴结和内脏器官严重充血,尤其是脾脏可肿大至5~6倍。
易感猪群其急性型死亡率可高达100%。
非洲猪瘟自2018年首次传入我国后,在短时间内迅速蔓延至全国各地,导致猪群大量死亡,使我国的养猪产业遭受巨大打击,导致市场猪肉价格一路高涨,最高涨幅甚至超过300%,对国民生产生活产生了极大的影响。
我国将此病列为一类动物疾病,世界动物卫生组织(O I E)将其列为法定报告动物疫病。
目前市场上仍未出现批准上市的商品化疫苗,因此快速有效的检测方法对该病的防控具有重要意义。
一般来说,猪群在未接种非洲猪瘟疫苗的前提下,健康猪的体内不存在非洲猪瘟抗体,利用血清学检测方法若检测到抗体阳性,则提示该猪场可能感染了非洲猪瘟。
非洲猪瘟病毒抗体检测试剂盒目前是基层兽医实验室监测非洲猪瘟疫情的主要实验手段。
对实验试剂的保存,应当自预定试剂时起,提前调试好相应保存设备,因试剂在长途运输过程中,难免会产生与最适储藏温度有所偏差的情况。
收到试剂后,应根据储存要求进行合理的保存,若储存方式不当,有可能对试剂产生一定的影响,也可能干扰实验结果的准确性。
本文主要研究了使非洲猪瘟病毒阻断E LI S A抗体检测试剂盒在不同温度保存下对实验结果的影响裴钰1,史振海2,张颖嵩3,李韬4,张宁1★(1.汉中市汉台区畜牧兽医技术推广中心,陕西汉中723000;2.汉中市南郑区动物疫病预防控制中心,陕西汉中723102;3.南郑区阳春镇农业综合服务站,陕西汉中723102;4.汉中市动物疫病预防控制中心,陕西汉中723000)D O I:10.3969/J.I SSN.1671-6027.2024.02.015摘要:ELI SA抗体检测试剂盒在不同低温保存下对检测结果的影响。
非洲猪瘟病毒p30蛋白卵黄抗体的制备及生物活性检测

非洲猪瘟病毒p30蛋白卵黄抗体的制备及生物活性检测张皓淳(辽宁省农业发展服务中心,辽宁 沈阳 110034)非洲猪瘟病毒(African swine fever virus,ASFV)在1921年第一次被人类检测到,发现地为肯尼亚,家猪、野猪都能感染。
因为宿主的不一致性,非洲猪瘟(African swine fever,ASF)的临床症状也有所差异,家猪感染后的临床表现比较接近传统猪瘟的,都会出现呼吸窘迫、全身出血等症状,死亡率达到100%。
世界动物卫生组织将ASF 纳入A 类疫病。
ASFV 是一种带有囊膜的DNA 病毒,全长170 kb ~190 kb,基因组涵盖150~167个开放阅读框(open reading frames,ORFs),可编码超过150种蛋白,包括p54蛋白、p30蛋白等。
其中磷蛋白p30基因(phosphoprotein p30 gene,CP204L)位于ASFV 基因组保守区,编码的p30蛋白是ASFV 重要的毒力蛋白,具有较好的抗原性。
p30蛋白在ASFV 感染早期就已产生,且数量较多,可以导致感染猪产生中和抗体,是一种比较理想的血清学诊断以及免疫学测定的抗原[1-2]。
我国于2018年8月开始出现非洲猪瘟疫情,现已严重影响我国养猪业的发展,因此建立快速诊断方法对确保养猪生产正常进行极为重要。
本试验成功构建了pET-32a-p30原核表达载体,利用表达的p30蛋白免疫蛋鸡,能够得到ASFV p30蛋白的特异性卵黄抗体,根据测定结果发现该卵黄抗体具有良好的生物学活性,可以为今后研发用卵黄抗体检测非洲猪瘟疾病打下一个良好的基础。
中图分类号:S852.4+3 文献标志码:A 文章编号:1001-0769(2022)01-0032-05摘 要:为了制备非洲猪瘟病毒(African swine fever virus,ASFV)p30蛋白卵黄抗体,研究卵黄抗体的生物活性。
试验构建了pET-32a-p30原核表达载体,制定了科学的免疫程序和样本采集方法。
彭亨猪TNF-alpha ELISA试验簿说明书

Porcine TNF-alpha ELISA KitCatalog Number ES24RB (96 tests)Rev. 6Product descriptionThe Porcine TNF-alpha ELISA Kit is a solid-phase sandwich Enzyme-Linked Immunosorbent Assay (ELISA) designed to detect and quantify the level of porcine TNF-alpha in cell culture supernatants, plasma, and serum.Contents and storageUpon receipt, store at 2-8°C for 6 months or -20°C for 1 year.Components Cat. No. ES24RB(96 tests)Porcine TNF-alpha Antibody Coated wells, 96-well plate 1 platePorcine TNF-alpha Biotin Conjugate 2 vialsPorcine TNF-alpha Standard, recombinant porcine TNF-alpha 2 vialsWash Buffer Concentrate (20X)25 mLAssay Diluent C30 mLAssay Diluent B (5X)15 mL Streptavidin-HRP (600X)0.2 mLTMB Substrate12 mLStop Solution8 mL Adhesive Plate Covers2Materials required but not suppliedDistilled or deionized waterMicrotiter plater reader with software capable of measuring at 450 nmPlate washer-automated or manual (manifold dispenser)Calibrated adjustable precision pipettes and glass or plastic tubes for diluting solutionsProcedural guidelinesReview the Procedural guidelines and Plate washing directions in the ELISA Technical Guide at for details prior to starting the procedure.Reagents are lot-specific. Do not mix or interchange different reagent lots from various kit lots.Prepare 1X Wash Buffer1.Allow Wash Buffer Concentrate (20X) to reach room temperature and mix to redissolve any precipitated salts.2.Dilute 20 mL of the Wash Buffer Concentrate into 380 mL of deionized or distilled water. Label as 1X Wash Buffer.3.Store the concentrate and 1X Wash Buffer in the refrigerator. Use the diluted buffer within one month.Prepare diluentAssay Diluent B should be diluted 5-fold with deionized or distilled water before use.Prepare biotin conjugate1.Briefly spin down the biotin conjugate before use.2.Add 100 µL of 1X Assay Diluent B into the vial to prepare a biotin conjugate concentrate.3.Pipette up and down to mix gently (the concentrate can be stored at 4°C for 5 days).4.The biotin conjugate concentrate should be diluted 80-fold with 1X Assay Diluent B and used in step 2 of ELISA procedure.Sample preparation guidelinesCollect samples in pyrogen/endotoxin-free tubes.Freeze samples after collection if samples will not be tested immediately. Avoid multiple freeze-thaw cycles of frozen samples.Thaw completely and mix well (do not vortex) prior to analysis.Avoid the use of hemolyzed or lipemic sera. If large amounts of particulate matter are present in the sample, centrifuge or filter sample prior to analysis.Pre-dilute samplesAssay Diluent C should be used for dilution of serum, plasma, and cell culture supernatant samples.Dilute serum and plasma 2-fold.Because conditions may vary, it is recommended that each investigator determine the optimal dilution to be used for each application.Dilute standardsNote: Use glass or plastic tubes for diluting standards.1.Briefly spin down a vial of lyophilized standard.2.Add 400 µL Assay Diluent C into vial to prepare a 40 ng/mL standard solution. Dissolve the powder thoroughly by a gentle mix.Add 200 µL TNF-alpha standard from the vial, into a tube with 600 µL Assay Diluent C to prepare a 10 ng/mL standard solution.Pipette 400 µL Assay Diluent C into each tube. Use the stock standard solution to produce a dilution series (shown below). Mix each tube thoroughly before the next transfer. Assay Diluent C serves as the zero standard (0 ng/mL).200200 200 200 200 200 200DiluentVolume600 µL400 µL400 µL400 µL400 µL400 µL400 µL400 µL40 ng/mLStd110 ng/mLStd23.333 ng/mLStd31.111 ng/mLStd40.37 ng/mLStd50.123 ng/mLStd60.041 ng/mLStd70.014 ng/mLBlank0 ng/mLPrepare 1X Streptavidin-HRP solutionNote: Prepapre the Streptavidin-HRP within 15 minutes of usage.1.Briefly spin the Streptavidin-HRP and pipette up and down to mix gently before use, as precipitates may form during storage.2.Dilute Streptavidin-HRP 600-fold with 1X Assay Diluent B.3.Do not store diluted solution for future use.Perform ELISA (Total assay time: 4 hours and 45 minutes)Allow all reagents to reach room temperature before use. Mix all liquid reagents prior to use.IMPORTANT! Perform a standard curve with each assay.Determine the number of 8-well strips required for the assay. Insert the strips in the frames for use. Re-bag any unused strips and frames, and store at 2 to 8°C for future use.1Bind antigen a.For the standard curve, add 100 µL of standards to the appropriate wells (see Dilute standards). Forsamples, add 100 µL of diluted samples (see Dilute samples) to the wells.b.Cover wells and incubate for 2.5 hours at room temperature or over night at 4°C with gentle shaking.c.Discard the solution and wash 4 times with 1X Wash Buffer. Wash by filling each well with WashBuffer (300 µL) using a multi-channel Pipette or autowasher. Complete removal of liquid at each stepis essential for good performance. After the last wash, remove any remaining Wash Buffer byaspirating or decanting. Invert the plate and blot it against clean paper towels.2Add biotin conjugate a.Add 100 µL of prepared biotin conjugate (see Prepare biotin conjugate) to each well.b.Incubate for 1 hour at room temperature with gentle shaking.c.Discard the solution. Repeat the wash as in step 3.3Add Streptavidin-HRP a.Add 100 µL of prepared Streptavidin-HRP solution (see Prepare Streptavidin-HRP solution) to eachwell.b.Incubate for 45 minutes at room temperature with gentle shaking.c.Discard the solution. Repeat the wash as in step 3.4Add TMB substrate a.Add 100 µL of TMB Substrate to each well. The substrate will begin to turn blue.b.Incubate for 30 minutes at room temperature in the dark with gentle shaking.5Add stop solution Add 50 µL of Stop Solution to each well. Tap the side of the plate gently to mix. The solution in thewell changes from blue to yellow.Read the plate and generate the standard curve1.Read the absorbance at 450 nm. Read the plate within 30minutes after adding the Stop Solution.e curve-fitting software to generate the standard curve. Afour parameter algorithm provides the best standard curve fit.Optimally, the background absorbance may be subtracted from all data points, including standards, unknowns and controls,prior to plotting.3.Read the concentrations for unknown samples and controlfrom the standard curve. Multiple value(s) obtained forsample(s) by the appropriate factor to correct for the sampledilution.Note: Dilute samples producing signals greater than that of thehigest standard in Standard Diluent Buffer and reanalyze.Multiply the concentration by the appropriate dilution factor.Performance characteristicsStandard curve (example)These standard curves are for demonstration only. A standardcurve must be run with each assay.Intra-assay precisionTo determine intra-assay precision, two standard curves and 3 samples for each standard curve are run. The standard curve concentration points as well as the samples are tested in duplicates on a single plate. Two different concentration values are obtained for each sample, using the two separate standard curves. The two concentration values for each sample is compared to each otherusing the CV% calculation. Intra-Assay CV%: <10%Inter-assay precision To evaluate inter-assay precision, the second standard curve is tested on a separate plate along with the second set of samples. Inter-Assay CV%: <12%RecoverySample TypeAverage % Recovery Range (%)Cell Culture Supernatants 112102-121Plasma 9770-126Serum132123-142SpecificityThe sandwich ELISA antibody pair detects Porcine TNF-alpha. Linearity of dilutionThe cell culture supernatants, plasma, and serum samples were spiked with recombinant porcine TNF-alpha, serially diluted in sample diluent and evaluated. Observed values were compared to expected values to calculate percent recovery and demonstrate the dilution linearity of the assay.Sample TypeAverage % Expected Range (%)1:2 Dilution1:4 Dilution1:2 Dilution1:4 DilutionCell CultureSupernatants897678-9767-85 Plasma957585-10267-86Serum1037792-11868-88SensitivityThe minimum detecable dose of porcine TNF-alpha is 20 pg/mL.This was determined by assaying replicates of zero and thestandard curve. The mean signal of zero + 2 standard deviationsread in dose from the standard curve is the LLD. This value is thesmallest dose that is not zero with 95% confidence.Limited product warrantyLife Technologies Corporation and/or its affiliate(s) warrant theirproducts as set forth in the Life Technologies' General Terms andConditions of Sale found on Life Technologies' website at/us/en/home/global/terms-andconditions.html.If you have any questions, please contactLife Technologies at /support.Product label explanation of symbols and warningsCatalogNumberBatchCodeTemperaturelimitationUsebyManufacturerConsultinstructions for useCaution, consultaccompanying documentsDISCLAIMERTO THE EXTENT ALLOWED BY LAW, LIFE TECHNOLOGIES AND/OR ITS AFFILIATE(S) WILL NOT BE LIABLE FOR SPECIAL, INCIDENTAL, INDIRECT, PUNITIVE, MULTIPLE, OR CONSEQUENTIAL DAMAGES IN CONNECTION WITH OR ARISING FROM THIS DOCUMENT, INCLUDING YOUR USE OF IT. Important Licensing Information: These products may be covered by one or more Limited Use Label Licenses. By use of these products, you accept the terms and conditions of all applicable Limited Use Label Licenses.Corporate entity: Life Technologies Corporation | Carlsbad, CA 92008 USA | Toll Free in USA 1 800 955 6288©2021 Thermo Fisher Scientific Inc. All rights reserved. All trademarks are the property of Thermo Fisher Scientific and its subsidiaries unless otherwise specified.For support visit /support or contact ************************.12-Apr-21。
猪瘟的实验室诊断及抗体监测

猪瘟的实验室诊断及抗体监测作者:高冲张平来源:《农家致富顾问·下半月》2019年第01期摘要猪瘟(CSF)是由猪瘟病毒(CSFV)引起的一种具有高度传染性的疫病,对养猪业危害极大,我国将其列为一类动物传染病。
近年来,猪瘟的非典型临床表现和病理变化越来越常见,给该病的临床诊断及有效防控带来了难度。
本文通过对猪瘟的实验室诊断及抗体检测技术进行简要综述,以期为做好猪瘟的实验室诊断与抗体监测,加强猪瘟的防控和净化提供参考。
关键词猪瘟;实验室诊断;抗体监测实验室检测技术是畜禽疾病防控的重要手段,准确而快速的诊断是畜禽疾病控制的前提。
猪瘟检测技术一直是该病防控研究的一个重要内容。
2007年我国农业部发布了《猪瘟防治技术规范》和相关的系列诊断方法用于中国的猪瘟防控。
近年来,随着养殖业规模化、集约化的快速发展,非典型猪瘟流行普遍,与其他猪病混合感染现象日趋严重,猪瘟疫苗高密度100%全面免疫带来了感染猪与免疫猪鉴别诊断的难题,加之非洲猪瘟的传入,对猪瘟的实验室诊断及抗体监测提出了更高的要求。
近年来,随着病毒学、组织培养技术、生物化学技术、单克隆抗体技术和分子生物学技术飞速发展,大大推动了我国猪瘟检测技术的研发进程。
1 猪瘟病原学诊断技术常用的猪瘟病原学诊断方法有病毒分离鉴定和实验动物法、鸡新城疫病毒强化实验、免疫荧光实验、酶联免疫吸附试验(ELISA)和分子生物学检测技术。
ELISA免疫检测技术是当前应用最广泛、发展最快的一项免疫检测技术。
猪瘟病毒抗原ELISA检测方法主要是双抗体夹心ELISA,也称抗原捕获ELISA(AC-ELISA),该方法优点是操作简单、自动化程度高、可做到高通量检测大分子抗原,缺点是该方法只对强毒检测效果良好,但对弱毒的监测不敏感。
随着分子生物学的迅速发展,猪瘟病毒核酸检测灵敏度呈现数量级的提高,RTPCR、RT-nPCR、荧光定量RT-PCR、RT-LAMP等多种分子生物学的检测方法为猪瘟病毒的临床快速诊断、基层场地实时便捷诊断、实验室检测、流行病学调查及野毒株和疫苗株的鉴别诊断提供了强有力的支持。
金标准诊断-非洲猪瘟病毒检测方案说明书
Diagnosis Solutions for African Swine Fever VirusTo collaborate in the prevention of spread of ASFV, and to maintain the well-being of your farm animals, Gold Standard Diagnostics provides a wide range of support tools, as well as in-field or laboratory tests to guarantee an early detection of the disease, as there is currently no effective vaccine or treatment available for the disease.Prevention and early detection play a key role in the control strategy of the ASFV. We aim to offer management tools and comprehensive diagnostic solutions - ELISA, LFA and molecular assays - to detect ASFV in domestic pigs and wild boars.Key Benefits• Easy and reliable tests with high specificity and sensitivity• Detecting a wide range of ASFV genotypes• Different formats available to fulfill specific requirements• Streamlined workflows• Offering one solution for eachscenario of ASFV situationRecommended Protocols of Analysis for the Management of different ASFV Scenarios*How Many Animals Do I Have to Analyze on my Facilities?The following data is just informative, it is not mandatory to strictly follow the information in the table.*Taking into account the following parameters: 95% confidence and 10% prevalence, you have to analyze 10% of the animals to ensure that the disease is not in your facilities with: • PPA COMPAC • INgene q PPA• Combination of INgezim PPA CROM Ag and INgezim PPA CROM Ab •INgezim PPA DASIf you use separately INgezim ASF CROM Ag detection or INgezim PPA CROM Ab detection, you have to analyze 13% of the animals to ensure that the infection has no presence in your facilities.These parameters are used for populations of more than 2,000 pigs. If this is not the case, and the number of pigs is lower, it is advisable to follow the table below to know the minimum number of pigs to be analyzed:* The following information is collected in the coming document: World Organisation for Animal Health (OIE); Manual of Diagnostic Tests and Vaccines for Terrestrial Animals; Infection with African Swine Fever VirusGold Standard Diagnostics**********************************.com Antibody Detection SolutionsAntigen Detection SolutionsINgezim PPA COMPAC - 11.PPA.K.3Blocking ELISA IgG and IgM detection (1)(2)• Detection in pig serum samples.• >99% Specificity & >99,5% Sensitivity respect the OIE method• This test has been validated by the European Reference Laboratory (EURL)•This method is recognized and recommended by the OIE Reference Laboratory for ASFVINgezim PPA CROM Ab- 11.PPA.K.41Laterla Flow Assay (2)• Detection in pig and wild boar serum, plasma and blood samples • Processing time of 10 minutes• Sensitivity: 99% correspondence with the OIE ELISA.• Specificity: 99.5% correspondence with INGEZIM ® PPA COMPAC and OIE ELISA. •96%specificity and >80% sensitivity respect IPMA (wild boars)INgezim ASF Ab – 11.ASF .K1 NEW!Indirect ELISA IgG detection• Detection of Ab in wild boars and pigs serum and blood samples •Particularly useful for “non-well-preserved” samplesINgezim PPA DAS - 11.PPA.K.2 RENEWED!Double Antibody Sandwich ELISA (2)• Analytical Sensitivity: detection of antigen in blood from day 7-10 p.i.• Detection in pig and wild boar blood, serum, exudates, tissues samples •Market Exclusivity for this referenceINgezim ASF CROM Ag - 11.ASF .K.42Lateral Flow Assay (3)• Detection in pig and wild boar blood samples• Analytical Sensitivity: detection of antigen in blood from day 7-10 p.i.• Processing time of 10 minutes•Especially efficient in acute stages of the diseaseINgene q PPA - 11.PPA.K.5TX/Q RENEWED!Real-Time PCR kit• Improved Sensitivity, LOD95%=10 copies/rxn • Improved formulation and stability• Detection in blood, serum, exudates and tissue samples • Designed in compliance with OIE guidelines • Validated by the EURL-ASF (CISA-INIA)• Perfect agreement with the OIE reference method (UPL) & better sensitivity than the UPL assay in pooled samples •Suitable for pools of up to 20 samples (for subclinical or chronic infections (CT>30), pools of 3-5 samples are recommended)(1) This method is recognized by the OIE Reference Laboratory for ASFV(2) Evaluation of protection induced by immunisation of domestic pigs with deletion mutant African swine fever virus BeninMGF by different doses and routes. Sanchez-Cordon PJ, Jabbar T, Berrezaie M, Chapman D, Reis A, Sastre P , Rueda, P , Goatley L, Dixon LK. Vaccine. 2018(3) Development of a novel lateral flow assay for detection of African swine fever in blood. Sastre P , Gallardo C, Monedero A, Ruiz T, Arias M, Sanz A, Rueda P . BMC Vet Res. 2016 Sep 15;12:206. doi: 10.1186/s12917-016-0831。
用ELISA对猪瘟免疫抗体效价监测的效果分析____
疫病防制为切实了解、掌握遂宁市安居区农村生猪散养户猪瘟免疫效果,给以后免疫预防提供科学依据,使猪瘟等动物重大疾病得到更好控制,遂宁市安居区动物预防控制中心于2013年2月在5个乡镇的农村生猪散养户中随机抽取了176份猪血清,用酶联免疫吸附试验(ELISA )检测免疫抗体,并对有关情况进行了进一步的分析。
结果表明,随机抽取的176份猪血清的猪瘟免疫抗体合格率为71.02%,但部分散养户猪瘟免疫结果不够理想,还需进一步加大力度,采取切实有效措施,提高猪只的有效免疫率,确保养猪业健康发展。
1材料与方法1.1血清样品从5个乡镇的农村生猪散养户中随机抽取了176份猪血清,其中玉丰镇41份,拦江镇38份,分水镇35份,聚贤乡30份,马家乡32份。
1.2诊断试剂与方法猪瘟抗体监测ELISA 试剂:购自深圳市绿诗源生物技术有限公司,诊断试剂在有效期内使用;试验严格按照诊断试剂说明书的要求进行操作。
1.3试验原理利用猪瘟抗原包被ELISA 板,然后加入适当稀释的待检猪血清与之反应形成CSFV-IgG 结合,再通过辣根过氧化物酶标记的抗猪IgG 二抗来检测与包被抗原结合的猪瘟特异抗体,最后加入颜色反应系统显色,显色的深浅与CSFV-IgG 的量成正比,通过酶标仪对待检血清的OD450值测定,当显色超过设定的临界值时结果判为阳性,反之则为阴性。
1.4判定标准本试剂盒的临界值为0.4,在酶标仪上测各孔的OD 值。
试验成立的条件是阳性对照孔的平均OD 值≥0.7,阴性对照孔的平均OD 值必须<0.1;样品OD 值≥0.4时判为阳性;样品OD 值<0.35时判为阴性;0.35到0.4之间为可疑。
2结果与分析结果表明:被检测的176份血清中OD 值高于或等于0.4的有125份血清,比例为71.02%;OD 值介于0.35到0.4之间的为9份血清,比例为5.11%;OD 值小于0.35有42份血清,比例为23.86%。
在检测的176份血清样品中,玉丰镇、拦江镇、用ELISA 对猪瘟免疫抗体效价监测的效果分析尹杰1,李洁萍2(1.四川省遂宁市安居区畜牧食品局四川遂宁629000;2.四川省遂宁市船山区畜牧食品局四川遂宁629000)doi:10.3969/j.issn.1008-4754.2013.04.013B 0.3210.2130.3550.3140.6390.7450.5550.6350.2130.2630.2440.463C 0.5530.6930.4830.560.6720.8990.7630.4630.7770.2110.3220.631D 0.4440.1550.5430.5320.6210.3610.7560.7230.6320.6120.5440.455E 0.4960.5830.3740.4630.5130.5660.7520.3860.4630.5360.2270.156F 0.4360.5630.6330.2660.7530.8230.4660.4750.2990.4960.5260.188镇;D6~D12、E1~E12、F1~F12、G1~G7血清采至拦江镇;G8~G12、H1~H7血清采至分水镇)。
三分钟帮您看懂抗体检测报告——猪瘟篇
三分钟帮您看懂抗体检测报告——猪瘟篇各位猪友在看完前几期中牧生物平台推送的内容后,是否对猪场防疫与疫苗使用有了更全面的认识呢?小编我是获益匪浅。
那么各位猪友在因地制宜地采用综合性的管控措施之后,又是否对即将获得的收益多了一份期待?等等……先别着急。
在无限的期许当中,由提升生产管理所带来的滚滚财源,是否真的能化虚为实?进一步的说,如何检验我们在猪场防疫方面所取得的成果呢?科学准确的抗体检测报告给您答案!最近几年,一些有条件的养殖场已经定期开展抗体检测工作。
那么在投入大量人力、物力后拿到手的抗体检测报告,您是否真的读的懂呢?本期中牧生物的专题,小编就与您一起来探究抗体检测报告里的门道。
目前,市场上最为常见的抗体检测报告主要有:猪瘟,蓝耳病,伪狂犬,口蹄疫,乙脑,细小,圆环等。
本次我们就选取公认的猪瘟阻断Elisa检测方式,以猪瘟抗体检测的金标准IDEXX检测试剂盒为例。
首先,从原理出发,通过一张图来看看猪瘟抗体检测。
上图所示的阻断法检测猪瘟疫苗抗体的原理,可以简单的概括为:第3步中加入的酶标记物(抗猪瘟病毒的单克隆抗体),与被检血清中的抗猪瘟病毒抗体,两者竞争与包被抗原结合。
而第2步加入的被检血清中如果大量含有抗猪瘟病毒抗体,就会阻断酶标物抗体与包被抗原的结合。
最后加入底物显色。
被检血清中猪瘟病毒抗体越多,阻断率越高,颜色越浅。
猪瘟疫苗的免疫评估一般关注两点:1.阳性率:猪瘟抗体(阻断率(Blocking)≥40%,判为阳性结果;30%<Blocking<40%,判为可疑结果;Blocking≤30%,判为阴性结果)。
免疫合格率:阻断率(Blocking)≥50%的,即为免疫合格(断奶仔猪猪瘟第一次免疫受母源抗体干扰,≥30%可视为合格)。
免疫合格的比例即为免疫合格率。
2.变异系数:Coefficient of Variation(CV)变异系数计算的是平均个体的变化,以平均滴度背离的百分数来表示公式如下:变异系数 CV = 标准偏差(STDEV)/平均阻断率×100%CV≤40%,显示了群内猪只有一个均衡的、相似反应。
非洲猪瘟病原学检测方法
《非洲猪瘟病原学检测方法》非洲猪瘟(African Swine Fever,ASF)是一种严重危害全球养猪业的烈性传染病,给世界各国的生猪养殖业带来了巨大的经济损失和社会影响。
及时、准确地检测非洲猪瘟病毒(African Swine Fever Virus,ASFV)对于疫情的防控、诊断和扑灭至关重要。
本文将对目前常用的非洲猪瘟病原学检测方法进行详细的介绍和分析,以期为相关领域的研究和实践提供参考。
一、病毒分离培养病毒分离培养是非洲猪瘟病原学检测的经典方法,也是确诊 ASFV 的金标准。
该方法通过将疑似感染组织样本接种到适宜的细胞培养体系中,在特定的培养条件下培养,观察细胞病变效应(Cytopathic Effect,CPE)以及进行病毒的鉴定和分离。
病毒分离培养的优点是具有高度的特异性和敏感性,能够直接检测到病毒的存在和增殖。
然而,该方法也存在一些局限性。
病毒分离培养需要较长的时间周期,通常需要数天到数周甚至更长时间才能观察到结果,不利于疫情的快速诊断和及时防控。
病毒分离培养对实验条件和技术要求较高,需要专业的实验室设备和熟练的技术人员,操作较为复杂且成本较高。
一些弱毒株或变异毒株可能在细胞培养中难以分离和鉴定,从而影响检测的准确性。
二、实时荧光定量 PCR 技术实时荧光定量 PCR(Real-time Fluorescence Quantitative PCR)技术是目前非洲猪瘟病原学检测中应用最为广泛、最具发展潜力的方法之一。
该技术基于 PCR 原理,通过特异性引物和荧光探针,在 PCR 反应体系中实时监测荧光信号的变化,从而定量检测 ASFV 的核酸。
实时荧光定量 PCR 技术具有以下显著优点。
检测速度快,一般几个小时内即可获得结果,大大缩短了检测周期,能够满足疫情快速响应和处置的需求。
灵敏度高,可以检测到极低浓度的病毒核酸,提高了检测的准确性和可靠性。
特异性强,能够特异性地识别 ASFV 核酸,避免与其他病毒的交叉干扰。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(上接第49页)
3 讨论
目前,我国针对非洲猪瘟病毒已建立了荧光定量PCR方法, 该方法用于检测抗原灵敏度高,特异性强,但实验条件要求高。 用血清学方法检测抗体有利于大规模的普查和快速诊断且实验条 件要求低。本试剂盒的原理为间接ELISA,若检测的血清中含有 抗体就会生成抗原- 抗体- 酶标二抗复合物,加入底物后反应成深 色。该试剂盒要求将样品做100倍稀释后再检测,可见此试剂盒灵
铜程度成正比。并在缺铜较严重的样品中,发现有鳞片层破损的 毛样,镜检观察有碎玻光现象,有的毛纤维粗细不匀,偶有异常
的突然弯曲。
动 物 毛 中 的 Zn 可 以反 映 日 粮 中 Zn 的 变 化 。 Zn是 很 多 酶 的 复 合体和催化剂,它通过参与机体内DNA和RNA聚合酶的合成来直
接影响核酸和蛋白质的合成E 133。Zn严重缺乏的绵羊,表现为羊 毛生长受阻,纤维弯曲减少,强度降低,表皮有大量鳞片皮屑,
状。另外,有些羊毛中混杂的皮屑较多,使羊毛粘连在一起,眼 观比较脏乱,上述症状与本次实验测定结果相结合充分说明该羊
群属于锌缺乏群体。
4 结论
经本次实验对阿拉尔市托喀依乡羊群中羊只的外观健康状况
观察,毛样的采集、眼观、显微观察,毛样中铜、锌含量的测定 可知阿拉尔地区卡拉库尔羊羊毛中铜、锌两种元素缺乏明显。为
2 结果
2. 1 被检样品的OD值 对实验采集样品检测的OD值详见表2。
2. 2 结果判定 计算公式为PP= (OD neg or OD sample)/(OD pos)×100
本 实 验结 果 成 立的 前 提 是阳 性 对 照OD4 50 nm ≥0 .5 ,同 时 阴 性对 照 PP ≤10 数据才有效,判定标准为PP≤10 阴性 PP在11~19 可 疑,PP≥20 阳性。因为,阴性对照和样品计算均和阳性对照OD 值有关,所以本实验还要求2个阳性对照的OD值与平均值相差在 25%以内才算有效。另外,我们可以将公式简化,得出O D neg ≤0.1OD pos,这样更利于直接做出判断。经计算发现阴阳性对照 OD值符 合实 验要 求, 样品 OD值均 ≤0 .1ODpos, 结果 为阴 性。
敏度非常高,操作时应严格按照试剂盒要求,特别是加入酶标二 抗后冲洗的过程,若洗不干净容易产生假阳性,本实验采用洗板 机清洗,相对人工清洗效果要好一些。另外本试剂盒配有一块确 认板,该板是针对筛选版筛选出的阳性样品进行复检,若复检结 果 为 阳性 那 就可 以 确定 有 抗体 存在 。 本实 验 检测 的 92 份血 清 筛选 板检测的结果均为阴性,所以没再用确认板复检。
提高卡拉库尔羊的健康状况、繁殖率及毛皮的经济价值,应在饲 料中补饲适量的铜、锌添加剂,为该地区养羊业的健康发展奠定
基础。 参考文献 [1] 李莲瑞,陈根元,王晓 斌,等. 新疆卡拉库尔羊的研究现状及 前
景[J].中国草食动物.2008,28(2):63- 64. [2] 李志农.卡拉库尔羊[M].第一版.北京:农业出版社.1984. [3] 李继兴,陶大 勇.卡拉库尔羊妊娠母 羊微量元素的测定 [J].黑龙 江
氨酸转化为黑色素的关键酶与限速酶,且酪氨酸酶是一种含铜 的酶[8],所以,铜含量的多少,会直接影响毛纤维色素颗粒的颜 色,数量及其在皮质层细胞内的分布情况。
经过高倍显微镜观 察,发现在卡拉库尔羊其他条件(如毛
色、年龄、性别、胎次)接近的情况下,毛中铜元素含量缺乏 者,毛中皮质层颜色较含铜较高或正常者要浅淡,浅淡程度与缺
随着年龄的增长,羊毛中铜锌的含量是逐渐减少的,在毛色 变化的过程中,铜锌的含量也随之变化,可见,两者之间存在着 一定的正相关的关系。
表5 不同胎次卡拉库尔羊羊毛中铜、锌的平均含量
胎次
样本数(份) Cu(μg/ g) Zn(μg/ g)
2胎以下
12
2~4胎
16
5. 102 5. 162
66. 621 72. 234
脱落并再生不良或不再生,即脱毛症。一般植物有富集锌的能
力,所以就算在缺锌地区不算严重的情况下,动物一般也不会发 生缺锌。另外,经查阅一些相关资料,发现以前在托喀依乡采样
并测得的卡羊毛中锌含量是在正常范围之间。但据本次实验结果 显示,本次实验羊群属于锌缺乏群体。但在取样的羊群中本人也
见到有个别羊表现局部脱毛,脱毛处皮肤嫩红,类似角化不全症
表1 主要试剂
表2 检测血清OD值统计表
A1、B1为阴性对照,C1 、D1为阳性对照,计算时取其平均值。A12 ~H12为野猪血清。
(下转第48页)
·49·
基础科学
中国畜牧兽医文摘 2012年 28卷 第11期
表4 不同年龄段卡拉库尔羊羊毛中铜、锌的平均含量
年龄
样本数(份) Cu(μg/ g) Zn(μg/ g)
4胎以上
11
4. 400
61. 068
表5实验数据显示:毛中铜、锌含量在2~4胎羊毛中最高。可 能是 初胎 导致 铜、 锌需 求被 胎儿 剥夺 ;2 胎后 羊群 适应 外界 环境 造 成羊毛中铜、锌含量逐渐升高;4胎后因母羊已到高龄(本次实验 中母 羊 样 本占 93 %) , 因采 食 量和 吸 收 利用 功 能降 低 导 致铜 、 锌 两元素在体内含量显著下降导致机体内铜锌含量明显降低。
·48·
2岁内
14
5. 017
73. 247
2~4岁
18
4. 904
66. 878
4岁以上
18
4. 913
60. 942
由表 4可 知 ,2 岁以 内 的 卡拉 库 尔羊 群 体毛 中 铜、 锌 元素 含 量 最高 ;2~ 4岁 羊群 体铜 、锌 含量 次之 ;4 岁以 上羊 群体 毛中 铜锌 含 量介于上述2群体之间。笔者认为可能是由于当地饲草中铜含量较 低,在这种异常的情况下,各年龄段的羊处于缺铜状态,导致卡 拉库尔羊机体铜元素含量都限定在接近饲草中铜元素含量的水平 上。
瑞典 SVANOVA非洲 猪瘟 抗体 ELISA检 测试 剂盒 (见 表1 )。 1. 3 血清采集
来自辽宁绥靖,内蒙古赤峰,大连东港 共计92份抽检血清, 其中有8份为野猪血清。
1. 4 实验方法 ①使用前将试剂盒恢复常温。②用配好的洗液先冲洗要用的
板 条 3次 。③ 将 阴阳 性对 照 和样 品 都做 10 0倍 稀释 。 ④每 板 选阴 阳 性 对照 各两孔 ,其 余为 加样孔 ,每 孔加 100μl ,混 匀,置 37℃ 温箱 孵育1 h。⑤甩去孔内液体,用洗板机清洗4次。⑥每孔加100μl酶 标记物,置37℃温箱孵育1 h。⑦重复步骤④。⑧加100μl底物, 室温(18~25℃)下避光反应10 min。⑨每孔加50μl终止液,加 入顺序同上,用酶标仪450 nm读数。
畜牧兽医.2012,25(1):65- 67. [4] 周学辉, 苗小林,张继华. 青海湖滨草甸草 场土- 草- 畜生态系统
中铜的季节性变化研究[J].中国草地学报.2009,(2):108- 110. [5] 李树伟,尹阔,谢安,等.新疆4个绵羊品种羊毛微量元素 含量测
定[J].西北农业学报.2008,17(4):1- 4. [6 ] 陶大勇 ,蒋涛,陈荣 .塔里木河上 、中游卡拉库 尔羊放牧系统 中
中国畜牧兽医文摘 2012年 28卷 第11期
基础科学
非 洲 猪 瘟 ELI SA抗 体 检 测 报 告
张 倩1 刘明团1 任玮杰2
(1. 山东省青岛畜牧兽医研究所,青岛 266000; 2. 中国动物卫生与流行病学中心,青岛 266032) [ 摘 要] 采用瑞典SVANOVA试剂盒对抽检的92份猪血请进行非洲猪瘟病毒抗体检测。结果表明,该样本血清全部为阴性。 [ 关键词] 非洲猪瘟 抗体 ELI SA
目前,我国正在积极开展非洲猪瘟的相关研究,不仅要重视 在引进国外商品猪以及猪肉制品时做好检验检疫工作,还要定期 对国内的家猪、野猪进行检测,确保国内无带毒猪存活。由于非 洲猪瘟目前在我国尚未报道,所以我们可以通过检测抗体的方法 来进行监测。
1 材料与方法 1. 1 仪器与设备
TE CA N酶标 仪,T E CAN 洗板机, The rmo- Sha ker 温箱 , Eppendorf移液器 1. 2 试剂
3 讨论
本实验采样的地方为土壤中铜、锌元素都严重缺乏的地区, 植物中铜严重缺乏,但锌一般不缺乏[6]。与正常含量范围相比, 本实验所采集的卡拉库尔羊毛样中Cu、Zn含量与正常范围值相差 极显 著 (P<0.0 1) ,都 表 现为 明 显缺 乏 。动 物体 内 Cu、 Zn两 种元 素含量易受日粮中微量元素含量的影响。因此,缺铜原因可能是 当地农作物比较单一,一般只有棉花与水稻,土壤盐渍化,土壤 与植被的含铜量都很低。据农一师农科所有关资料显示,阿克苏 地区0- 20cm土层水溶性铜含量平均为11.83 mg/kg,芦苇为3.20 mg/kg,胡杨 叶为3. 10 mg/kg,棉花 叶为9. 00 mg/kg [9]。 平常羊 群又很少有针对性的补饲,便导致了羊群普遍性的缺铜。在毛纤 维角蛋白合成过程中,铜酶也决定了双硫键的形成与角蛋白的结 构。羊毛缺Cu使纤维含硫量下降,角蛋白角化延迟或角化不良, 角蛋白形成异常,导致了毛纤维发育发生各种畸形,纤维中皮质 发育不好,鳞片层与毛尖容易遭受机械性破损。造成弯曲频率降 低,纤维强度降低,产量降低[7]。据已有的研究,酪氨酸酶是酪
非洲猪瘟(ASF)是一种由非洲猪瘟病毒(ASFV)引起的猪 的发热性、接触性传染病,其特征是高热、皮肤充血及淋巴结和 内脏 器官 严重 充 血。 急性 型死 亡 率可 达10 0%。 我国 己将 此 病列 为 一类动物疾病,世界动物卫生组织(OIE )将其列为须通报的动 物疫病,该病受到世界各国高度重视,并作为动物外来疫病进行 研究。
铜、锌的测定[J].畜牧与兽医.2006,38(8):63- 64. [7 ] 袁之兆 ,郑绍仪,严 峻.铜对卡拉 库尔羊被毛组 织及理化特性 的
