原子的结构优秀课件
合集下载
原子结构的模型(PPT课件(初中科学)26张)

金金属箔
[1]大多数粒子不改变本来的运动方向,原因是:
原子内有较大的间隙。
。
[2]有小部分改变本来的运动路径,原因是: α粒子受到了同种电荷互相排挤作用而改变了运动方向。。
[3]极少数被弹射了回来,原因是: α粒子撞击到了带正电荷、质量大、体积很小的核。 。
自从卢瑟福用α粒子轰击了金属箔后,使人 们对原子内部的结构有了更深入的了解,从而对 原子内部结构的认识更接近了它的本质。
2.汤姆生的原子结构模型
汤姆生模型 (西瓜模型)
探究:卢瑟福的α粒子散射实验
1911年,英国科学家卢瑟福 用带正电的α粒子轰击金属箔, α粒子源 实验发现多数α粒子穿过金属箔 后仍保持本来的运动方向,但有 少量的α粒子产生了较大的偏转。
金金属箔
探究:卢瑟福的α粒子散射实验
1911年,英国科学家卢瑟福 用带正电的α粒子轰击金属箔, α粒子源 实验发现多数α粒子穿过金属箔 后仍保持本来的运动方向,但有 少量的α粒子产生了较大的偏转。 问题思考:
在化学变化中可分的微粒是( B ) A.原子 B.分子 C.电子 D.原子核
6.下列叙述正确的是……………( B ) A.原子核都是由质子和中子构成的 B.原子和分子都是构成物质的一种粒子,它 们都是在不停地运动的 C.原子既可以构成分子,也可以构成物质 D.物质在产生物理变化时,分子产生了变化, 在产生化学变化时,原子产生了变化
原 子
原子核 (+)
质子:一个质子带一个单位的正电荷 中子: 中子不带电
电子: 一个电子带一个单位的负电荷
( —)
原子核所带的电荷数简称为核电荷数。
说一说:以氧原子为例解说原子的结构
电子:8个,带8个单位负电荷
原子的结构ppt课件

13.关于构成物质的微观粒子,下列说法正确的是( )
D
A. 离子带电,所以不能直接构成物质B. 氯离子的质子数比电子数多1个C. 离子是带电粒子,所有带电粒子一定是离子D. 原子得失电子变成离子,原子核不发生变化
14.下列关于、 两种粒子的判断,正确的是( )
C
①核电荷数相同 ②核外电子数相等比 稳定 ④质量几乎相等⑤质子数相等A. ①③⑤ B. ②④ C. ①③④⑤ D. ①②③④⑤
A
B
C
11.下图形象地表示了氯化钠的形成过程。下列叙述中,不正确的是 ( )
B
A. 钠原子在化学反应中容易失去电子B. 钠原子与钠离子都不显电性C. 氯原子得到1个电子形成氯离子D. 氯化钠由钠离子和氯离子构成
12.某粒子结构示意图如图所示,下列说法错误的是( )
D
A. 若 ,则该粒子是阴离子B. 若 ,则该粒子是原子C. 若 ,则该粒子是阳离子D. 若 ,则该粒子是由一个原子得到2个电子形成的
5、相同的原子层结构化学性质相似相同的原子层结构:
化学性质相似:
电子层数相同,切每层上电子数相等
条件:最外层电子数认为最终的结果是( )A.Na原子与Cl原子都无法构成相对稳定结构B.Na原子与Cl原子都构成了相对稳定结构C.Na原子与Cl原子只有一方构成了相对稳定结构
小练习:试着写出下面的离子示意图代表什么
Al3+
S2-
5、离子符号的意义
Al3+
3Al3+
表示一个铝离子
表示3个铝离子
表示一个铝离子带3个单位正电荷
6、离子也是构成物质的一种粒子
由离子构成的物质,化学性质由离子保存
如:NaCl由Na+和Cl-构成,所以化学性质由 Na+和Cl-保持。
D
A. 离子带电,所以不能直接构成物质B. 氯离子的质子数比电子数多1个C. 离子是带电粒子,所有带电粒子一定是离子D. 原子得失电子变成离子,原子核不发生变化
14.下列关于、 两种粒子的判断,正确的是( )
C
①核电荷数相同 ②核外电子数相等比 稳定 ④质量几乎相等⑤质子数相等A. ①③⑤ B. ②④ C. ①③④⑤ D. ①②③④⑤
A
B
C
11.下图形象地表示了氯化钠的形成过程。下列叙述中,不正确的是 ( )
B
A. 钠原子在化学反应中容易失去电子B. 钠原子与钠离子都不显电性C. 氯原子得到1个电子形成氯离子D. 氯化钠由钠离子和氯离子构成
12.某粒子结构示意图如图所示,下列说法错误的是( )
D
A. 若 ,则该粒子是阴离子B. 若 ,则该粒子是原子C. 若 ,则该粒子是阳离子D. 若 ,则该粒子是由一个原子得到2个电子形成的
5、相同的原子层结构化学性质相似相同的原子层结构:
化学性质相似:
电子层数相同,切每层上电子数相等
条件:最外层电子数认为最终的结果是( )A.Na原子与Cl原子都无法构成相对稳定结构B.Na原子与Cl原子都构成了相对稳定结构C.Na原子与Cl原子只有一方构成了相对稳定结构
小练习:试着写出下面的离子示意图代表什么
Al3+
S2-
5、离子符号的意义
Al3+
3Al3+
表示一个铝离子
表示3个铝离子
表示一个铝离子带3个单位正电荷
6、离子也是构成物质的一种粒子
由离子构成的物质,化学性质由离子保存
如:NaCl由Na+和Cl-构成,所以化学性质由 Na+和Cl-保持。
人教版九年级化学上《原子的结构》公开课一等奖优秀课件

科学研究
原子钟的精确计时为科学 研究提供了重要的技术支 持,如测量光速、验证相 对论等。
原子结构与材料科学的关系
材料性能与原子结构
材料的物理和化学性能与其原子结构密切相关,如金属材料的导 电性、陶瓷材料的耐高温性等。
新材料研发
通过改变原子结构或排列方式,可以研发出具有特殊性能的新材料 ,如超导材料、纳米材料等。
原子在化学反应中保持其不可分割性。
卢瑟福的核式结构模型
原子中心有一个带正电荷的原 子核。
原子核外有一定数量的电子绕 核运动,电子带负电荷。
原子的质量几乎全部集中在原 子核上,电子的质量可以忽略 不计。
波尔的分层模型
电子在原子核外的运动不是任意的,而是分布在不 同的能级上,形成分层结构。
电子在不同能级之间的跃迁会吸收或发射特定频率 的光子。
原子结构与元素性质的关系
元素的化学性质主要由其原子的最外层电子数决定。最外层电子数决定 了元素的化合价和氧化还原性质。
元素的物理性质如熔点、沸点、密度等与其原子结构密切相关。例如, 碱金属元素由于原子半径较大,电子云密度较小,因此熔点、沸点较低
,密度较小。
元素的电负性、电离能、电子亲和能等性质也与其原子结构密切相关。 例如,卤素元素由于原子半径较小,核对外层电子的吸引力较强,因此 电负性较大。
原子的稳定性和化学反应性质与电子的分层结构密 切相关。
现代电子云模型
电子在原子核外的运动状态用电子云来描述,电子云表示电子出现的概率分布。 电子云的形状和大小与原子轨道有关,不同轨道的电子云具有不同的形状和大小。
原子的化学性质主要由最外层电子决定,最外层电子数决定了元素的化学性质。
04
原子结构与元素周期表
原子结构示意图ppt课件
(3)、次外层最多容纳电子数-----1---8--个---------
(4)、倒数第三层最多容纳电子数--3---2--个-------
注意:多条规律必须同时兼顾。
10
失去电子
+12 2 8 2
+12 2 8
Mg
Mg2+
得到电子
+8 2 6
+8 2 8
O
O2-
11
钠离子的形成
钠原子
钠离子
失一个电子
(1)、第n层最多容纳电子数(n指的是电子层数)
2n 个 --------------2-----------。1→ 2 → 3→ 4→ 5 → 6
K→L → M→N → O → P 2→ 8 →18→32→50→ 2n2
(2)、最外层最多容纳电子数--8---个-------。 (K层为最外层时,最多容纳电子数---2---个-----)
2、活泼非金属元素易得电子变为带负电 荷的阴离子
O 得 2e-
O2- (带2个单位负电荷)
15
Mg
+12
Mg2+
+12
O2-
O
+8
+8
结论:
原子最外层的电子数小于8个时,在
化学反应中总是得到或失去电子而达到
最外层8电子的稳定结构。
16
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应 生成氧化物和氯化物,请写出这些氧化物和氯化物的化 学式。
-1
7
1 17
问题解决
①金属最外层电子数﹤4时,易失去电子
原子
(化合价=+失去的电子数目)
②非金属最外层电子数≥4时,易得到电子
(4)、倒数第三层最多容纳电子数--3---2--个-------
注意:多条规律必须同时兼顾。
10
失去电子
+12 2 8 2
+12 2 8
Mg
Mg2+
得到电子
+8 2 6
+8 2 8
O
O2-
11
钠离子的形成
钠原子
钠离子
失一个电子
(1)、第n层最多容纳电子数(n指的是电子层数)
2n 个 --------------2-----------。1→ 2 → 3→ 4→ 5 → 6
K→L → M→N → O → P 2→ 8 →18→32→50→ 2n2
(2)、最外层最多容纳电子数--8---个-------。 (K层为最外层时,最多容纳电子数---2---个-----)
2、活泼非金属元素易得电子变为带负电 荷的阴离子
O 得 2e-
O2- (带2个单位负电荷)
15
Mg
+12
Mg2+
+12
O2-
O
+8
+8
结论:
原子最外层的电子数小于8个时,在
化学反应中总是得到或失去电子而达到
最外层8电子的稳定结构。
16
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应 生成氧化物和氯化物,请写出这些氧化物和氯化物的化 学式。
-1
7
1 17
问题解决
①金属最外层电子数﹤4时,易失去电子
原子
(化合价=+失去的电子数目)
②非金属最外层电子数≥4时,易得到电子
《原子的结构》PPT课件

电子的能级
电子在原子中具有不同的能级,每个 能级对应不同的电子轨道和能量状态。
电子的运动
电子在原子核外以极高的速度运动, 形成“电子云”或“概率分布”。
原子核与电子的关系
电荷平衡
原子核的正电荷与电子的负电荷 相互平衡,使得整个原子呈电中
性。
引力与斥力
原子核与电子之间存在引力和斥力, 引力使得电子被束缚在原子核周围, 斥力则使得电子不会塌缩到原子核 中。
电负性是衡量元素在化合物中吸引电子能力 相对大小的标度,电负性越大,元素的非金 属性越强。
元素周期表的应用
预测未知元素的性质
根据已知元素的性质和周期律, 可以预测未知元素的性质。
指导新材料的研发
利用元素周期表中的元素性质, 可以指导新材料的研发,如超导 材料、半导体材料等。
指导化学反应
利用元素周期表中的元素性质, 可以指导化学反应的进行,如选 择合适的催化剂、反应条件等。
3
汤姆生的“葡萄干面包”模型 发现电子后,提出原子由带正电的“面包”和嵌 在其中的带负电的“葡萄干”(电子)组成。
原子结构研究的重要性
01
02
03
理解物质本质
原子是构成物质的基本单 元,研究其结构有助于理 解物质的本质属性。
推动科技发展
原子结构的深入研究为量 子力学、核能利用、材料 科学等领域的发展奠定了 基础。
性质。
原子结构与元素性质的关系
原子半径
电离能
原子半径的大小与元素的化学性质密切相关, 原子半径越大,原子核对核外电子的吸引力 越小,元素的金属性越强。
电离能的大小反映了原子失去电子的难易程 度,电离能越小,原子越容易失去电子,元 素的金属性越强。
原子的结构完整版PPT课件

工业领域应用
放射性同位素可用于材料 检测、无损探伤、辐射加 工等。
其他领域应用
放射性同位素还可用于科 学研究、环境保护、农业 生产等领域。
放射性同位素对环境影响及安全防护措施
对环境影响
放射性同位素衰变产生的射线会对环境和生物体造成危害,如污 染空气、水源和土壤等。
安全防护措施
为了保障人类和环境安全,需要采取一系列安全防护措施,如合 理选址、屏蔽防护、废物处理等。
放射性同位素概念及来源
放射性同位素定义
01
具有相同原子序数但质量数不同的同位素,能自发地放出射线
并转变为另一种元素。
放射性同位素来源
02
天然放射性元素和人工合成放射性元素。
放射性同位素衰变类型
03
α衰变、β衰变和γ衰变。
放射性同位素在医学、工业等领域应用
医学领域应用
放射性同位素可用于诊断 和治疗疾病,如放射性碘 治疗甲状腺疾病、PET扫 描等。
过渡元素位于周期表中间部分, 包括3~12列的元素。它们具有 多种氧化态和丰富的化学性质, 是构成众多合金和催化剂的重要
成分。
稀有气体元素
稀有气体元素位于周期表的最右 侧,它们具有稳定的8电子构型 (氦为2电子构型),化学性质 极不活泼,一般不易与其他物质
发生化学反应。
04
化学键与分子间作用 力
化学键类型及特点
分子间作用力影响物质的物理性质
分子间作用力主要影响物质的熔点、沸点、密度、硬度等物理性质。一般来说,分子间作用力越强,物质的熔点 、沸点越高,密度越大,硬度也越大。例如,氢键的存在使得水的熔沸点异常高,范德华力则主要影响由分子构 成的物质的物理性质。
05
原子光谱与能级跃迁
人教版九年级化学上《原子的结构》公开课一等奖优秀课件(精)

典型元素核外电子排布实例分析
01
02
03
04
氢元素
原子核外只有一个电子,占据 1s轨道。
氦元素
原子核外有两个电子,分别占 据1s轨道的两个不同自旋方向 的状态。
碳元素
原子核外有六个电子,根据洪 特规则和泡利原理,两个电子 占据1s轨道,两个电子占据2s 轨道,剩余两个电子分别占据 2p轨道的两个不同自旋方向的 状态。
无法解释电子在原子核外 空间的分布和运动状态。
波尔分层模型及现代电子云模型
分层模型
波尔在卢瑟福模型的基础上,提出了电子分层运动的假设 ,即电子在特定的轨道上绕核运动,这些轨道具有不同的 能量级别。
量子化条件
波尔引入量子化条件,解释了氢原子光谱的不连续性和稳 定性,奠定了量子力学的基础。
现代电子云模型
量子计算机的研发
探讨量子计算机的原理、优势及挑 战,指出利用原子的量子态进行计 算是未来计算机发展的重要方向之 一。
THANK YOU
感谢聆听
结论分析
根据实验结果,可以推断原子内部有一个带正电 荷的、体积很小的核心,即原子核。
荧光屏实验观察原子核内部结构
实验原理
利用某些元素在受到激发时会发出特定波长的荧光的性质 ,通过荧光屏观察原子核内部结构。
实验步骤
准备放射性元素、荧光屏等实验器材;将放射性元素放置 在荧光屏附近,观察荧光屏上的发光情况;记录不同元素 发出的荧光颜色和位置,分析数据。
九年级化学教学要求
掌握原子结构的基本概念和原理
包括原子的定义、组成、结构模型等。
理解原子结构与元素性质的关系
了解元素周期表的结构和规律,理解元素性质与原 子结构的关系。
培养实验技能和科学探究能力
原子结构微课获奖课件公开课一等奖课件省赛课获奖课件

• 2. 下列半径最大的微粒是 ( C )
• A. F D. Ca2+
B. Mg2+
C. Cl-
• 3 .A和B是前三周期的元素,它们的离子 A2+和B3+含有相似的核外电子层构造,下 列说法对的的是 A (C )
• A. 原子半径:A>B
• B. 原子序数:A>B
• C. 离子半径:A2+>B3+
• D. 质量数:A>B
4 元素性质呈周期性变化
每一周期从左至右金属性逐步削弱, 非金属性逐步增强。
判断元素金属性强弱的方法
1、单质与水反映的难易程度 单质与酸反映的激烈程度
2、最高价氧化物对应水化 物的碱性强弱
判断元素非金属性强弱的方法
1、单质与氢气生成气态氢化物 的难易程度 以及氢化物的稳定性
(3)在哲学方面,元素周期律揭示了元素原 子核电荷数递增引发元素性质发生周期性变化 的事实,有力地论证了事物变化的量变引发质 变的规律性。
• 1.原子序数1—18号元素中:
• (1)与水反映最激烈的金属是____K_________;
• (2)与水反映最激烈的非金属单质是__F2_________;
• (3)在室温下有颜色的气体单质是__F_2_C_i2________;
• (4)在空气中容易自燃的单质名称是__白_磷_____;
• (5)除稀有气体外,原子半径最大的元素是_N_a____; • (6)原子半径最小的元素是__H___________;
• (7)气态氢化物水溶液呈碱性的元素是____N_____;
构造
反映
决定
性质
(1)构造决定位置:原子序数=核电荷数 周期序数=电子层数 主族序数=最外层电子数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+3 3 A
6 2 4 +10 2 8 +14 2 7 5
B
C
D
【感悟与收获】
这节课我们畅游了原子的世界,谈谈你的感悟和 收获。 1.认识物质是可分的,分子、原子是可以再分的。
2.通过科学史、多媒体动画、图标等素材,了解科 学研究物质微观结构的方法。
3.借助科学史话,感受科学家敢于质疑、严谨求实 的科学态度。 ……..
练习与应用
3. 某原子的原子结构示意图为
,该原子的
核电荷数为 13 ,核外有 3 个电子层,第二层上
有 8 个电子,最外电子层上有 3 个电子。
【亲手尝试】根据氧原子的结构图画出结构示意图
第一层(2个) 第二层(6个)
(最外层)
+8 2 6
探究二 原子核外电子的排布有什么规律?
3. 核外电子的排布规律:
⑴第一层最多容纳__2_个电子,第二层最多容纳__8_个电子。 (2)最外层不超过 8 个电子,只有1层的不超过__2_个电子。 ⑶电子先排满第__1_层,再排第__2_层,排满第__2_层,再 排第_3__层。(按照能量由低到高的顺序分层排布)
练习与应用
4. 下列原子结构示意图书写正确的是( C )
【情景激活】
+ ++
我是一个小小的电子,我在原子里围绕着正中心 的原子核不停地高速运动。虽然空间很大,但我和 我的同伴总想挣脱原子核的吸引。可是原子核这个 小老头很有能耐,虽然只占原子的一丁点空间,里面 却由质子和中子构成。中子不带电,质子带正电,正 好把我身上的负电深深地吸引…
哎!大家猜一猜,我和我的同伴在原子里是怎样运 动的呢?
能 量: 低
高
能量低的在离核近的区域运动, 能量高的在离核远的区域运动。
钠原子的结构 (三层(1个) (最外层)
2. 原子结构示意图:
第一层 第二层 第三层(最外层)
弧线表示 电子层
+11 2 8 1 弧线上的数字表示各电子层上的电子数
数字1也可以表示 最外层电子数 圆圈表示 原子核 圈内数字表示 质子数 “+”表示 原子核带正电
探究一 核外电子是怎样运动的? 观看原子的核外电子运动的模拟动画。
氢原子的结构 (1个电子)
行星绕太阳运功
钠原子的结构 (11个电子)
第一层 第二层 第三层
二.原子核外电子的排布
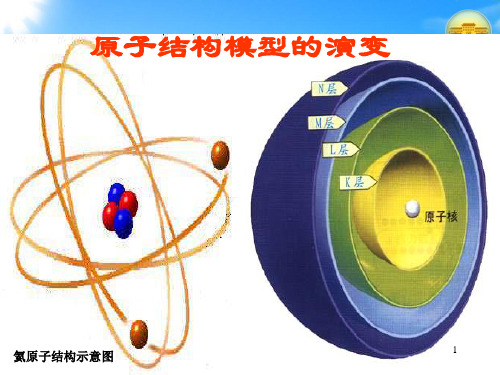
1. 核外电子的分层排布
核外电子分层排布示意图
核外电子分层排布规律
电子层: 1 2 3 4 5 6 7
离 核: 近
远
