工科化学(化学热力学)单元测试与答案
高三化学化学热力学练习题及答案

高三化学化学热力学练习题及答案1. 选择题1. 下列原因中,能够说明热力学第一定律成立的是:A. 熵是一个状态函数B. 热力学第二定律成立C. 理想气体的内能与温度有关D. 等温过程中,热容量为0答案:D2. 熵最小原理是热力学第几定律的基础?A. 热力学第一定律B. 热力学第二定律C. 热力学第三定律D. 热力学第四定律答案:C3. 以下哪个过程属于绝热过程?A. 等温过程B. 等通压过程C. 等经热过程D. 等熵过程答案:D2. 填空题1. 在绝热条件下,压强增加时,气体的_________。
答案:温度增加2. 一种气体的摩尔熵为5R/J·K^-1,当气体的摩尔数变为原来的2倍时,熵的变化量为_________。
答案:5R/J·K^-13. 摩尔焓是单位质量物质的_________。
答案:焓3. 计算题1. 一个氧气分子的质量为5.3×10^(-26) kg,它的平均动能为3.01×10^(-19) J,求氧气分子的温度。
答案:298 K解析:根据理想气体的平均动能公式:K_avg = (3/2)kT其中,K_avg为平均动能,k为玻尔兹曼常数,T为温度。
将已知数据代入计算:3.01×10^(-19) J = (3/2) × 1.38×10^(-23) J/K × TT = (3.01×10^(-19) J × 2) / ((3/2) × 1.38×10^(-23) J/K)T = 298 K2. 某物质在压强为1 atm,温度为298 K时,其体积为10 L。
将压强增加到2 atm,温度保持不变的情况下,体积变为多少?答案:5 L解析:根据理想气体状态方程:PV = nRT其中,P为压强,V为体积,n为物质的摩尔数,R为气体常数,T 为温度。
将已知数据代入计算:1 atm × 10 L = n × 0.0821 L·atm/(mol·K) × 298 Kn = 10 L × 1 atm / (0.0821 L·atm/(mol·K) × 298 K) ≈ 0.406 mol根据理想气体状态方程,将n和T保持不变,有:2 atm × V = 0.406 mol × 0.0821 L·atm/(mol·K) × 298 KV = 5 L4. 解答题请结合热力学第一定律回答以下问题:在一个封闭容器中,有一定质量的理想气体,初始温度为300 K。
第一章化学热力学习题参考答案
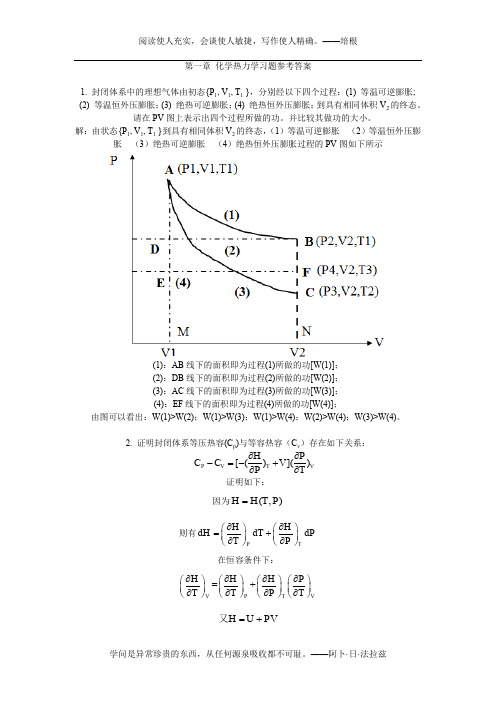
第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀;(2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)];(2):DB 线下的面积即为过程(2)所做的功[W(2)];(3):AC 线下的面积即为过程(3)所做的功[W(3)];(4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫ ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ =V P V T V H P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P P P T P C V S dT dP T T ∂∆=+-∂⎰⎰ 解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T H CpdT dp p ∂=+∂ dH TdS Vdp =+又()()T T H S T V p p∂∂=+∂∂则 (2) ()()T P S V p T ∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P V dH C dT T V dp T ∂=+-+∂ 积分得:2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S S dS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S V dS dT dP T T ∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S H T T T T∂∂==∂∂ 将(6)式代入(5)式得:[()](7)P P C V dS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C V S dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下: Q 2卡诺循环经如下过程(理想气体)1、等温可逆膨胀22U 0T Q W ∆=+=,2222121ln V T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V W PdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313ln VT V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=-220,,Q Q U W =∆=,214213411Q V V nRT V W PdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则 12144323,V V V V V V V V ==则有即或:根据绝热可逆过程方程PV =常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221ln ln =ln V V nRT nRT V V Q Q W V Q Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
第一章化学热力学基础参考答案

第一章2.计算下行反应的标准反应焓变△r Hθm:解:①2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)△f Hθm(kJ•mol-1) 0 -824.2 -1675.7 0 △r Hθm=△f Hθm(Al2O3,s)+2△f Hθm(Fe,s)-2△f Hθm(Al,s)- △f Hθm(Fe2O3 ,s)= -1675.7 + 2×0 - 2×0 - (-824.2)= - 851.5 (kJ•mol-1)②C2H2 (g) + H2(g) → C2H4(g)△f Hθm(kJ•mol-1) 226.73 0 52.26△r Hθm = △f Hθm(C2H4 ,g) - △f Hθm(C2H2,g) - △f Hθm(H2,g)= 52.26 - 226.73 - 0= -174.47 (kJ•mol-1)3. 由下列化学方程式计算液体过氧化氢在298 K时的△f Hθm(H2O2,l):① H2 (g) + 1/2O2 (g) = H2O (g) △r Hθm = - 214.82 kJ•mol-1② 2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1③ 2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1④ 2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1⑤ H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1解:方法1:根据盖斯定律有:[(方程①-方程②+方程③-方程⑤)×2-方程④]÷2可得以下方程⑥H2(g)+O2(g)=H2O2(l) △r Hθm△r Hθm=[(△r Hθ1-△r Hθ2+△r Hθ3-△r Hθ5) ×2-△r Hθ4] ÷2={[-214.82-(-926.92)+(-1070.6)-51.46] ×2-(-498.34)} ÷2=[(-409.96)×2+498.34] ÷2=(-321.58) ÷2= -160.79(kJ•mol-1)△f Hθm(H2O2 ,l)= △r Hθm= -160.79 kJ•mol-1方法2:(1)由①可知H2O的△f Hθm(H2O,g)= - 214.82 kJ•mol-1(2)根据④计算O的△f Hθm(O,g)2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1△r Hθm = △f Hθm(O2 ,g)- 2△f Hθm(O,g)= 0 - 2△f Hθm(O,g)= - 498.34 kJ•mol-1△f Hθm(O,g)= 249.17 kJ•mol-1(3) 根据②求算△f Hθm(H,g)2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1△f Hθm(kJ•mol-1) 249.17 - 214.82△r Hθm = △f Hθm(H2O,g) - 2△f Hθm(H,g) -△f Hθm(O,g)= - 214.82 - 2△f Hθm(H,g)- 249.17= - 926.92△f Hθm(H,g)= 231.465 kJ•mol-1(4) 根据③求算△f Hθm(H2O2 ,g)2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1△f Hθm(kJ•mol-1) 231.465 249.17△r Hθm = △f Hθm(H2O2 ,g) - 2△f Hθm(H,g) -2△f Hθm(O,g)=△f Hθm(H2O2 ,g) -2×231.465 - 2×249.17= - 1070.6△f Hθm(H2O2 ,g)= - 109.33 kJ•mol-1(5) 根据⑤求算△f Hθm(H2O2 ,l)H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1△f Hθm(kJ•mol-1) -109.33△r Hθm = △f Hθm(H2O2 ,g) - △f Hθm(H2O2 ,l)= -109.33 - △f Hθm(H2O2 ,l)= 51.46△f Hθm(H2O2 ,l)= -160.79 kJ•mol-14. 在373 K,101.3 kPa下,2.0 mol H2和1.0 mol O2反应,生成2.0 mol的水蒸气,总共放热484 kJ的热量,求该反应的△r H m和△U。
高中热力学考试题及答案

高中热力学考试题及答案一、选择题(每题3分,共30分)1. 热力学第一定律表明能量守恒,下列哪项描述是错误的?A. 能量既不能被创造,也不能被消灭B. 能量可以从一种形式转化为另一种形式C. 能量可以在一个封闭系统中自由流动D. 能量转化和转移过程中总量保持不变答案:C2. 以下哪种物质的状态变化过程不涉及相变?A. 水的沸腾B. 冰的融化C. 气体的压缩D. 液体的蒸发答案:C3. 理想气体状态方程为PV=nRT,其中R是?A. 气体常数B. 普朗克常数C. 相对原子质量D. 阿伏伽德罗常数答案:A4. 根据热力学第二定律,下列哪项描述是正确的?A. 热量可以从低温物体自发地流向高温物体B. 热量不能从低温物体自发地流向高温物体C. 所有自发过程都是熵增过程D. 所有自发过程都是熵减过程答案:C5. 熵是一个状态函数,其物理意义是?A. 系统混乱度的度量B. 系统能量的度量C. 系统压力的度量D. 系统体积的度量答案:A6. 以下哪种情况下,系统的熵会增加?A. 冰块融化成水B. 气体压缩成液体C. 气体膨胀D. 液体蒸发答案:A7. 热力学第三定律表明,当温度趋近于绝对零度时,完美晶体的熵值趋近于?A. 0B. 1C. 负无穷D. 正无穷答案:A8. 以下哪种过程是可逆过程?A. 气体迅速膨胀B. 气体缓慢膨胀C. 液体沸腾D. 固体融化答案:B9. 以下哪种情况下,系统的吉布斯自由能(G)会减少?A. 系统在恒温恒压下自发进行的过程B. 系统在恒温恒压下非自发进行的过程C. 系统在恒温恒容下自发进行的过程D. 系统在恒温恒容下非自发进行的过程答案:A10. 以下哪种物质的比热容最大?A. 气体B. 液体C. 固体D. 等离子体答案:D二、填空题(每题2分,共20分)11. 热力学第一定律的数学表达式是:△U = Q + _______。
答案:W12. 理想气体的内能仅与温度有关,与体积和压力无关,这是因为理想气体分子间没有_______。
工科化学(化学反应速率)单元测试与答案

一、单选题1、升高同样温度,一般化学反应速率增大倍数较多的是:()A.Ea较大的反应B.放热反应C.吸热反应D.Ea较小的反应正确答案:A2、下列描述中正确的是 ( )A.化学动力学研究反应的快慢和限度;B.某反应的速率系数的单位是mol·L-1·s-1,该反应是一级反应;C.反应速率系数是温度的函数,也是浓度的函数。
D.活化能大的反应受温度的影响大;正确答案:D3、提高温度可增加反应速度的原因是:()A.增加了活化分子的百分数B.增加了反应的活化能C.降低了反应的活化能D.使活化配合物的分解速度增加正确答案:A4、某反应的速率方程式是r=k[c(A)]x[c(B)]y,当c(A)减少50%时,r降低至原来的1/4,当c(B)增加到2倍时,r增加到1.41倍,则x、y分别为()A.2,0.5;B.0.5,1;C. 2,2D.2,0.7;正确答案:A5、 A的分解属于一级气相反应,A的起始量分解一半需8.8min,如果A的起始压力是53.33kPa,当A的分压降到6.66kPa时,所需时间是:()A.35.2minB. 1.1minC.26.4minD.17.6min正确答案:C6、下列叙述中,正确的是:()。
A.反应级数愈大,反应速率愈大;B.反应速率系数的大小即为反应速率的大小;C.反应级数与反应分子数是同义词;D.从反应速率系数的量纲可以推测该反应的总反应级数。
正确答案:D7、催化剂的作用是通过改变反应进行的历程来加快反应速率,这一作用主要是由于.()。
A.增大碰撞频率。
B.降低反应活化能;C.减小速率系数值;D.增大平衡常数;正确答案:B8、下列关于催化剂的叙述中,错误的是()。
A.催化剂可改变某一反应的正向与逆向的反应速率之比。
B.催化剂使正、逆反应速率增大的倍数相同;C.在几个反应中,某催化剂可选择地加快其中某一反应的反应速率;D.催化剂不能改变反应的始态和终态;正确答案:A9、某反应的速率常数k的量纲是(mol·L-1)-1·s-1, 该反应属于()。
第一章 化学热力学基础 习题解答

第一章 化学热力学基础1-1 气体体积功的计算式 dV P W e ⎰-= 中,为什么要用环境的压力e P ?在什么情况下可用体系的压力体P ?答: 在体系发生定压变化过程时,气体体积功的计算式 dV P W e ⎰-= 中,可用体系的压力体P 代替e P 。
1-2 298K 时,5mol 的理想气体,在(1)定温可逆膨胀为原体积的 2 倍; ( 2 )定压下加热到373K ;(3)定容下加热到373K 。
已知 C v,m = 28.28J·mol -1·K -1。
计算三过程的Q 、W 、△U 、△H 和△S 。
解 (1) △U = △H = 0kJ V V nRT W Q 587.82ln 298314.85ln 12=⨯⨯==-= 11282.282ln 314.85ln -⋅=⨯==∆K J V V nR S (2) kJ nC Q H m P P 72.13)298373(,=-==∆kJ nC U m V 61.10)298373(,=-=∆W = △U – Q P = - 3.12 kJ112,07.41298373ln )314.828.28(5ln -⋅=+⨯==∆K J T T nC S m P (3) kJ nC Q U m V V 61.10)298373(,=-==∆kJ nC H m P 72.13)298373(,=-=∆W = 0112,74.31298373ln 28.285ln -⋅=⨯==∆K J T T nC S m V 1-3 容器内有理想气体,n=2mol , P=10P θ,T=300K 。
求 (1) 在空气中膨胀了1dm 3,做功多少? (2) 膨胀到容器内压力为 lP θ,做了多少功?(3)膨胀时外压总W f dl p A dl p dVδ=-⋅=-⋅⋅=-⋅外外外解:(1)此变化过程为恒外压的膨胀过程,且Pa P e 510=J V P W e 1001011035-=⨯⨯-=∆-=- (2)此变化过程为恒外压的膨胀过程,且Pa P e 510=n R T P n R T P n R T P V V P V P W e 109)10()(12-=--=--=∆-=θθ J 6.4489300314.82109-=⨯⨯⨯-= (3) Vn R T P dP P P e =≈-= 1221ln ln 12121P P nRT V V nRT dV V nRT dV P W V V V V e ==-=-=⎰⎰ kJ PP 486.11101ln 300314.82-=⨯⨯⨯=θ1-4 1mol 理想气体在300K 下,1dm 3定温可逆地膨胀至10dm 3,求此过程的 Q 、W 、△U 及△H 。
物理化学热力学单元检测含答案

物理化学热力学单元检测含答案热力学单元检测一、单项选择题(每题2分,共35题,共计70分)(1)1mol单原子分子理想气体,绍代艾态p1=202650pa,t1=273k沿着p/v=常数的途径可逆变化到终态为p2=405300pa则δh为()(a)17.02kj(b)-10.21kj(c)-17.02kj(d)10.21kj(2)半封闭体系中,存有一个状态函数维持恒定的变化途径就是什么途径?()(a)一定就是对称途径(b)一定就是不可逆途径(c)不一定就是对称途径(d)体系没产生变化(3)当体系将热量传递给环境之后,体系的焓:()(a)必定增加(b)必定减少(c)必定维持不变(d)不一定发生改变(4)下列关系式中哪个不需要理想气体的假设?()(a)cp-cv=nr(b)(dlnp)/dt=δh/(rt2)(c)对恒压过程,δh=δu+pδv(d)对边界层可逆过程,pv=常数。
(5)对于孤立体系中发生的实际过程,下列关系中不正确的是()。
a.w=0b.q=0c.δu=0d.δh=0(6)例如图,在边界层盛水容器中,灌入电阻丝,通电一段时间,通电后水及电阻丝的温度均略有升高,今以电阻丝为体系有()。
a.w=0,q<0,δu<0b.w>0,q<0,δu>0c.w<0,q<0,δu>0d.w<0,q=0,δu>0(7)某物质b的标准摩尔燃烧焓为?chm(298.15k)??200kj?mol,则该物质b在298.15k时冷却反应的标准摩尔焓变小?rhm为()。
a.?200kj?molb.0kj?molc.200kj?mol?1?1?1$?1$d.40kj?mol?1(8)在实际气体的节流膨胀过程中,哪一组描述是正确的()。
a.q>0,δh=0,δp<0b.q=0,δh<0,δp>0c.q=0,δh=0,δp<0d.q<0,δh=0,δp<0(9)一对称热机与另一不可逆热机在其他条件都相同时,冷却等量的燃料,则可逆热机拖动的列车运行的速度()。
化学热力学考试试题

化学热力学考试试题一、选择题1. 下列哪个量在物质由液态变成气态时改变?A. 分子振动B. 分子旋转C. 分子间距D. 分子排列方式2. 当一个化学反应进行至平衡时,下列哪个量不会发生变化?A. 反应速率B. 物质浓度C. 反应物质摩尔比D. 平衡常数3. 完全燃烧1 mol甲烷生成CO2和H2O的焓变是-802.3 kJ/mol,那么生成1 mol CO2需要吸收多少热量?A. -400.2 kJB. -401.15 kJC. -802.3 kJD. 802.3 kJ二、填空题1. 标准状态下,1 mol反应物在298 K时的标准摩尔焓变称为______。
答:标准反应焓变2. 爱因斯坦提出的爱因斯坦关系式将______定量地和______联系在一起。
答:能量、物质三、计算题1. 某化学反应的平衡常数Kc为0.05,如果初始反应物摩尔浓度分别为1 mol/L和2 mol/L,则平衡时反应物和生成物的摩尔浓度分别为多少?答:设平衡时反应物A的摩尔浓度为x mol/L,则反应物B和生成物C 的摩尔浓度也为x mol/L。
由平衡常数的定义可得:Kc = [C]^n/[A]^m[B]^n代入已知的值可得:0.05 = x^1/x^1*x^2化简得 0.05 = 1/x解得x ≈ 20 mol/L所以平衡时反应物和生成物的摩尔浓度均为20 mol/L。
2. 给定以下反应的平衡常数Kp为0.05:2CO(g) + O2(g) ⇌ 2CO2(g)已知在某实验温度下CO的分压为0.3 atm,O2的分压为0.4 atm,求CO2的分压。
答:根据平衡常数的定义可得:Kp = P(CO2)^2/[P(CO)]^2[P(O2)]代入已知的值可得:0.05 = [P(CO2)]^2/[0.3]^2[0.4]化简得 [P(CO2)]^2 = (0.05)(0.3)^2(0.4)解得P(CO2) ≈ 0.13 atm所以CO2的分压约为0.13 atm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、单选题
1、下述说法中,正确的是()。
A.单质的焓等于零
B.反应的热效应就是反应的焓变
C.单质的生成焓为零
D.石墨的标准摩尔生成焓等于零
正确答案:D
解析: D、只有稳定单质的标准摩尔生成焓是零,石墨是稳定单质,故其标准摩尔生成焓是零。
2、下述说法中,不正确的是()。
A.只有在某种特定条件下,封闭系统的焓才与系统的反应热相等
B.焓的定义是H=U+pV
C.在某种特定条件下,封闭系统热力学能的变化与系统的反应热相等。
D.焓是系统的状态函数
正确答案:A
解析: A、只有在某种特定条件下,封闭系统的焓变与反应热相等,焓与反应热相等是错误的。
3、298K时2mol氮气与1mol氧气反应生成2mol一氧化二氮气体,该反应的定容反应热为166.5 kJ/mol,则该反应的定压反应热为()。
A.164 kJ/mol
B.328 kJ/mol
C.146 kJ/mol
D.82 kJ/mol
正确答案:A
4、反应2C6H6(l)+15O2(g)=12CO2(g)+6H2O(l),当反应进度是1mol时,下述说法正确的是()。
A.消耗掉的反应物是1mol
B.生成物是1mol
C.消耗了2 mol 苯和15 mol 氧气,生成了12 mol 二氧化碳气体和
6 mol 水蒸气
D.以上说法都是错误的
正确答案:C
5、在常温下,下列反应中焓变等于AgBr(s)的∆f H mθ的是( )。
A.Ag+(aq)+Br−(aq)=AgBr(s)
B. 2Ag(s)+Br2(l)=2AgBr(s)
Br2(l)=AgBr(s)
C. Ag(s)+1
2
Br2(g)=AgBr(s)
D. Ag(s)+1
2
正确答案:C
6、下列关于熵的叙述中正确的是()。
A.熵是系统混乱度的量度,在0℃时,任何完美晶体的绝对熵为零
B.在一定条件下,对某反应来说,随着反应物增加,则反应的∆r S mθ增大
C.熵是系统混乱度的量度,一定量的某物质的熵随着温度升高而增大
D.对一个化学反应来说,如果系统的熵增加,则该反应一定能自发进行
正确答案:C
7、在一定温度和压力的条件下,判断封闭系统中的化学反应是否到达平衡状态了,应该用以下关系式:()。
A. Kθ=0
B.∆r G m=0
C.∆r G mθ=0
D. ∆f G mθ=0
正确答案:B
8、下列说法正确的是()。
A.封闭系统中熵增大的化学反应一定可以自发进行。
B.封闭系统中吉布斯函数减小的化学反应一定能自发进行。
C.封闭系统中,定温定压条件下,化学反应的∆r G mθ<0,该反应能自发进行。
D.以上说法都是错误的。
正确答案:D
9、在1000K,100kPa条件下,气相反应2NO(g)+F2(g)=2NOF(g)达到平衡,下述说法正确的是()。
A.各物质的分压不随时间而变化
B.该反应如果是放热反应,则升高温度化学平衡向正反应方向移动
C.为了提高NO的转化率,可以在反应体系中加入惰性气体
D. ∆r G mθ=0
正确答案:A
10、五氯化磷的分解反应,在200℃达到平衡时,五氯化磷有48.5%分解,在300 ℃达到平衡时,有97%分解,则该分解反应()。
A.为吸热反应
B.为放热反应
C.无法判断是吸热反应还是放热反应
D.在两个温度下的平衡常数相等
正确答案:A
二、判断题
1、功和热是系统与环境间能量传递的两种形式。
正确答案:√
2、环境对系统做功,系统的热力学能一定增加。
正确答案:×
解析:根据热力学第一定律,热力学能与系统的热和功有关,环境对系统做功,热力学能不一定增加,还要考虑系统是吸热还是放热。
3、所有气体单质的标准摩尔生成焓都为零。
正确答案:×
解析:只有稳定单质的标准摩尔生成焓为零。
14、在298K,标准状态下,稳定的纯态单质的标准摩尔熵不为零。
正确答案:√
15、某一系统中,反应能自发进行,其熵值一定是增加。
正确答案:×
16、在一定温度和压力的条件下,封闭系统中的化学反应达平衡状态,此时反应商和标准平衡常数一定相等。
正确答案:√
17、凡是放热反应均能自发进行。
正确答案:×
解析:反应能否自发进行不仅与热效应有关,还与熵变有关,所以该说法错误。
8、平衡常数与温度有关,温度升高,平衡常数一定增大。
正确答案:×
解析:平衡常数与温度的关系还要受化学反应热效应的影响减小。
一个反应如果是吸热反应,温度升高,平衡向吸热反应方向移动,平衡常数增大;一个反应如果是放热反应,温度升高,平衡向吸热反应方向移动,平衡常数减小。
9、一个化学反应达到平衡时正、逆反应的速率都为零。
正确答案:×
解析:一个化学反应达到平衡时正、逆反应的速率相等,但并不为零。
10、某一化学反应,其反应物的转化率越大,则该反应的平衡常数也越大。
正确答案:×
解析:平衡常数只与温度有关。
