蛋白质翻译后修饰1课件
蛋白质泛素化修饰的技术路线PPT课件

针对感染性疾病的治疗,一些研究关注利用泛素化系统来抑制病毒或细菌的复制。通过 调节泛素化修饰相关信号通路,可以抑制感染进程并改善疾病预后。
04
泛素化修饰的干预手段
药物干预
01
02
03
靶向药物
针对特定蛋白质的泛素化 修饰,开发靶向药物,以 调节蛋白质的稳定性、定 位或功能。
开发泛素化修饰相关药物
基于对泛素化修饰机制的理解,开发能够调节泛素化修饰的药物,用于治疗相关疾病。
THANK YOU
抑制酶活性
通过抑制泛素化修饰相关 酶的活性,调控蛋白质的 泛素化水平,进而影响其 生物学功能。
激活酶活性
激活泛素化修饰相关酶的 活性,增加特定蛋白质的 泛素化修饰,以调节其生 物学行为。
基因治疗
基因敲除
通过基因敲除技术,消除 与泛素化修饰相关的基因, 从而调控蛋白质的泛素化 状态。
基因过表达
过表达与泛素化修饰相关 的基因,增加特定蛋白质 的泛素化修饰,以调节其 生物学功能。
泛素化修饰在神经退行性疾病中的作用
泛素化修饰可以调控神经元的生长、突起和凋亡等过程。在神经退行性疾病中,异常的泛 素化修饰可能导致神经元功能障碍和死亡。
神经退行性疾病治疗中的泛素化修饰研究
针对神经退行性疾病的治疗,一些研究关注调节泛素化修饰相关信号通路。通过抑制某些 泛素化酶的活性或调节相关信号通路,可以延缓神经元死亡和疾病进展。
蛋白质泛素化修饰的技术路线ppt 课件
目录
• 泛素化修饰概述 • 泛素化修饰的检测技术 • 泛素化修饰相关疾病研究 • 泛素化修饰的干预手段 • 展望与未来研究方向
01
泛素化修饰概述
泛素化修饰的定义
蛋白质翻译后修饰

细胞应激反应
在应激条件下,如氧化应激和DNA损伤, 蛋白质翻译后修饰可以调控应激反应相关蛋 白的活性和功能,从而影响细胞的生存和凋
亡。
THANK YOU
泛素化作用
泛素化可以影响靶蛋白的稳定性、定位、活性以及与其他蛋白质的相互作用,从 而调控细胞内的多种生物学过程,如细胞周期、信号转导和自噬等。
泛素化可以标记受损或不需要的蛋白质,引导其被蛋白酶体降解,从而维持细胞 内蛋白质的平衡。
泛素化调控
泛素化过程受到严格的调控,涉及多种酶的协同作用。这些酶包括E1(泛素活化酶)、 E2(泛素结合酶)和E3(泛素连接酶)。
E3酶在泛素化过程中起着关键作用,它能够识别并结合特定的靶蛋白,将泛素分子准 确地连接到靶蛋白上。
此外,去泛素化酶能够逆转泛素化过程,去除已经结合在靶蛋白上的泛素分子,从而对 泛素化进行动态调控。
05
其他翻译后修饰
乙酰化
总结词
乙酰化是一种常见的蛋白质翻译后修饰,通过将乙酰基团连接到蛋白质的特定氨基酸残基上,可以调节蛋白质的 活性和功能。
翻译后修饰可以影响蛋白质的稳定性 ,通过增加或减少蛋白质的降解速率 ,从而影响细胞内蛋白质的水平和功 能。
蛋白质降解
某些翻译后修饰,如泛素化,可以标 记蛋白质进行降解,通过蛋白酶体途 径降解蛋白质,维持细胞内蛋白质的 动态平衡。
蛋白质功能调控
酶活性调节
亚细胞定位
许多蛋白质在翻译后被修饰以改变其酶活性, 例如,磷酸化可以激活或抑制酶的活性,从 而调控代谢过程和信号转导。
03
疾病与磷酸化
许多人类疾病与蛋白质磷酸化的异常有关。例如,一些癌症和神经退行
性疾病的发生与特定蛋白质的异常磷酸化有关。因此,对蛋白质磷酸化
蛋白质翻译及翻译后修饰课件.ppt

1.3 核糖体(ribosome)与核糖体rRNA
核糖体是rRNA 与几十种蛋白质的复合体,有大、小两个亚基构成。含有 合成蛋白质多肽链所必需的酶、起始因子(IF)、延伸因子(EF)、释放 因子(RF)等。
原核的核糖体(70S)= 30S小亚基 + 50S大亚基 30S小亚基: 16S rRNA + 21种蛋白质 50S大亚基: 23S,5SrRNA + 34种蛋白质
蛋白质翻译及翻译后修饰课件
tRNA的结构—“四环一臂”
倒L形的三级结构
蛋白质翻译及翻译后修饰课件
tRNA的功能是解读mRNA上的密码子和搬运氨基酸。 tRNA上至少有4 个位点与多肽链合成有关:即3’CCA氨基酸接受位
点、氨基酰-tRNA合成酶识别位点、核糖体识别位点和反密码子位点。 每一个氨基酸有其相应的tRNA携带, 氨基酸的羧基与tRNA的 3’
反应如下:
A A t R N A A T P 氨 酰 基 - t R N A 合 成 酶 A A - t R N A A M P P P i
氨基酸的羧基与tRNA 的3’端CCA-OH 以酯键相连,因此其氨基是自 由的。
蛋白质翻译及翻译后修饰课件
tRNAfmet fMet-tRNA合成酶
蛋白质翻译及翻译后修饰课件
分泌型蛋白质在翻译过程中通过信号肽协助转入内质网的机制
信号肽(signal peptide)是在新生的多肽链中,可被细胞识别系统识别的 特征性氨基酸序列,在蛋白质翻译过程中或翻译后的定位发挥引导的作用。
蛋白质翻译及翻译后修饰课件
本章结束
蛋白质翻译及翻译后修饰课件
氨酰基tRNA进入A位
新的氨基酸-tRNA的进位依赖Tu-Ts因子和GTP的协助
翻译后修饰 ppt课件

以和那一种糖基转移酶结合,发生特定的 糖基化修饰。
ppt课件
15
ppt课件
16
甲基化
蛋白质的甲基化( methylation)修饰是 在甲基转移酶催化下,在赖氨酸或精氨酸 侧链氨基上进行的甲基化.另外也有对天 冬氨酸或谷氨酸侧链羧基进行甲基化形成 甲酯的形式,这里主要关注前一种甲基化 形式
核小体发生作用,导致核小体构象紧凑及 染色质高度折叠。乙酰化使组蛋白与DNA
间的作用减弱,导致染色质构象松散,这
种构象有利于转录调节因子的接近,从而 可以和转录因子结合,促进基因的转录; 去 乙酰化则抑制基因转录。
ppt课件
21
不同翻译后修饰过程的互相协 调与影响
在体内,各种翻译后修饰过程不是孤立 存在的.在很多细胞活动中,需要各种翻 译后修饰的蛋白共同作用
对于同一个蛋白可以拥有一种以上的后 修饰过程.各种翻译后修饰形式相互影响、 相互协调
ppt课件
22
谢谢观赏
ppt课件
23
ppt课件
14
糖基化修饰的过程
• N-连接的糖链合成起始于内质网,完成于高 尔基体。在内质网形成的糖蛋白具有相似 的糖链,由Cis面进入高尔基体后,在各膜 囊之间的转运过程中,发生了一系列有序
的加工和修饰,原来糖链中的大部分甘露
糖被切除,但又被多种糖基转移酶依次加
上了不同类型的糖分子,形成了结构各异
ppt课件
17
组蛋白上的甲基化修饰
组蛋白上的甲基化修饰有赖氨酸的甲基化 和精氨酸的甲基化两种,它们同转录调节和异 染色体的形成有关。
组蛋白乙酰化水平增加与转录活性增强有 关,而组蛋白甲基化修饰的结果则相对复杂, 它可以是转录增强或转录抑制
蛋白质翻译后修饰【病理生理学教研室】 ppt课件

Southern Medical University
泛素化
泛素化是指泛素(一类低分子量的蛋白 质)分子在一系列特殊的酶作用下,将细胞 内的蛋白质分类,从中选出靶蛋白分子,并 对靶蛋白进行特异性修饰(主要是降解)的 过程。
Southern Medical University
Thanks for your attention
Southern Medical University
(二)蛋白激酶的种类
真核细胞的蛋白激酶可分为五类:
丝氨酸/苏氨酸蛋白激酶,磷酸基团的受体是丝氨酸 /苏氨酸羟基; 酪氨酸蛋白激酶,磷酸基团的受体是酪氨酸的酚羟 基;
组/赖/精氨酸蛋白激酶,磷酸基团的受体是咪唑环 、胍基、氨基; 半胱氨酸蛋白激酶,磷酸基团的受体是巯基;
MEK5
MKK
ERK1/2
JNKs
p38s
ERK5
MAPK
生长
凋亡
炎症反应
?
细胞反应
Southern Medical University
MAPK的作用底物:
转录因子: ATF2、c-Jun、Chop10、 MEF2C、ELK1
胞内蛋白激酶:MAPKAPK2/3、MNK1/2、 PRAK、MSK1/2
骨架相关蛋白:MAPs、Tau、sHSP
离子通道蛋白:Na+通道蛋白
Southern Medical University
MAPK介导的细胞反应
Stress response
Inflammation
Apoptosis
Development Proliferation
MAP kinases Differentiation
Southern Medical University
蛋白质翻译后修饰1(课堂PPT)
第二节 真核生物的翻译后加工
➢ 许多真核生物的新生肽都要经过翻译后加工或修饰,这种加工 修饰可以发生在延伸着的肽链中和翻译后。
➢ 一般情况下,翻译后修饰一是为了功能上的需要,另一种情况 是折叠成天然构象的需要。
1.切除加工 2.糖基化 3.羟基化 4.磷酸化 5.脂酰化 6.甲基化 7.乙酰化 8.泛素化 9.二硫键形成
➢ 近年来,已经发现由蛋白激酶和蛋白磷酸化酶催化的蛋 白质磷酸化/去磷酸化在原核生物中十分普遍。磷酸化/ 去磷酸化的意义还不太清楚。目前只知在细菌趋化性和 氮代谢调空中有瞬间的磷酸化作用。
5.乙酰化 乙酰化修饰首先是在真核生物中发现的,发生乙酰化的 位点是结合在DNA 上组蛋白的赖氨酸残基着-NH2,对基 因转录起到重要的调节作用。随着研究的深入,近些年 在原核生物中也发现了蛋白质乙酰化修饰。 DNA结合蛋白的乙酰化修饰 乙酰辅酶A合成酶(ACS)的乙酰化修饰 核糖体蛋白的乙酰化修饰
曾经一度认为糖基化只存在于真核细胞中,但研究表明, 原核生物中也存在蛋白质的糖基化修饰,而且由于在糖 基的单糖结构和组成上的不同而显得比真核生物中的更 加丰富多样。
3.甲基化 ➢ 蛋白质的甲基化是指在甲基转移酶催化下,甲基基团由S- 腺
苷基甲硫氨酸转移至相应蛋白质的过程,既可以形成可逆的 甲基化修饰,如羧基端的甲基化修饰;也可以形成不可逆的 甲基化修饰,如氨基端的甲基化修饰。在原核生物中也普遍 存在蛋白质的甲基化。
➢ 蛋白质翻译后修饰几乎参与了细胞所有的正常生命活动过程, 并发挥十分重要的调控作用,目前已经成为国际上蛋白质研 究的一个极其重要的领域。
第三章 蛋白质翻译后修饰
第一节 原核生物的翻译后修饰 第二节 真核生物的翻译后修饰
第一节 原核生物的翻译后加工
蛋白质翻译后修饰——末端修饰(氨基末端、羧基末端)——加密版

蛋白质翻译后修饰——末端修饰(氨基末端、羧基末端)(~~by luckyboy)(微生物班、精简打印、元旦巨献版)在核糖体上翻译的时候,当氨基酸添加到新生多肽之后,在体内氨基酸残基会发生各种各样的共价修饰。
I、氨基端的修饰初生蛋白的第一个氨基酸的命运:在细菌中:在细菌中生物合成蛋白质的第一步一般是甲酰甲硫氨酰-tRNAfmet和第二个氨酰tRNA通过肽键合成,因此初生蛋白质存在一个甲酰甲硫氨酰位点。
在真核生物中:虽然N末端甲硫氨酰位点从第一个甲硫氨酸获取在成熟蛋白质中很常见,N末端的α-甲基一般很快会被移除,接着在大多数情况下甲硫氨酸残基会被断裂下来。
这个作用是依靠甲硫氨酸氨基肽酶的作用,并且这个裂解过程由第二个残基控制。
(1)在酵母中(啤酒酵母):如果倒数第二个氨基酸残基有一个0.129nm或更小的回转半径的时候,甲硫氨酸会被完完全全的裂解掉(这些氨基酸有:Gly, Ala, Ser, Cys, Thr, Pro, Val)(3)在真菌或哺乳动物的线粒体中:起始甲硫氨酸的不被去除,但在植物的线粒体中还是会发生的。
在工程菌中:在大肠杆菌中过量表达的蛋白质通过质粒技术会导致一种甲硫氨酸残基保留的不正常现象。
一、乙酰化1.N端a-乙酰基修饰(a-acetyl)在蛋白质中是很普遍的在Ehrlich ascite 细胞中:大概有80%的可溶蛋白是N端a-乙酰基修饰的。
在高等真核生物中:有证据表明在这些细胞中氨基酸末端乙酰化是非常普遍的,几乎可以作为高等真核生物蛋白质的一个典型标志。
在低等真核生物中:N端a-乙酰基的比例比较低,但还是存在的2. N端a-乙酰基化修饰通常是翻译中同时发生的,一般发生在新生肽链大约40个残基长的时候3.N端残基乙酰化修饰的频率(概率)是不同的:一般Ala,Ser > Met,Gly, Asp > Asn,lle,Thr,Val > 其他氨基酸残基(1)在高等真核生物中的蛋白质比细菌或真菌中的蛋白质更可能发生乙酰基修饰(2)在大肠杆菌中表达的真核细胞蛋白部分发生乙酰化。
2.蛋白质翻译后修饰-----末端修饰

蛋白质翻译后修饰——末端修饰(氨基末端、羧基末端)2010 遗传学在核糖体上翻译的时候,当氨基酸添加到新生多肽之后,在体内氨基酸残基会发生各种各样的共价修饰。
I、氨基端的修饰初生蛋白的第一个氨基酸的命运:在细菌中:在细菌中生物合成蛋白质的第一步一般是甲酰甲硫氨酰-tRNAf met和第二个氨酰tRNA通过肽键合成,因此初生蛋白质存在一个甲酰甲硫氨酰位点。
在真核生物中:虽然N末端甲硫氨酰位点从第一个甲硫氨酸获取在成熟蛋白质中很常见,N末端的α-甲基一般很快会被移除,接着在大多数情况下甲硫氨酸残基会被断裂下来。
这个作用是依靠甲硫氨酸氨基肽酶的作用,并且这个裂解过程由第二个残基控制。
1)在酵母中(啤酒酵母):如果倒数第二个氨基酸残基有一个0.129nm或更小的回转半径的时候,甲硫氨酸会被完完全全的裂解掉(这些氨基酸有:Gly, Ala, Ser, Cys, Thr, Pro, Val)2)在真菌或哺乳动物的线粒体中:起始的甲硫氨酸不被去除,但在植物的线粒体中还是会发生的。
在工程菌中:在大肠杆菌中过量表达的蛋白质通过质粒技术会导致一种甲硫氨酸残基保留的不正常现象。
一、乙酰化1.N端α-乙酰基修饰(α-acetyl)在蛋白质中是很普遍的在Ehrlich ascite 细胞中:大概有80%的可溶蛋白是N端α-乙酰基修饰的。
在高等真核生物中:有证据表明在这些细胞中氨基酸末端乙酰化是非常普遍的,几乎可以作为高等真核生物蛋白质的一个典型标志。
在低等真核生物中:N端α-乙酰基的比例比较低,但还是存在的2.N端α-乙酰基化修饰通常是翻译中同时发生的,一般发生在新生肽链大约20-50个残基长的时候3.N端残基乙酰化修饰的频率(概率)是不同的:一般Ala,Ser > Met,Gly, Asp > Asn,lle,Thr,Val > 其他氨基酸残基(1)在高等真核生物中的蛋白质比细菌或真菌中的蛋白质更可能发生乙酰基修饰(2)在大肠杆菌中表达的真核细胞蛋白部分发生乙酰化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.切除加工
? 典型的情况包括切除 N-端甲硫氨酸、信号肽序列 和切除部分肽段将无活性的前体转变成活性形式。
? 一些酶的前体(称为前体酶 proenzyme,或酶原 zymegen)或无活性的多肽前体(称为前体蛋白, proprotein)只有切除特定的肽段后才能从无活 性形式转变成活性形式。下图是胰岛素的翻译后 加工。
6
4.磷酸化 ? 蛋白质的磷酸化是指通过酶促反应将磷酸基团转移到目
的蛋白特定的氨基酸残基上的过程,是可逆的。这是生 物体内存在的一种普遍的调节方式,在细胞信号的传递 过程中占有极其重要的地位。 ? 近年来,已经发现由蛋白激酶和蛋白磷酸化酶催化的蛋 白质磷酸化/去磷酸化在原核生物中十分普遍。磷酸化/ 去磷酸化的意义还不太清楚。目前只知在细菌趋化性和 氮代谢调空中有瞬间的磷酸化作用。
8
6.类泛素化 ? 2008 年之前在原核生物中只发现了蛋白酶体,却从未发
现泛素或类泛素的蛋白质的修饰,因此一度认为蛋白酶 体对原核生物蛋白质的降解完全依赖于蛋白质自身的组 成和结构。 ? 2008年,Pearce等在结核分枝杆菌中发现了与泛素功能相 似 的 蛋 白 质 , 命 名 为 原 核 类 泛 素 蛋 白 (prokaryotic ubiquitin-like protein,Pup)。Pup可以在辅助因子的 作用下标记多种功能蛋白 ,并介导被标记蛋白质通过蛋白 酶体降解。 Pup-蛋白酶体通路的发现揭示了原核生物中 一个崭新的蛋白质降解机制。
13
蛋白质内含子 90年代初,发现了两类新的内含子。 一类是蛋白质内含子,其 DNA序列与外显子一起转录和 翻译,产生一条多肽链,然后从肽链中切除与内含子对 应的氨基酸序列,再把与外显子对应的氨基酸序列连接 起来,成为有功能的蛋白质。 另一类是翻译内含子, mRNA中存在与内含子对应的核苷 酸序列,在翻译过程中这一序列被“跳跃”过去,因此 产生的多肽链不含有内含子对应的氨基酸序列。
5
3.甲基化 ? 蛋白质的甲基化是指在甲基转移酶催化下,甲基基团由 S- 腺
苷基甲硫氨酸转移至相应蛋白质的过程,既可以形成可逆的 甲基化修饰,如羧基端的甲基化修饰;也可以形成不可逆的 甲基化修饰,如氨基端的甲基化修饰。在原核生物中也普遍 存在蛋白质的甲基化。 ? 在大肠杆菌和有关细菌中发现的一种甲基转移酶能甲基化膜 结合的化学受体蛋白的谷氨酸残基。这种甲基转移酶和另外 一种甲基酯酶催化的甲基化 /去甲基化过程在细菌趋化性的信 号转导中起重要作用。
? 蛋白质翻译后修饰几乎参与了细胞所有的正常生命活动过程, 并发挥十分重要的调控作用,目前已经成为国际上蛋白质研 究的一个极其重要的领域。
2
第三章 蛋白质翻译后修饰
第一节 原核生物的翻译后修饰 第二节 真核生物的翻译后修饰
3
第一节 原核生物的翻译后加工
一些新生肽链从核糖体上释放下来后可以直接折叠成 最终的三维结构。但多数情况下是新生肽要经过一系列的 加工修饰,才具有功能。
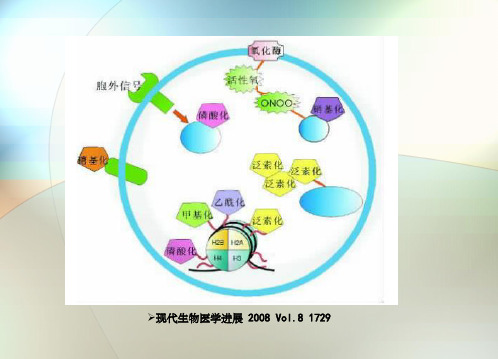
?现代生物医学进展 2008 Vol.8 1729
1
? 很长时间里,蛋白质翻译后修饰并未引起足够重视,直到 2004 年泛素介导蛋白质降解的发现获得诺贝尔奖之后,这一 情形才有明显改观。迄今,人们已发现多达 200 多种的蛋白 质修饰。蛋白质翻译后修饰是调节蛋白质生物学功能的关键 步骤之一,是蛋白质动态反应和相互作用的一个重要分子基 础,同时,它也是细胞信号网络调控的重要靶点。
1.切除加工 2.糖基化 3.甲基化 4.磷酸化 5.乙酰化 6.泛素化
4
1.切除加工 ? 包括去掉N端的甲酰甲硫氨酸和信号肽序列。 ? 信 号 肽 ( Signal peptide ) , 也 叫 引 导 肽 ( leader
peptide),是决定多肽最终去向的一段序列,通常较短, 典型情况下位于 N端。在细菌中的一个例子就是多肽要插 入细胞质膜必须借助信号肽序列。 2.糖基化 曾经一度认为糖基化只存在于真核细胞中,但研究表明, 原核生物中也存在蛋白质的糖基化修饰,而且由于在糖 基的单糖结构和组成上的不同而显得比真核生物中的更 加丰富多样。
14
15
2.糖基化
? 真核生物中糖基化修饰很普遍。 ? 通常情况下,分泌蛋白的寡糖链较复杂,而内质网膜蛋白含有
较高的甘露糖。 下图是细胞中涉及糖基化的蛋白
16
3.羟基化
在结缔组织的胶原蛋白和弹性蛋白中pro和lys是经过羟基化的。 此外,在乙酰胆碱酯酶(降解神经递质乙酰胆碱)和补体系统(参 与免疫反应的一系列血清蛋白)都发现有4-羟辅氨酸。 位于粗糙内质网( RER)上的三种氧化酶(脯氨酰 -4-羟化酶, prolyl-4-hydroxylase , 脯 氨 酰 -3- 羟 化 酶 和 赖 氨 酰 羟 化 酶 , lysylhydroxylase)负责特定pro和lys残基的羟化。 脯氨酰-4-羟化酶只羟化 -Gly-x-pro-,脯氨酰 -3-羟化酶羟化 Glypro-4-Hyp (Hyp: hydroxyproline),赖氨酸羟化酶只作用于 Gly-X-lys-。 胶原蛋白的脯氨酸残基和赖氨酸残基羟化需要Vc,饮食中Vc不足时 就易患坏血症(血管脆弱,伤口难愈),原因cture)。
11
包含信号肽的胰岛素前体称 为 前 胰 岛 素 原 ( preproinsulin)。
去掉信号肽的胰岛素的前体 称为胰岛素原(proinsulin)。
进一步切除称为 C链的肽段后 才能形成活性形式的胰岛素 (insulin)
12
? 蜂毒素能溶解动物细胞,也能溶解蜜蜂自身 的细胞,在细胞内合成没有活性的前毒素, 分泌进入刺吸器后,N端的22个氨基酸残基被 蛋白酶水解生成毒素。
9
第二节 真核生物的翻译后加工
? 许多真核生物的新生肽都要经过翻译后加工或修饰,这种加工 修饰可以发生在延伸着的肽链中和翻译后。
? 一般情况下,翻译后修饰一是为了功能上的需要,另一种情况 是折叠成天然构象的需要。
1.切除加工 2.糖基化 3.羟基化 4.磷酸化 5.脂酰化 6.甲基化 7.乙酰化 8.泛素化 9.二硫键形成
7
5.乙酰化 乙酰化修饰首先是在真核生物中发现的,发生乙酰化的 位点是结合在 DNA 上组蛋白的赖氨酸残基着 -NH2,对基 因转录起到重要的调节作用。随着研究的深入,近些年 在原核生物中也发现了蛋白质乙酰化修饰。 DNA结合蛋白的乙酰化修饰 乙酰辅酶A合成酶(ACS)的乙酰化修饰 核糖体蛋白的乙酰化修饰
