有机合成中间体(2011)
D-1,2,4-丁三醇的绿色合成

D-1,2,4-丁三醇的绿色合成杨萌;董润安【摘要】D-1,2,4-丁三醇(D-1,2,4-butanetriol,BT)是四碳的手性多羟基醇,同时也是极具价值的有机合成中间体,应用十分广泛,特别是在医药和军事工业领域.目前D-1,2,4-丁三醇的工业化生产仍以化学合成法为主,该方法存在反应条件苛刻、产率低、副产物多,易引发环境污染等弊端.目前,利用合成生物学技术,安全高效的生物合成该化学品成为研究的热点.本文评述了D-1,2,4-丁三醇的化学合成和生物合成,以期为D-1,2,4-丁三醇的绿色合成提供理论基础.【期刊名称】《生命科学仪器》【年(卷),期】2016(014)004【总页数】4页(P11-14)【关键词】D-1,2,4-丁三醇;生物合成;绿色合成【作者】杨萌;董润安【作者单位】北京理工大学生命学院,北京100081;北京理工大学生命学院,北京100081【正文语种】中文【中图分类】Q81D-1,2,4-丁三醇是无色无味、透明、粘稠的四碳多元醇[1],其分子式为C4H10O3,结构式如图1所示,由于第二位碳是手性碳原子,具有旋光性,在水和醇类物质中溶解度较高,具有吸湿性。
工业用的D-1,2,4-丁三醇呈草黄色或褐色[2]。
D-1,2,4-丁三醇是重要的有机合成中间体,广泛应用于医药、农业、化妆品、造纸、高分子材料、烟草、军工等领域[3-6]。
D-1,2,4-丁三醇的硝基化合物冲击敏感性低、热稳定性好、低毒性、吸湿性好,与其它含能增塑剂混合使用,可显著提高以硝化纤维素为基火药的低温力学性能[7-9]。
D-1,2,4-丁三醇用作缓释剂,是制备抗病毒化合物等药物的关键中间体[10-12],添加在烟草中,降低了硝基化合物的毒害作用,可用作高分子材料的交联剂,增加材料的强度和硬度,还可用作高级墨水的防干剂、高级服装表面处理剂、陶瓷加工助剂、特殊用途包装与储运等[13,14]。
D-1,2,4-丁三醇能抑制微生物,是抗微生物制剂(如防腐剂)的组成部分[2]。
历年浙江高考化学真题(有机合成与推断)
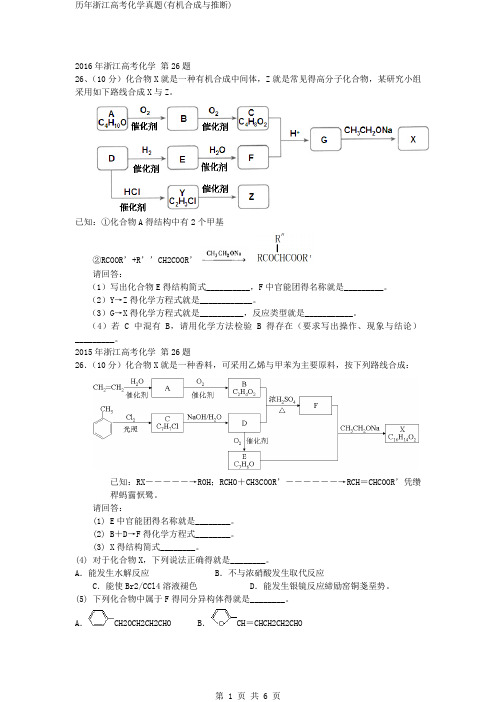
2016年浙江高考化学第26题26、(10分)化合物X就是一种有机合成中间体,Z就是常见得高分子化合物,某研究小组采用如下路线合成X与Z。
已知:①化合物A得结构中有2个甲基②RCOOR’+R’’CH2COOR’请回答:(1)写出化合物E得结构简式__________,F中官能团得名称就是_________。
(2)Y→Z得化学方程式就是____________。
(3)G→X得化学方程式就是__________,反应类型就是___________。
(4)若C中混有B,请用化学方法检验B得存在(要求写出操作、现象与结论)_________。
2015年浙江高考化学第26题26.(10分)化合物X就是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:已知:RX―――――→ROH;RCHO+CH3COOR’――――――→RCH=CHCOOR’凭缵稈蚂靄恹鹭。
请回答:(1) E中官能团得名称就是________。
(2) B+D→F得化学方程式________。
(3) X得结构简式________。
(4) 对于化合物X,下列说法正确得就是________。
A.能发生水解反应B.不与浓硝酸发生取代反应C.能使Br2/CCl4溶液褪色D.能发生银镜反应締励窑铜戔堊势。
(5) 下列化合物中属于F得同分异构体得就是________。
A.CH2OCH2CH2CHO B.CH=CHCH2CH2CHOC.CH2=CHCH=CHCH=CHCH=CHCOOHD.COOCH2CH2CH3氩頜镉攏軸懍剂。
2014年浙江高考化学第29题29.(15分)某兴趣小组以苯与乙烯为主要原料,采用以下路线合成药物普鲁卡因:已知:;。
请回答下列问题:(1)对于普鲁卡因,下列说法正确得就是________。
A.可与浓盐酸形成盐B.不与氢气发生加成反应C.可发生水解反应D.能形成内盐(2)写出化合物B得结构简式____________________。
精细有机合成习题答案

精细有机合成习题答案【篇一:08应化精细有机合成复习题答案】txt>一.单项选择题(8)在下列每小题的四个备选答案中选出一个正确的答案,并将其字母标号填入题干的括号内。
1.如果分子本身包含一个反应活性低的官能团在适当的阶段,通过某种专一性的反应,可转化为反应活性较高的官能团。
这种官能团称为:(b)a.亲电官能团;b.潜官能团;c.亲核官能团;d.极性官能团;2.想象选择一个合适的位置将分子的一个键切断,使分子转变为两个不同的部分。
用双线箭头符号和画一条曲线穿过被切断的键来表示。
这种方法称为:(c)a.极性反转;b.反向分析;c.分子切断;d. 反应选择性;在一系列的转变的某一阶段,引入一个原子或原子团,使后续的反应过程能按设计的要求,有控制地进行,从而保证系列反应能够高效率地完成。
这种引入的原子或原子团称为:(a)a.控制因素;b.潜官能团;;c.极性官能团;d.极性反转;4.在合成设计中使某个原子或原子团的反应特性发生了暂时性的转换称为:(b)a. 关键反应;b.极性转换;c.反应选择性;d.控制因素;5.在复杂化合物的合成中,有些反应转化率很低或正副产物很难分离纯化,反应时间长,这些反应称为:(c)a.反应选择性;b.反应的专一性;c.关键反应;d. .控制因素;6.目标分子—中间体—化工原料的分析过程称为:(b)a.正向合成分析法;b .逆向合成分析法; c.不对称合成分析法;d.关键反应分析法;7.一个反应在底物的不同部位和方向进行,从而形成几种产物时的选择程度称为:(d)a.反应的专一性;b.反应的控制性;c.反应的对称性;d,反应选择性;8.将分子的一个键切断,使分子转变为两个不同的部分,这不同的部分叫:(a)a.合成子;b.合成等价物;c.目标分子;d. 有机中间体;9.绿色化学是指在制造和应用化学品时( a )a.应有效利用(最好可再生)原料,消除废物和避免使用有毒的或危险的试剂和溶剂。
复合催化剂催化合成对羟基苯甲酸正丁酯_冯一佳

第11卷第20期2011年7月1671—1815(2011)20-4917-03科学技术与工程Science Technology and EngineeringVol.11No.20July 2011 2011Sci.Tech.Engng.复合催化剂催化合成对羟基苯甲酸正丁酯冯一佳熊双喜*(台州学院医药化工学院,临海31700)摘要研究了在一水硫酸氢钠复合催化剂存在的条件下,由正丁醇和对羟基苯甲酸高收率合成对羟基苯甲酸正丁酯。
探讨了一水硫酸氢钠复合催化剂用量、正丁醇用量和反应时间,带水剂的选择等因素对催化合成对羟基苯甲酸正丁酯收率的影响。
实验结果表明,当对羟基苯甲酸、正丁醇和硫酸氢钠的摩尔比为1ʒ2ʒ0.072,助催化剂在0.1g 、带水剂5mL 时,回流分水4h ,酯收率达92.0%,为最佳条件。
关键词对羟基苯甲酸正丁酯合成硫酸氢钠复合催化剂催化中图法分类号TQ245.24;文献标志码A2011年4月6日收到第一作者简介:冯一佳(1988—),男,浙江萧山人。
*通信作者简介:熊双喜(1953—),男,副教授,湖南道县人。
研究方向:分离工程。
E-mail :xsxi@tzc.edu.cn 。
对羟基苯甲酸酯又称尼泊金酯,是目前世界上用途最广、用量最大、应用频率最高的防腐剂。
具有高效、低毒、广谱和易配伍等优点,广泛应用于日化、医药、食品、饲料及各种工业防腐等方面,同时是有机合成中间体。
我国对尼泊金酯的开发应用较晚,但也进行了广泛地研究工作[1—5]。
由于硫酸在加热时易引起醚化,氧化,磺化等副反应,同时其腐蚀性强。
在参考了俞善信等人[3]发表的有关一水硫酸氢钠催化合成对羟基苯甲酸丁酯和陈红[7]发表的有关复合酸催化合成乙二醇单硬脂酸酯的文章后[6,7],提出了使用硫酸氢钠复合催化剂催化合成对羟基苯甲酸正丁酯的方法。
实验得到了对羟基苯甲酸正丁酯的最佳反应条件等。
1实验1.1主要试剂正丁醇(浙江杭州双林化工试剂厂华东医药有限公司经销,化学纯);对羟基苯甲酸(中国医药集团上海化学试剂公司,化学纯);一水硫酸氢钠金山化工厂(化学纯);其余试剂均为化学纯。
2011年—2020年十年高考化学真题分类汇编 专题55 有机合成(选修)(含详细解析)

专题55 有机合成(选修)1.(2020年江苏卷)化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如下:(1)A中的含氧官能团名称为硝基、__________和____________。
(2)B的结构简式为______________。
(3)C→D的反应类型为___________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式________。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α-氨基酸,另一产物分子中不同化学环境的氢原子数目比为1:1且含苯环。
(5)写出以CH3CH2CHO和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)________。
【答案】(1)醛基(酚)羟基(2)(3)取代反应(4)(5)【解析】本题从官能团的性质进行分析,利用对比反应前后有机物不同判断反应类型;(1)根据A的结构简式,A中含氧官能团有硝基、酚羟基、醛基;(2)对比A和C的结构简式,可推出A→B:CH3I中的-CH3取代酚羟基上的H,即B的结构简式为;(3)对比C和D的结构简式,Br原子取代-CH2OH中的羟基位置,该反应类型为取代反应;(4)①能与FeCl3溶液发生显色反应,说明含有酚羟基;②能发生水解反应,说明含有酯基或肽键,水解产物之一是α-氨基酸,该有机物中含有“”,另一产物分子中不同化学环境的氢原子数目之比为1:1,且含有苯环,说明是对称结构,综上所述,符合条件的是;(5)生成,根据E生成F,应是与H2O2发生反应得到,按照D→E,应由CH3CH2CH2Br与反应得到,CH3CH2CHO与H2发生加成反应生成CH3CH2CH2OH,CH3CH2CH2OH在PBr3作用下生成CH3CH2CH2Br,合成路线是CH3CH2CHO CH3CH2CH2OH CH3CH2CH2Br。
2.(2020年天津卷)天然产物H具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
1,3,7-三甲基〔8-~3h〕黄嘌呤的制备

1,3,7-三甲基〔8-~3h〕黄嘌呤的制备1、引言三甲基[8-3h]黄嘌呤(1,3,7-trimethylpurine-2,6-dione)是一种重要的有机合成中间体,广泛应用于药物、农药、医药、材料等产业。
研究表明,三甲基[8-3h]黄嘌呤能够抑制菌体生长,同时具有抗癌活性,可被用于肿瘤治疗。
为了方便制备高纯度的三甲基[8-3h]黄嘌呤,人们探索了几种制备技术。
2、原料三甲基[8-3h]黄嘌呤的制备原料主要为三个化学成份,包括:肼,邻甲酰胺和苯甲醛。
肼是重要的胍基源,常用于有机合成中,它是从金属硫化物(如锡、铅、硫酸根)和硫酸膦中制备而来,其分子式为H2N–NH2。
邻甲酰胺是重要的氨基酸激酶抑制剂和氧化酶抑制剂,它的分子式为CH3CO–NH2。
苯甲醛是用于有机合成的重要单醛,分子式为C6H5CHO。
3、实验步骤(1)将肼、邻甲酰胺和苯甲醛混合在一起,加入少量的磷酸,再将混合液加热至沸点,以提高反应活性;(2)加入冰醋酸,当液体温度达到95℃时,即可用紫外分光光度计测定产物1,3,7-trimethylpurine-2,6-dione的浓度;(3)将1,3,7-trimethylpurine-2,6-dione和冰醋酸酯形成溶液,用沸点分离法将三甲基[8-3h]黄嘌呤从溶液中分离出来;(4)将制备得到的三甲基[8-3h]黄嘌呤用干燥剂纯化,提取至高纯度。
4、结论通过上述实验步骤,我们成功地研制出了一种有效的方法,用于制备高纯度的三甲基[8-3h]黄嘌呤。
它以提供可靠的理论基础和实用方法,为生产高纯三甲基[8-3h]黄嘌呤、抗癌药物和其他有机合成中间体提供了可能性。
nhs结构式

nhs结构式
NHS(N-羟基丁二酰亚胺)是一种重要的有机合成中间体,其化学
结构式为O=C(N-CH-CH-OH)。
它是一种白色结晶体,可以溶于水和许多有机溶剂。
NHS在化学反应中被广泛应用。
在肽合成和蛋白质修饰中,NHS
被用作活化剂,它可以在氨基酸残基和其他分子之间形成酰胺键。
这种反应通常被称为NHS活化反应,它在化学合成中具有广泛的应用。
此外,NHS还被用作染料和荧光探针的前体。
由于其能够与氨或羟基反应,因此可以在分析化学中用作检测分子或生物分子的化合物。
从技术上讲,NHS的结构中包含了两个羧基和一个N-羟丙基。
这种结构为其提供了很多独特的化学性质。
例如,NHS可以在pH值为8.5左右的碱性条件下稳定。
这种稳定性使得NHS成为一种受欢迎的活化剂,在生物化学和生物技术领域中被广泛应用。
总的来说,NHS的结构式和化学性质使其在许多领域都具有广泛的应用。
尤其在生物化学和生物技术领域中,NHS的应用已经得到了广泛的认可和应用。
- 1 -。
一锅法kumada偶联反应合成烷基吡啶化合物

2011年第31卷有 机 化 学V ol. 31, 2011* E-mai l : ***************.cnReceived July 3, 2011; revised September 15, 2011; accepted September 30, 2011.·研究简报·一锅法Kumada 偶联反应合成烷基吡啶化合物刘涛平 谢俊杰 李 彬 蔡良珍* 陶晓春*(华东理工大学化学与分子工程学院 上海 200237)摘要 以溴代吡啶为原料, 用简单结构的镍化合物(Py 4NiCl 2)作为催化剂, 经过一锅法Kumada 偶联反应合成一系列甲基、烯丙基或苄基取代的吡啶化合物, 收率在中等以上. 关键词 Kumada 偶联反应; 溴代吡啶; 镍催化; 一锅法Synthesis of Alkylpyridines via One-Pot Kumada ReactionLiu, Taoping Xie, Junjie Li, Bin Cai, Liangzhen * Tao, Xiaochun *(School of Chemistry and Molecular Engineering , East China University of Science and Technology , Shanghai 200237)Abstract A series of methyl-, allyl-, benzyl-substituted pyridines were prepared in moderate yield, usingbromopyridines as starting material and a simple structure nickel complex (Py 4NiCl 2) as catalyst by one-pot Kumada reaction.Keywords Kumada reaction; bromopyridine; nickel-catalyzed; one-pot烷基吡啶类化合物作为重要的有机合成中间体, 广泛应用于医药、农药、香料以及诸多化工领域[1,2]. 传统的合成烷基吡啶的方法有三种, 分别是醛酮催化氨化法、侧链烷基化法与不饱和烃法[3].Chichibabin [4]发现了醛或酮与氨气在硅铝酸盐等催化剂的作用下环化生成烷基吡啶的方法, 英国化学工业公司(ICI)等[5~12]在此基础上进行了改良并相继申请了合成烷基吡啶的专利. 醛酮催化氨化法的缺点是催化剂选择性低, 并且需要较高温度或加压反应, 得到的产物都是烷基吡啶和高沸点化合物的混合物, 且催化剂的寿命很短.侧链烷基化的方法, 通常是用烷基吡啶与金属钠在乙醚中回流使其侧链α位金属化, 然后和卤代烃作用生成侧链增长烷基吡啶产物[13]. 该方法需要无水、无氧以及使用金属钠等条件, 反应条件苛刻.不饱和烃法是乙烯、丙炔等化合物与乙腈、丙烯腈等腈类化合物在Co 与Pd 催化剂存在下加压合成烷基吡啶的方法[14]. 该类方法产物多为各种烷基吡啶的混合物, 选择性低, 烯烃转化率低.过渡金属催化的卤代吡啶与烷基锌试剂[15]、烷基硼试剂[16]、烷基锡试剂[17]和烷基格氏试剂[18]等的偶联反应成为合成烷基吡啶的一个有效的新方法. 其中, 用烷基格氏试剂作为反应底物的偶联反应被称为Kumada 反 应[19].这些偶联反应通常需要较为昂贵的金属催化剂, 而且反应中所用的格氏试剂需要预先制备好后, 才能用于偶联反应中.本文发展了一种以溴代吡啶为原料, 廉价易得的吡啶-镍络合物为催化剂, 经一锅法Kumada 偶联反应合成烷基吡啶的新方法(Eq. 1).2174有机化学V ol. 31, 20111 实验部分1.1 仪器与试剂Brucker WP-400SY (400 MHz)核磁共振仪(CDCl3为溶剂, TMS为内标); 所用硅胶为青岛海洋化工有限公司HF254; 所用反应试剂或溶剂均为市售分析纯或化学纯.1.2 碘甲烷制备格氏试剂的Kumada偶联反应合成2-甲基-3-甲氧基吡啶无水无氧条件下, 25 mL三口烧瓶加入87 mg (3.6 mmol)镁屑和2 mL乙醚, 恒压滴液漏斗中加入426 mg (3.0 mmol)碘甲烷与2 mL乙醚, 先滴入几滴碘甲烷乙醚溶液到烧瓶中引发反应, 然后滴加剩余液, 滴加完毕后, 加热回流2 h, 冷却后备用. 另一个三口烧瓶中加入0.188 mg (1.0 mmol) 2-溴-3-甲氧基吡啶, 25 mg (5 mol%) Py4NiCl2, 再加入2 mL乙醚. 室温下滴入现制的碘甲烷的格氏试剂, 滴加完全后, 回流1 h. 反应完全后, 用饱和NH4Cl溶液淬灭反应, 乙酸乙酯提取, 有机相用无水Na2SO4干燥, 浓缩后硅胶柱层析分离得到80 mg (65%收率)的产品.1.3 2-溴-3-甲氧基吡啶制备格氏试剂的Kumada偶联反应合成2-甲基-3-甲氧基吡啶无水无氧条件下, 25 mL三口烧瓶加入130 mg (5.4 mmol) 镁屑和2 mL 四氢呋喃(THF), 恒压滴液漏斗中加入550 mg (4.5 mmol )异丙基溴与3 mL THF, 先滴入几滴到烧瓶中引发反应, 然后滴加剩余液. 滴加完毕后, 加热回流2 h, 在滴液漏斗中加入570 mg (3.0 mmol) 2-溴-3-甲氧基吡啶与2 mL THF的混合液, 在回流条件下滴加到反应瓶中, 滴完再回流1 h冷却后备用. 另一个三口烧瓶中加入213 mg (1.5 mmol)碘甲烷, 38 mg (5 mol%) Py4NiCl2, 再加入2 mL THF, 室温下滴入现制的2-溴-3-甲氧基吡啶的格氏试剂, 滴加完全后, 回流1 h. 反应完全后, 用饱和NH4Cl溶液淬灭未反应的格氏试剂, 乙酸乙酯提取, 有机相用无水Na2SO4干燥, 浓缩后硅胶柱层析分离得到125 mg产品, 收率为(以碘甲烷加入量计)68%.1.4 2-溴-3-甲氧基吡啶的“一锅法”Kumada偶联反应无水无氧条件下, 25 mL三口烧瓶中加入53 mg (2.2 mmol)镁屑, 2 mL乙醚, 188 mg (1.0 mmol) 2-溴-3-甲氧基吡啶, 一粒碘, 25 mg (5 mol%) Py4NiCl2, 在滴液漏斗中加入2 mL乙醚和2 mmol RX, 室温下先滴入几滴引发反应, 然后再慢慢全部滴完, 继续回流1 h. 饱和NH4Cl溶液淬灭反应, 乙酸乙酯提取, 有机相用无水Na2SO4干燥, 浓缩后硅胶柱层析分离得到产品.2-甲基-3-甲氧基吡啶(1)[20]: 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 2.48 (s, 3H), 3.84 (s, 3H), 7.09~7.16 (m, 2H), 8.08~8.09 (m, 1H).2-烯丙基-3-甲氧基吡啶(2)[21]: 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 3.61 (d, J=6.6 Hz, 2H), 3.84 (s, 3H), 5.09~5.13 (m, 2H), 6.08~6.12 (m, 1H), 7.11~7.12 (m, 2H), 8.13~8.14 (m, 1H).2-苄基-3-甲氧基吡啶(3)[22]: 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 3.81 (s, 3H), 4.18~4.19 (m, 2H), 7.11~7.37 (m, 7H), 8.13~8.14 (m, 1H).2-烯丙基吡啶(4)[23]: 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 3.60 (d, J=6.7 Hz, 2H), 5.07~5.13 (m, 2H), 6.04~6.09 (m, 1H), 7.11~7.26 (m, 2H), 7.59~7.62 (m, 1H), 8.54~8.55 (m, 1H).2-二甲胺基-5-甲基吡啶(5)[24]: 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 2.19 (s, 3H), 3.06 (s, 6H), 6.46~6.48 (m, 1H), 7.27~7.30 (m, 1H), 8.01 (s, 1H).2-甲基-5-二甲胺基吡啶(6)[25]: 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 2.40 (s, 3H), 2.91 (s, 6H), 6.92~6.94 (m, 2H), 7.96 (d, J=2.4 Hz, 1H).2-(2'-甲基烯丙基)吡啶(7)[26]: 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 1.72 (s, 3H), 3.52 (s, 2H), 4.77 (s, 1H), 4.87 (s, 1H), 7.10~7.20 (m, 2H), 7.58~7.63 (m, 1H), 8.54~8.55 (m, 1H).2-(2',2'-二甲基乙烯基)-3-甲氧基吡啶(8): 淡黄色油状液体. 1H NMR (CDCl3, 400 MHz) δ: 1.90 (s, 3H), 1.99 (s, 3H), 3.75 (s, 3H), 6.42 (s, 1H), 6.97~7.04 (m, 2H), 8.09~8.11 (m, 1H); HRMS calcd for C10H14NO (M++H), 164.1075, found 164.1070.2 结果与讨论2.1 Kumada偶联反应合成2-甲基-3-甲氧基吡啶2-甲基-3-甲氧基吡啶是抗球虫药物常山酮合成中的一个中间体[27], 该中间体经典的合成方法是以2-乙酰呋喃与氨水加热并加压反应生成2-甲基-3-羟基吡啶, 然后进行甲基醚化. 这两步反应收率都不高[28], 尤其是第一步氨化扩环反应只有30%~40%收率[29~31].用Kumada反应合成2-甲基-3-甲氧基吡啶, 可以有两种方法. 第一种方法是用3-羟基吡啶通过溴化[32]与醚化[33]可以很方便地得到2-溴-3-甲氧基吡啶. 以此为原料与甲基格氏试剂进行Kumada反应, 得到2-甲基-3-甲氧基吡啶, 收率为65% (Eq. 2). 在此反应中我们所用的催化剂为Py4NiCl2, 很容易合成[34].No. 12刘涛平等:一锅法Kumada 偶联反应合成烷基吡啶化合物2175NBrOCH 3CH 3MgIN CH 3OCH 32+4265%(2)第二种方法是反过来用3-甲氧基-2-吡啶基的格氏试剂, 与碘甲烷在Py 4NiCl 2催化下的Kumada 反应, 也能得到相同的产物, 收率为68%. 但该格氏试剂不能直接制备, 而是通过2-溴-3-甲氧基吡啶与异丙基格氏试剂发生交换反应得到(Scheme 1). 大部分卤代吡啶格氏试剂的制备都是通过这样的方法[35].Scheme 1上述两种方法都得到了目标产物. 但是, 两种方法都要预先用一份卤代烃制备成相应的格氏试剂, 然后在催化剂的作用下与另一份的卤代烃反应.2.2 一锅法Kumada 偶联反应合成烷基吡啶化合物根据卤代吡啶不能直接制备格氏试剂, 而碘甲烷容易制备格氏试剂的性质, 我们设想, 将原料2-溴-3-甲氧基吡啶、镁、催化剂以及溶剂置于反应瓶中, 一边搅拌, 一边滴加碘甲烷, 使其一生成甲基格氏试剂, 在催化剂的存在下立即与2-溴-3-甲氧基吡啶发生偶联反应, 一锅法合成2-甲基-3-甲氧基吡啶. 反应结果见表1.以乙醚为溶剂, 在相同条件下进行上述反应, 我们选择(DPPE)NiCl 2为催化剂与Py 4NiCl 2对照发现, 产物收率相差不大, 分别为65%和63% (表1, Entries 1, 2).氯丙烯与苄氯也能代替碘甲烷进行反应, 得到相应的烯丙基化与苄基化产物, 产率有所降低(表1, Entries 3, 5). 未带取代基的2-溴吡啶以及2-二甲胺基-5-溴吡啶、2-溴-5-二甲胺基吡啶也能分别与氯丙烯或者碘甲烷反应得到各自产物(表1, Entries 6~8).表1 一锅法Kumada 反应合成烷基化合物aTable 1 One-pot Kumada reaction to prepare alkylpyridineEntry Substrate RXCatalystProduct Yield b /%1CH 3I Py 4NiCl 2N OCH 3CH 31652CH 3I (DPPE)NiCl 2N OCH 3CH 31633Py 4NiCl 2604(DPPE)NiCl 2655PhCH 2Cl Py 4NiCl 2N OCH 3CH 2Ph3506Py 4NiCl 2507CH 3I Py 4NiCl 2652176有 机 化 学 V ol. 31, 2011续表Entry Substrate RX CatalystProduct Yield b /%8CH 3I Py 4NiCl 2N CH 36N709Py 4NiCl 2N76810cPy 4NiCl 280aReaction conditions: 2.2 mmol of Mg, 1.0 mmol of bromopyridine, 5 mol% Py 4NiCl 2 or (DPPE)NiCl 2 and 2 mL of ethyl ether were mixed, then 2 mmol of RX wasadded dropwise. The mixture was refluxed for 1 h under N 2; b isolated yield; c THF as solvent2位甲基取代的氯丙烯与2-溴吡啶反应, 得到正常的烯丙基化反应产物, 收率达到68%(表1, Entry 9), 而该氯化物与2-溴-3-甲氧基吡啶在同样条件下不发生反应, 但当用四氢呋喃(THF)代替乙醚作溶剂, 加热反应, 得到的不是正常的烯丙基化产物, 而是乙烯基化的产物(表1, Entry 10), 收率为80%, 推测可能是在催化剂的作用下, 烯丙基发生异构化之故.References1 Scriven, E. F. V.; Toomey, J. E.; Murugan, R. Pyridine andPyridine Derivatives , Kirk -Othmer Encyclopedia of Chemi-cal Technology , Vol. 4, Wiley, New York, 1996, pp. 641~679.2 Higashio, Y.; Shoji, T. Appl . Catal . A 2004, 260(2), 251.3 Beatriz, I.; Rosana, A.; Angel, R. A. Tetrahedron 2001, 57,3125.4 Chichibabin, A. E. J . Prakt . Chem . 1924, 107, 122.5 The Lummus Company GB 1182705, 1970 [Chem. Abstr.1970, 72, 132552].6 Darragh, J. I. US 4089863, 1978 [Chem. Abstr. 1978, 91,5117]. 7 Baylis, A. B. US 3970655, 1976 [Chem. Abstr. 1976, 86,43568].8 Chang, C. D.; Lang, W. H. US 4220783, 1980 [Chem.Abstr. 1980, 93, 220607].9 Feither, D.; Wolfgang, S.; Henry, W. EP 131887, 1985[Chem. Abstr. 1985, 103, 104849].10 Cheng, W. J.; Lin, F. S.; Jong, Y. L. US 4866179, 1989[Chem. Abstr. 1989, 112, 76964].11 Shimizu, S.; Abe, N.; Doba, M. EP 382543, 1990 [Chem.Abstr. 1990, 114, 42582].12 Goe, G. I.; Davis, R. D. WO 9003366, 1990 [Chem. Abstr.1990, 113, 132012]. 13 Yamaji, M . BE 902867, 1985 [Chem. Abstr. 1985, 106,18358]. 14 Kusunoki, Y.; Okazaki, H. Nippon Kagaku Kaishi 1979, 11,1520.15 (a) Morales-Ramos, A. I.; Li, Y. H.; Hilfiker, M.; Mecom, J.S.; Eidam, P.; Shi, D. C.; Tseng, P. S.; Brooks, C.; Zhang, D.; Wang, N.; Jaworski, J. P.; M orrow, D.; Fries, H.; Edwards, R.; Jin, J. Bioorg . Med . Chem . Lett . 2011, 21(10), 2806.(b) Krasovskiy, A.; Thome, I.; Graff, J.; Krasovskaya, V.; Konopelski, P.; Duplais, C.; Lipshutz, B. H. Tetrahedron Lett . 2011, 52(17), 2203.16 (a) Clark, R. B.; He, M.; Fyfe, C.; Lofland, D.; O'Brien, W.J.; Plamondon, L.; Sutcliffe, J. A.; Xiao, X. Y. J . Med . Chem . 2011, 54(5), 1511.(b) Hikawa, H.; Yokoyama, Y. Tetrahedron 2010, 66(49), 9552.17 (a) Sunderland, P. T.; Dhami, A.; Mahon, M. F.; Jones, L.A.; Tully, S. R.; Lloyd, M. D.; Thompson, A. S.; Javaid, H.; M artin, N. M.B.; Threadgill, M. D. Org . Biomol . Chem . 2011, 9(3), 881.(b) Koike, T.; Hoashi, Y.; Takai, T.; Uchikawa, O. Tetra-hedron Lett . 2011, 52(23), 3009.18 (a) Qian, B.; Xie, P.; Xie, Y. J.; Huang, H. M. Org . Lett .2010, 13(10), 2580.(b) Stowers, K. J.; Fortner, K. C.; Sanford, M. S. J . Am . Chem . Soc . 2011, 133(17), 6541. 19 Tamao, K. J . Organomet . Chem . 2002, 653, 23.20 Largeron, M .; Auzeil, N.; Bacque, E.; Fleury, M . B. J .Chem . Soc ., Perkin Trans . 2 1997, 495.21 Tao, X. C.; Zhao, R.; Xie, J. J.; Cai, L. Z.; Zhang, C. H. CN101591289, 2009 [Chem. Abstr. 2010, 152, 97343]. 22 Tran, L. D.; Daugulis, O. Org . Lett . 2010, 12, 4277.23 Nunez, A.; Abarca, B.; Cuadro, A. M .; Alvarez, B. J.;Vaquero, J. J. J . Org . Chem . 2009, 74, 4166.24 Hatton, P. M.; Sternhell, S. Aust . J . Chem . 1992, 46, 149 25 Markovac, A.; Ash, A. B.; Stevens, C. L.; Hackley, B. E.;Steinberg, G. M. J . Heterocycl. Chem . 1977, 14, 19.26 Iwasaki, M .; Hayashi, S.; Hirano, K.; Yorimitsu, H.;No. 12 刘涛平等:一锅法Kumada偶联反应合成烷基吡啶化合物2177Oshima, K. J. Am. Chem. Soc. 2007, 129(14), 4463.27 Barringer, D. F.; Berkelhammer, G.; Carter, S. D.;Goldman, L.; Lanzilot, A. E. J. Org. Chem. 1973, 38, 1933.28 Waletaky, E.; Princeton, G.; Berkylhammer, S.; Kantor, T.US 3320124, 1967 [Chem. Abstr.1967, 68, 39647].29 Rapoport, H.; Volcheck, E. J. J. Am. Chem. Soc. 1956, 78,2451.30 Walter, L. A.; Springer, C. K.; Kenney, J.; Galen, S. K.;Sperber, N. J. Med. Chem. 1968, 11, 792.31 Williams, H.; Kaufmann, P.; Mosher, H. S. J. Med. Chem.1955, 20, 1139.32 Clark, G. J.; Deady, L. W. Aust. J. Chem. 1981, 34, 927.33 Tiecco, C.; Tingoli, M.; Testaferri, L.; Chenelli, D.; Wen-kert, E. Tetrahedron1986, 42, 1475.34 Liu, G. Y.; Du, Q. L.; Xie, J. J.; Zhang, K. L.; Tao, X. C.Chin. J. Catal. 2006, 27(12), 1051 (in Chinese).(刘谷雨, 杜巧玲, 谢俊杰, 张凯黎, 陶晓春, 催化学报, 2006, 27(12), 1051.)35 Joule, J. A.; Mills, K. Heterocyclic Chemistry, Vol. 4, WileyBlackwell, New York, 2000, pp. 103~110.(Y1107211 Qin, X.; Lu, Z.)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机合成中间体
1、甲基亚磷酸二乙酯
别名:氯代亚磷酸二乙酯
英文名:Diethylmethylphosphite;Diethylchlorophosphite
分子式:C5H13O2P
分子量:136.13
CAS:15715-41-0
用途:重要的农药及医药中间体。
产品介绍:无色液体含量95%98%
2、3,5-二氯硝基苯
CAS:618-62-2
英文名称:1,3-dichloro-5-nitro-benzen
3,5-dichloronitrobenzene
分子式:C6H3Cl2NO2
分子质量:192.00
熔点:64-65℃
用途:重要的农药,医药及化工染料中间体。
3、3,5-二氯苯胺
CAS:626-43-7
外观:淡黄色块状固体。
熔点:51-53°C
含量:98%
用途:本品用作杀菌剂的原料,由它制得陇望蜀二甲菌核利、菌核利、乙烯菌核利、菌核净、异菌脲、乙菌利、氯苯咯菌胺和甲菌利;还可用于合成杀虫剂、除草剂、植物生调节剂。
医药工业用于制造治疗疟疾病的喹啉衍生物。
染料工来用于制偶氮染料和颜料。
在工业卫生方面用于制造杀虫剂和有害生物驱除剂.
4、二苯甲醇
英文:Benzhydrol
别名:双苯甲醇
CAS-NO:91-01-0
外观:白色结晶粉末
熔点:63-69°C
含量:》99%
产品用途:本品用于有机合成,医药工业作为苯甲托品、苯海拉明的中间体。
包装:25公斤/纸板桶
5、2-氨基-3-甲基苯甲酸
CAS:4389-45-1
含量:≥99%
外观:类白色结晶粉状
6、2,3-二氯吡啶
化学名称:2,3-二氯吡啶
CAS号:2402-77-9
含量: 97%
分子式: C5H3Cl2N
分子量: 147.99
包装:25 kg/桶
主要用途:医药和农药的重要中间体。
7、2-氟-5-三氟甲基吡啶
2-氟-5-三氟甲基吡啶(2-fluoro -5-(trifluoromethyl)pyridine)
CAS登记号(CAS NO.)69045-82-5
含量≥98%(GC)
50公斤/ 桶(无色透明液体)
8、2-氟-3-氯-5-三氟甲基吡啶
2-氟-3-氯-5三氟甲基吡啶(2-fluoro-3-chloro-5-(trifluoromethyl)pyridine) CAS登记号(CAS NO.)
含量≥98.0%(GC)
50公斤/ 桶(无色透明液体
用作农药中间体
10、2-氯-5-氯甲基噻唑
CAS NO.: 105827-91-6
分子式:C4H3NSC l2
分子量:168
结构式:
外观:淡黄色结晶或淡黄色液体
含量:≥98%
熔点:29-31℃
包装:250公斤/塑料桶
用途:医药中间体.农药中间体
11、对氟苯乙酮(4-氟苯乙酮)
CA S;403-42-9
主要用途:对氟苯乙酮用作抗菌消炎药的中间体,在有机氟农药的合成中
也有很重要的作用。
质量指标:外观:浅无色或浅黄色液体沸程:193-196℃
含量:≥99.0%水分:≤0.5%
包装:200KG衬塑铁桶
12、2,4,6-三甲基苯甲酰氯
含量 98.5%(%)
用途用作染料、杀虫剂、医药和光引发剂的中间体。
可合成三甲基苯
甲酰氯、聚环氧化物的硬化剂和聚合物的光引发剂。
CAS 938-18-1 化学名 Mesitoyl chloride
外观:无色至浅黄色透明液体
包装:衬塑铁桶包装200kg/桶
13、二苯甲酮腙
CAS:5350-57-2
外观:白色结晶粉末
含量:≥99%
熔点:97-99℃
干燥失重:≤0.5
结构式:
用途:用作有机颜料和医药中间体。
14、3,4-二氟苯腈
CAS: 64248-62-0
含量:≥99%
分子量: 139.1 外观:白色固体
熔点:48-53 ºC 沸点:180 ºC
闪点:69 ºC
包装: 25kg/桶
用途: 中间体
15、2,4,6(三甲基苯甲酰基)二苯基氧化膦
别名:光引发剂 >> RUNTECURE® 1108
CAS NO. : [75980-60-8]
外观:淡黄色结晶
含量:97%
用途::本品多用于白色体系,可用于紫外固化涂料、印刷油墨、紫外固化粘合剂、光导纤维涂料、抗光蚀剂、光聚合印版、立体平版树脂、复合材料、牙齿填充料等。
