化工热力学习题 冯新主编第6章习题及答案打印版
化工热力学考试试卷(附答案)

化工热力学考试试卷(附答案)1、(2分)在PT 图上纯物质三种聚集态互相共存处称 三相点 。
2、(2分)纯物质 P-V 图临界等温线在临界点处的斜率 ____0______, 曲率为 ___0______。
3、(4分)指出下列物系的自由度数目,(1)水的三相点 0 ,(2)液体水与水蒸汽处于汽液平衡状态 1 ,(3)甲醇和水的二元汽液平衡状态 2 ,(4)戊醇和水的二元汽-液-液三相平衡状态 1 。
4、(2分)组成为x 1=0.2,x 2=0.8,温度为300K 的二元液体的泡点组成y 1的为(已知液相的Pa) ___0.334____________。
5、(2分)一定状态下体系的火用指体系由该状态达到与 环境基态完全平衡 时,此过程理想功。
6、(2分)二元混合物容积表达式为V=X 1V 1+X 2V 2+αX 1X 2,如选同温同压下符合Lewis-Randll 规则的标准态就有 △V= ∆V =αX 1X 2 。
7、(2分)能量平衡时以热力学 第一定律 为基础,有效能平衡时以热力学 第二定律 为基础。
8、(4分)丙酮(1)-甲醇(2)二元体系在98.66KPa 时,恒沸组成x 1=y 1=0.796,恒沸温度为327.6K,已知此温度下的kPa 则 van Laar 方程常数是A 12=______0.587_____,A 21=____0.717____(已知van Laar 方程为 )9、(4分)等温等压下二元溶液组分的活度系数与组成之间关系,按Gibbs-Duhem 方程 X 1dln γ1+X 2 d ㏑γ2 = 010、(6分)由于邻二甲苯与对二甲苯、间二甲苯的结构、性质相近,因此它们混合时会形成______理想溶液_______溶液,它们的ΔH=_______0______,ΔV=______0_____。
二.判断题1、(2分)一定压力下,纯物质的泡点温度和露点温度是相同的,且等于沸点。
物理化学 热力学习题

一、选择题(10题)1、如图所示,在绝热盛水容器中,浸有电阻丝,通电后水与电阻丝的温度均升高,如以水和电阻丝为系统,则上述过程中的Q、W和系统的△U的符号为:(D)A. W=0,Q<0, △U<0 B. W>0,Q<0, △U>0C. W=0,Q>0, △U>0D. W<0,Q=0, △U>02、在 100℃和 25℃之间工作的热机,其最大效率为:(D)A. 100 %B. 75 %C. 25 %D. 20 %3、1mol单原子分子理想气体,从273 K,202.65 kPa, 经 pT=常数的可逆途径压缩到405.3 kPa的终态,该气体的ΔU为: ( D )A. 1702 JB. -406.8 JC. 406.8 JD. -1702 J4、理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的压力,则其终态的温度,体积和系统的焓变必定是( B )A. T(可逆)>T(不可逆),V(可逆)>V(不可逆),△H(可逆)>△H(不可逆)B. T(可逆)<T(不可逆),v(可逆)<v(不可逆),△H(可逆)<△H(不可逆)C. T(可逆)<T(不可逆),V(可逆)>V(不可逆),△H(可逆)<△H(不可逆)D. T(可逆)<T(不可逆),V(可逆)<v(不可逆),△H(可逆)>△H(不可逆)5、在一个体积恒定的绝热箱中有一绝热隔板,其两侧放有n、T、p皆不相同的N 2(g),N2(g)视为理想气体。
今抽去隔扳达到平衡,以N2(g)作为系统,此过程的( A )A. W=0,△U=0,△H=0B. W>0,△U>0,△H>0C. W<0,△U<0,△H<0D. W=0,△U=0,△H>06、理想气体与温度为T的大热源接触作等温膨胀,吸热Q,所做的功是变到相同终态的最大功的20%,则系统的熵变为 ( C )A.Q/T B.-Q/T C.5Q/T D.- 5Q/T7、单原子理想气体的Cv,m =3R/2.当温度由T1,变到T2时,等压过程系统的熵变(△S)p 与等容过程熵变(△s)v之比是 ( D )A.1;1B.2:IC.3:5D.5:38. 正常沸点时液体气化为蒸气的过程在定压下升高温度时体系的△VapG⊖值应如何变化?( C )A. △Vap G⊖=0 B. △VapG⊖≥0 C.△VapG⊖<0 D. △VapG⊖>09、p=1x106Pa 时,某气相反应在T 1=400 K 的热效应与T 2=800 K 时的热效应相等,则两种条件下反应的熵变 ( B )A.△r S M (T 1)>△r S M (T 2)B. △r S M (T 1)=△r S M (T 2)C.△r S M (T 1)<△r S M (T 2)D.不能确定其相对大小10、对物质的量为n 的理想气体,(∂T/∂P)s 应等于 ( D ) A. V/R B.V/(nR) c. V/Cv D.V/Cp二、填空题(10题)1. 等温、等压下,1mol 苯和甲苯形成了液态混合物,现在要将两组分完全分离为纯组分至少要做的非体积功的数值为 ___-2 RTln0.5___2.已知25℃时,金刚石的标准摩尔生成焓△f H m =1.90KJ/mol,石墨的标准摩尔燃烧焓△c H m =-393.51KJ/mol,则金刚石的标准摩尔燃烧焓△c H m ___-395.41KJ/mol _____3. 已知金属铝的熔点T f 为933K 、熔化热△fus H m 为10619J •mol-1, 若其液态和固态时的摩尔恒压热容C P, M(l)和C P, M(s)分别为34.3 J •mol -1•K -1和32.8 J •mol -1•K -1,则当铝从873K 加热到973K ,其熵变化为15.0 J •mol -1•K -14. 实际气体经一不可逆循环,则△S = 0, △U = 05. 已知:在298K,1大气压下:△c H m (H 2,g)=-241.8kJ/mol; △c H m (C 6H 6,g)=-3169.5kJ/mol; △c H m (C 6H 12,g)=-3688.9kJ/mol. 各物质的热容为: C p,m (C 6H 6,g)=11.72+0.2469T; C p,m (H 2,g)=28.87; C p,m (C 6H 12,g) =10.88+0.4017T计算反应: C 6H 6(g)+3H 2(g)=C 6H 12(g) 在125℃下的△H=___-209.4 kJ/mol ____6. 室温下,10×P ⊖的理想气体绝热节流膨胀至 5×P ⊖的过程有:(1) W > 0 ; (2) T 1> T 2; (3) Q = 0 ; (4) △S > 0 其正确的答案应是: (3)、(4)7. 某非理想气体服从状态方程 PV = nRT + bP (b 为大于零的常数),1mol 该气体经历等温过程体积从 V 1变成 V 2,则熵变 △S m 等于 R ln (V 2-b)/(V 1-b)8. 选择“>”、“<”、“=”中的一个填入下列空格理想气体经节流膨胀 △S _>__0,△G __<__ 0。
工程热力学习题答案

0;295.4 kJ;0.568 kJ/K -4.16×103 kJ;-5.82×103 kJ;-5.82×103 kJ (1)-86.55 kJ/kg; (2)-101.67 kJ/kg 定温:p 2 =0.6 MPa,v 2 =0.149 m3/kg;W=-247.04 kJ;Q=-247.04 kJ;△U=0 多变:p 2 =0.88 MPa,v 2 =0.149 m3/kg;T 2 =442.3 K;W=-301.88 kJ;Q=-90.56 kJ;△U=211.32 kJ 162.81 m3 (1)300 K;154.27 kJ/kg;0.514 kJ/(kg·K)
3-16: 0.13 kJ/K 3-17: 35 kJ 3-18: (2) cm
TA TB
2
TA TB ; (3) cm ln
4TATB
2
第四章 4-2: 4-3: 4-4: 4-5: 4-6: 4-7: 4-8: 4-9: 4-10: 4-11: 4-12: 4-13: 4-14: 4-15: 第五章 5-3: 5-4: 5-5: 5-6: 5-8: 5-9: 0.15 kg (1)95.3℃; (2)8.2×10-3 kg 6.85 kg;0.627 MPa 1.068×105 m3/h 27.93 kg/kmol (1)612.3 kJ; (2)713.9 kJ 558 kJ/kg 285.86 kJ;400.21 kJ; 293.53 kJ;407.9 kJ -595.8 kJ;-765.9 kJ;0.322 kJ/K (1)8.14×103 kJ;1.14×104 kJ; (2)8.97×103 kJ;1.23×104 kJ; (3)8.95×103 kJ;1.22×104 kJ; (4)6.66×103 kJ;9.91×103 kJ (1)93.46 kJ/min;130.85 kJ/min;0.4503 kJ/(K·min) (2)91.58 kJ/min;129.44 kJ/min;0.446 kJ/(K·min) (1)-147.19 kJ/kg;-205.82 kJ/kg;-0.4597 kJ/kg·K (2)-150.81 kJ/kg;-209.68 kJ/kg;-0.4683 kJ/kg·K (1)441.76 kJ/kg; (2)0.04218 kJ/kg·K;12.65 kJ/kg; (3)472.04 kJ/kg 3 O 2 :7.6%;N 2 :53.6%;CO 2 :38.8%; 0.189 m /kg
化工热力学习题集-周彩荣

《化工热力学》习题集郑州大学化工学院周彩荣2008.12.第二章 流体的p-V-T 关系和状态方程一、问答题:2-1为什么要研究流体的pVT 关系?2-2在p -V 图上指出超临界萃取技术所处的区域,以及该区域的特征;同时指出其它重要的点、线、面以及它们的特征。
2-3 要满足什么条件,气体才能液化?2-4 不同气体在相同温度压力下,偏离理想气体的程度是否相同?你认为哪些是决定偏离理想气体程度的最本质因素?2-5 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?2-6 什么是状态方程的普遍化方法?普遍化方法有哪些类型?2-7简述三参数对应状态原理与两参数对应状态原理的区别。
2-8总结纯气体和纯液体pVT 计算的异同。
2-9如何理解混合规则?为什么要提出这个概念?有哪些类型的混合规则?2-10状态方程主要有哪些类型? 如何选择使用? 请给学过的状态方程之精度排个序。
二、计算题:(说明:凡是题目中没有特别注明使用什么状态方程的,你可以选择你认为最适宜的方程,并给出理由)2-1. 将van der Waals 方程化成维里方程式;并导出van der Waals 方程常数a 、b 表示的第二维里系数B 的函数表达式2-2. 维里方程可以表达成以下两种形式。
21(pV B C Z RT V V ==+++……1) 21''(2pV Z B p C p RT==+++……) 请证明:'B B RT = 2'2()C B C RT −= 2-3. 某反应器容积为,内装有温度为的乙醇45。
现请你试用以下三种方法求取该反应器的压力,并与实验值(2.75)比较误差。
(1)用理想气体方程;;(2)用RK 方程;(3)用普遍化状态方程。
31.213m 0227C .40kg MPa 2-4. 容积1m 3的贮气罐,其安全工作压力为100atm ,内装甲烷100kg ,问:1)当夏天来临,如果当地最高温度为40℃时,贮气罐是否会爆炸?(本题用RK 方程计算)2)上问中若有危险,则罐内最高温度不得超过多少度?3)为了保障安全,夏天适宜装料量为多少kg ?4)如果希望甲烷以液体形式储存运输,问其压缩、运输的温度必须低于多少度?2-5. 液化气的充装量、操作压力和温度是液化气罐安全操作的重要依据。
物化第六章-答案

第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x B呈线性关系。
()3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于K;(2)必高于K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种( )(1) 3种;(2) 2种;(3) 1种;(4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。
第六章复习题-附答案

第六章复习题-附答案 第六章相平衡 填空题 1.蒸馏时,组分和温度均不发生变化的溶液叫什么?________________________ 答案:恒沸溶液 2.将一定量的NH4Cl(s)置于真空容器中, 加热分解达平衡, 系统的组分数为_____ , 相数为______ , 自由度数为________ 。 答案:1;2;1 3.如果完全互溶的二组分液体混合物对拉乌尔定律有较大的正偏差, 在T - x 相图中就有一个, 此点组成的混合物称为, 具有相等和恒定的特征。 答案:最低恒沸点;恒沸混合物;气液两相组成;沸腾温度。 4.FeCl3 和H2O形成四种水合物: FeCl3(6H2O; 2FeCl3(3H2O; 2FeCl3(5H2O; FeCl3(2H2O, 该系统的独立组分数为_______, 在恒压下最多能有______相共存. 答案:2;3 F= C-P+1 5.在80℃下,将过量的NH4HCO3(s)放入真空密闭容器内,NH4HCO3(s)发生下列分解反应NH4HCO3(s) =NH3(g)+ H2O(g)+ C2O(g)达平衡后,系统的C= 、P= 、F= 。 答案:(1;2;0)。该系统中物质数S =4,化学反应数R =1,独立的浓度关系式数R’=2,因为p(NH3)=p(H2O)=p(CO2)。故组分数C =4-1-2=1,相数P =2,温度一定,所以自由度数F =1-2+1=0。 6.下列化学反应,同时共存并到达平衡(温度在900K~1200K范围内) CaCO3(s)( CaO(s)+ CO2(g) CO2(g)+ H2(g)( CO(g)+ H2O(g) H2O(g)+ CO(g)+ CaO(s)= CaCO3(s)+ H2(g) 该系统的自由度F为。 答案:S=6、R=2、R`=0,(C=S-R-R`= 4,F= C-P+2 = 4-3+2=3 7. CaCO3(s)、BaCO3(s)、BaO(s)和CO2(g)构成的多相平衡系统的组分数为、相数为、自由度数为。 答案:S=4、R=1、R`=0,(组分数C=S-R-R`= 3,相数P= 4,自由度数F = C-P+2 = 3-4+2=1 8.水在三相点附近的蒸发热和熔化热分别为45和6kJ·mol-1,则此时冰的升华热为________ kJ(mol-1。 答案:=H(g)-H(s)=H(g)-H(l)+H(l)-H(s)= +=(45+6)kJ(mol-1 = 51 kJ(mol-1 9. 右图为二组分A和B的T—x图,当M 组成为M的溶液缓缓冷却至温度T1时,T1 溶液中A的活度随标准态的选择而异。 当以纯固体A为标准态时aA 1,当 以过冷液体为标准态时,aA 1(填(、(、()。 A XB B 答案:由相图看出,当组成为M的溶液缓缓冷却至温度T1时,系统处于液-固两相平衡。根据相平衡原理,A物质在两相中的化学势相等,即:(A*(s) = (A(l)= (A*(l) +RTlnaA,当以纯固体A为标准态时因(A*(s)= (A*(l) ( RTlnaA=0,aA=1;以过冷液体为标准态时,(A*(s) = (A(l)= (A((l) +RTlnaA,因过冷液体为热力学不稳定状态,其化学势高,即(A((l)( (A*(l) ( RTlnaA( 0,aA ( 1 10. 温度T下,A、B两组分液态完全互溶,其饱和蒸气压分别为p﹡A 、p﹡B,且p﹡A >p ﹡B .在A、B组成的气-液平衡系统中,当系统组成xB<0.3时,向系统中加入B(l)会使系统压力增大;反之,当系统组成xB>0.3时,向系统中加入B(l)会使系统压力降低,则该系统具有________ 恒沸点。 答案:最低。由p-x图分析,当xB<0.3时,加入B使系统压力增大,而xB>0.3时,加入B 使系统压力降低,说明在xB=0.3时系统压力最大,即该系统具有最大正偏差,也就具有最低恒沸点。 二、单项选择题 1. 某种物质在某溶剂中的溶解度_____。 A. 仅是温度的函数 B. 仅是压力的函数 C. 同时是温度和压力的函数 D. 是温度, 压力及其它因素的函数 答案:C。F = C-P + 2当C = 2; P = 2时, F = 2 (温度,压力) 2.通常情况下,对于二组分物系能平衡共存的最多相为 (A) 1 (B) 2 (C) 3 (D) 4 答案:D。F=2-P+2=4-P,F不能为负值,最小为零。当F=0时P=4。 3.正常沸点时,液体蒸发为气体的过程中 (A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0 答案:B。此为可逆过程故ΔG=0。 4. NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度 (A) F=0 (B) F=1 (C) F=2 (D) F=3 答案:B。F=C-P+2,C=2,P=3,故F=2-3+2=1。 5.碳酸钠与水可形成下列化合物NaCO3(H2O,NaCO3(7H2O,NaCO3(10H2O,试指出在常压下与碳酸钠水溶液和冰共存的含水盐最多有几种? (A)1种(B)2种(C)3种(D)0种 答案:(A),根据相律:S=5、R=3、R`=0,(组分数C=S-R-R`= 2,F(最小)= C-P+1 = 3-P=0,则P (最大)=3,已经存在碳酸钠水溶液和冰共两相,所以与其共存的含水盐只有一种。 6.纯物质的三相点,其自由度为多少? (A)4 (B)3 (C)2 (D)1 (E)0 答案:(E),F=C-P+2 = 1-3+2 = 0。 7.单组分系统的固液平衡线的斜率dp/dT的值 (A)大于零(B)等于零(C)小于零(D)不确定 答案:( D) dp/dT=(H/(T(V),任何单组分物质,熔化时都吸热(H(0,凝固时放热(H(0,但(V的符号不确定,有的物质凝固时体积增加,有的物质相反体积减小。固液平衡线的斜率也不确定。 8.A、B两液体混合物在T—x图上出现最高点,则该混合物对拉乌尔定律产生 (A)正偏差(B)负偏差(C)没偏差(D)无规则 答案:(B)。 9. 关于三相点, 下面的说法中正确的是 (A) 纯物质和多组分系统均有三相点 (B) 三相点就是三条两相平衡线的交点 (C) 三相点的温度可随压力改变 (D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点 答案:D 10. 关于杠杆规则的适用对象, 下面的说法中不正确的是 (A) 不适用于单组分系统 (B) 适用于二组分系统的任何相区 (C) 适用于二组分系统的两个平衡相 (D) 适用于三组分系统的两个平衡相 答案:B 11. FeCl3和H2O能形成FeCl3(6H2O, 2FeCl3(7H2O, 2FeCl3(5H2O,FeCl3(2H2O四种水合物,该系统的独立组分数C和在恒压下最多可能的平衡共存相数P分别为 (A)C = 3,P = 4 (B)C = 2,P = 4 (C)C = 2,P = 3 (D)C = 3,P = 5 答案:C.S=6、R=4、R`=0,(组分数C =S-R-R`= 2,F (最小)= C-P +1 = 2-P +1= 3-P= 0,则P (最大)=3。 12. 对于三组分系统, 在相图中实际可能的最大自由度数是 (A) f=1 (B) f=2 (C) f=3 (D) f=4 答案:C。F=C-P+2=3-P+2,P最小为1,F=3-1+2=4。因三组分系统相图无法表达出4个自由度,故取答案C。 13. 对于下述结论, 正确的是 (A) 在等压下有确定沸点的液态系统一定是纯物质 (B) 任何纯固体物质都有熔点 (C) 在一定温度下, 纯液体的平衡蒸气压与液体所受外压力无关 (D) 纯固体物质的熔点可以有很多个 答案:D。因熔点是与压力有关。 14. 下面的表述中不正确的是 (A) 在定压下, 纯固体物质不一定都有确定的熔点 (B) 在定压下, 纯液态物质有确定的唯一沸点 (C) 在定压下, 固体混合物都不会有确定的熔点 (D) 在定温下, 液体的平衡蒸气压与外压有关 答案:C。共熔混合物在定压下有确定的熔点。 15.在410 K,Ag2O(s)部分分解成Ag(s)和O2(g),此平衡体系的自由度为: (A) 0 (B) 1 (C) 2 (D) -1 答案:A。F=C-P+1=2-3+1=0。 16.下图中,从P点开始的步冷曲线为: 图1 答案:D 17.图1中,生成固体化合物的经验式为: (A) CCl4·C4H10O2 (B) CCl4·(C4H10O2)2 (C) (CCl4)2·C4H10O2 (D) CCl4(C4H10O2)3 答案:C 18.图1中,区域H的相态是: (A)溶液(B)固体CCl4 (C)固体CCl4 +溶液(D)固体化合物+溶液 答案:C 19.对于与本身的蒸气处于平衡状态的液体,通过下列哪种作图法可获得一直线: (A) p对T (B) lg(p/Pa) 对T (C) lg(p/Pa) 对1/T (D) 1/p 对lg(T/K) 答案:C。由克劳修斯_克拉贝龙方程可以看出: 20.已知苯一乙醇双液体系中,苯的沸点是353.3K, 乙醇的沸点是351.6K, 两者的共沸组成为:含乙醇47.5%(摩尔分数),沸点为341.2K。今有含乙醇77.5%的苯溶液,在达到气、液平衡后,气相中含乙醇为y2,液相中含乙醇为x2。下列结论何者正确? (A) y2 > x2 (B) y2 = x2 (C) y2< x2 (D) 不确定 答案:C 21.如上题,若将上述溶液精馏,则能得到: (A) 纯苯(B) 纯乙醇 (C) 纯苯和恒沸混合物(D) 纯乙醇和恒沸混合物 答案:D 三、简答题 1.如何用相律来说明恒沸混合物不是化合物。 答:恒沸混合物的特点是其气相和其平衡的液相组成相同,故R’=1。对这种两相平衡系统来说 F=(N-R-R’)-P+2 F=(2-0-1)-2+2=1 压力一经指定,其平衡系统中的温度、气相及液相的组成亦恒定,但若压力改变,平衡系统的温度及各相组成亦改变,可见恒沸混合物的组成随压力而变,它不是化合物。 2.不同温度下溶液的蒸气压可以用克-克方程来计算吗? 答:不能。克-克方程只适用于纯物质的蒸汽压随温度的变化关系。 3. 指出下列平衡系统中的物种数、组分数、相数和自由度数: Ca(OH)2(S)与CaO(S)和H2O(g)呈平衡。 在A和B形成的二元凝聚系统中,在转熔点发生转熔反应: B(晶)+ L(熔液)( AmBn(晶)。 CaSO4与其饱和水溶液达平衡。 5克氨气通入1升水中,在常温常压下与蒸气平衡共存。
第六章第七章 吸收习题参考答案

第六章 吸收习题参考答案(注:红色字体标注部分对教材所给答案进行了修正,请核查)【6-1】 含有8%(体积分数)22C H 的某种混合气体与水充分接触,系统温度为20℃,总压为101.3kPa 。
试求达平衡时液相中22C H 的物质的量浓度。
解:混合气体按理想气体处理,则22C H 在气相中的分压为101.30.088.104p p y kPa kPa ==⨯=总22C H 为难溶于水的气体,故气液平衡关系符合亨利定律,并且溶液的密度可按纯水的密度计算。
查得20℃水的密度为ρ=998.23/kgm 。
由 *Ac Hp =, SH EM ρ=故 *ASpc EM ρ=查表8-1可知,20℃时22C H 在水中的亨利系数E=1.23⨯510kPa ,故 *333A5998.28.104/ 3.65410/1.231018c kmol m kmol m -⨯==⨯⨯⨯ 【6-2】 总压为101.3 kPa ,温度为20 ℃的条件下,使含二氧化硫为3.0%(体积分数)的混合空气与含二氧化硫为3503/gm 的水溶液接触。
试判断二氧化硫的传递方向,并计算以二氧化硫的分压和液相摩尔分数表示的总传质推动力。
已知操作条件下,亨利系数E=3.55310⨯kPa ,水溶液的密度为998.2kg/3m 。
解:由道尔顿分压定律101.30.03 3.039p p y kPa kPa ==⨯=总液相摩尔分数为(溶液近似按纯水计算):0.35640.0000986998.218x ==稀溶液符合亨利定律,所以:*33.55100.00009860.35p Ex kPa ==⨯⨯=p >p *,二氧化硫由气相向液相传递,进行吸收过程。
用气相分压表示的总推动力为:3.0390.35 2.689p p kPa *-=-=与气相浓度相平衡的液相平衡浓度:33.0390.0008563.5510p x E *===⨯ 用液相摩尔分数表示的总推动力为:0.0008560.00009860.0007574x x *-=-=【6-3】 在某填料塔中用清水逆流吸收混于空气的2CO ,空气中2CO 的体积分数为8.5%,操作条件为15℃、405.3kPa ,15℃时2CO 在水中的亨利系数为1.24510⨯kPa ,吸收液中2CO 的组成为411.6510x -=⨯。
化工热力学考试5套题库与答案
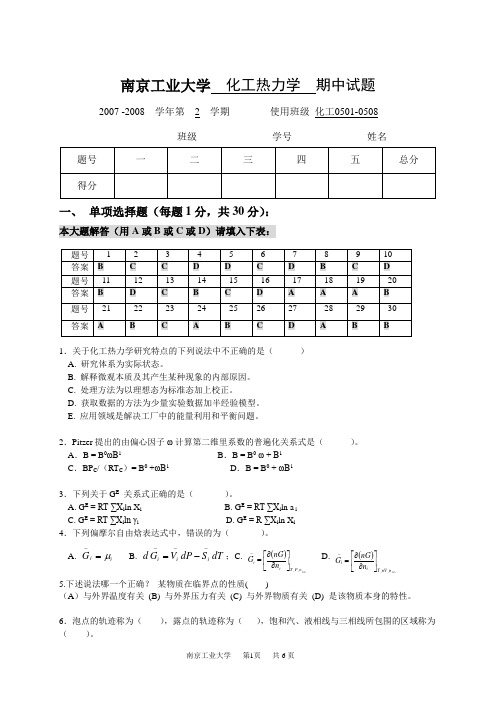
南京工业大学 化工热力学 期中试题2007 -2008 学年第__2__学期 使用班级_化工0501-0508_班级 学号 姓名一、 单项选择题(每题1分,共30分):本大题解答(用A 或B 或C 或D )请填入下表:1.关于化工热力学研究特点的下列说法中不正确的是( ) A. 研究体系为实际状态。
B. 解释微观本质及其产生某种现象的内部原因。
C. 处理方法为以理想态为标准态加上校正。
D. 获取数据的方法为少量实验数据加半经验模型。
E. 应用领域是解决工厂中的能量利用和平衡问题。
2.Pitzer 提出的由偏心因子ω计算第二维里系数的普遍化关系式是( )。
A .B = B 0ωB 1 B .B = B 0 ω + B 1 C .BP C /(RT C )= B 0 +ωB 1 D .B = B 0 + ωB 13.下列关于G E 关系式正确的是( )。
A. G E = RT ∑X i ln X iB. G E = RT ∑X i ln a iC. G E = RT ∑X i ln γiD. G E = R ∑X i ln X i 4.下列偏摩尔自由焓表达式中,错误的为( )。
A. i i G μ=-B. dT S dP V G d i i i ----=;C.()ij n P T i i n nG G ≠⎥⎦⎤⎢⎣⎡∂∂=-,, D.()ij n nV T i i n nG G ≠⎥⎦⎤⎢⎣⎡∂∂=-,,5.下述说法哪一个正确? 某物质在临界点的性质( )(A )与外界温度有关 (B) 与外界压力有关 (C) 与外界物质有关 (D) 是该物质本身的特性。
6.泡点的轨迹称为( ),露点的轨迹称为( ),饱和汽、液相线与三相线所包围的区域称为( )。
A. 饱和汽相线,饱和液相线,汽液共存区B.汽液共存线,饱和汽相线,饱和液相区C. 饱和液相线,饱和汽相线,汽液共存区7.关于逸度的下列说法中不正确的是 ( ) (A )逸度可称为―校正压力‖ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第6章 压缩、膨胀和制冷循环一、选择题1. 蒸汽压缩制冷循环过程中,制冷剂蒸发吸收的热量一定 制冷剂冷却和冷凝放出的热量 A 大于 B 等于 C 小于 (C )2. 从制冷原理和生产应用方面说明制冷剂的选择原则。
答(1)潜热要大。
因为潜热大,冷冻剂的循环量可以减小。
氨在这方面具有显著的优点,它的潜热比氟里昂约大10倍,常用于大型制冷设备。
(2)操作压力要合适。
即冷凝压力(高压)不要过高,蒸发压力(低压)不要过低。
因为冷凝压力高将增加压缩机和冷凝器的设备费用,功率消耗也会增加;而蒸发压力低于大气压力,容易造成空气漏入真空操作的蒸发系统,不利于操作稳定。
在这方面氨和氟里昂也是比较理想的。
(3)冷冻剂应该具有化学稳定性。
冷冻剂对于设备不应该有显著的腐蚀作用。
氨对铜有强烈的腐蚀作用,对碳钢则腐蚀不强;氟里昂则无腐蚀。
(4)冷冻剂不应有易燃和易爆性。
(5)冷冻剂对环境应该无公害。
氟里昂F11、F12对大气臭氧的破坏已被公认,将逐渐被禁用,无公害的氟里昂替代品已大量应用。
综合以上各点,氨作为冷冻剂常用于大型冷库和工业装置。
而无公害氟里昂常用于小型冷冻机和家用电器3. 某蒸汽压缩制冷过程,制冷剂在250K 吸收热量Q L ,在300K 放出热量-Q H ,压缩和膨胀过程是绝热的,向制冷机输入的功为Ws ,判断下列问题的性质。
A 可逆的 B 不可逆的 C 不可能的 (1). Q L =2000kJ Ws=400kJ ( A )2505300250η==-可逆 20005400L sQ W η===ηη=可逆 该制冷过程是可逆的 (2). Q L =1000kJ Q H =-1500kJ ( B ) 2505300250η==-可逆 1000215001000L L sH LQ Q W Q Q η====---ηη<可逆该制冷过程是不可逆的(3). Ws=100kJ Q H =-700kJ ( C )2505300250η==-可逆 7001006100H sL ssQ W Q W W η---====ηη>可逆该制冷过程是不可能的4. 卡诺制冷循环的制冷系数与 有关。
A 制冷剂的性质 B 制冷剂的工作温度 C 制冷剂的循环速率 D 压缩机的功率 ( B )T S 二、计算题1.为使冷库保持-20℃,需将419000kJ/h 的热量排向环境,若环境温度T 0=27℃,试求理想情况下每小时所消耗的最小功和排向大气的热量。
解: ()027320 5.382720c cT T T ξ-===--- c sQ W ξ=41900077838/5.38c s Q W kJ h ξ===041900077838496838/c s Q Q W kJ h =--=--=-2. 利用热泵从90℃的地热水中把热量传到160℃的热源中,每消耗1kw 电功,热源最多能得到多少热量?解: 0160273 6.1916090R R T T T ξ+===-- 1H P netQ P ξ=1 6.191 6.19H P net Q P kW ξ=⨯=⨯=3.某蒸汽动力循环操作条件如下:冷凝器出来的饱和水,由泵从0.035Mpa 加压至1.5Mpa 进入锅炉,蒸汽离开锅炉时被过热器加热至280℃。
求:(1) 上述循环的最高效率。
(2) 在锅炉和冷凝器的压力的饱和温度之间运行的卡诺循环的效率,以及离开锅炉的过热蒸汽温度和冷凝器饱和温度之间运行的卡诺循环的效率。
(3) 若透平机是不可逆绝热操作,其焓是可逆过程的80%求此时的循环效率。
解: (1) 各状态点的热力学性质,可由附录水蒸汽表查得16303.46H K J kg-=⋅123611612()1.024510(1.50.035)101.5P P H H V d PV PP k J k g ---==-=⨯⨯-⨯=⋅⎰115.146.303-⋅+=kg kJ H (由于液体压力增加其焓增加很少,可以近似16H H =)142992.7H K J kg-=⋅ 46.8381S =11--⋅⋅K kg kJ该循环透平机进行绝热可逆操作,增压泵也进行绝热可逆操作时效率最高。
54 6.8381S S ==,由0.035Mpa ,查得气相,117153.7--⋅⋅=KkgkJ S g (查饱和蒸汽性质表)液相,119852.0--⋅⋅=K kg kJ S l (查饱和水性质表内插)气相含量为x8381.69852.0)1(7153.7)1(3=⨯-+⨯=-+⨯=x x S x S x S l g87.0=x15(1)0.872631.4(10.87)303.462328.77g l H x H x H kJ kg-=⋅+-=⨯+-⨯=⋅45412992.72328.770.2472992.7303.96H H H H η--===--冷凝器压力0.035Mpa ,饱和温度为72.69℃;锅炉压力1.5Mpa ,饱和温度为198.32℃。
卡诺循环运行在此两温度之间,卡诺循环效率267.027332.19869.7232.198=+-=-=高低高卡T T T η若卡诺循环运行在实际的二个温度之间,其效率为375.027328069.72280=+-=-=高低高卡T T T η(3)不可逆过程的焓差为0.80(H 2-H 3),而吸收的热仍为12H H -,因此效率45410.80()0.800.2470.198H H H H η-==⨯=-4. 在25℃时,某气体的P-V-T 可表达为PV=RT +6.4×104P ,在25℃,30MPa 时将该气体进行节流膨胀,向膨胀后气体的温度上升还是下降?解;判断节流膨胀的温度变化,依据Joule-Thomson 效应系数μJ 。
由热力学基本关系式可得到:pP HJ C VT VT P T -∂∂=∂∂=)()()(μ将P-V-T 关系式代入上式,P RT PV 4104.6⨯+=→4104.6⨯+=PRT V ,其中PR TV P =∂∂)(0104.6104.644<⨯-=⨯-=⨯-=-⨯=ppppJ C C C P PV RT C VP R T μ可见,节流膨胀后,温度比开始为高。
5.将典型的蒸汽压缩制冷循环的T-S 图分别在P-H 图和H-S 图上表示出来。
解:压缩机的可逆绝热过程是等熵过程,节流过程常可看作为等焓过程,则循环可用如下P-H 和H-S 图表示。
T6. 某蒸汽压缩制冷循环,制冷量Q 0为3×104kJ ·h -1,蒸发室温度为-15℃,冷凝器用水冷却,进口为8℃。
若供给冷凝器的冷却水量无限大时,计算制冷循环消耗的最小功为多少?如果冷凝器用室温(25℃)空气冷却时,其消耗的最小功又是多少?解:首先需要明确的是:在所有的制冷循环中,逆卡诺循环的制冷效率最高,即功耗最小。
循环效率有如下的关联式:)()()()(ξ0121卡净功制冷量冷凝温度蒸发温度N W Q T T T =-=按照传热原理,如果进出冷却器的冷却水量无限大,则不仅冷却水进出口温度接近相同,而且被冷介质的温度也相同。
因此当冷却水量无限大时,冷凝温度T 2=(8+273)K , 所以最少净功14N hKJ 4.267410327315)27315()2738(W -∙=⨯⨯+-+--+=当冷凝器用空气冷却时,冷凝温度近似等于室温25℃ 最小净功 142.465110327315)27315()27325(-∙=⨯⨯+-+--+=hkJ W N由计算结果可见,冷却温度越低,消耗功越小。
但是空气冷却所用设备简单,如家用空调器,冰箱采用散热片空气冷却,不过它们的能耗要比水冷却高许多。
7. 实际蒸汽压缩制冷装置中的膨胀过程,为何采用节流阀而不用膨胀机?如果用膨胀机,请在T —S 图上标出哪些面积代表膨胀机回收的功?解:制冷装置的膨胀过程,采用节流元件(如阀、孔板等)主要考虑到节流设备简单,装置紧凑。
对于中小型设备而言,这个膨胀功是不值得回收的,功量不大,但是设备投资要增加许多。
因此,大多不采用膨胀机。
在下面的T —S 图上,节流元件膨胀过程如3→4,是等焓过程,而膨胀机膨胀过程如3→4',是等熵过程。
膨胀机回收的功量如阴影部分积分。
8.某压缩制冷装置,用氨作为制冷剂,氨在蒸发器温度为-25℃,冷却器中的压力为1.0MPa ,假定氨进入压缩为饱和蒸汽,而离开冷凝器时为饱和液体,每小时制冷量1.67×105 kJ·h -1。
求:(1)所需的氨流率;(2)制冷系数。
解:通过NH 3的P-H 图可查到各状态点焓值。
P1.0M Pa -25℃按照题意,氨进入压缩机为饱和状态1,离开冷凝器为饱和状态3。
氨在蒸发器中的过程即4→1 H 1=1430KJ ·kg -1H 2=1710KJ ·kg -1氨在冷凝器中的过程即2→3,H 3=H 4=320KJ ·kg -1 氨流率 15410005.15032014301067.1-⋅=-⨯=-==hkg H H Q q Q G制冷系数 0142114303201110 3.9617101430280sq H H W H H ξ--=====--注:求解此类题目:关键在于首先确定各过程状态点的位置,然后在P-H 图或T —S 图上查到相应的焓(或温度、压力)值,进行计算。
9.有一氨压缩制冷机组,制冷能力Q 0为4.0×104KJ ·h -1,在下列条件工作:蒸发温度为-25℃,进入压缩机的是干饱和蒸汽,冷凝温度为20℃,冷凝过冷5℃。
试计算:(1)单位重量制冷剂的制冷能力; (2)每小时制冷剂循环量;(3)冷凝器中制冷剂放出热量; (4)压缩机的理论功率; (5)理论制冷系数。
解:首先在P —H 图(或T —S 图)上按照已知条件定出各状态点。
查得 H 1=1430KJ ·kg -1H 2=1680KJ ·kg -1冷凝出来的过冷液体(过冷度为5℃)状态3'的决定:假设压力对液体的焓值几乎没有影响,从状态3沿着饱和液体线向下过冷5℃,找到3'',用此点的焓值近似代替3'的焓值,由于过冷度是有限的,实际上3'和3''很接近,不会造成太大的偏差。
3''→4仍为等焓膨胀过程, H 3`=H 4=270kJ ·kg -1制冷能力 q 0=H 1-H 4=1430-270=1160KJ ·kg -1 制冷剂循环量 1405.341160104-⋅=⨯==hkg q Q G冷凝过程即2→3',放出热量Q=(H 3-H 2)G=34.5(270-1690)=-48645KJ ·h -1压缩机功率 kW H H G N 40.23600)14301680(5.343600)(12=-=-=制冷系数 64.425011601430168027014301241==--=--=H HH H ξ10.压缩机出口氨的压力为1.0MPa ,温度为50℃,若按下述不同的过程膨胀到0.1MPa ,试求经膨胀后氨的温度为多少? (1)绝热节流膨胀;(2)可逆绝热膨胀。
