麦氏比浊法
银杏果实(白果)多糖提取工艺优化及其抑菌活性分析

江苏农业学报(Jiangsu J.qfAgr.Sci.),2020,36(6):1551~1558http://1551吴海霞,田志芳.银杏果实(白果)多糖提取工艺优化及其抑菌活性分析[J].江苏农业学报,2020,36(6):1551-1558.doi:10.3969/j.issn.1000-4440.2020.06.027银杏果实(白果)多糖提取工艺优化及其抑菌活性分析吴海霞1,田志芳2(1.运城学院生命科学系/特色农产品加工山西省重点实验室,山西运城044000; 2.山西省农业科学院农产品加工研究所,山西太原030031)摘要:以银杏(Ginkgo biloba L.)果实(白果)为原料,利用响应面分析法优化白果多糖的提取工艺,并分析白果多糖的抑菌活性。
以多糖得率为指标,通过单因素试验及响应面分析,探讨液料比、提取温度及提取时间等因素对白果多糖得率的影响,从而建立白果多糖的提取工艺模型,得出其最佳提取工艺条件;结合牛津杯法及二倍稀释法,分析白果多糖的抑菌活性及最小抑菌质量浓度。
结果表明,白果多糖的最佳提取工艺条件如下:液料比45ml: 1g,95t浸提3.Oh,在该条件下多糖得率为19.67%。
抑菌试验结果表明,白果多糖对细菌有一定的抑制活性,对枯草芽抱杆菌(Bacillus subtilis)的抑制活性最强,最小抑菌质量浓度为2.50mg/ml;白果多糖对大肠杆菌(Escherichia coli)的抑制活性也较强,当白果多糖质量浓度为15.00mg/ml时,抑菌圈直径约为2.25cm;白果多糖对真菌几乎无抑制活性,因而不具有广谱抑菌活性。
关键词:银杏果实(白果);多糖;响应面分析;抑菌活性中图分类号:S792.950.1文献标识码:A文章编号:1000-4440(2020)06-1551-08Optimization of extraction technology of polysaccharides from Ginkgo biloba L.fruit(Ginkgo biloba seed)and antibacterial activityWU Hai-xia1,TIAN Zhi-fang2(1.Department of Life Science,Yuncheng University/Shanxi Key Laboratory qf Characteristic Agro-Products Processing,Yuncheng044000,China; 2.Institute of Agro-Products Processing,Shanxi Academy of Agricultural Sciences,Taiyuan030031,China)Abstract:Ginkgo biloba seed was used as raw material,the conditions of extracting polysaccharides were optimized based on response surface method(RSM),and the antibacterial activity was studied.The yield of polysaccharide was used as the index,single factor tests and RSM were performed to study the effects of liquid-to-solid ratio,extraction temperature and extraction time on polysaccharide yield.The mathematical model of polysaccharides extraction was established,and the optimum extraction conditons were obtained.The antibacterial activity and minimum inhibitory concentration of polysaccharides were analyzed by Oxford cup method and double dilution method.The results showed that the optimum extraction con-收稿日期:2020-05-18基金项目:山西省高等学校科技创新项目(2019L0865);山西省“1331”工程重点学科项目(098-091704);运城学院博士科研启动项目(YQ-2017010);运城学院学科群学科研究项目(XK-2018001、XK-2019034);特色农产品加工山西省重点实验室开放课题项目;山西省重点研发计划重点项目(201903D211006)作者简介:吴海霞(1980-),女,山西河津人,博士,副教授,主要研究方向为植物活性成分及其构效关系。
牛津杯法定量检测大蒜抑菌作用实验

牛津杯法定量检测大蒜抑菌作用实验一、实验目的1.了解大蒜对微生物中大肠杆菌的抑菌作用2.学习不同抑菌效价检测方法的原理和差异3.掌握牛津杯法的抑菌试验二、实验原理抑菌试验是指在体外测定样品的抑菌或杀菌能力。
在药品、功能食品、保健品和化妆品等行业中,所用中药材提取物、天然活性物质(如多糖类、黄酮类和精油类等)和抗生素类等物质的抑菌性能是一个重要指标。
抑菌试验常用的方法有抑菌圈法、菌落计数法、最小抑菌浓度法和比浊法等。
牛津杯法属于抑菌圈法的一种,其原理是利用待测药物在琼脂平板中扩散使其周围的细菌生长受到限制而形成透明圈——抑菌圈,根据抑菌圈大小判定待测药物抑菌效价。
它既可用于定性试验,也可用于定量分析,并且操作便捷、成本低廉、结果准确可靠,在多个领域被广泛使用。
大蒜是百合科葱属植物,具有医食同源性,既是调味品也是天然的药剂。
大蒜具有较高的营养价值,含有丰富的氨基酸、肽类、蛋白质、糖类、脂肪、无机盐、维生素以及蒜油。
同时它还具有抗菌抑菌、抗癌防癌、营养保健、降血压、抗击各种病毒侵袭、提高机体免疫力等功能。
大蒜被誉为“天然广谱抗生素”,对多种致病菌如大肠杆菌、金黄色葡萄球菌和致病性肠道细菌都有较强的抑制或杀灭作用,其抑菌的活性成分主要是含硫化合物等挥发性物质和大蒜素等。
本实验以大蒜作为待测样品、以大肠杆菌(Escherichia coli)作为指示菌,通过牛津杯法定量检测大蒜粗提物对大肠杆菌的抑制作用,让学生在掌握牛津杯法抑菌实验的同时,观察到大蒜粗提液的抗菌杀菌效果,从而增加对生活中食用大蒜对人体的抗感染和保健作用的了解。
三、实验方法1.试验菌种大肠杆菌(Escherichia coli)2.培养基与试剂1)LB液体培养基:胰蛋白胨10 g (1%);酵母提取物5 g (0.5%);氯化钠10g (1%);蒸馏水1000 mL;pH值7.0~7.2。
2)LB半固体培养基(含1%琼脂): 胰蛋白胨10 g (1%);酵母提取物5 g(0.5%);氯化钠10 g (1%);琼脂10 g (1%);蒸馏水1000 mL;pH值7.0~7.2。
医学检验专业技能考核

说明测试带各模块对应的检测内容
开机、预热
0.5
调试
检测仪器性能和测试带质量
根据结果,判断能否使用该仪器检测标本
测定
按start键后,按仪器提示,适时、正确把测试带浸入尿中,浸入时间(2秒)准确
放置测试带到仪器检测槽内,完成检测,打印结果
取出测定完的测试带,放入指定地点
正确说明打印结果代码的中文含义(每错1个扣0。5分)
消毒灭菌
1
结果及报告(1分)
报告书写规范、整洁,无笔误
1
总分(10分)
二、尿液常规检验技术评分标准
考核项目
评分标准
标准
分数
得分
备注
实验用品准备
(2分)
滴管、质控带、测试带、质控尿液、尿液分析仪、10ml刻度离心管、载玻片、盖玻片、离心机、显微镜
每缺一样扣0.2分
实验过程(7分)
尿液仪器分析(3分)
准备
2
收场
整理清场(试剂、器材归位、实验台面清理)
消毒灭菌
0。5
完成时间
30min内完成,每延时2min扣0.5分
1
结果及报告(1分)
报告书写规范、整洁,无笔误
1
总分(100分)
三、细菌接种培养技术评分标准
考核项目
评分标准
标准
分数
得分
备注
实验用品准备
(2分)
普通平板、菌种、接种环、酒精灯、打火机、记号笔
0.5
完成时间
全过程12min内完成,每延长2min扣0。5分
1
白细胞计数(3分)
计数结果准确
白细胞计数结果评分方法:
变异百分率V=│X测-X靶│/ X靶×100
真菌常用的体外药敏试验方法比较(1)

64 32 16 8
4
2 1 0.5 .25 .125 +
-
前10管: 0.2ml氟康唑+1.8ml菌液
念珠菌属 35 ℃孵育48小时 新型隐球菌 72小时
菌液制备
将受试菌在沙保罗培养基上转种,以保证其纯度和活性。用0.85%的盐 水制成酵母菌悬液,调整其浊度达到0.5麦氏比浊标准(约为 1~5×106CFU/ml)。
常量稀释法:用RPMI1640液体稀释2000倍
接种浓度约为0.5~2.5×103CFU/ml
微量稀释法:用RPMI1640液体稀释1000倍
NCCLS M44-P. 2003
培养基: Mueller-Hinton琼脂
补充 2%
Glucose
0.5ug/ml Methylene blue dye
PH7.2-7.4
优点:有较好的重复性和稳定性
操作简便,价廉
缺点:目前只限氟康唑
NCCLS纸片扩散法
0.5麦氏比浊标准(约为1~5×106CFU/ml)。
读取MIC结果
2ml菌液 1.8ml1640
常量稀释法
药敏结果判定
氟康唑,伊曲康唑,两性霉素为100%抑制 其他唑类药物为80%抑制
(取0.2ml的生长对照菌液加入0.8mlRPMI液体培养基的菌液浓度)
质控株
克柔念珠菌ATCC 6258 近平滑念珠菌ATCC 22019 白念珠菌ATCC 90028 白念珠菌ATCC 24433
微量肉汤法
氟康唑的稀释方法同常量法,但起始浓度为2×常量法的 浓度(即128µg/ml ),终浓度为0.25µg/ml 。
抗菌药物敏感性实验及细节耐药检测

抗菌药物敏感性实验与细节耐药性监测来源:查验医学在线2009-4-15 南网编辑2010-7-6一、需氧菌及兼性厌氧菌的药物敏感实验(一)纸片琼脂扩散法纸片琼脂扩散法又称Kirby-Bauer实验,是操作最简易、利用最普遍的抗菌药物敏感性实验。
1.实验原理将含有定量抗菌药物的纸片贴在已接种测试菌的琼脂平板上。
纸片中所含的药物吸收琼脂中的水分溶解后不断向纸片周围区域扩散形成递减的梯度浓度。
在纸片周围抑菌浓度范围内测试菌的生长被抑制,从而形成透明的抑菌圈。
抑菌圈的大小反映测试菌对测定药物的敏感程度,并与该药对测试菌的最低抑菌浓度(MIC)呈负相关关系,即抑菌圈越大,MIC越小。
2.培育基和抗菌药物纸片(1)培育基:水解酪蛋白(Mueller-Hin-ton,MH)培育基是CLSI/NCCLS采用的兼性厌氧菌和需氧菌药敏实验标准培育基,pH值为~,对那些营养要求高的细菌如流感嗜血杆菌、淋病奈瑟菌、链球菌等需加入补充物质。
琼脂厚度为4mm。
配制琼脂平板当天利用或置塑料密封袋中4℃保留,利用前应将平板置35℃孵育箱孵育,使其表面干燥。
(2)抗菌药物纸片:选择直径为6.35mm,吸水量为20ul的专用药敏纸片用逐片加样或浸泡方式使每片含量达到规定所示。
含药纸片密封贮存2~8℃或-20℃无霜冷冻箱内保留,β-内酰胺类药敏纸片应冷冻贮存,且不超过l周。
利用前将贮存容器移至室温平衡l~2h,避免开启贮存容器时产生冷凝水。
3.细菌接种细菌接种采用直接菌落或细菌液体生长方式。
用麦氏比浊标准的菌液浓度。
校正浓度后的菌液应在15min内接种完毕。
接种步骤如下:①用无菌棉拭子蘸取菌液,在管内壁将多余菌液旋转挤去后,在琼脂表面均匀涂片接种3次,每次旋转60°,最后沿平板内缘涂抹1周;②平板置室温下干燥3~5min,用纸片分离器或无菌镊将含药纸片紧贴于琼脂表面;③置35℃孵育箱孵育16~18h后阅读结果,对甲氧西林和万古霉素药敏感实验结果应孵育24h。
抗菌药物最小抑菌浓度的测定
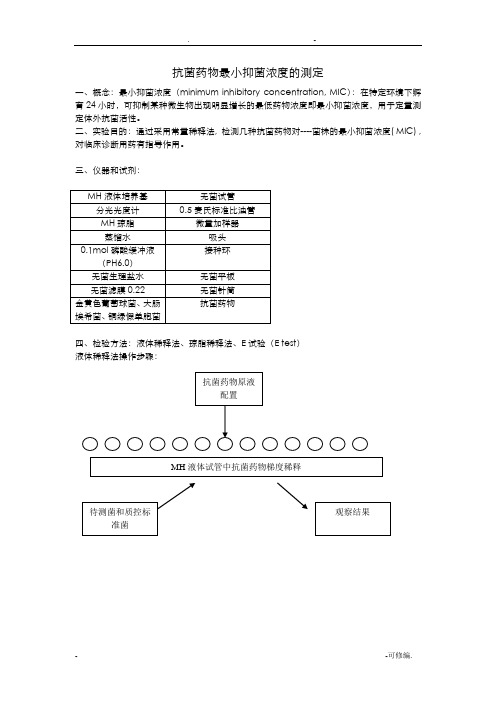
抗菌药物最小抑菌浓度的测定一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现明显增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性。
二、实验目的:通过采用常量稀释法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有指导作用。
三、仪器和试剂:四、检验方法:液体稀释法、琼脂稀释法、E试验(E test)液体稀释法操作步骤:1..抗菌药物原液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml 的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表1。
配制好的抗菌药物贮存液应贮存于-20℃环境,并注意抗菌药物的保存期限。
表1 稀释法中常用的抗菌药物容积稀释法2.药敏试验用抗菌药物浓度X围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度X 围应包含耐药、中介和敏感分界点值,特殊情况例外。
3.培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
两种方法测试抗菌肽与抗生素的联合抑菌效果

20244两种方法测试抗菌肽与抗生素的联合抑菌效果赵晶晶1李晓凤2刘保国2杭柏林2*(1洛宁县动物疫病预防控制中心,河南洛宁471700;2河南科技学院动物科技学院,河南新乡453003)摘要为了解抗菌肽泰立停与抗生素的联合抑菌作用,本研究通过倍比稀释法和纸片法测试了泰立停和抗生素在单用和联用时对大肠杆菌和沙门菌的抑菌活性。
结果表明:抗菌肽泰立停和抗生素安普霉素、恩诺沙星、多西环素在单用时对大肠杆菌和沙门菌均有不同程度的抑菌活性,在联合使用时,倍比稀释法观察到泰立停与恩诺沙星联合可以提高对大肠杆菌CVCC1568的抑菌活性;纸片法观察到仅泰立停与多西环素以8∶2的比例进行联合时对大肠杆菌AE1具有联合抑菌作用,同时观察到泰立停与某些抗生素联合时,抑菌效果与该抗生素单用的效果相当。
说明抗菌肽泰立停与某种抗生素联合可针对某种菌的某些菌株有很好的抑菌活性,同时可以降低抗生素的使用剂量。
这将减少抗生素在临床中的应用,进而避免或减少耐药菌的形成,维护人与动物的健康,保护生态环境。
关键词抗菌肽;泰立停;抗生素;联合抑菌作用中图分类号S859.79+6文献标识码A文章编号1007-5739(2024)04-0139-04DOI:10.3969/j.issn.1007-5739.2024.04.035开放科学(资源服务)标识码(OSID):Two Methods for Testing Combined Antibacterial Effects of Antimicrobial Peptideand AntibioticsZHAO Jingjing1LI Xiaofeng2LIU Baoguo2HANG Bolin2*(1Prevention and Control Center for Animal Disease in Luoning County,Luoning Henan471700;2College of Animal Science and Veterinary Medicine,Henan Institute of Science and Technology,Xinxiang Henan453003) Abstract In order to understand the combined antimicrobial activity of antimicrobial peptide Tailiting and anti-biotics,the antibacterial activity of Tailiting and antibiotics against Escherichia coli and salmonella was tested by double dilution method and paper slice method when Tailiting or antibiotic was used alone,or Tailiting combined with anti-biotic.The results showed that single use of Tailiting or antibiotic(apramycin,enrofloxacin and doxycycline)had different antimicrobial activity against E.coli and salmonella.The combination of Tailiting and enrofloxacin could increase the antimicrobial activity against E.coli CVCC1568by double dilution method.Only the combination of Tailiting and doxycycline at the ratio of8∶2had the combined antimicrobial effect on E.coli AE1.The combined antimicrobial effect of Tailiting and some antibiotics was similar to that of antibiotic alone.The results indicated that the combination of antimicrobial peptide Tailiting and some antibiotics had good antibacterial activity against some strains of certain bacteria and could reduce the dosage of antibiotics.This would reduce the application of antibiotics in clinic,and could avoid or reduce the formation of drug-resistant bacteria,maintain the health of human and animals and protect the ecological environment.Keywords antimicrobial peptide;Tailiting;antibiotic;combined antibacterial activity基金项目河南省科技攻关项目(222102110411);河南科技学院高层次人才启动项目(2014020);河南省三区人才项目(105020222016/011)。
实验七_鸡大肠杆菌灭活疫苗的

实验十一鸡大肠杆菌灭活疫苗的制备和检验细菌性灭活疫苗制备的基本程序为菌种的选择和种子的生产、菌液培养、灭活、配苗和分装,在此过程中还包括菌种、半成品以及成品检验。
大量生产的细菌培养方法有:固体表面培养法、液体静置培养法、液体深层通气培养法、透析培养法及连续培养法等。
灭活菌苗通常根据细菌的特性加入最有效的灭活剂,采取最适当的灭活条件进行。
灭活疫苗的佐剂不同,所以配苗方法也不相同。
鸡大肠杆菌灭活菌通常采用司盘白油佐剂,经过乳化而成。
一、目的要求1、了解细菌性灭活疫苗制造和检验的基本原理和过程。
2、掌握种子的生产、菌液培养、灭活、配苗和半成品以及成品检验方法。
二、材料与试剂1.材料(1)菌种:鸡大肠杆菌灭活疫苗菌种或临床分离株。
(2)实验动物:1~4月龄健康鸡。
(3)主要器材:超净工作台、恒温培养箱、冰箱、摇床、胶体磨、压盖机、高压锅、显微镜、酒精灯、温度计、普通试管、三角瓶、平皿、1ml注射器、疫苗瓶、瓶盖、记号笔和SPF鸡隔离箱等。
2.试剂蛋白胨营养琼脂培养基、普通肉汤培养基、甲醛溶液、鉴别培养基、甲醛溶液、佐剂等。
三、实验内容1、大肠杆菌培养与细菌的灭活。
2、大肠杆菌油乳剂灭活疫苗的配制。
3、大肠杆菌油乳剂灭活疫苗的成品检验方法。
四、操作步骤1.大肠杆菌茵液培养(1)种子液:将大肠杆菌菌种或临床分离株,分别于普通肉汤培养基中,置36~37℃保温18~24h,经纯检验后作为种子液。
(2)细菌培养:将种子液接于蛋白胨营养琼脂培养基表面,36~37℃保温24h。
加适量灭菌生理盐水将细菌洗下,装入玻瓶中,充分振荡菌液,使细菌分散开。
(3)纯检:将培养的细菌菌液接种于琼脂培养基表面,36~37℃保温24h。
观察菌落大小,应均匀一致。
(4)细菌计数:用麦氏比浊管法测定菌数或用平板计数,将菌数调整为15亿个/ml。
2.细茵灭活按菌液体积加入终浓度为O.3%的甲醛溶液,于37℃温箱中灭活24h,其振荡数次。
灭活后取少量菌液,接种于普通营养琼脂平板,37℃培养24~48h,进行灭活检验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细菌浓度的简单确定法:麦氏比浊法
麦氏比浊管是McFarland发明的一种用于微生物比浊的不同浊度的标准浊
度管。具体的配制方法是根据硫酸和氯化钡的比例来定的,有表可查,这样不同
比例生成的硫酸钡沉淀的浓度不同,且都有定值。
麦氏比浊管的配比如下:
操作方法:
1、轻摇标准试管。
2、无菌操作将被测定的肉汤培养物加到与标准管相同直径(大小)的无菌试
管中。
3、以无菌操作向被测定试管加入无菌生理盐水(NaCl),直到浓度与所要求
的标准管的浓度相同。
使用技巧:
1、直接用眼睛看(需要经验,误差较大)。
2、找张白纸,打上平行直线,然后看(如图示,利用光在不同浓度液体折射
不同)。
注意事项:
1、如果测定的肉汤培养物不澄清,由培养物的值减去未接种培养基的值来
校正细菌浓度。4号管(肉汤培养物)-1号管(孵育过的未接种的肉汤管)=3号管
(校正读数)。
2、如果肉汤颜色很深,把未接种试管放在标准管的后面读数即可。
编者注:
1、测定好的细菌,最好做一下梯度稀释涂布计数。
2、此浓度是对应的大肠杆菌的浓度,如果是其他细菌,会有一定的差别,
但编者做过的几个菌差别都在一个数量级之内,适合于普通实验。
3、此种方法测定的准确性不是很高,如果是对细菌数量要求较精确的,请
用紫外分光光度计。
麦氏比浊法 麦氏比浊管
麦氏比浊管
管 号(McFarland) 0.5 1 2 3 4 5
0.25%BaCl2(ml) 0.2 0.4 0.8 1.2 1.6 2.0
1%H2SO4(ml) 9.8 9.6 9.2 8.8 8.4 8.0
细菌的近似浓度(×108/ml) 1.5 3 6 9 12 15
细菌的近似浓度(百万/ml) 150 300 600 900 1200 1500
【使用方法】:
1、 轻摇标准试管。
2、 无菌操作将被测定的肉汤培养物加到与标准管相同直径(大小)的无菌试管中。
3、 以无菌操作向被测定试管加入无菌蒸馏水,直到浓度与所要求的标准管的浓度相同。
【计算被测培养物试管的浓度】:
1、 第2个标准管为3×108细菌/ml的倍数。
2、 细菌浓度标准管号×3×108=该管号的细菌/ml。
3、 例如:3号管(#3)为9×108细菌/ml。
【制备所要求的浓度,如需要105细菌的浓度】:
1、 相当1号管(3×108)的细菌作1:3稀释到108。
2、 再作1:1000稀释。
3、 108-103=10
5
【注意事项】:
1、 如果测定的肉汤培养物不澄清。
A、由培养物的值减去未接种培养基的值来校正细菌浓度。
B、列: 4号管(肉汤培养物)-1号管(孵育过的未接种的肉汤管)=3号管(校正读数)
2、如果肉汤颜色很深,把未接种试管放在标准管的后面读数即可。
