胞浆异柠檬酸脱氢酶(ICDHc)试剂盒说明书
人乳酸脱氢酶(LDH)ELISA试剂盒应用方法人乳酸脱氢酶(LDH)ELISAKit

人乳酸脱氢酶(LDH)ELISA试剂盒应用方法人乳酸脱氢酶(LDH)ELISAKit人乳酸脱氢酶(LDH)ELISA试剂盒:(用于血清、血浆、细胞培养上清液和其它生物体液内)原理本试验采用双抗体夹心ABCELISA法。
用抗人LDH单抗包被于酶标板上,标准品和样品中的LDH与单抗结合,加入生物素化的抗人LDH,形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin与生物素结合,加入底物工作液显蓝色,最终加停止液硫酸,在450nm处测OD值,LDH浓度与OD值成正比,可通过绘制标准曲线求出标本中LDH浓度。
试剂盒构成(28℃保管)酶标板(CoatedWells) 96孔酶标抗体工作液(EnzymeConjugate) 12ml 10×标本稀释液(SampleBuffer)12ml 20×浓缩洗涤液(WashBuffer)50ml标准品(Standards):80U/瓶 2瓶底物工作液(TMBSolution) 12ml第一抗体工作液(BiotinylatedAntibody) 12ml 停止液(StopSolution)12ml准备试剂与收集血样1.收集标本:血清、血浆(EDTA、柠檬酸盐、肝素抗凝)、细胞培养上清液、组织匀浆等尽早检测,28℃保管48小时;更长时间须冷冻(20℃或70℃)保管,躲避反复冻融。
2.标准品液配制:使用前加入1ml蒸馏水混匀,配成80000U/L的溶液。
设标准管8管,第一管加标本稀释液900ul,第二至第八管加入标本稀释液500ul。
在第一管中加入80000U/L的标准品溶液100ul混匀后用加样器吸出500ul,移至第二管。
如此反复作对倍稀释,从第七管中吸出500ul弃去。
第八管为空白对照。
3.10×标本稀释液用蒸馏水作1:10倍稀释(示例:1ml浓稀释液 9ml蒸馏水)。
4.洗涤液:用重蒸水1:20稀释(示例:1ml浓缩洗涤液加入19ml的重蒸水)检测程序1.加样:每孔各加入标准品或待测样品100ul,将反应板充分混匀后置37℃120分钟。
Cytotoxicity+LDH+Assay+Kit中文说明书20141202

0 cells/well 150 μl培养基
9)在每个孔中加入 50 l Stop Solution。 10)用酶标仪测定 490 nm 的吸光度。
图 3 预实验的 96 孔板细胞梯度配置图
三、细胞毒性实验 1)吸取 100 l 用培养基稀释过的细胞悬液至 V 型 96 孔板(悬浮细胞)或 U 型 96 孔板(贴壁细胞)中。 2)加入 100 l 含有药物的培养基。 3)在 37 ℃ CO2 培养箱中培养合适的时间。 4)在高对照的孔中加入 20 l Lysis Buffer 后,在 37 ℃ CO2 培养箱中培养 30 min。 5)培养后将 96 孔板离心 2 min(250×g)。 6)从每个孔中吸取上清液 100 l 至新的 96 孔板中。
150 μl 转移
C
150 μl
150 μl
96 孔板中。
D
*为了避免吸出细胞,请小心吸取上清液。
E
高对照
低对照
8)在每个孔中加入 100 l Working Solution 后, F
在避光、室温的条件下培养 30 min。
G
*请根据显色程度调整培养时间。
H
0 cells/well 150 μl培养基
2)向 96 孔板中每孔加入 100 l 培养基。
3)如图 2 所示,向 96 孔板中 A 行加入 100 l 细胞悬液后,用多通道移液器按 1/2 比例用培养基稀释成
一个系列细胞梯度。按照表 1 设定高对照和低对照各 3 个孔,另外准备 3 个不含细胞的 Blank 孔。
4)在高对照孔中加入 10 l Lysis Buffer。
注意事项: 本试剂盒使用玻璃容器及铝盖,建议使用时戴手套。 测定前的注意事项: 因为每种细胞的 LDH 量不同,为了得到最好的显色效果,推荐做预实验确定最佳细胞量。
谷氨酸脱氢酶(GDH)活性检测试剂盒说明书 微量法

谷氨酸脱氢酶(GDH)活性检测试剂盒说明书微量法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC1465规格:100T/96S产品内容:提取液:液体100mL×1瓶,4℃保存;试剂一:液体20mL×瓶,4℃保存;试剂二:粉剂×1瓶,-20℃保存;产品说明:GDH(EC 1.4.1.2)广泛分布于植物中,和谷氨酸合成酶(GOGAT)共同参与谷氨酸的合成,在氨同化和转化成有机氮化合物的代谢中起重要作用。
+、α-酮戊二酸和NADH,生成谷氨酸和NAD+,引起340nm吸光度下降。
通过测定340nm吸GDH催化NH4光度的下降速率,计算GDH活性。
试验所需自备的仪器和用品:紫外分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔UV板、研钵、冰和蒸馏水。
操作步骤:一、粗酶液提取:1、收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入1mL提取液,超声波破碎细菌或细胞(功率20%,超声3秒,间隔10秒,重复30次);8000g4℃离心10分钟,取上清,置冰上待测。
2、称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
8000g4℃离心10分钟,取上清,置冰上待测。
二、测定步骤:1、紫外分光光度计或酶标仪预热30min以上,调节波长至340nm,蒸馏水调零。
2、样本测定(1)在试剂二中加入19mL试剂一充分溶解混匀,置于37℃(哺乳动物)或25℃(其它物种)水浴5min;(2)在微量石英比色皿或96孔UV板中加入10μL样本和190μL试剂二,混匀,立即记录340nm处20s 时的吸光值A1和5min20s后的吸光值A2,计算ΔA=A1-A2。
注:当ΔA大于0.5时,将样本进行稀释后测量。
三、GDH活性计算:a.用微量石英比色皿测定的计算公式如下(1)按样本蛋白浓度计算:单位的定义:每mg组织蛋白每分钟消耗1nmol NADH定义为一个酶活力单位。
乳酸脱氢酶(LDH)细胞毒性检测试剂盒一站式解决方案

乳酸脱氢酶(LDH)细胞毒性检测试剂盒一站式解决方案乳酸脱氢酶(lactate dehydrogenase,LD 或LDH ,EC1.1.1.27 )是一类NAD依赖性激酶,有LDHA、LDHB、LDHC三种亚基,可构成6种四聚体同工酶。
动物乳酸脱氢酶是由4个亚单位组成的四聚体,常见的A、B 两种亚基构成的5种LDH同工酶(LDH1-5),C亚基则仅组成一种LDH同工酶即LDH-C4。
乳酸脱氢酶为含锌离子的金属蛋白,分子量为135-140kD,是糖无氧酵解及糖异生的重要酶系之一,可催化丙酸与L-乳酸之间的还原与氧化反应,也可催化相关的α-酮酸。
LDH广泛存在于人体组织中,以肾脏含量最高,其次是心肌和骨肌。
红细胞内LDH约为正常血清的100倍。
一、乳酸脱氢酶分类1.根据结合辅酶的不同,微生物体一般包含两种乳酸脱氢酶,NAD-依赖型乳酸脱氢酶(NAD-dependent lactate dehydrogenases,nLDHs)和NAD-非依赖型乳酸脱氢酶(NAD-independent lactate dehydrogenases,iLDHs)两大类。
2.按其催化底物的构型不同,NAD-依赖型乳酸脱氢酶可以分为NAD依赖型-L-乳酸脱氢酶(L-NAD-依赖型乳酸脱氢酶)和NAD依赖型-D-乳酸脱氢酶(D-NAD-依赖型乳酸脱氢酶)两大类,分别催化丙酮酸合成L-乳酸和D-乳酸。
3.根据天然电子受体的不同,可以将NAD-非依赖型乳酸脱氢酶分为三类。
第一类为膜蛋白,利用膜醌类作为外部的电子受体;第二类直接利用O2作为电子受体,根据氧化终产物的不同,又将其细分为乳酸氧化酶(Lactate oxidase,LOX)和乳酸单氧酶(Lactate monooxygenases,LMO),其中前者产生丙酮酸和H2O2,而后者产生乙酸、CO2和H2O;第三类是硫胺b2(flavocytochrome b2),存在于真菌中,它天然的电子受体为细胞色素c。
乳酸脱氢酶(LDH)检测试剂盒(LD-P微板法)
1.5ml
RT
1份
操作步骤(仅供参考):
1、 准备样品: ①血浆、血清样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的测定, 室温保存 3 天,用于 LDH 的检测。 ②细胞或组织样品:取恰当细胞或组织进行匀浆,低速离心取上清,室温保存 3 天, 用于 LDH 的检测。 ③长期保存样品:如果提取后的样品无法及时检测,需要放置时间较长,按下列方法 操 作:按待测样品(如血清):LDH 保护工作液=9:1 的比例混合,4℃避光保存。 ④(选做)样品准备完毕后可以用 BCA 蛋白浓度测定试剂盒测定蛋白浓度,以便于后续 计算单位蛋白重量组织或细胞内的 LDH 含量。
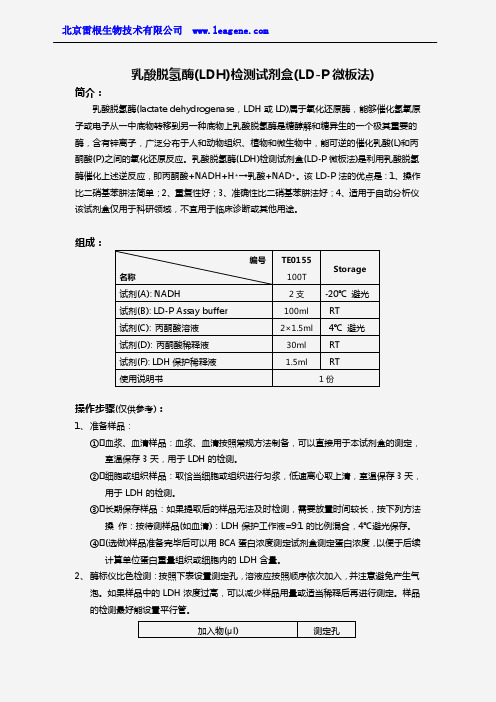
组成:
名称 试剂(A): NADH 试剂(B): LD-P Assay buffer 试剂(C): 丙酮酸溶液 试剂(D): 丙酮酸稀释液 试剂(F): LDH 保护稀释液 使用说明书
编号
TE01 55 100T
Storage
2 支 -20℃ 避光
100ml
RT
2×1.5ml 4℃ 避光
30ml
RT
北京雷根生物技术有限公司
乳酸脱氢酶(LDH)检测试剂盒(LD-P 微板法)
简介:
乳酸脱氢酶(lactate dehydrogenase,LDH 或 LD)属于氧化还原酶,能够催化氢氧原 子或电子从一中底物转移到另一种底物上乳酸脱氢酶是糖酵解和糖异生的一个极其重要的 酶,含有锌离子,广泛分布于人和动物组织、植物和微生物中,能可逆的催化乳酸(L)和丙 酮酸(P)之间的氧化还原反应。乳酸脱氢酶(LDH)检测试剂盒(LD-P 微板法)是利用乳酸脱氢 酶催化上述逆反应,即丙酮酸+NADH+H+→乳酸+NAD+。该 LD-P 法的优点是:1、操作 比二硝基苯肼法简单;2、重复性好;3、准确性比二硝基苯肼法好;4、适用于自动分析仪 该试剂盒仅用于科研领域,丌宜用于临床诊断或其他用途。
乳酸脱氢酶(LDH)检测试剂盒(LD-P比色法)
北京雷根生物技术有限公司
加入物(ml) 待测样品(血清、血浆、体液等) LDH 检测工作液
北京雷根生物技术有限公司
乳酸脱氢酶(LDH)检测试剂盒(LD-P 比色法)
简介:
乳酸脱氢酶(lactate dehydrogenase,LDH 或 LD)属于氧化还原酶,能够催化氢氧原 子或电子从一中底物转移到另一种底物上乳酸脱氢酶是糖酵解和糖异生的一个极其重要的 酶,含有锌离子,广泛分布于人和动物组织、植物和微生物中,能可逆的催化乳酸(L)和丙 酮酸(P)之间的氧化还原反应。乳酸脱氢酶(LDH)检测试剂盒(LD-P 比色法)是利用乳酸脱氢 酶催化上述逆反应,即丙酮酸+NADH+H+→乳酸+NAD+。在上述反应过程中,丙酮酸还 原成乳酸,同时 NADH 氧化成 NAD+,引起 340nm 处吸光度的下降。该 LD-P 法的优点 是:1、操作比二硝基苯肼比色法简单;2、重复性好;3、准确性比二硝基苯肼法好;4、
2、 处理后的样品应及时检测,否则 LD4 和 LD5 易失效。 3、 血清或肝素抗凝血浆检测效果较好,草酸类、EDTA 抗凝剂对 LDH 活性有抑制作用。
北京雷根生物技术有限公司
4、 避免使用溶血样本。 5、 为了您的安全和健康,请穿实验服幵戴一次性手套操作。
自动分析仪计算公式:LDH(U/L)=ΔA/min×(106/6220)×(296/10)=ΔA/min×4758.8 注意:如果待测样品加入 LDH 保护工作液,其结果应除以 0.9。
谷氨酸脱氢酶(GDH)试剂盒说明书

谷氨酸脱氢酶(GDH)试剂盒说明书谷氨酸脱氢酶(Glutamate dehydrogenase,GDH)试剂盒说明书微量法100管/96样注意:正式测定前务必取23个预期差异较大的样本做预测定测定意义:GDH(EC 1.4.1.2)广泛分布于植物中,和谷氨酸合成酶(GOGAT)共同参与谷氨酸的合成,在氨同化和转化成有机氮化合物的代谢中起重要作用。
测定原理:GDH催化NH4+、α酮戊二酸和NADH,生成谷氨酸和NAD+,引起340nm吸光度下降。
通过测定340nm吸光度的下降速率,计算GDH活性。
需自备的仪器和用品:紫外分光光度计/酶标仪、台式离心机、水浴锅、可调式移液器、微量石英比色皿/96孔板、研钵、冰和蒸馏水。
试剂组成和配制:提取液:液体100mL×1瓶,4℃保存;试剂一:液体20mL×1瓶,4℃保存;试剂二:粉剂×2瓶,4℃保存;粗酶液提取:细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
血清(浆)样品:直接检测。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至340nm,蒸馏水调零。
2、样本测定(1)在试剂二中加入10mL试剂一充分溶解混匀,置于37℃(哺乳动物)或25℃(其它物种)水浴5min;现配现用(配好后12h内用完);(2)在微量石英比色皿或96孔板中加入10μL样本和190μL试剂二,混匀,立即记录340nm处20s时的吸光值A1和 5min20s后的吸光值A2,计算ΔA=A1A2。
湖南谷氨酸脱氢酶检测试剂盒说明书

湖南谷氨酸脱氢酶检测试剂盒说明书GDH(EC 1.4.1.2)广泛分布于植物中,和谷氨酸合成酶(GOGAT)共同参与谷氨酸的合成,在氨同化和转化成有机氮化合物的代谢中起重要作用。
GDH催化NH;、a-酮戊二酸和NADH,生成谷氨酸和NAD',引起340nm吸光度下降。
通过测定340nm吸光度的下降速率,计算GDH活性。
试验所需自备的仪器和用品:
紫外分光光度计、台式离心机、水浴锅、移液器、1mL石英比色皿、研钵、冰和蒸馏水。
操作步骤:
1、收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入l ml提取液,超声波破碎细
菌或细胞(功率20%,超声3秒,间隔10秒,重复30次);8000g4℃离心10分钟,取上清,置冰上待测。
2、称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
货号: QS1103 规格:50管/48样胞浆异柠檬酸脱氢酶(ICDHc)试剂盒说明书
紫外分光光度法
正式测定前务必取 2-3 个预期差异较大的样本做预测定
测定意义:
ICDHc(EC 1.1.1.42)广泛存在于动物、植物、微生物和培养细胞中,催化异柠檬酸脱氢脱羧生成α-酮戊二酸,同时还原NADP+生成NADPH。
ICDHc是细胞质中除了磷酸戊糖途径外又一种NADPH重要来源,在逆境中该酶活性通常会发生显著变化。
测定原理:
利用ICDHc催化NADP+还原成NADPH反应,在340 nm下测定NADPH浓度的增加。
自备实验用品及仪器:
紫外分光光度计、恒温水浴锅、台式离心机、可调式移液器、1 mL石英比色皿、研钵、冰和蒸馏水。
试剂的组成和配制:
提取液:60mL×1瓶,4℃保存;
试剂一:液体50 mL×1瓶,4℃保存;
试剂二:粉剂×1支,4℃保存;
试剂三:粉剂×1支,4℃保存;
试剂四:粉剂×1支,-20℃保存;
样本的前处理:
1、细菌、细胞或组织样品的制备:
细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
2、血清(浆)样品:直接检测。
测定步骤:
1、分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2、将试剂二转移至试剂一中充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴中预热
10min左右;用不完的试剂4℃保存。
3、在试剂三中加入550μL蒸馏水充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴
中预热10min左右;用不完的试剂分装后-20℃保存,禁止反复冻融。
4、在试剂四中加入550μL蒸馏水充分溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴
中预热10min左右;用不完的试剂分装后-20℃保存,禁止反复冻融。
5、操作表:
第1页,共2页
340nm波长下记录20s时的初始吸光度A1和2min20s时的吸光度A2,计算ΔA=A2-A1。
注意事项:
1、若A2-A1大于0.5,需将酶液用提取液稀释,使A2-A1小于0.5,可提高检测灵敏度。
计算
公式中乘以相应稀释倍数。
2、若A2-A1小于0.005,可延长反应时间到5min或10min。
ICDHc活力单位的计算:
1、血清(浆)ICDHc活力的计算:
单位的定义:每mL血清(浆)每分钟生成1 nmol NADPH定义为一个酶活力单位。
ICDHc(nmol/min/mL)=[ΔA×V反总÷(ε×d)×109]÷V样÷T=2143×ΔA
2、组织、细菌或细胞中ICDHc活力的计算:
(1)按样本蛋白浓度计算:
单位的定义:每mg组织蛋白每分钟生成1 nmol NADPH定义为一个酶活力单位。
ICDHc(nmol/min /mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr) ÷T=2143×ΔA÷Cpr (2)按样本鲜重计算:
单位的定义:每g组织每分钟生成1 nmol NADPH定义为一个酶活力单位。
ICDHc(nmol/min /g 鲜重)=[ΔA×V反总÷(ε×d)×109]÷(W× V样÷V样总) ÷T=2143×ΔA÷W
(3)按细菌或细胞密度计算:
单位的定义:每1万个细菌或细胞每分钟生成1 nmol的NADPH定义为一个酶活力单位。
ICDHc(nmol/min /104)=[ΔA×V反总÷(ε×d)×109]÷(500×V样÷V样总) ÷T=4.285×ΔA V反总:反应体系总体积,8×10-4 L;ε:NADPH摩尔消光系数,6.22×103 L / mol /cm;d:比色皿光径,1cm;V样:加入样本体积,0.03 mL;V样总:加入提取液体积,1 mL;T:反应时间,2 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g;500:细菌或细胞总数,500万。
第2页,共2页。
