平衡与转化率
化学平衡转化率

化学平衡转化率
化学平衡转化率指的是在给定化学反应条件下,反应物转化为生成物的程度。
化学平衡是指反应物与生成物之间反应速度相等,即反应物转化为生成物的速率等于生成物转化为反应物的速率。
在化学平衡状态下,反应物和生成物的浓度保持不变。
化学平衡转化率的计算公式为:转化率= 已转化量/ 总量×100%
例如,对于反应式A + B ⇌ C + D,如果已知反应开始时A和B的摩尔数分别为2mol和3mol,反应达到化学平衡时A完全转化为C,B转化了2mol形成了C和D,求化学平衡转化率。
已转化量为2mol + 2mol = 4mol,总量为2mol + 3mol = 5mol,化学平衡转化率为4/5 ×100% = 80%。
化学平衡移动中反应物转化率的变化

化学平衡移动中反应物转化率的变化转化率指指定反应物起始浓度减去指定反应物平衡浓度之差除以指定反应物起始浓度再乘以百分之百。
转化率小于百分之百。
化学平衡移动中反应物又是怎样的?(下列所列情况只改变一个反应条件)
1.温度变化:若温度变化导致平衡正向移动,则反应物转化率增大;若温度变化导致平衡逆向移动,则反应物转化率降低。
2.压强变化:若压强变化导致平衡正向移动,则反应物转化率增大;若压强变化导致平衡逆向移动,则反应物转化率降低。
3.催化剂:不引起平衡移动,转化率不变。
4.浓度变化:
①多个反应物的反应,增加一种反应物浓度,平衡正向移动,其它反应物转化率提高,增加浓度的反应物转化率降低。
②只有一种反应物的反应,增加反应物浓度,平衡正向移动。
转化率变化要视具体反应而定。
如碘化氢分解生成碘蒸气反应,增加Hl浓度其转化率不变;二氧化氮生成四氧化二氮反应,增大NO2浓度其转化率增大;四氧化二氮生成二氧化氮反应,增大N2O4浓度其转化率降低。
③多个反应物的反应达平衡后按初始加入量成倍加入,则转化率随反应中气体物计量数而定。
化学平衡移动方向与反应物转化率的关系

化学平衡移动方向与反应物转化率的关系一、温度改变温度,若引起平衡向正反应方向移动,则反应物的转化率一定增大;反之,若引起平衡向逆反应方向移动,则反应物的转化率一定减小。
练习:二、压强改变压强,若引起平衡向正反应方向移动,则反应物的转化率一定增大;反之,若引起平衡向逆反应方向移动,则反应物的转化率一定减小。
练习:在一密闭容器中,反应mA(g)nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的2.2倍,则错误的为:()A.平衡向逆反应方向移动了B.物质A的转化率增加了C.物质C的质量分数增加了D. m<2n三、反应物的用量(一)、恒温恒压下1、若反应物只有一种,如aA(g)bB(g)+cC(g),增加A的量,平衡向正反应方向移动,此种情况等效于起始浓度相同,因此A的转化率也不变。
2、若反应物不只一种,如aA(g)+bB(g)cC(g)+dD(g)。
(1)若只增加A的量,情况较复杂,视具体题目而定,这里不讨论。
(2)若反应物A、B的物质的量同倍数的增加,平衡向正反应方向移动,此种情况等效于起始浓度相同,因此转化率不变。
(二)、恒温恒容下1、若反应物只有一种:A(g)B(g)+C(g),达到平衡后,恒温恒容下增加A的物质的量,平衡向正反应方向移动(实际过程),若考虑成由于浓度增大引起的压强增大,平衡向逆反应方向移动(总的结果),本过程是平衡向正反应方向移动,但总的结果是A的转化率减小(见下面的实例)。
即:增加A的量,A的浓度增大,平衡正向移动;考虑转化率时,此种情况等效于加压,A 的转化率与气态物质的化学计量数有关:例:在一固定容积(1 L)的密闭容器中充入2 mol A,发生可逆反应:A(g)B(g)+C(g),达到平衡后,A、B、C的物质的量均为1 mol,在恒温恒容下,再加入2 mol A,则平衡向哪个方向移动,与原平衡相比,A的转化率增大还是减小?解: A(g)B(g)+C(g)起始 2 0 0转化 1 1 1平衡 1 1 1A的转化率为×100%=50%,K=1达到平衡后,再加入2 mol A,由于A的浓度增大,平衡向正反应方向移动,设又转化了x mol。
化学平衡中的转化率判断技巧

化学平衡中的转化率判断技巧化学平衡是指化学反应在达到一定条件下,前后反应物和生成物的浓度保持不变的状态。
在进行化学平衡反应时,了解和判断反应的转化率是很重要的。
转化率是指反应物转化为产物的比例或百分比。
它可以用来评估反应的完全性和产率。
下面是一些判断和计算化学平衡中转化率的技巧。
1.理论转化率:理论转化率是在理想条件下由化学方程确定的转化率。
通过化学方程中反应物和生成物的摩尔比例可以确定理论转化率。
例如,对于反应A+B→C,如果反应实际转化了5摩尔A,但理论上只能转化10摩尔,那么实际转化率为5/10=0.5,即50%。
2.反应物和产物的浓度:通过测量反应物和产物的浓度可以确定实际转化率。
浓度可以用摩尔浓度或质量浓度表示。
根据化学方程的摩尔比例,可以计算出实际转化率。
例如,如果反应物A的初始浓度为1mol/L,最终浓度为0.8mol/L,而反应物B的初始浓度为2mol/L,最终浓度为1.6mol/L,那么实际转化率可以通过计算(0.2mol/L)/(1mol/L)和(0.4mol/L)/(2mol/L)得出,即0.2和0.2,转化率为1:13.去除摩尔数相同的物质:在一些反应中,生成物的摩尔数与反应物相同,这种情况下可以通过去除相同摩尔数的物质来判断转化率。
例如,如果反应A+B→B+C,反应过程中生成的B的摩尔数与初始的摩尔数相同,那么反应的转化率为1:14.化学平衡常数:化学平衡常数是用来描述化学反应在平衡状态下的转化率的指标。
通过测量反应物和产物的浓度,并用它们的比值来求解化学平衡常数。
化学平衡常数越大,表示反应向右移动的趋势越强,转化率越高。
5.使用比色法或分光光度法:对于有色物质或可以产生可检测光吸收的物质,可以使用比色法或分光光度法来测量其浓度,从而判断转化率。
通过对比初始浓度和最终浓度之间的差异,可以计算出实际转化率。
6.使用溶解度积常数:对于溶解度较小的盐类或不溶物的生成,可以使用溶解度积常数来判断反应的转化率。
平衡转化率问题总结(超完全详细版)

高中化学平衡转化率问题总结 平衡转化率=%100)()( 或物质的量的浓度质的量该反应物的起始起始物或物质的量浓度量某反应物转化的物质的 若要求某一时刻的转化率只要把平衡时的反应物浓度(或物质的量)改为某一时刻的反应物浓度(或物质的量)即可。
现将有关平衡转化率的问题小结如下:1. 对有多种反应物的可逆反应达到平衡后加其一。
这种情况不管状态如何均认为所加物本身转化率减小其它物质转化率增大例1:,反应达到平衡后增大的浓度,则平衡向正反应方向移动,的转化率增大,而的转化率降低。
逆向运用:例2.反应: 3A (g )+B (g ) 3C (g )+2D (g )达到平衡后加入C 求A 的转化率 分析:加入C 促使D 向A 、B 进一步转化故D 向A 、B 转化的转化率增大而A 、B 向C 、D 转化的转化率减小。
2. 对只有一种反应物的可逆反应达到平衡后再加。
由于反应只有一种所以无论往反应物加多少量都可视为等比例增加反应物的用量,故认为有两种情况:(1)恒温恒压:由于恒温恒压时等比例扩大或缩小反应物的用用量均与原平衡等效故转化率不变,各反应物和生成物的体积分数不变,各反应物和生成物物质量会跟原平衡相比,等比例增加,但浓度不变(2)恒温恒容:此时可以看成反应叠加后,增大压强使平衡向气体总系数小方向移动, 例3.,反应达到平衡后,再向密闭容器中加入,反应达到平衡时NO 2、N 2O 4的物质的量(或物质的量浓度)均增大,颜色变深,NO 2转化率增大。
分析:该反应可认为后加入NO 2与原反应进行叠加,叠加后气体总体积增加,为了使体积维持不变,只能向体系加压从而引起叠加后的平衡向生成N 2O 4的方向移动。
逆向运用:例4.,反应达到平衡后,再向密闭容器中加入N 2O 4,反应达到平衡时NO 2、N 2O 4的物质的量(或物质的量浓度)均增大,颜色变深,N 2O 4向NO 2转化的转化率减小。
分析:该反应可认为后加入NO 2与原反应进行叠加,叠加后气体总体积增加(此时,NO 2的量会比原来的多,)为了使体积维持不变,只能向体系加压从而引起叠加后的平衡向生成N 2O 4的方向移动。
【知识解析】化学平衡移动与平衡转化率的关系
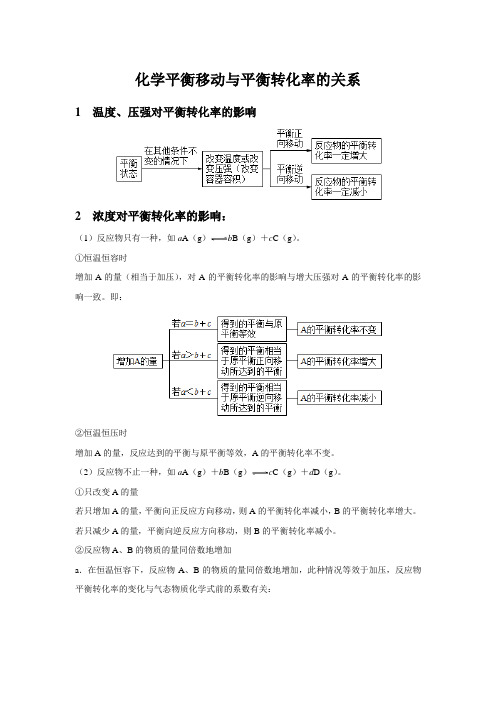
化学平衡移动与平衡转化率的关系1 温度、压强对平衡转化率的影响2 浓度对平衡转化率的影响:(1)反应物只有一种,如a A(g)b B(g)+c C(g)。
①恒温恒容时增加A的量(相当于加压),对A的平衡转化率的影响与增大压强对A的平衡转化率的影响一致。
即:②恒温恒压时增加A的量,反应达到的平衡与原平衡等效,A的平衡转化率不变。
(2)反应物不止一种,如a A(g)+b B(g)c C(g)+d D(g)。
①只改变A的量若只增加A的量,平衡向正反应方向移动,则A的平衡转化率减小,B的平衡转化率增大。
若只减少A的量,平衡向逆反应方向移动,则B的平衡转化率减小。
②反应物A、B的物质的量同倍数地增加a.在恒温恒容下,反应物A、B的物质的量同倍数地增加,此种情况等效于加压,反应物平衡转化率的变化与气态物质化学式前的系数有关:b.在恒温恒压下,反应物A、B的物质的量同倍数地增加,反应达到的平衡与原平衡等效,A、B的平衡转化率都不变。
典例详析例6-16(2021四川成都月考)α1和α2,c1和c2分别为两个恒容容器中平衡体系N2O4(g)2NO2(g)和3O2(g)2O3(g)的反应物转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的是()A.α1、α2均减小,c1、c2均增大B.α1、α2均增大,c1、c2均减小C.α1减小,α2增大,c1、c2均增大D.α1减小,α2增大,c1增大,c2减小解析◆恒温恒容条件下,均增加反应物的物质的量,相当于增大压强,对于N2O4(g)2NO2(g)而言,压强增大,平衡逆向移动,α1减小;对于3O2(g)2O3(g)而言,压强增大,平衡正向移动,α2增大。
因都直接加入了反应物,则反应物的平衡浓度c1、c2均增大。
答案◆C例6-17(2021江苏邗江中学月考)对于密闭容器中可逆反应A2(g)+3B2(g)2AB3(g),探究单一条件改变时,对平衡状态的影响,得到如图2-2-7所示的曲线(图中T表示温度,n表示物质的量),下列判断正确的是()图2-2-7A.加入催化剂可以使状态d变为状态bB.若T1>T2,则逆反应一定是放热反应C.达到平衡时A2的转化率大小为b>a>cD.达到平衡时AB3的物质的量大小为c>b>a解析◆催化剂只改变反应速率,不影响平衡移动,所以加入催化剂不可能使状态d变为状态b,A项错误;若T1>T2,由题图可知,温度升高,AB3的平衡体积分数减小,说明升高温度平衡向逆反应方向移动,则逆反应为吸热反应,B项错误;由题图可知,横轴表示B,的起始物质的量,增大一种反应物的量会使另一种反应物的平衡转化率增大,则n(B2)越大,达到平衡时A2的转化率越大,反应产物AB3的物质的量越大,即达到平衡时A2的转化率大小为c>b>a,平衡时AB3的物质的量大小为c>b>a,C项错误,D项正确。
平衡转化率阶段转化率

平衡转化率阶段转化率平衡转化率是指某一反应在达到平衡状态时,参与反应的原料或起始物转化为产物的比率。
这个转化率通常用百分数表示,反映了在平衡状态下反应进行的程度。
在化学工程、石油化工以及生物化工等领域中,"平衡转化率"和"阶段转化率"是描述反应过程中的两个重要概念:1. 平衡转化率(Equilibrium Conversion):在封闭系统中进行可逆反应时,当正向反应速率与逆向反应速率相等,达到动态平衡状态时的转化率称为平衡转化率。
这意味着反应物进一步转化为产物的能力被最大限度地利用,但并不意味着所有反应物都被转化,而是达到一个固定的转化程度,这个程度由反应的动力学性质和热力学条件共同决定。
2. 阶段转化率(Stage Conversion):在连续操作或多级反应器设计中,阶段转化率通常指的是在一个特定的操作单元(如一个反应器阶元)内,原料通过该阶段后所达到的转化程度。
这种转化率可以根据实际工艺条件进行调控,以优化整个生产流程的效率。
两者的关系在于,在一个多级反应体系中,每一级的阶段转化率都会影响到整体的反应效果和最终产品的收率。
通过合理设定各级的阶段转化率,可以更接近于理论上的平衡转化率,从而提高整个反应系统的经济效益。
在化学反应中,平衡转化率取决于多个因素,包括反应温度、压力、物质的浓度以及催化剂的存在等。
在一定条件下,平衡转化率是一个常数,可以通过实验测定。
平衡转化率的计算公式因反应类型的不同而有所区别。
对于可逆反应,平衡转化率可以用下式计算:平衡转化率= (已转化的反应物的量/ 反应物的总量)×100%其中,已转化的反应物的量指的是在平衡状态下已经转化为产物的反应物的量,反应物的总量则是起始时投入的反应物的总量。
对于不可逆反应,平衡转化率通常等于100%,因为所有的反应物都将转化为产物。
了解平衡转化率对于工业生产和科学实验具有重要意义。
通过优化反应条件和提高平衡转化率,可以提高产物的产量和纯度,降低能耗和原料浪费,提高经济效益。
平衡转化率的变化规律

平衡转化率的变化规律转化率这东西啊,就像一个调皮的小精灵,在化学平衡这个大舞台上蹦跶着,有时候往这边跑,有时候又往那边闪,可真让人捉摸不透呢!咱就说化学平衡吧,这就好比是一个跷跷板,两边坐的是反应物和生成物。
转化率呢,就是反应物变成生成物的那部分所占的比例。
这比例可不是一成不变的,就像天气一样,说变就变。
比如说,咱家里蒸馒头。
面粉、酵母、水这些就是反应物,蒸出来的馒头就是生成物。
刚开始的时候,面粉多酵母少,那面粉变成馒头的这个转化率就低呀。
为啥呢?因为酵母不够,忙不过来,好多面粉还在那闲着呢,就像一群人等着一个小工头安排工作,小工头能力有限,能安排干活的人就少,这转化率能高吗?再看看温度对平衡转化率的影响。
温度就像是这个蒸馒头的火候。
要是温度合适,酵母就特别活跃,面粉变成馒头的速度就快,转化率就高。
可要是温度太高或者太低呢?就像人在特别冷或者特别热的环境里干活,都不舒服,酵母也一样,它的活性就受影响,转化率也就跟着变了。
温度高了,可能酵母就被烫得没力气了,面粉转化成馒头的量就少了;温度低了,酵母就像被冻得哆哆嗦嗦的,干活也不利索,转化率自然就低。
压强也是个影响平衡转化率的因素。
这压强啊,就好比是给蒸馒头的锅加个盖子的松紧程度。
要是压强合适,就像盖子盖得刚刚好,馒头在锅里能舒舒服服地膨胀,反应物变成生成物就顺利,转化率就高。
要是压强太大,就像盖子盖得死死的,馒头在锅里都被挤得没地方长了,反应可能就受到抑制,转化率就低了;压强太小呢,就像盖子松松垮垮的,馒头还没发起来就跑气了,转化率也不行。
浓度也不能忽视啊。
反应物的浓度就像是投入蒸馒头工作的面粉和酵母的量。
如果反应物浓度大,就像面粉和酵母堆得满满的,那转化成馒头的潜力就大,转化率可能就高。
但是呢,这里面也有个度,要是太多了,锅都装不下了,也转化不过来,转化率就又下去了。
咱再从另一个角度看,平衡转化率还像一场拔河比赛。
反应物和生成物两边在较着劲呢。
如果改变了某个条件,就像一方队伍里突然来了几个大力士帮忙,那这个平衡就被打破了,转化率也就跟着改变。
