人教版高中化学选修五课件 芳香烃
合集下载
人教版选修五高中化学芳香烃PPT完整版
哪些现象说明发生了取代反应而不是加成反应? 导管口有白雾出现,锥形瓶中的溶液有浅黄色 沉淀生成。
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
苯与溴的反应实验思考
⒈试剂的加入顺序怎样?能否颠倒?各试剂在反
应中所起到的作用?
苯 液溴
Fe屑
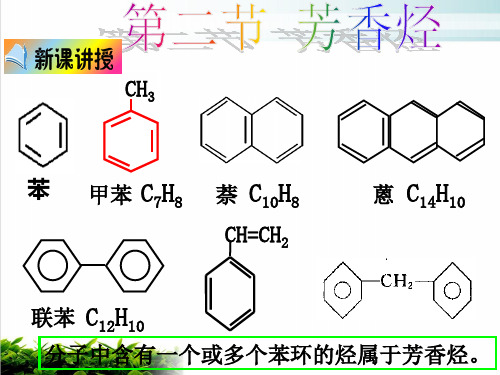
CH3
苯 甲苯 C7H8 萘 C10H8
CH=CH2
蒽 C14H10
联苯 C12H10
分子中含有一个或多个苯环的烃属于芳香烃。
一、苯(benzene)的结构与化学性质
⒈苯的分子结构 分子式: 最简式: 结构式:
苯的σ键模型
结构简式:
鲍林式
苯大π键模型 由于习惯,凯库勒式仍使用
结构特点 ⒈:苯分子是平面正六边形结构,所有原子均在同 一平面上;键角为120°,为平面形分子。 ⒉苯分子中所有碳碳键等同,是一种介于单键和 双键之间的独特的键。 ⒊苯分子中六个碳原子等效,六个氢原子等效。 ⒉苯的物理性质
⑴为防止溴的挥发,先加入苯后加入溴,然后加
入铁屑。
⑵溴应是液溴,而不是溴水。加入铁屑起催化作
用,实际上起催化作用的是FeBr3。 ⒉长玻璃导管的作用是什么?能否将导管口插入
液面以下?
⑴伸出烧瓶外的导管要有足够长度,其作用是导 气、冷凝回流。
⑵导管未端不可插入锥形瓶内水面以下,因为HBr
气体及易溶于水,以免发生倒吸。
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
⒋怎样设计实验证明苯与液溴发生了取代反应而 不是加成反应?用上图实验装置验证,可以吗?
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
苯与溴的反应实验思考
⒈试剂的加入顺序怎样?能否颠倒?各试剂在反
应中所起到的作用?
苯 液溴
Fe屑
CH3
苯 甲苯 C7H8 萘 C10H8
CH=CH2
蒽 C14H10
联苯 C12H10
分子中含有一个或多个苯环的烃属于芳香烃。
一、苯(benzene)的结构与化学性质
⒈苯的分子结构 分子式: 最简式: 结构式:
苯的σ键模型
结构简式:
鲍林式
苯大π键模型 由于习惯,凯库勒式仍使用
结构特点 ⒈:苯分子是平面正六边形结构,所有原子均在同 一平面上;键角为120°,为平面形分子。 ⒉苯分子中所有碳碳键等同,是一种介于单键和 双键之间的独特的键。 ⒊苯分子中六个碳原子等效,六个氢原子等效。 ⒉苯的物理性质
⑴为防止溴的挥发,先加入苯后加入溴,然后加
入铁屑。
⑵溴应是液溴,而不是溴水。加入铁屑起催化作
用,实际上起催化作用的是FeBr3。 ⒉长玻璃导管的作用是什么?能否将导管口插入
液面以下?
⑴伸出烧瓶外的导管要有足够长度,其作用是导 气、冷凝回流。
⑵导管未端不可插入锥形瓶内水面以下,因为HBr
气体及易溶于水,以免发生倒吸。
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
⒋怎样设计实验证明苯与液溴发生了取代反应而 不是加成反应?用上图实验装置验证,可以吗?
人教版选修五高中化学 2-2 芳香烃(共38张PPT)
人教版高中化学选修五课件2-2芳香烃

①
②
③ CH3 H3C
CH3④
CH3 C8H17
苯的同系物
CH CH2
⑤
芳香烃⑥
⑦
芳香CH化3 合物
O2N
NO2
⑧
⑨
⑩
NO2
卤代反应:苯环上氢原子被卤素原子取代
催化剂
Br2
Br HBr
溴苯
现象:未加入铁屑时无明显现象,加入铁屑后 混合液逐渐沸腾剧烈反应。
长导管口出现白雾
反应后,向锥形瓶内加入AgNO3,生成淡黄色沉淀 烧瓶内的液体倒入水中,有不溶于水的褐色油状液体
相对分子质量为128的烃?
1、用一种试剂可将三种无色液体CCl4、苯、甲苯鉴别出来 该试剂是() A.硫酸溶液B.水C.溴水D.KMnO4酸性
2、工业上将苯蒸气通过炽热的铁合成的一种传热载体的化合物,
其分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时
最多消耗6mol氢气,则该传热载体的化合物是()
火焰明亮,产生浓烈黑 烟;不能使酸性高锰酸 钾溶液褪色。
卤代 取反应
Br2 催化剂
Br HBr
溴苯为无色、比水重、不溶于水
的液体,溶有少量溴而显褐色。
液溴, FeBr3做催化剂
代
反 应
HO NO2 浓H2SO4
NO2 H 2O
水浴加热55℃~60℃
硝化 硝基苯为无色,难溶于水,比水 浓硫酸:催化剂、吸水剂
无明显变化 结论:
苯环对甲基(侧链) 无明显变化 产生影响,使侧链
褪色
易被氧化。
R KMnO4(H )
O C — OH
氧化反应: 苯的同系物能使酸性高锰酸钾褪色。
人教版化学选修5芳香烃PPT(28页)

提示:先写出反应方程式,思考需要哪些物质? 如何混合反应物? 在什么装置中反应?需要加热吗? 如何加热?如何处理反应产物?
4、甲苯和苯在性质上有哪些异同?请说明产生 这些差异的原因。
提示:对相关反应进行比较
一 、苯的分子结构
H
分子式: C6H6
C
结构式:
HC CH
结构简式:
HC CH C
H
苯分子结构特点: (1) 碳碳键:介于 C-C 和 C=C 之间的独特的键
❖溶解性: 不溶于水, 易溶于有机溶剂
❖挥发性: 易挥发
❖熔沸点: 熔点5.5℃,沸点80.1 ℃
问题:往溴水中加适量的苯,振荡,有何现象?
——分层,上层显橙色,下层显无色
人教版化学选修5芳香烃PPT(28页)
(二)苯的化学性质 人教版化学选修5芳香烃PPT(28页)
(1) 氧化反应——燃烧 2C6H6 + 15O2 点燃
最多有四个 原子在同一 平面上
所有原子在 所有原子在 同一平面上 同一平面上
人教版化学选修5芳香烃PPT(28页)
人教版化学选修5芳香烃PPT(28页)
二、苯的性质
(一)苯的物理性质
❖颜 色: 无色透明 ❖气 味: 特殊气味 ❖状 态: 液体
工业上制取苯
煤焦油分离提纯 石化产品催化重整
❖密 度: 比水小
(5)本实验制得的硝基苯常显黄色,为什么?如何提纯 硝基苯? 由于反应温度控制不当,硝酸分解产生的NO2溶在 其中;将粗产品依次用蒸馏水和NaOH溶液洗涤,再分液。
4、苯的同系物的性质
(I)物理性质:与苯相似: 均为难溶于水、密度小于水的 有特殊气味的液体(或固体)
(II)化学性质: 探究实验:把苯和甲苯各2mL分别注入2支
4、甲苯和苯在性质上有哪些异同?请说明产生 这些差异的原因。
提示:对相关反应进行比较
一 、苯的分子结构
H
分子式: C6H6
C
结构式:
HC CH
结构简式:
HC CH C
H
苯分子结构特点: (1) 碳碳键:介于 C-C 和 C=C 之间的独特的键
❖溶解性: 不溶于水, 易溶于有机溶剂
❖挥发性: 易挥发
❖熔沸点: 熔点5.5℃,沸点80.1 ℃
问题:往溴水中加适量的苯,振荡,有何现象?
——分层,上层显橙色,下层显无色
人教版化学选修5芳香烃PPT(28页)
(二)苯的化学性质 人教版化学选修5芳香烃PPT(28页)
(1) 氧化反应——燃烧 2C6H6 + 15O2 点燃
最多有四个 原子在同一 平面上
所有原子在 所有原子在 同一平面上 同一平面上
人教版化学选修5芳香烃PPT(28页)
人教版化学选修5芳香烃PPT(28页)
二、苯的性质
(一)苯的物理性质
❖颜 色: 无色透明 ❖气 味: 特殊气味 ❖状 态: 液体
工业上制取苯
煤焦油分离提纯 石化产品催化重整
❖密 度: 比水小
(5)本实验制得的硝基苯常显黄色,为什么?如何提纯 硝基苯? 由于反应温度控制不当,硝酸分解产生的NO2溶在 其中;将粗产品依次用蒸馏水和NaOH溶液洗涤,再分液。
4、苯的同系物的性质
(I)物理性质:与苯相似: 均为难溶于水、密度小于水的 有特殊气味的液体(或固体)
(II)化学性质: 探究实验:把苯和甲苯各2mL分别注入2支
《芳香烃》人教版高中选修五化学PPT精品课件

一、苯的结构与化学性质
思考交流:
a.试剂混合顺序?
a.浓硝酸-浓硫酸-苯
b.浓硫酸的作用?
b.催化剂吸水剂
c.如何控制温度?
c.水浴加热、
d.长导管的作用?
e.实验现象
d.使挥发的苯和浓硝酸冷凝回流
e.上层黄色液体、下层淡黄色油状液体,能闻到苦杏仁气味
f.纯净的硝基苯是无色油状液体,
初级产品溶液为何为淡黄色? g.如何分离提纯?
CH3 CH−CH3 CH3
CH3
CH3 C−CH3
CH3
二、苯的同系物
(2)取代反应(可与卤素、硝酸、硫酸等反应)
b.侧链对苯环的影响
使苯环上与甲基邻、对位上的氢原子变得活泼而易被取代
CH3
CH3
+ 3HNO3
浓H2SO4 △
O2N−
−NO2
+ 3H2O
NO2 2,4,6-三硝基甲苯
TNT
药。
淡黄色晶体,不溶于水。是一种烈性炸
一、苯的结构与化学性质
2、苯的物理性质 • 观察总结 • 颜色、气味、状态、毒性、溶解性、密度、熔沸点 • 无色、特殊气味、油状液体、有毒、不溶于水易溶于有机溶剂、密度小
于水、熔点5.5℃、沸点80.1℃
一、苯的结构与化学性质
3. 苯的化学性质 难氧化、易取代、能加成
(1)氧化反应
a. 燃烧: 火焰明亮且伴有浓黑烟
二、芳香烃的来源及其应用
作业布置
1.完成教材P40习题1、2、3、4 2、完成补充作业 3、预习第三节卤代烃
人教版高中选修五化学课件
讲解人: 时间:
感谢各位的聆听
第2章 烃和卤代烃
b. 平面正六边形结构,所有原子在同一平面内,键角120°
高中化学 2.2芳香烃课件 新人教版选修5

练习:写出苯与氯气发生取代反应、苯 与溴发生加成反应的化学方程式。
二、苯的同系物 通式:CnH2n-6(n≥6)
1、苯环上的氢原子被烷基取代的产物
如:
CH3
C2H5
R
2、化学性质: 由于苯基和烷基的相互影响,使其
性质发生了一定的变化——更活泼
a、能被酸性KMnO4溶液氧化;
R
KMnO4 H+
COOH
应用:区别苯和苯的同系物
b、取代反应(比苯更容易) 黄色针
如:甲苯的硝化反应 NO2
状晶体
C+H33HNO3(浓)浓3H0℃2SO4 P.39学与问
NO2
NO2+ 3H2O CH3
芳香烃
三、芳香烃的来源及其应用 产量低
1、来源:a、煤的干馏
3.5kg/T
b、石油的催化重整
2、应用:简单的芳香烃是基本的有
请根据有关信息设计实验室制取溴苯、硝基苯 的简单实验装置图?
信息: ①溴、苯、浓硝酸均具有强挥发性
②制溴苯的反应为剧烈的放热反应
③溴苯、硝基苯的沸点较高
3)苯的加成反应 (与H2、Cl2)
+ 3H2 Ni
(环己烷)
Cl H
H Cl
+ 3Cl2 催化剂 Cl
H
H
Cl
总结:难加成 易取代
Cl
H
H Cl
机化工原料。
稠环芳香烃(P.39 资料卡片) 萘
蒽
苯环间共用两个或两个以上碳原子形成
的一类芳香烃 苯并芘 菲
问题:对比分析甲烷、乙烯、乙炔、苯,完成下表
甲烷
乙烯
乙炔
苯
结构简式
结构特点
人教版高二化学选修五教学课件_2.2_芳香烃(共33张ppt)

C原子sp2杂化
②碳碳之间的键是介于单键与双键之间的独特的 键(大∏键) 苯的结构比较稳定
一分耕耘一分收获
练习1:
1、哪些事实可证明苯分子中不存在单双键交替 的结构?
①苯的邻位二元取代物只有一种 ②苯不能使溴水发生化学反应而褪色 ③苯不能使酸性高锰酸钾溶液褪色 ④经测定,苯环上碳碳键的键长相等,都是 1.40×10-10m ⑤经测定,苯环中碳碳键的键能均相等
菲
苯并芘
一分耕耘一分收获
【练习】
已知分子式为C12H12的物质A结构简式为
CH3
CH3
则A环上的一溴代物有 ( B )
A、2种 B、3种 C、4种
D、6种
一分耕耘一分收获
【归纳】
饱和链烃 烷烃
链烃
烯烃
不饱和链烃
(脂肪烃)
二烯烃
烃
炔烃
环烃
脂环烃 环烷烃等
苯的同系物
芳香烃
稠环芳烃 其它芳烃
一分耕耘一分收获
不饱和度=4
一分耕耘一分收获
3、简单的苯的同系物的命名 CH3 甲苯
CH3
CH2CH3 乙苯
CH3
CH3 邻二甲苯
CH3
CH3
CH3 对二甲苯 间二甲苯
CH3
CH2CH3
对甲乙苯
一分耕耘一分收获
4、苯的同系物的物理性质
甲苯、二甲苯、乙苯等在通常状况下,无色液体;有特殊 气味;密度小于水;不溶于水,易溶于有机溶剂。本身也 可以作溶剂。
苯的特殊性质
溴代反应 硝化反应 磺化反应
饱和烃 取代反应
不饱和烃 加成反应
与H2 与Cl2
一分耕耘一分收获
二、苯的同系物
1.定义: 苯环上的氢原子被烷基取代的产物,
高中化学选修5人教版:2.2芳香烃 ppt

学习目标定位 1.认识苯的分子结构和化学性质,学会溴苯、硝 基苯的实验室制取。 2.知道苯的同系物的结构与性质的关系,知道芳 香烃的来源及其应用。
第二节 属于芳香烃
最简单的芳香烃是
一、苯(benzene)的结构与化学性质
•【苯的分子结构】 (1) 分子式:C6H6 (2) 结构式
(3) 结构简式
12原子( 6个C,6个H )共平面
(4)苯分子为平面正六边形结构,键角为120°。 (5)苯分子中碳碳键键长完全相等,是介于碳碳单 键和碳碳双键之间的特殊的化学键。
【苯的空间构型】
苯分子球棍模型 苯分子比例模型
证明苯分子中不存在单双键交替的结构
1.正六边形分子,六个碳碳键长相同。
2.化学性质
(1)氧化反应 ①可燃 ②可使酸性高锰酸钾溶液褪色(侧链氧化)
通过这个反应,可以说明: 苯环对侧链影响:苯环活化侧链,使侧链易于氧化。
下列物质能否使酸性高锰酸钾溶液褪色?
CH2CHCH3 CH3
CH2CH2 C H3
?
CH3
CH3
H3C C CH3
H3C C CH2CH3
(2)取代反应
4.不能使酸性高锰酸钾溶液褪色。
当堂练习
下列物质中所有原子都有可能在同一平面上的是 BC
2、苯的物理性质
• (1) 无色、有特殊气味的液体。 • (2) 密度比水小(0.88g/ml),不溶于水,易溶于有机
溶剂。(常用做有机溶剂) • (3) 熔点为5.5℃,沸点为80.1℃。熔沸点低,易挥发
,用冷水冷却,苯凝结成无色晶体 • (4) 苯有毒。
3、苯的化学性质
1)苯的氧化反应:在空气中燃烧
2C6H6+15O2
第二节 属于芳香烃
最简单的芳香烃是
一、苯(benzene)的结构与化学性质
•【苯的分子结构】 (1) 分子式:C6H6 (2) 结构式
(3) 结构简式
12原子( 6个C,6个H )共平面
(4)苯分子为平面正六边形结构,键角为120°。 (5)苯分子中碳碳键键长完全相等,是介于碳碳单 键和碳碳双键之间的特殊的化学键。
【苯的空间构型】
苯分子球棍模型 苯分子比例模型
证明苯分子中不存在单双键交替的结构
1.正六边形分子,六个碳碳键长相同。
2.化学性质
(1)氧化反应 ①可燃 ②可使酸性高锰酸钾溶液褪色(侧链氧化)
通过这个反应,可以说明: 苯环对侧链影响:苯环活化侧链,使侧链易于氧化。
下列物质能否使酸性高锰酸钾溶液褪色?
CH2CHCH3 CH3
CH2CH2 C H3
?
CH3
CH3
H3C C CH3
H3C C CH2CH3
(2)取代反应
4.不能使酸性高锰酸钾溶液褪色。
当堂练习
下列物质中所有原子都有可能在同一平面上的是 BC
2、苯的物理性质
• (1) 无色、有特殊气味的液体。 • (2) 密度比水小(0.88g/ml),不溶于水,易溶于有机
溶剂。(常用做有机溶剂) • (3) 熔点为5.5℃,沸点为80.1℃。熔沸点低,易挥发
,用冷水冷却,苯凝结成无色晶体 • (4) 苯有毒。
3、苯的化学性质
1)苯的氧化反应:在空气中燃烧
2C6H6+15O2
人教版高中化学选修五2.2芳香烃PPT课件

1)苯的氧化反应:在空气中燃烧 2C6H6+15O2 点燃 12CO2+ 6H2O 但不能使酸性高锰酸钾溶液褪色
产生 浓烟
2)苯的加成反应 (与H2、Cl2)
+ 3H2
Ni △
+ 3Cl2
环己烷
H Cl H Cl
催化剂 Cl
H
△
H
Cl
Cl H
H Cl
3)苯的取代反应(卤代、硝化)
+ Br2 FeBr3
2)取代反应(可与卤素、硝酸等反应)
CH3
CH3
浓硫酸O2N
NO2
+ 3HNO3 △
—CH3对苯环的影响
+ 3H2O
NO2
使取代反应更易进行 淡黄色针状晶体,不溶于水。
不稳定,易爆炸
3)加成反应
CH3
CH3
+ 3H2
催化剂 △
三、芳香烃的来源及其应用
1、来源:a、煤的干馏 b、石油的催化重整
2、应用:简单的芳香烃是基本的有机 化工原料。
H
C
HC
CH
HC
CH
C
(1)苯分子是平面六边 形的稳定结构;
(2)苯分子中碳碳键是
H
2)结构简式
介于碳碳单键与碳碳双 键之间的一种特殊的键。
(3)苯分子中六个碳原子
等效,六个氢原子等效。
3、苯的化学性质
在通常情况下比较稳定,在一定条件下能 产生氧化、加成、取代等反应。
1.苯的化学性质和烷烃、烯烃、炔烃有何异 同点?为什么? 2. 分别写出苯与氧气反应,与氢气加成,与溴 和硝酸产生取代的化学方程式.
Br + HBr
