高中化学化学反应原理专题二 化学平衡的移动课件苏教版 选修四.ppt
合集下载
苏教版化学选修4《化学平衡的移动》课件

技能要求
学生需要掌握判断化学平衡移动方向的方法,包括通过改变温度 、浓度、压强等条件来判断平衡移动的方向。此外,学生还需要 具备实验设计和数据分析能力,以便通过实验验证理论预测结果 。
教学方法与手段
教学方法
本课程采用讲授、讨论、实验等多种教学方法相结合的方式。通过教师的讲解和引导,学生积极参与讨论和实验, 加深对化学平衡移动原理和应用的理解。
教材分析与课程目标
02
01
03
课程目标:通过本课程的学习,学生应该能够 理解化学平衡移动的原理和影响因素; 掌握判断化学平衡移动方向的方法;
教材分析与课程目标
01
了解化学平衡移动在实际应用中 的意义;
02
培养分析和解决化学问题的能力 。
知识点与技能要求
知识点
本课程涉及的主要知识点包括化学平衡常数、沉淀溶解平衡、电 离平衡、水解平衡以及影响化学平衡移动的因素等。
THANK YOU
感谢聆听
应用
利用勒夏特列原理可以解释和预 测许多化学现象,如沉淀的生成 与溶解、气体的吸收与释放、酸 碱中和反应等。
沉淀溶解平衡的移动
沉淀溶解平衡
在一定条件下,难溶电解质的 溶解速率等于其沉淀速率,形 成动态平衡。
移动因素
改变温度、浓度、压强等条件 ,可使沉淀溶解平衡发生移动 。
应用
通过控制条件,可实现难溶电 解质的分离与提纯。
溶度积常数($K_{sp}$)的意义
可用来判断难溶电解质在给定条件下的溶解能力大小,溶度积常数越大,溶解能 力越强。同时,溶度积常数也是难溶电解质溶解度大小的一个衡量标准。
03
影响化学平衡的因素
温度对化学平衡的影响
温度升高,平衡向吸热反应方向移动
学生需要掌握判断化学平衡移动方向的方法,包括通过改变温度 、浓度、压强等条件来判断平衡移动的方向。此外,学生还需要 具备实验设计和数据分析能力,以便通过实验验证理论预测结果 。
教学方法与手段
教学方法
本课程采用讲授、讨论、实验等多种教学方法相结合的方式。通过教师的讲解和引导,学生积极参与讨论和实验, 加深对化学平衡移动原理和应用的理解。
教材分析与课程目标
02
01
03
课程目标:通过本课程的学习,学生应该能够 理解化学平衡移动的原理和影响因素; 掌握判断化学平衡移动方向的方法;
教材分析与课程目标
01
了解化学平衡移动在实际应用中 的意义;
02
培养分析和解决化学问题的能力 。
知识点与技能要求
知识点
本课程涉及的主要知识点包括化学平衡常数、沉淀溶解平衡、电 离平衡、水解平衡以及影响化学平衡移动的因素等。
THANK YOU
感谢聆听
应用
利用勒夏特列原理可以解释和预 测许多化学现象,如沉淀的生成 与溶解、气体的吸收与释放、酸 碱中和反应等。
沉淀溶解平衡的移动
沉淀溶解平衡
在一定条件下,难溶电解质的 溶解速率等于其沉淀速率,形 成动态平衡。
移动因素
改变温度、浓度、压强等条件 ,可使沉淀溶解平衡发生移动 。
应用
通过控制条件,可实现难溶电 解质的分离与提纯。
溶度积常数($K_{sp}$)的意义
可用来判断难溶电解质在给定条件下的溶解能力大小,溶度积常数越大,溶解能 力越强。同时,溶度积常数也是难溶电解质溶解度大小的一个衡量标准。
03
影响化学平衡的因素
温度对化学平衡的影响
温度升高,平衡向吸热反应方向移动
苏教化学选修 化学反应原理专题2 第三单元 化学平衡的移动(共26张PPT)

一、浓度对化学平衡的影响
[探究汇报1]
实验1
加NaOH
实验现象
实验结论
溶液从橙色 平衡向正反应方向移动 向黄色转变
实验2
加HNO3
溶液从黄色 平衡向逆反应方向移动 向橙色转变
结论1:其它条件不变的情况下
①增大反应物浓度或减小生成物浓度 平衡向正反应方向移动
②增大生成物浓度或减小反应物浓度
平衡向逆反应方向移动
不移动
不移动
浓度
温度
化学平衡移动
压强
催化剂
【问题解决】
假如说你是一个合成氨工厂的技术人员,如何利用 所学化学知识来提高工厂的经济效益?
N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ·mol-1
基本要求:1.反应要快 2.原料利用率要高 3.单位时间内氨产量要高
N2(g)+3H2(g)
改变影响化学平衡的一个因素,平衡将向 能够减弱这种改变的方向移动。
思考:根据勒夏特列原理总结出压强的变化对
化学平衡如何影响
可逆反应
改变压强对平衡的影响 增大压强 减小压强
N2(g)+ 3H2(g) ⇌ 2NH3(g)
N2O4
2NO2
正向移动 逆向移动 逆向移动 正向移动
FeO(s)+CO(g)⇌Fe(s)+CO2(g)
正向移动
结论2:其它条件不变的情况下 ①温度升高, 化学平衡向吸热方向移动; ②温度降低, 化学平衡向放热方向移动。
练习与实践
3.关节炎是因为在关节滑液中形成了尿酸钠晶体,尤 其是在寒冷季节易诱发关节疼痛,其化学机理如下:
①HUr+H2O 尿酸
Ur-+H3O+ 尿酸根离子
优秀课件苏教版高中化学选修四 2.3化学平衡的移动课件 (共40张PPT)

浓度引起平衡移动的相关图象
V
V ( 逆) V( 正 )
V(正)= V(逆) V(正)=V(逆)
V
V( 正 )
V(正) = V(逆)
V(正)
V(逆) V(正)
V( 逆 )
V(正)=V(逆)
V( 逆 )
0
t1
t2
t3
t
0
t1
t2 t3
t
①增大生成物浓度
②减小反应物浓度
V逆>V正 平衡逆反应方向移动
练习1:
在密闭容器中进行如下反应: CO2(g)+C(s)
高温
2CO(g)
Δ H>0,达到平衡后,若
改变下列条件,则指定物质的浓度及平衡如何变化。
不变 。 (1)增加C,平衡_________ 不移动 ,c(CO2)______
(2)保持反应容器的容积不变,升高温度,
增大 。 向右移动 ,c(CO)________ 则平衡__________
实验1:向试管中加入4mL 0.1mol/LK2Cr2O7溶液,再 加数滴1mol/LNaOH溶液 实验2:将上述溶液分成两 份向其中一份中滴加1mol/L HNO3,和另一份做对比
一、浓度对平衡的影响
已知铬酸根和重铬酸根离子间存在如下平衡: Cr2O72-+H2O 2CrO42-+2H+ 橙色 黄色 铬 酸 钾 溶 液
(3)保持反应容器的容积和温度不变,通入N2,
不移动 则平衡________,c(CO 不变 。 2)_________
练习2: 在一恒容的密闭容器中发生可逆反应: C(s) + H2O(g) CO(g) + H2(g)已达到平衡 状态。现欲使平衡向正反应方向移动,且 增大V(正),可进行的操作是(C ) A.再加入一些C B.移走一部分CO或H2 C.充入一些水蒸气 D.充入一些CO或H2,
V
V ( 逆) V( 正 )
V(正)= V(逆) V(正)=V(逆)
V
V( 正 )
V(正) = V(逆)
V(正)
V(逆) V(正)
V( 逆 )
V(正)=V(逆)
V( 逆 )
0
t1
t2
t3
t
0
t1
t2 t3
t
①增大生成物浓度
②减小反应物浓度
V逆>V正 平衡逆反应方向移动
练习1:
在密闭容器中进行如下反应: CO2(g)+C(s)
高温
2CO(g)
Δ H>0,达到平衡后,若
改变下列条件,则指定物质的浓度及平衡如何变化。
不变 。 (1)增加C,平衡_________ 不移动 ,c(CO2)______
(2)保持反应容器的容积不变,升高温度,
增大 。 向右移动 ,c(CO)________ 则平衡__________
实验1:向试管中加入4mL 0.1mol/LK2Cr2O7溶液,再 加数滴1mol/LNaOH溶液 实验2:将上述溶液分成两 份向其中一份中滴加1mol/L HNO3,和另一份做对比
一、浓度对平衡的影响
已知铬酸根和重铬酸根离子间存在如下平衡: Cr2O72-+H2O 2CrO42-+2H+ 橙色 黄色 铬 酸 钾 溶 液
(3)保持反应容器的容积和温度不变,通入N2,
不移动 则平衡________,c(CO 不变 。 2)_________
练习2: 在一恒容的密闭容器中发生可逆反应: C(s) + H2O(g) CO(g) + H2(g)已达到平衡 状态。现欲使平衡向正反应方向移动,且 增大V(正),可进行的操作是(C ) A.再加入一些C B.移走一部分CO或H2 C.充入一些水蒸气 D.充入一些CO或H2,
苏教化学选修 化学反应原理专题2 第三单元 化学平衡的移动(共16张PPT)
式 增大压强 减小压强
N2(g)+ 3H2(g) ⇌ 2NH3(g)
正向移动 K c2(NH3) c(N2 ) c3 (H2 )
N2O4
2NO2
K c2 (NO2 ) 逆向移动 c(N2O4 )
FeO(s)+CO(g)⇌Fe(s)+CO2(g) K c(CO2 ) 不移动
c(CO)
逆向移动 正向移动 不移动
逆
V’
正
1、浓度变化对化学平衡的影响 t
结论:其它条件不变的情况下
① 增大反应物浓度--或--减小生成物浓度, 平衡向正反应方向( 正向 / 向右 )移动
②增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动
练习
1、在定温定容的容器中发生 N2+3H2
2NH3,
当反应达到平衡后,下列措施将会对化学平衡产生
增大的幅度大,’ (正)
新平衡
V(正) 原平衡
V’
(逆)
V(逆)
v
V(正)
V’ 新平衡
(逆)
V’ (正)
原平衡
V(逆)
0 若
t 正反应吸热△H ﹥0 ,如上图
0
若 正反应放热△H ﹤0,如上t 图
原因分析:
降低温度
( 给所有反应物和生成物降低了能量 )
2、温度降低时,正逆反应速率均( 减 小 ),
但 对放热方向的反应不利影响小,,故平衡向 放热反应方向移动
Ѵ(放)减小的幅度小,则 Ѵ(放) ﹥ Ѵ(吸)
v
v
V(正)
原平衡
V(逆)
V’ (逆)新平衡
V’
(正)
0 正反应吸热 △H ﹥0 t
时,如上图
N2(g)+ 3H2(g) ⇌ 2NH3(g)
正向移动 K c2(NH3) c(N2 ) c3 (H2 )
N2O4
2NO2
K c2 (NO2 ) 逆向移动 c(N2O4 )
FeO(s)+CO(g)⇌Fe(s)+CO2(g) K c(CO2 ) 不移动
c(CO)
逆向移动 正向移动 不移动
逆
V’
正
1、浓度变化对化学平衡的影响 t
结论:其它条件不变的情况下
① 增大反应物浓度--或--减小生成物浓度, 平衡向正反应方向( 正向 / 向右 )移动
②增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动
练习
1、在定温定容的容器中发生 N2+3H2
2NH3,
当反应达到平衡后,下列措施将会对化学平衡产生
增大的幅度大,’ (正)
新平衡
V(正) 原平衡
V’
(逆)
V(逆)
v
V(正)
V’ 新平衡
(逆)
V’ (正)
原平衡
V(逆)
0 若
t 正反应吸热△H ﹥0 ,如上图
0
若 正反应放热△H ﹤0,如上t 图
原因分析:
降低温度
( 给所有反应物和生成物降低了能量 )
2、温度降低时,正逆反应速率均( 减 小 ),
但 对放热方向的反应不利影响小,,故平衡向 放热反应方向移动
Ѵ(放)减小的幅度小,则 Ѵ(放) ﹥ Ѵ(吸)
v
v
V(正)
原平衡
V(逆)
V’ (逆)新平衡
V’
(正)
0 正反应吸热 △H ﹥0 t
时,如上图
化学:2.3《化学平衡的移动》课件(4)(苏教版选修4)

3、迅速拉动活塞,观察现象
思考二 1、改变压强对化学反应速率有 什么影响?
2、增大压强,该反应向哪个方 向移动?减小压强呢?
结论
2、压强的变化对化学平衡的影响
结论:其它条件不变的情况下 ①增大压强,会使平衡向着气体体积缩小的反 应方向移动;
②减少压强,会使平衡向着气体体积增大的反 应方向移动
实验四
3、温度对化学平衡的影响
结论:其它条件不变的情况下
温度升高,会使化学平衡向着吸热反应的方向移动;
温度降低,会使化学平衡向着放热反应的方向移动。
4、催化剂对化学平衡的影响
① 正催化剂能同等程度的加快正、逆反应速率,V′正=
V′逆,平衡不移动。
② 使用催化剂能缩短反应达到平衡的时间
小结
(1)当反应物的浓度增大时,平衡正向移动, 反应物的浓度逐渐 减弱 ;
红色 用空白滴管将上述溶液分置于井穴板的三个井穴中, 其中一个井穴进行对比
步骤:
(1)向1号井穴中滴加4滴FeCl3溶液,观察颜色变化;
(2)向2号井穴中滴加4滴KSCN溶液,观察颜色变化;
(3)向1、2号井穴中各加入5滴0.01mol/LNaOH溶液液, 观察现象。
思考一:
A组: 1、2试管中加入H2SO4的目的是什么?改变了什么条件? 2、3试管中加入NaOH的目的是什么?改变了什么条件?
(2)当压强增大时,平衡向着气体体积减小的 方向移动,体系压强 减小 ;
(3)当温度升高时,平衡向着吸热反应方向移 动,体系温度降低 降低 。
化学平衡移动原理(勒夏特列原理)
改变影响化学平
衡的一个因素,平衡
将向能够减弱这种改 变的方向移动。
练习:
1、对已经达到化学平衡的下列反应2X(g) +Y(g) 2Z(g),减小压强时,对反应产生的影响的是( C )
思考二 1、改变压强对化学反应速率有 什么影响?
2、增大压强,该反应向哪个方 向移动?减小压强呢?
结论
2、压强的变化对化学平衡的影响
结论:其它条件不变的情况下 ①增大压强,会使平衡向着气体体积缩小的反 应方向移动;
②减少压强,会使平衡向着气体体积增大的反 应方向移动
实验四
3、温度对化学平衡的影响
结论:其它条件不变的情况下
温度升高,会使化学平衡向着吸热反应的方向移动;
温度降低,会使化学平衡向着放热反应的方向移动。
4、催化剂对化学平衡的影响
① 正催化剂能同等程度的加快正、逆反应速率,V′正=
V′逆,平衡不移动。
② 使用催化剂能缩短反应达到平衡的时间
小结
(1)当反应物的浓度增大时,平衡正向移动, 反应物的浓度逐渐 减弱 ;
红色 用空白滴管将上述溶液分置于井穴板的三个井穴中, 其中一个井穴进行对比
步骤:
(1)向1号井穴中滴加4滴FeCl3溶液,观察颜色变化;
(2)向2号井穴中滴加4滴KSCN溶液,观察颜色变化;
(3)向1、2号井穴中各加入5滴0.01mol/LNaOH溶液液, 观察现象。
思考一:
A组: 1、2试管中加入H2SO4的目的是什么?改变了什么条件? 2、3试管中加入NaOH的目的是什么?改变了什么条件?
(2)当压强增大时,平衡向着气体体积减小的 方向移动,体系压强 减小 ;
(3)当温度升高时,平衡向着吸热反应方向移 动,体系温度降低 降低 。
化学平衡移动原理(勒夏特列原理)
改变影响化学平
衡的一个因素,平衡
将向能够减弱这种改 变的方向移动。
练习:
1、对已经达到化学平衡的下列反应2X(g) +Y(g) 2Z(g),减小压强时,对反应产生的影响的是( C )
选修4 化学平衡移动 ppt课件

ppt课件
11
1对等体反应,压强改变对化学平衡移动无影响
△
例: I2 + H2
2HI
增大体系的压强,平衡不移动,
但浓度增大,颜色加深,速率加快!
V(molL-1S-1)
2.充入”惰性气体”
V’正= V’逆 V正= V逆
a 恒温恒压 当成”减压”
b 恒温恒容 速率不变,平衡不 移动
0
t2
ppt课件
T(s)
适用范围:已达到平衡的体系
适用对象:动态平衡
减弱的含义:定性的看,平衡移动的方向是减弱外界
条件变化的方向;
定量的看,平衡移动的结果只是减弱了外界条件的变化,
而不能完全抵消外界条件的变化量。
ppt课件
5
二、影响化学平衡移动的条件
1、浓度的变化对化学平衡的影响
Cr2O72-+H2O 橙色
2CrO42-+2H+ 黄色
ppt课件
18
思考:
N2 (g)+ 3H2(g) 2NH3(g)△H=-92.4KJ/mol
根据化学平衡移动原理,工业上要提高合成氨的 产率可采取哪些有效的措施?
ppt课件
19
N2 (g)+ 3H2(g) 2NH3(g)△H=-92.4KJ/mol
400℃,不同压强下N2和H2反应生成NH3达到化学平衡状
12
课堂练习
1、在密闭容器中进行下列反应
CO2(g)+C(s)
2CO(g) △H﹥0
达到平衡后,改变下列条件,则指定物质的浓度及 平衡如何变化:
(2)减小密闭容器体积,保持温度不变,则平 衡 逆向移动 ; c(CO2) 增大 。
(3)通入衡N不2,移保动持密; c闭(C容O2器) 体积不和变温度不。变,则平
苏教化学选修 化学反应原理专题2 第三单元 化学平衡的移动
增大压强,则 a﹥1
若 m+n﹥p+q ,则K’ ﹤ K ,平衡正向移动。 若 m+n﹤p+q ,则K’ ﹥ K ,平衡逆向移动。 若 m+n=p+q ,则K’ =K ,平衡不发生移动。
压
aA(g)+bB(g)
cC(g)
强
对
化
学 平
a+b>c
衡
的
影
响
a+b<c
aA(g)+bB(g)
cC(g)
压
强
化学平衡移动原理 及应用
1.化学平衡移动的概念
当改变已经达到化学平衡的可逆反应的条 件时,平衡状态被破坏,随反应的进行重新达到 新平衡的过程.
2.移动原理
勒夏持列原理:如果改变影响平衡的一个 条件(如浓度、压强和温度等),平衡就向着 能够减弱这种改变的方向移动。
注意: ①影响平衡的因素:浓度、压强、温度三种; ②原理适用范围:只适用于一项条件发生变化 的情况(即温度或压强或一种物质的浓度),当 多项条件同时发生变化时,情况比较复杂; ③平衡移动的结果:只能减弱(不可能抵消) 外界条件的变化。 ④平衡移动:是一个“平衡状态→不平衡状态 →新的平衡状态”的过程。一定条件下的平衡 体系,条件改变后,可能发生平衡移动。
非平衡状态时有浓度商
当Q = K时,达平衡 当Q < K时,正向移动 当Q > K时,逆向移动
欲破坏化学平衡状态,必须使Q ≠ K,
【例】现有反应:CO(g)+H2O(g) CO2(g)+H2(g);
△H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 小于 1
(填“大于”“小于”或“等于”)。
苏教版高中化学选修四课件2.3化学平衡的移动
向正反应方向移动
C.保持其他条件不变,若反应开始时A、B、C的浓度分 别为0.4mo1·L-1、0.5mo1·L-1和0.2mo1·L-1,则达到 平衡后,C的浓度大于0.4mo1·L-1 D.保持其他条件不变,升高温度,正、逆反应速率均增
大,且A的转化率降低
【解析】选B。由Ⅰ图可知发生反应:
A(g)+3B(g)2C(g),压强增大,平衡向正反应方向移
答案:减小
(2)A、B
(3)低温、高压700K,1×107Pa~1×108Pa (4)-33.42℃氨N2和H2提高N2和H2的利用率 (5)加入过量的N2(或及时从平衡混合物中移走NH3)
A组 (30分钟50分) 一、选择题(本题包括4小题,每小题6分,共24分ห้องสมุดไป่ตู้ 1.对于合成氨工业,只从提高合成氨反应速率的方面来
看,从下列条件中选择最适宜的组合是()
①高温②低温③低压 ④高压⑤催化剂⑥加氨⑦除氨 A.②④⑤⑦B.②③④⑦ C.①④⑤⑦D.②③⑤⑥
【解析】选C。本题考查的是从反应速率的角度分析合
成氨的适宜条件,首先高温高压催化剂均可以加快合成 氨的反应速率,关键是加氨还是除氨对反应速率如何影 响,可以从合成氨的速率方程式来进行分析,由速率方 程v=kc(N2)c1.5(H2)c-1(NH3)可知,速率与氨的浓度的
响,还采取了一些措施。请写出其中的一个措施:___
______________________________________________。
【解析】(1)由方程式N2(g)+3H2(g)2NH3(g)不难写出: 此反应Δ H<0,说明正反应为放热反应,升高温度平衡 向吸热方向移动,即向左移动,c(NH3)减小,c(N2)和 c(H2)增大,故K减小。
高二化学苏教版选修4课件:2.3 化学平衡的移动
2.对于有气体参加的化学反应,增大压强(或减小压强),v(正)和v(逆)都增加(或都 减小)。对于反应前后气体分子数有变化的可逆反应,增大压强(或减小压强),v(正) 和v(逆)增大(或减小)的程度不一样,因此平衡会发生移动。但对于反应前后气体 分子数相等的可逆反应,增大压强(或减小压强),v(正)和v(逆)增大(或减小)的程度 一样,因此平衡不移动。
目标导航 预习导引 一 二
自主预习 合作探究
预习交流1 外界条件如何影响化学平衡移动的方向? 提示:外界条件的改变对化学平衡的影响实质上是通过改变正、逆反应速率来 实现的。 ①若外界条件改变,引起v(正)>v(逆)时,正反应占优势,化学平衡向正反应方向移 动。 ②若外界条件改变,引起v(正)<v(逆)时,逆反应占优势,化学平衡向逆反应方向移 动。 ③若外界条件改变,引起v(正)、v(逆)都发生变化,但v(正)、v(逆)仍保持相等,化 学平衡就没有发生移动。
自主预习 合作探究
目标导航 预习导引 一 二
(2)压强:通过改变容器体积的方法增大压强,反应物的浓度和生成物的浓度同 时增大。分析体系压强的改变对物质浓度的影响,我们会发现:对于可逆反应aA(g)
bB(g)来说,当a>b,即正反应方向是气体分子数目减小的反应,增大压强, 平衡正向移动;当a=b,即反应前后气体分子数目不变的反应,改变反应体系的压强, 平衡不发生移动;当a<b,即正反应方向是气体分子数目增大的反应,增大压强,平衡 逆向移动。
目标导航 预习导引 一 二
自主预习 合作探究
预习交流2 外界条件对v(正)与v(逆)有何影响? 提示:增大浓度、增大压强、升高温度、加入正催化剂,都能使v(正)与v(逆)增 大;减小浓度、减小压强、降低温度、加入负催化剂,都能使v(正)与v(逆)减小。
目标导航 预习导引 一 二
自主预习 合作探究
预习交流1 外界条件如何影响化学平衡移动的方向? 提示:外界条件的改变对化学平衡的影响实质上是通过改变正、逆反应速率来 实现的。 ①若外界条件改变,引起v(正)>v(逆)时,正反应占优势,化学平衡向正反应方向移 动。 ②若外界条件改变,引起v(正)<v(逆)时,逆反应占优势,化学平衡向逆反应方向移 动。 ③若外界条件改变,引起v(正)、v(逆)都发生变化,但v(正)、v(逆)仍保持相等,化 学平衡就没有发生移动。
自主预习 合作探究
目标导航 预习导引 一 二
(2)压强:通过改变容器体积的方法增大压强,反应物的浓度和生成物的浓度同 时增大。分析体系压强的改变对物质浓度的影响,我们会发现:对于可逆反应aA(g)
bB(g)来说,当a>b,即正反应方向是气体分子数目减小的反应,增大压强, 平衡正向移动;当a=b,即反应前后气体分子数目不变的反应,改变反应体系的压强, 平衡不发生移动;当a<b,即正反应方向是气体分子数目增大的反应,增大压强,平衡 逆向移动。
目标导航 预习导引 一 二
自主预习 合作探究
预习交流2 外界条件对v(正)与v(逆)有何影响? 提示:增大浓度、增大压强、升高温度、加入正催化剂,都能使v(正)与v(逆)增 大;减小浓度、减小压强、降低温度、加入负催化剂,都能使v(正)与v(逆)减小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
v
V ’吸
V ’放
升高温度 t 平衡向吸热方向移动
V’吸=V’放
v
V’ 放
V’放=V’吸
t1
降低温度
V’ 吸
平衡放热方向移动
t
2、压强对化学平衡的影响
实验探究 2NO2(气) N2O4(气) (1体积,无色)
(2体积,红棕色)
浓加压混和气体颜色先深后浅;
B.减压混和气体颜色先浅后深。
【小结】
化学平衡的移动,是由于外界条件的 改变而引起V正≠ V逆
V’正=V’逆 t
减小反应物浓度
V’逆>V’正
平衡逆向移动
1、浓度的变化对化学平衡的影响
结论:其它条件不变的情况下
①增大反应物浓度或减小生成物浓度平衡向正方向移动
②增大生成物浓度或减小反应物浓度,平衡向逆方向移动
应用:
在工业生产中适当增大廉价的反应物的浓 度,使化学平衡向正反应方向移动,可以 提高价格较高原料的转化率,以降低生产 成本 2SO2(g) + O2(g) SO3(g)的平衡体系中, 为了提高SO2的利用率,可采用什么措施?
第三单元
第三单元 【复习】化学平衡状态的定义:(化学反应的限度)
一定条件下,可逆反应里,正反应速率和逆反应速率 相等,反应混合物中各组分的浓度保持不变的状态。
v V正 0 V逆 V正=V逆
t
条件改变,使V正≠ V逆原平衡被破坏,可见,化学平衡 只有在一定的条件下才能保持。当外界条件改变,旧的化 学平衡将被破坏,并建立起新的平衡状态。
化学平衡的移动
增加反应物的浓度, v,正 > v,逆, 原因分析: 平衡向正反应方向移动; 速率-时间关系图:
增 大 反 应 物 浓 度
v(molL-1.S-1)
V
, 正
v”正 = v”逆 v正 平衡状态Ⅱ v正 = v逆 V ’逆 平衡状态Ⅰ v逆
0
t1
t2
t3
t(s)
v V正 V逆
V ’逆
V ’正
3.平衡移动的本质原因:
【思考】 如何通过改变条件来打破旧平衡?
可通过改变影响反应速率的条件来打破原有平衡, 建立新平衡。
【回忆】影响化学反应速率的外界条件主要有哪些?
浓度
温度
催化 剂
化学反应速率
压 强
二、影响化学平衡移动的条件 1、浓度的变化对化学平衡的影响
已知铬酸根和重铬酸根离子间存在如下平衡: 2CrO42-+2H+ 黄色 Cr2O72-+H2O 橙色
CoCl42- △H>0
蓝色 平衡移动的方向
溶液变蓝 溶液变粉红色
平衡向正反应 方向移动 平衡向逆反应 方向移动
温度如何影响化学平衡呢?
2NO2(气) N2O4(气) △H=-56.9kJ/mol
温度升高平衡向逆反应方向移动 温度降低平衡向正反应方向移动
Co2++4Cl-
粉红色
CoCl42- △H>0
催化剂
2、温度对化学平衡的影响
2NO2(气)
(红棕色) 步骤
N2O4(气) △H=-56.9kJ/mol
(无色) 气体颜色 平衡移动的方向 平衡向逆反应 方向移动 平衡向正反应 方向移动
热水
溶液变深
热水
常温
冷水
溶液变浅
3、温度变化对化学平衡的影响
Co2++4Cl-
粉红色 步骤 热水 冷水 溶液的颜色
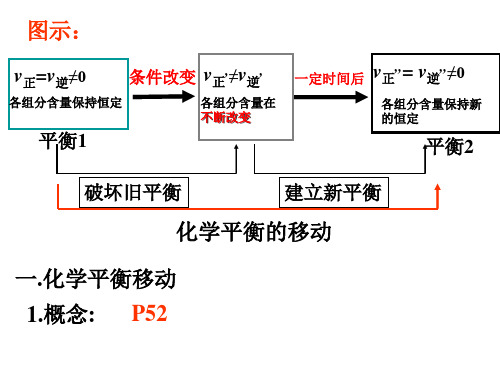
化学平衡不移动
v正,=v逆,
各组分含量不 改变
条件改变
v正=v逆≠0
各组分含量保持恒定
v正,≠v逆,
各组分含量在 不断改变
,,= v ,,≠0 v 逆 一定时间 正
各组分含量保持新 恒定
平衡1 破坏旧平衡
平衡2 建立新平衡
化学平衡的移动
一.化学平衡移动
1.概念: 改变外界条件,破坏原有化学平 衡状态,建立新的化学平衡状态的 过程叫做化学平衡的移动。 2.研究对象: 已建立平衡状态的体系 v, 正 ≠ v, 逆
实验现象
实验1
溶液由黄色 向橙色转变 溶液由橙色 向黄色转变
实验结论
增大反应物浓度, 可使化学平衡向 正反应方向移动 减小反应物浓度, 可使化学平衡向 逆反应方向移动
实验2
C
FeCl3或KSCN
c-t图
FeCl3或KSCN
Fe(SCN)3
Fe(SCN)3
0
t1
旧平衡 状态
t2
t3
新化学平 衡状态
t
蓝色
温度升高平衡向正反应方向移动 温度降低平衡向逆反应方向移动
共 同 特 点 ?
温度对化学平衡的影响
规律:
在其它条件不变的情况下:
温度升高,会使化学平衡向着吸热反应的方向移动;
温度降低,会使化学平衡向着放热反应的方向移动。 1、温度升高时,正逆反应速率均(增大 ), 但 Ѵ(吸)> Ѵ(放,故平衡向 ) 吸热反应 方向移动; 2、温度降低时,正逆反应速率均(减小 ), 但 Ѵ(吸)< Ѵ(放) ,故平衡向 放热反应 方向移动;
