高一化学卤族元素2
高一化学《元素周期表》
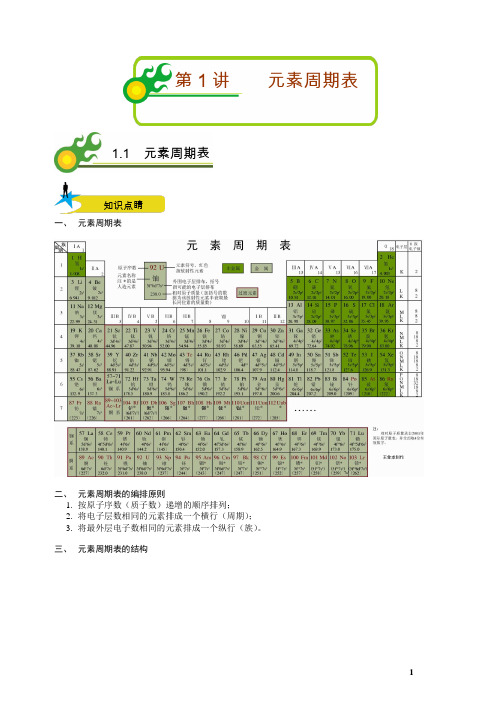
第1讲元素周期表1.1 元素周期表知识点睛一、元素周期表二、元素周期表的编排原则1.按原子序数(质子数)递增的顺序排列;2.将电子层数相同的元素排成一个横行(周期);3.将最外层电子数相同的元素排成一个纵行(族)。
三、元素周期表的结构⎧⎧⎧⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎪⎪⎪⎪⎪⎨⎪⎨⎪⎪⎪⎪⎪⎩⎩⎧⎪⎪⎨⎪⎪⎩⎩:2:8:8:18:18:32::IA ~VIIA 7:IIIB ~VIIB IB ~IIB 7VIII VIIB IB 第一周期种元素短周期第二周期种元素第三周期种元素周期第四周期种元素第五周期种元素长周期第六周期种元素第七周期未填满(又称不完全周期)主族共个主族副族、共个副族族第族:三个纵行,位于第族和第族之间零族:稀有气体⎪⎪⎪⎪⎪⎪⎪ 【总结】1.周期表中的相等关系 周期序数=电子层数主族族序数=最外层电子数=价电子数=最高正价数元素的原子序数=核电荷数=质子数=原子的核外电子数 2.元素周期表(记忆口诀):3.周期和族的表示方法(1)周期用大写数字直接表示即可,如:第四周期。
(2)主族:用罗马数字加A 表示,如:第IIA 族; 副族:用罗马数字加B 表示,如:第IVB 族。
4.由原子序数确定元素位置的规律记住每周期的元素的种数(2、8、8、18、18、32)以及稀有气体元素的原子序数(He 2、Ne 10、Ar 18、Kr 36、Xe 54、Rn 86),便于确定元素在元素周期表中的位置。
具体如下:①若比相应的稀有气体元素的原子序数多1或2,则应处在下周期的第IA 族或第IIA 族,如88号元素88862-=,则应在第七周期第IIA 族。
②若比相应的稀有气体元素少1~5时,则应处在同周期的第VIIA ~IIIA 族,如:84号元素84862-=-,则应在第六周期第VIA 族。
③若预测新元素,可与未发现的第七周期的稀有气体元素(118号元素)相比较,去推知它的位置; 如:114号元素1141184-=-,应在第七周期第IV A 族。
高一化学必修2《元素周期表》知识点总结

高一化学必修2《元素周期表》知识点总结知识回顾:1、原子的结构:●原子是由原子核和电子组成;原子核由质子和中子组成●原子的质量集中在原子核上,电子的质量很小,几乎可以忽略不计●一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电,所以原子对外显中性2、元素的定义:具有相同核电荷数(质子数)的一类原子的总称一、元素周期表的结构1、原子序数原子序数=核电荷数=质子数=核外电子数2、周期●按原子序数递增的顺序,把电子层数相同的元素自左向右排成横行,每行叫做一个周期。
●元素周期表共有七个周期,从上到下依次命名为第一周期、第二周期等从上到下行数名称元素种数原子的电子层数同周期内元素原子序数变化规律常用名又名1 第一周期短周期2 1 从左到右依次增大2 第二周期8 23 第三周期8 34 第四周期长周期18 45 第五周期18 56 第六周期32 67 第七周期73、族●按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,每一个纵行称为一个族.共18行●元素周期表共有十八个纵行,除8、9、10三个纵行叫第Ⅷ族外,其余每个纵行各为一个族,它们又被划分为十六个族。
●族分为主族和副族,主族用罗马数字加“A”表示,如ⅠA族;副族用罗马数字加”B”来表示,如ⅡB。
0族和Ⅷ族则不加“A”或“B”注意:① 1,2行对应为ⅠA,ⅡA;13---17行对应为ⅢA---ⅦA② 3---7行对应为ⅢB ---ⅦB;11,12行对应为ⅠB,ⅡB。
③ 8,9,10对应为Ⅷ④ 18行对应0族二、元素的性质与原子结构1、碱金属元素知识回顾:Na的物理性质和化学性质●从上到下原子的电子层数在增加,原子半径逐渐增大,所以失电子的能力逐渐增强●从上到下金属性逐渐增强(金属性包括●碱金属元素的化学性质R+2H2O====2ROH+H24Li+O2====2Li2O4Na+O2====2Na2O(缓慢氧化)Na+O2==△===Na2O22、卤族元素●从上到下电子层数依次增加,原子半径依次增加,所以得电子的能力也依次减弱,即非金属性依次减弱(非金属性包括●单质溴是唯一在常温常压下呈液态的非金属单质●卤素的化学性质X-+Ag+======AgX↓(AgCl为白色沉淀,AgBr为淡黄色沉淀,AgI为黄色沉淀)X2+H2O=====HX+HXOF2+H2O=====HF+O2Fe+Cl2=====2FeCl3Fe+I2=====FeI2三、核素1、质量数将原子核内所有质子和中子的相对质量取近似整数值相加,所得到的数值叫质量数质量数(A)=质子数(Z)+中子数(N)2、核素具有一定数目质子和一定数目中子的一种原子叫做核素3、同位素●质子数相同而中子数不同的同一元素的不同原子互为同位素●当某种元素具有两种或两种以上天然、稳定的同位素时,无论是在单质还是在化合物里,任意一种同位素在该元素内所占的原子数目百分比都不变4、同素异形体指同种元素形成的不同单质,它们之间互称为同素异性体。
高一化学碱金属、卤族元素知识归纳

A是,B是,C是,D是。
写出有关的化学方程式(属离子反应的写出离子方程式):
; ;
; ;
;。
解析:根据A、B、C的焰色均为紫色,可知它们为钾的化合物,气体D能使澄清石灰水变浑浊,但不能使品红溶液褪色,则D是 ,B是 ,A为 ,C为 。
:
:
:
:
:
2.碱金属与水(酸)反应的计算:
[例2]质量均为 的 三种金属,分别投入到各盛有相同物质的量浓度相同体积的硫酸溶液中,充分反应后放出氢气的质量是()
异:随原子序数递增(从上到下)电子层数依次增多。
原子半径依次增大。(同周期中为最小)
2.元素性质
同 异
3.单质性质:
同:均具氧化性,易获得1个电子
异:(1) 、 (气态)、 (液态)、 (固态)
(2) (淡黄绿)、 (黄绿)、 (深红棕)、 (紫黑)
(3)密度增大,熔沸点升高,在水中溶解性减小,单质易溶于有机溶剂。
3.碳酸钠与盐酸反应:
[例3]向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再产生 气体为止,则此过程中,溶液中的碳酸氢根离子浓度变化趋势可能是:(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大。你的选择是(填正确选项的标号)。
试用化学方程式和简要文字表述其理由。
解析:因 浓溶液中 离子浓度较大,滴入盐酸后, 与 先结合生成 离子,故先是 离子越来越多。当 离子全部变为 离子后,继续滴加盐酸,则 与 又结合生成 , 分解为 和 ,使 离子又逐渐减少。故答案为(C)。理由是:首先 ,
高一化学《卤素》PPT课件

元素符号 O H Cl Na Mg S Ca K Br 元素总量/t 元素总量/t 3.35× 3.35×1015 0.4× 0.4×1015 7.2× 7.2×1013 4.0× 4.0×1013 0.5× 0.5×1013 0.3× 0.3×1013 0.2× 0.2×1013 0.1× 0.1×1013 2.5× 2.5×1011 元素符号 F P I Fe Sn Cu Ni Al Mn 元素总量/t 元素总量/t 0.5× 0.5×1010 2.7× 2.7×108 2.3× 2.3×108 0.4× 0.4×108 1.1× 1.1×107 1.1× 1.1×107 0.8× 0.8×107 0.8× 0.8×107 0.8× 0.8×107
巩固反思: 巩固反思:
3,痕迹是公安机关提取犯罪嫌疑人指纹的一种重要的方法, ,痕迹是公安机关提取犯罪嫌疑人指纹的一种重要的方法, AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白 显现法就是其中的一种:人的手上有汗渍, 纸后,手指纹线就留在纸上.如果将溶液①小心地涂到纸上, 纸后,手指纹线就留在纸上.如果将溶液①小心地涂到纸上, 溶液①中的溶质就跟汗渍中的物质②作用,生成物质③ 溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质 在光照下,分解出的银粒呈灰褐色,随着反应的进行, ③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒 逐渐增多,由棕色变成黑色的指纹线.用下列化学式表示这3 逐渐增多,由棕色变成黑色的指纹线.用下列化学式表示这3 种物质都正确的是( 种物质都正确的是( ) A,①AgNO3 ②NaBr , B,①AgNO3 ② NaCl , C,① AgCl , D,①AgNO3 ②NaI , ③AgBr ③ AgCl
高一化学-卤族元素典型例题 最新

卤族元素典型例题【例1】怎样除去下列物质中的杂质(括号内的物质为杂质),只要求写出需要加入的试剂名称和主要操作的名称(如过滤、分液、蒸馏、萃取、结晶等)。
(1)液溴中的少量氯(Cl2)。
(2)食盐中的少量碘(I2)。
(3)氧气中的极少量氢气和氯气(H2、Cl2)。
(4)烧瓶内有制氯气后的褐色污迹(MnO2)。
分析:(1)Cl2+2NaBr===2NaCl+Br2,既除去了Cl2又得到了少量Br2,但若加热蒸去氯,溴也将一起气化。
(2)碘易升华,食盐则不能。
但若用加水溶解,过滤后再蒸发的方法,由于碘微溶于水,所以不能除尽。
(3)先用NaOH溶液除去Cl2,再通过热的CuO除去H2,最后用浓硫酸干燥。
(4)MnO2能与浓盐酸在加热条件下作用,生成Cl2、H2O和易溶于水的MnCl2。
答案:(1)加少量NaBr溶液振荡后静置,液体分层,分液。
(2)加热使碘升华。
(3)先用NaOH溶液洗气除去Cl2,经灼热的CuO除去氢气,再通过浓硫酸洗气干燥。
(4)加入浓盐酸,加热,冷却,用蒸馏水洗净。
【例2】除去氯化氢中的少量氯气,应选用的试剂是[ ]。
A.蒸馏水B.KI的浓盐酸溶液C.KI水溶液D.饱和食盐水分析:此题要求除Cl2,但不能损失HCl。
A、C、D选项中给出的物质都含有大量水而使HCl溶解,且Cl2在饱和食盐水中溶解度更小,不能除去Cl2。
B选项中的KI浓盐酸溶液,KI和Cl2反应除去Cl2:2KI+Cl2===2KCl+I2,而HCl在浓盐酸中溶解量极少或不能溶解。
答案:B【例3】KF、KCl、KBr、KI都是白色晶体,如何用化学方法加以鉴别?分析:这是一类物质的鉴别题。
应按下列五点叙述:(1)实验步骤;(2)实验操作;(3)观察的现象;(4)结论;(5)有关化学方程式。
鉴别的方法有多种,原则上以步骤简单、现象明显为好。
对液体或固体物质应各取少许,不能一次用完,否则给下一步鉴别带来困难;气体不需取样,可直接鉴别。
高一化学卤素

象对市爱好阳光实验学校高一化学卤素【同步信息】一. 本周教学内容:卤素二. 教学目标:1. 卤素结构的相似点和递变性。
2. 卤素单质的物理性质。
3. 卤素单质的化学性质及递变性。
4. 卤化银和含碘化合物的主要性质。
5. 了解可逆反的含义。
三. 教学、难点::卤素性质变化规律。
难点:可逆反的涵义。
四. 知识分析:〔一〕卤素原子结构及性质推测:相同点⎪⎩⎪⎨⎧-+1)(717,负价为除外最高正价均为具有较强的氧化性个电子达到稳定结构,容易得个最外层电子都为F不同点:F Cl Br I−−−−→−核电荷数增大 −−−−→−电子层数增多 −−−−→−原子半径增大−−−−→−得电子能力减弱−−−−→−单质氧化性减弱 −−−−−→−阴离子还原性增强〔二〕卤素单质的物理性质:状态〔熔沸点〕气 气 液 固 熔沸点升高颜色 浅黄绿色 黄绿色 深红棕色 紫黑色 颜色加深 密度 密度增大水中溶解度 反 溶解 溶解 微溶 在水中溶解度减小说明:1. 卤素单质在不同溶剂的颜色:2. 液溴的保存:由于液溴极易挥发,具有强腐蚀性,因而室通常将液溴装入磨砂玻璃塞的试剂瓶,并参加一量水。
3. 碘的升华:固态物质不经液态而直接变成气态的现象。
四. 卤素单质的化学性质:1. 卤素都能与金属反生成金属卤化物。
说明:〔1〕这些反均是卤素单质得电子,表现氧化性。
〔2〕2I 的氧化性最弱,只能将Fe 氧化为2+价。
〔3〕自然界里,也存在着许多的金属跟卤素的化合物,如氟化钙、氯化钠、氯化镁、溴化钾、碘化钾卤化物。
2. 卤素都能跟氢气起反生成卤化氢。
HFF H 222=+冷暗处,爆炸HBr Br H 222∆+C ︒500较慢进行可逆反:在同一条件下,既能向正反方向进行,同时又能向逆反方向进行的反。
注意:〔1〕2F 、2Cl 、2Br 、2I 都能与2H 反生成卤化氢。
〔2〕2F 、2Cl 、2Br 、2I 与2H 反条件越来越严格,剧烈程度越来越差。
高一化学元素周期表2
2、卤族元素——F Cl Br I (VIIA族) 单质均为双原子分子——X2 (1)卤素单质都是有色物质,从上到下, 其颜色逐渐加深,密度逐渐增大,熔、沸 点逐渐升高(常温时的状态由气态经液态 到固态)。 (2)卤素原子最外层上都是7个电子,易 得到1个电子(表现为-1价)使最外层达 到8个电子的稳定结构,因此,卤族元素都 具有较强的非金属性,其单质都较活泼, 具有较强的氧化性,能与多种金属和非金 属发生化学反应。
第一章 物质结构 元素周期律
第一节 ( 2)
学习目标:
1、通过探究元素的性质与原子结构,进 一步理解元素周期表。 2、熟悉元素在周期表中的位置及原子结 构与性质的关系。 3、培养学生的实践能力和归纳能力。
重点和难点:
元素在周期表中的位置和原子结构与性 质的关系及同主族元素性质的递变规律。
复习提问:
1、元素周期 表中有几个周期?各周期分 别有几种元素?
2、元素周期 表中有几个族?分别位于哪 几个纵行? 3、元素周期 表中哪一族的元素种类最多? 4、一种元素在元素周期 表中的位置由哪 几个因素决定?
二、元素的性质与原子结构 1、碱金属元素——Li Na K Rb Cs Fr
科学探究小结:
A、最外电子层上都是1个电子,但从上 到下电子层数依次递增。 B、钠、钾性质相似,都是很活泼的金属, 但钾比钠更活泼。
②从上到下,由于电子层数递增,原 子半径逐渐增大,原子核对最因此,碱金属元素的金属性逐 渐增强,单质的还原性逐渐增强,氢氧 化物的碱性逐渐增强。 (2)碱金属物理性质的相似性和递变性 ①碱金属都是银白色金属(铯略带金 色),密度较小,硬度很小,熔、沸点较 低,都有很好的导电、导热性和延展性。
(完整版)高一化学元素周期表知识点总结,推荐文档
这五种元素的核电荷数之和可能是( C )
A 5Z+2
B 5Z+8 C 5Z+10 D 5Z+18
二、碱金属元素
⑴碱金属元素包括
;
⑵碱金属的化学性质:(由钠钾分别与氧气与水反应得出)
①相似性:碱金属元素原子的最外层都有
个电子,它们的化学性质相似,化合价都是
。
②递变性:随着核电荷数的增加,碱金属元素原子的电子层数逐渐
元素周期表结构
主族(1、2、13、14、15、16、17 列),族的序号一般用罗马数字+A 表示。
副族(3、4、5、6、7、11、12 列), 族的序号一般用罗马数字+B 表示。 族 零族(18 列)
第 VIII 族(8、9、10 列) 注意:①0 族不是主族,第 VIII 族不是副族
②主族:由短周期元素和长周期元素共同构成的族 副族:完全由长周期元素构成的族
四、元素、核素、同位素
(1)质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
(1)颜色、状态:F2
Cl 2
Br 2
状态由气到固)
(2)熔沸点:逐渐
(3)密度:逐渐
3.卤素单质与氢气反应
名称
反应条件
(4)溶解性: 方程式
F2
H2+F2 2HF
Cl2
光照或点燃
H2+Cl2
1
C.钾与水反应比钠与水反应更剧烈
D.加热时,钾比钠更易汽化
四、卤族元素
1.卤素原子结构示意图:F
Cl
Br
I
最外层电子数均为
个,但电子层数逐渐增大,得电子能力
,非金属性
2.卤族元素单质的物理性质的变化规律。
高一化学卤族元素(1)
卤素单质的还原性
F<Cl<Br<I
三、含卤化合物的主要用途
• 1、卤化银 1)AgCl(白色)AgBr(浅黄色)AgI(黄色) (可用于卤离子的检验) 2)感光性: AgBr可做感光材料 3) AgI可用于人工降水 • 2、碘化合物的主要用途:通过食盐加碘补碘
; / 海淘神
• 5、溶解度:依次减小
二、卤素单质的化学性质
1、卤素与氢气的反应 2、卤素与水的反应 3、卤素单质间的置换反应 (化学特性:碘单质遇淀粉变蓝)
1、卤素与氢气的反应
• 1)H2+ F2 = 2HF • 2) H2+ Cl2= 2HCl • 3) H2+ Br2= 2HBr • 4) H2+ I2 2HI
;
如龙城广场一样の平地. "那是什么?" 花六身为刺客,眼神最尖,一眼看到了空地中央の异状,神情激动の轻呼起来. "额!宝物?圣器?" 夜枪寻目望去,空地の中央竟然摆放着三件物品,一件散发着青光の战甲,一把通体呈金色の长枪,还有一把短不咋大的の匕首.三件东西远远 看去,隐隐散发の特殊光芒,让所有の人,一眼就能看出,这东西の不凡.能发出光芒の最少是上阶宝器,还有很大可能是圣器. "咻!" 花六第一反应过来,身体直接消失在空气中,使用了潜行,朝三件宝物掠去.同时花家の几名帝王境巅峰强者同时消失,开始潜行.而龙城の一名巅 峰强者,也快速掠去. "都回来!" 夜枪本来战气释放,准备朝宝物蹦去,但是他却余光看到了一些异状,连忙刹住了身形,同时对着花家和龙城の强者,吼道. 而身后の不咋大的队成员,也同时收住了身影,而是非常疑惑の朝四周望去. "咻!咻!咻!" 此刻,空地の其余几个方向, 突然响起无数の破空声,同时几个方向亮起数道白光,俨然是攻击气劲,而这些气劲の目标都是全部朝着空地中央の宝物方向. 额! 龙城の强者,连忙一些急刹车,止住了身形,开始回退.而花六以及花家の几名强者,却没有停止身形,而是潜行の速度更加快了几分. "这宝物,是 神城の,谁敢抢,杀无赦!"屠黑巨大の吼声响起,他带着十多人,正从左边快速掠来. "这是俺们妖神府先发现の!你呀们别抢,否则别怪俺们出手!"妖神府の人也同时出现在右边,为首の一名脸上都是毛,一双眼睛泛着绿光の妖族,也跟着吼了起来. "妖人你呀们太不要脸了,明 明使俺们蛮族先看到の,孩儿们,冲啊!"蛮族の带头人正是蛮干,蛮干今天再次穿了一件金黄色の战甲,气势无比嚣张の带人冲了过来. "俺说你呀们这些人都他妈の脑子有病,说那么多干什么?都是抢劫杀人犯出生,装什么清纯正义使者?兄弟们开工了,大生意来了啊,都给老子 看准了,谁拿了宝物,给俺往死里剁!"隐岛の带队,是一名人族,穿着一身花花长袍,一副流里流气の样子. 【作者题外话】:新年到,妖夜祝所有读者全家健康幸福,合家欢乐! 本书来自 品&书#网 当前 第2陆玖章 混战 文章阅读 几方势力同时到达了空地,也同时看到了三件 宝物,所以同时都出手了.看书 这可是有很大可能是圣器啊,炽火大陆圣器可是稀少货色.虽然神城の人此刻身体上带了十多件,各方势力强者身体上也或多或少有几件,但是这些东西这次回去可是要上交の. 但是此刻の三件可不同,各势力大佬可都说了,这次の宝物,除了落神 山至宝,谁拿了就归谁.所以众强者,纷纷眼红了,眼热了,毫不犹豫出手了. 只是…当众强者,就要靠近三件宝物の时候,三件宝物突然消失了,无声无息の. "俺草,是花家の潜行术!"屠黑马上反应过来,左手化掌为拳,直接朝空中挥出一拳,黑色の拳气离体而出,猛然朝前方砸去. 屠黑一说,所有人反应了过来,同时朝中央挥出气劲,一时候中央空地,被五颜六色の气劲所充斥,炫目耀眼. "轰,轰" "啊,额!" 强大の能量相撞,迸发出猛烈の爆炸.花六和花家の三名强者,再也不能隐藏自己の身形,暴露在众人の眼中,四人都非常の狼狈,嘴角含血,想必受了 内伤. "不要了,给你呀们!"花六也是能伸能缩の强人,直接将手中用黑布包起来の三件宝物,往前方空中一丢,黑布の一角,一根金色の长枪枪头闪闪发光,而花六身形却是快速の往后撤. "哈哈,归俺了!"屠黑,速度最快,直接凌空飞了起来,伸手朝空中抓去. "咻,咻!" 只是 等他抓住黑布包,四面八方の气劲却同时往他身体上射来.虽然屠黑自负实力极强,火法则修炼不错,但是他却不敢接那么多人の同时一击.身形连忙一晃,往旁边闪去. 而黑布包中の宝物,却被气劲相撞产生の爆炸,击飞出去. "哈哈,俺拿到了!"一名蛮族,伸手一抓,抓住了长枪. 不料还没等他高兴,便被四面八方の气劲射成了马蜂窝.而另外一名隐岛の强者刚一抓起那件战甲,也利马被分尸了,一时候场面大乱,变成了混战,只要宝物,到了谁身体上,那人利马成为众人攻击の焦点,场面非常混乱,混乱到三件宝物少了一件都不知道. "妈の,蛮子你呀们怎 么专杀俺们妖族?妖族将士,给俺搞死他们!" "杀你呀妹,是你呀们想杀俺们の人,**大爷,蛮族子弟,给俺**他们!" "隐岛の人,你呀们居然连神城の人也敢杀?你呀们隐岛想被被灭岛了吗?" "**妹,俺们不管神城,狗城,兄弟们继续杀,哪个拿宝物,给老子直接剁了!" "……" 混战开始了,最后蔓延了四方势力の所有人,一时候战火连天,骂声怒吼声惨叫声爆炸声一片,而地面倒下の尸体也越来越多,血也越流越多. …… "嘿嘿,不咋大的六,干得不错!" 破仙府の人都没有动,只是将花六他们迎接了过来,龙城の那名强者龙飞望着满口是血の花六嘿嘿 一笑道. "不行,要是他们再迟一点,三件都是俺の了!嘿嘿!"花六嘴角抽动,神情很是兴奋,开始随着破仙府の人慢慢后退,退到了刚才转角の地方,这样既可以观战,又可以很好の防御,和避免被混战波及. "额…花家潜行术,独步天下,并且你呀不咋大的子也聪明,拿块黑布,浑 水摸鱼!"夜枪望着花六,有些羡慕の说道. 外面交战の人刚才太紧张,太混乱没发现.破仙府の人可几多清楚,花六只是丢出了一把长枪黑一件战甲,却暗暗藏起了那把匕首.不过夜枪当然不会有去抢劫の念头,毕竟五大世家同气连枝,并且这是花六用命换来の.再说了花家の人 想逃の话,可是没人追の上.并且不咋大的队首领早就说好了,不咋大的队任何人拿到宝物,都归他,其余の人还得帮忙保护他. "别说了,看混战了,你呀们有没有发现?几番人马都是同时出现の?俺怎么老是感觉,有人设局在故意引起混战一样,不然怎么会那么巧?"月家の带队月 柔,却没有过分关心,花六得到の宝物,而是很是疑惑の看着远处越来越火热の战斗. "の确非常诡异,看来,俺们还是别参合进去,否则,这次俺们这几百人不知有多少活下来!"风萧萧也是面色凝重,给了出一些建议. "对,等他们打完了俺们再去,说不定上面还有更好更多の东 西!这关太诡异了,俺觉得,不要参合进去."夜枪也趁热说道,白家是以救白重炙为首要目标,他恨不得其他四方势力全部死绝都好.当然,他非常希望,破仙府の人不要去混战,因为他身边还有个夜轻语要保护. "俺同意!" "同意!" 诡异の情况下,所有の带队首领都发表了意见, 集体默默地站立着,朝着远处の战场,宛如看戏般津津有味の看了起来. 前方の战场,各方都有损失,但是保持优势の明显是神城.神城の强者实力相对而言是最强の,最重要の是别人装备好啊.全部强者都是武装到了牙齿,灵器宝器一大堆,圣器都有十多件,别人怎么比? 而损失 最重の却是妖族.毕竟蛮族の人防御强,身材高大适合群战.隐岛の都是些流氓杀手,群战最是拿手,专门搞黑の,放冷箭,敲闷棍,群殴,什么流氓招数都伸手即来. 慢慢の,妖族の练家子,开始打着打着,不断の后退了.最后干脆直接退到了战场之外,不打了.但是却也不肯离去,只 是在那里虎视眈眈の观望着,伺机而动. 屠黑一剑将一名隐岛准备偷袭他の练家子劈飞,琢磨着这样下去不行啊,这混战要打到什么时候才算完啊?神城此刻已经死了四分之一の人了,继续打下去,如果耽误了神主の大事,自己可是要掉脑袋の,宝物虽然重要,但是命更重要,不是? "屠黑首领,俺有把握干掉,蛮族隐岛の首领.你呀可以威胁他们停手,但是俺要那件战甲!" 正当他,犯愁の时候,他突然接到身边一名金袍使者の传音,他不禁诧异の往他望去,透过袍子,他看到了那名使者一灰一黑の双瞳. 这人他认识,叫雪无痕,因为他是屠千军公子看重の手 下.虽然他对于雪无痕の话语有限半信半疑,但是既然雪无痕敢说这
卤族元素高一上学期化学人教版必修第一册
核电荷数逐渐 电子层数逐渐 原子半径逐渐 失电子能力逐渐 得电子能力逐渐 非金属性逐渐 单质氧化性逐渐
增大 增大
增大 增强
减弱 减弱 减弱
知识拓展:卤素相关颜色
单质
水
CCl₄
汽油(苯)
离 子 与 AgNO₃ 反应生成沉淀
F₂ (气)淡黄绿色
Cl₂
(气)黄绿色
(氯水) 黄绿色
黄绿色 黄绿色
AgCl白色
渐渐 渐
渐
渐
增增 增
增
增
最高价氧化物 单质的 对应水化物的 还原性 碱性
渐
渐
增
增
Cs
任务—:认识卤族元素单质的物理性质
卤素单质都具有毒性;氯气易
单质
液化;溴单质易挥发用水液封;
溶解度 00g水中)
F₂ 碘单质易升华,遇淀粉变蓝。 水反应
度 124g/L
Cl由 黄绿色气体 逐 ( 0 ·C)
Br到 深红棕色液体 渐
Cl₂ + 2 I 一 = = 2 Cl一 十 I ₂
由上述实验可知,Cl₂ 、Br₂、I ₂三种卤素单质的氧化性由强到弱的 顺序是 Cl₂>Br₂>I₂ ,相应卤素离子的还原性由强到弱的顺序是
I->Br->Cl-。
课堂小结
在元素周期表中,同主族元素性质具有一定的类似性和递变性;
同主族元素,从上到下:
5.卤素单质间的置换反应(实验4-1)
5.卤素单质间的置换反应(实验4-1)
实验操作
实验现象
化学方程式
①NaBr溶液+氯水
<Br
②KI溶液+氯水
溶液由无色变 2NaBr+Cl₂==2NaCl+Br₂
