总酸度的测定
总酸度的测定公式

总酸度的测定公式好的,以下是为您生成的关于“总酸度的测定公式”的文章:在咱们化学的世界里,总酸度的测定公式就像是一把神奇的钥匙,能打开了解溶液酸性程度的大门。
记得有一次,我在实验室里带着一群充满好奇的学生做实验。
那天阳光透过窗户洒在实验台上,照得那些仪器闪闪发亮。
我们的任务就是测定一种未知溶液的总酸度。
我先给学生们讲解了总酸度的基本概念,看着他们那一双双充满求知欲的眼睛,我知道他们在努力地理解和吸收这些新知识。
总酸度的测定,常用的公式是基于酸碱中和反应的原理。
比如说,用氢氧化钠标准溶液来滴定酸溶液时,总酸度通常以每升溶液中所含酸的毫摩尔数来表示。
假设我们用 C(NaOH) 表示氢氧化钠标准溶液的浓度(单位:mol/L),V(NaOH) 表示消耗的氢氧化钠标准溶液的体积(单位:L),V(样品) 表示所取样品溶液的体积(单位:L),那么总酸度(以某种酸计,比如以乙酸计)的计算公式就是:总酸度(mmol/L) =C(NaOH) × V(NaOH) × n / V(样品) ,这里的 n 是酸的换算系数,不同的酸有不同的换算系数哦。
就拿乙酸来说,n 就是 1,因为 1 摩尔的氢氧化钠恰好中和 1 摩尔的乙酸。
在那次实验中,有个学生小心翼翼地操作着滴定管,眼睛紧紧盯着刻度,额头上都冒出了汗珠,那认真的模样真是可爱极了。
当最终得出实验结果时,他那兴奋的表情仿佛发现了新大陆。
其实啊,总酸度的测定在生活中也有不少用处呢。
比如在食品工业中,要检测果汁、醋等的酸度,确保产品的质量和口感。
想象一下,如果一瓶果汁太酸了,那咱们喝起来肯定不舒服。
通过测定总酸度,就能调整生产工艺,让咱们喝到酸甜可口的果汁。
在环境监测方面,测定水样的总酸度也很重要。
它能帮助我们了解水体的污染情况,判断是否对生态系统造成了不良影响。
总之,总酸度的测定公式虽然看起来只是几个简单的字母和数字的组合,但它背后蕴含着丰富的化学知识和实际应用价值。
总酸度游离酸度的测定

酸度测定操作方法一. 总酸度的测定本法采用酸碱滴定法。
取试样10ml,用0.1mol/L氢氧化钠标准溶液滴定,所消耗的毫升数用点数表示。
A.1 试剂氢氧化钠:0.1mol/L标准溶液按GB/T 601规定;酚酞指示剂:1.0/L 按GB/T 603规定。
A.2 试验方法吸取10ml试液于250ml锥形烧瓶中,加50ml蒸馏水,加3~4滴酚酞指示剂。
用0.1mol/L氢氧化钠标准溶液滴至溶液由无色变为粉红色为终点。
记下消耗氢氧化钠标准溶液毫升数V1。
A.3 计算方法总酸度点数按下列公式计算:总酸度(点)= 10V1 c/ 0.1V式中:V1 —滴定时耗去氢氧化钠标准溶液毫升数,mL;c—氢氧化钠标准溶液实际浓度,mol/L;V—取样毫升数,mL。
二. 游离酸度的测定本法采用酸碱滴定法。
取试样10ml,用0.1mol/L氢氧化钠标准溶液滴定,所消耗的毫升数用点数表示。
A.1试剂氢氧化钠:0.1mol/L标准溶液按GB/T 601规定;溴酚蓝指示剂:0.4mol/L 按GB/T 603规定。
A.2试验方法吸取10ml试液于250ml锥形烧瓶中,加50ml蒸馏水,加2~3滴溴酚蓝指示剂。
用0.1mol/L氢氧化钠标准溶液滴至溶液由黄色变至蓝紫色为终点。
记下消耗氢氧化钠标准溶液毫升数A。
A.3计算方法游离酸度点数按下列公式计算:游离酸度(点)= 10Ac/ 0.1V式中:A —滴定时耗去氢氧化钠标准溶液毫升数,mL;c—氢氧化钠标准溶液实际浓度,mol/L;V—取样毫升数,mL。
编制苏辉审核韩娟批准山东金泰机械制造有限公司。
食醋中总酸度的测定计算公式(一)

食醋中总酸度的测定计算公式(一)
食醋中总酸度的测定计算公式
引言
食醋是我们日常生活中经常使用的一种调味品,其中的酸度是决定其口感和质量的重要因素之一。
测定食醋中的总酸度可以帮助我们
评估其酸度水平,进而判断其质量和适用范围。
总酸度的定义
总酸度是指食醋中所有酸性物质的含量总和。
一般来说,总酸度用醋酸钠溶液对食醋进行中和滴定来测定。
总酸度的计算公式
根据滴定反应的化学平衡关系,可以得到计算食醋中总酸度的公式如下:
总酸度(g/L)= (滴定液的浓度 × 滴定液的体积 × 1000) / 食醋的体积
其中, - 滴定液的浓度是指醋酸钠溶液的浓度(一般为/L); - 滴定液的体积是指醋酸钠溶液滴定到终点所需的体积; - 食醋的体积是指取样测定的食醋的体积。
示例说明
假设我们取样量为10 mL的食醋进行滴定测定,滴定液为/L的醋酸钠溶液,滴定液滴定到终点所需的体积为20 mL。
根据上述计算公式,我们可以进行如下计算:
总酸度(g/L)= (/L × 20 mL × 1000) / 10 mL = 200 g/L 因此,这个食醋样品的总酸度为200 g/L。
结论
通过上述计算公式,我们可以方便地计算食醋中的总酸度。
这对于评估食醋的质量和应用范围具有一定的参考价值。
当然,在实际操作中,还需要注意滴定的准确性和取样的代表性,以提高测定结果的可靠性。
白醋总酸度的测定实验
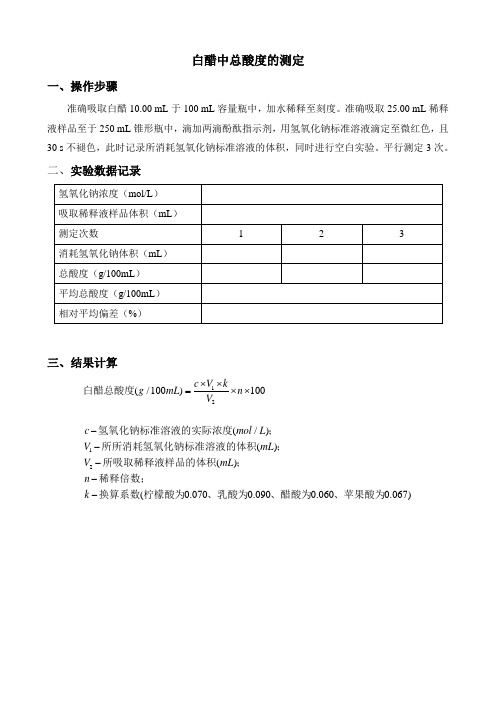
白醋中总酸度的测定
一、操作步骤
准确吸取白醋10.00 mL 于100 mL 容量瓶中,加水稀释至刻度。
准确吸取25.00 mL 稀释液样品至于250 mL 锥形瓶中,滴加两滴酚酞指示剂,用氢氧化钠标准溶液滴定至微红色,且30 s 不褪色,此时记录所消耗氢氧化钠标准溶液的体积,同时进行空白实验。
平行测定3次。
二、实验数据记录
三、结果计算
12
12(/100)100(/)()()(0.0700.0900.0600.067)
c V k g mL n V c mol L V mL V mL n k ⨯⨯=⨯⨯-----白醋总酸度氢氧化钠标准溶液的实际浓度;
所所消耗氢氧化钠标准溶液的体积;
所吸取稀释液样品的体积;
稀释倍数;
换算系数柠檬酸为、乳酸为、醋酸为、苹果酸为。
食醋中总酸度的测定实验报告数据

食醋中总酸度的测定实验报告数据一、实验目的测定食醋中总酸度,了解酸碱滴定的基本原理和操作方法,掌握实验数据的处理和分析。
二、实验原理食醋中的主要成分是醋酸(CH₃COOH),此外还含有少量的其他有机酸。
总酸度通常以醋酸的含量来表示,单位为 g/100mL。
酸碱滴定是利用酸碱中和反应来测定酸或碱的浓度。
在本实验中,用已知浓度的氢氧化钠(NaOH)标准溶液滴定食醋样品,当达到化学计量点时,根据消耗的氢氧化钠标准溶液的体积和浓度,计算出食醋中醋酸的含量。
化学反应方程式为:CH₃COOH + NaOH = CH₃COONa + H₂O三、实验仪器与试剂1、仪器酸式滴定管(50mL)碱式滴定管(50mL)锥形瓶(250mL)移液管(25mL)容量瓶(250mL)电子天平玻璃棒烧杯(500mL、100mL)2、试剂氢氧化钠(分析纯)邻苯二甲酸氢钾(基准试剂)酚酞指示剂(1%乙醇溶液)食醋样品四、实验步骤1、配制 01mol/L 的氢氧化钠标准溶液称取 4g 氢氧化钠固体,用少量蒸馏水溶解后,转移至 1000mL 容量瓶中,定容至刻度线,摇匀。
用基准试剂邻苯二甲酸氢钾对氢氧化钠标准溶液进行标定。
准确称取 04 06g 邻苯二甲酸氢钾于锥形瓶中,加入 50mL 蒸馏水溶解,滴加2 3 滴酚酞指示剂,用待标定的氢氧化钠溶液滴定至溶液呈粉红色,且30s 内不褪色。
记录消耗的氢氧化钠溶液的体积。
平行标定三份,计算氢氧化钠标准溶液的浓度。
2、食醋样品的预处理用移液管准确移取 25mL 食醋样品于 250mL 容量瓶中,用蒸馏水定容至刻度线,摇匀。
3、食醋中总酸度的测定用移液管准确移取 2500mL 稀释后的食醋样品于锥形瓶中,加入 2 3 滴酚酞指示剂。
用已标定好的氢氧化钠标准溶液滴定至溶液呈粉红色,且 30s 内不褪色。
记录消耗的氢氧化钠标准溶液的体积。
平行测定三份。
五、实验数据记录与处理1、氢氧化钠标准溶液的标定|编号|邻苯二甲酸氢钾质量(g)|消耗氢氧化钠溶液体积(mL)|氢氧化钠溶液浓度(mol/L)|平均值(mol/L)|相对平均偏差||||||||| 1 |_____ |_____ |_____ |||| 2 |_____ |_____ |_____ |||| 3 |_____ |_____ |_____ |||计算公式:$c(NaOH) =\frac{m}{M \times V}$其中,$c(NaOH)$为氢氧化钠标准溶液的浓度(mol/L),$m$为邻苯二甲酸氢钾的质量(g),$M$为邻苯二甲酸氢钾的摩尔质量(20422g/mol),$V$为消耗氢氧化钠溶液的体积(L)。
盐酸中总酸度的测定

盐酸中总酸度的测定
一、盐酸中总酸度的测定原理
试样溶液以溴甲酚绿为指示剂,用氢氧化钠滴定由黄色为蓝色为终点。
反应式如下H++OH-→H2O
二、测定过程
1.量取3ml实验室样品,置于内装约15ml水并称量(精确到0.0001g)的锥形瓶中,混匀并称量(精确到0.0001g)。
2.测定
向试样中加2-3滴溴甲酚绿指示剂,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
3.计算方法
总酸度以氯化氢(HCL)的质量分数W1计,数值以%表示。
W1=
V
1000
cM
m o
×100
式中:
V----氢氧化钠标准滴定溶液的体积的数值,单位为毫升(ml)
C---氢氧化钠标准滴定溶液浓度的准确数值,单位摩尔每升(mol/l)m o---试样的质量数值,单位为克(g)
M---氯化氢的摩尔质量的数值,单位为克每摩尔(g/mol)(M=36.461)三、数据处理
平行测定结果之差的绝对值不大于0.2%
取平行测定结果的算术平均值为报告结果
四.注意事项
1.指示剂加入量多少影响变色敏锐程度。
2.指示剂消耗滴定剂
3.指示剂应适当少用.
4.不同酸碱指示剂其变色范围和理论变色不同.
5.各种指示剂变色范围和理论变色范围不同。
食用醋总酸度的测定
对实验结果进行分析,判断实验误差是否在可接受范围内,并对异 常结果进行排查和修正。
结果可靠性分析
重复性检验
对实验结果进行重复性检验,判断实验结果的可靠性。可以通过多次重复 实验,计算结果的平均值和标准差,以评估实验的精密度和准确度。
对照实验
进行对照实验,以验证实验方法的可靠性。可以选用已知总酸度的食用醋作为 标准样品,进行同样的实验操作和数据处理,将实验结果与已知数据进行对比 。
对实验结果进行分析,判断数据的准确性和可靠性,如有需要可进 行误差分析和重复实验。
05
结果分析与讨论
数据处理与结果分析
数据记录
在食用醋总酸度测定过程中,应准确记录每次实验的数据,包括实 验前后的滴定管读数、实验温度、实验时间等。
数据处理
根据实验原理和公式,对记录的数据进行计算和处理,得出食用醋 的总酸度。
THANKS
感谢观看
性。
03
实验材料与设备
实验材料
01
02
03
04
食用醋样品
需要准备至少5种不同品牌的 食用醋样品,以保证实验的准
确性和可靠性。
酚酞指示剂
用于指示滴定终点,使终点颜 色变化明显,易于观察。
氢氧化钠标准溶液
作为滴定剂,用于与醋中的醋 酸反应,计算醋的总酸度。
蒸馏水
用于稀释醋样品和溶解酚酞指 示剂。
实验设备
外部验证
寻求第三方机构或权威实验室对实验结果进行外部验证, 以确保实验结果的可靠性。
结果与讨论
结果总结
总结实验结果,明确食用醋的总酸度值 ,并判断是否符合相关标准和规定。
VS
结果讨论
根据实验结果,对食用醋的质量和生产工 艺进行讨论,分析可能影响总酸度的因素 ,并提出改进建议。同时,将实验结果与 相关研究进行比较,探讨食用醋总酸度与 其品质和营养价值的关系。
磷化液的游离酸度及总酸度的测定方法
磷化液的游离酸度及总酸度的测定方法一、游离酸度的测定:
用移液管吸取10ml磷化槽槽液于250ml三角烧瓶中,加50ml 纯水,加2—3滴甲基橙指示剂,用0.1N或0.1mol/1的NaOH标准液滴定到溶液呈橙色,即为终点。
记下消耗NaOH标准液毫生数即为滴定的游离酸度点数。
二、总酸度的测定:
用移液管吸取10ml磷化槽槽液于250ml三角烧瓶中,加50ml 纯水,加2—3滴酚酞指示剂,用0.1N或0.1mol/1的NaOH标准液滴定到溶液呈粉红色,即为终点。
记下消耗NaOH标准液毫生数即为滴定的总酸度点数。
三、促进剂浓度的测定:
以发酵管盛装20ml槽液,放入3—5g的A.C试药,用手将发酵管入口堵住,使之倾倒,待发酵管内的试药抵达管端时立即将发酵管摆正,并将堵住发酵管入口的手松开,待气体发生终止时,发酵管顶端之毫升数即为槽液内促进剂的浓度,1ml=1点。
食品中总酸的测定实验报告范文
食品中总酸的测定实验报告范文(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如公文写作、报告体会、演讲致辞、党团资料、合同协议、条据文书、诗词歌赋、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of classic sample essays, such as official document writing, report experience, speeches, party and group materials, contracts and agreements, articles and documents, poems and songs, teaching materials, essay collections, other sample essays, etc. Learn about the different formats and writing styles of sample essays, so stay tuned!食品中总酸的测定实验报告范文食品中总酸的测定实验报告范文篇一:食品中总酸度的测定实验报告1.方法提要总酸度是食品中所有酸性物质的总量,包括已离解的酸和未离解的酸,常采用酸碱滴定法进行测定,即用标准碱溶液进行滴定,以酚酞为指示剂来判断终点,并以样品中主要代表酸的百分含量表示。
醋酸中总酸度的测定实验报告
醋酸中总酸度的测定实验报告一、实验目的1、掌握酸碱滴定的基本原理和操作方法。
2、学会使用酸碱指示剂确定滴定终点。
3、准确测定醋酸溶液中的总酸度。
二、实验原理醋酸(CH₃COOH)是一种弱酸,在水溶液中部分电离:CH₃COOH ⇌ CH₃COO⁻+ H⁺。
用已知浓度的氢氧化钠(NaOH)标准溶液滴定醋酸溶液,发生中和反应:CH₃COOH + NaOH =CH₃COONa + H₂O。
当滴定达到化学计量点时,溶液的 pH 值会发生突变。
通过选择合适的指示剂(如酚酞),可以根据指示剂颜色的变化来确定滴定终点。
根据所消耗的氢氧化钠标准溶液的体积和浓度,计算出醋酸溶液中总酸度(以醋酸的质量浓度表示)。
三、实验仪器与试剂1、仪器酸式滴定管(50 mL)碱式滴定管(50 mL)锥形瓶(250 mL)移液管(25 mL)容量瓶(250 mL)电子天平玻璃棒烧杯(500 mL、100 mL)2、试剂氢氧化钠(NaOH)固体:分析纯邻苯二甲酸氢钾(KHC₈H₄O₄):基准试剂酚酞指示剂(2 g/L 乙醇溶液)醋酸试样四、实验步骤1、配制 01 mol/L NaOH 标准溶液称取 4 g 氢氧化钠固体于小烧杯中,加适量水溶解。
将溶液转移至 1000 mL 容量瓶中,用蒸馏水冲洗烧杯数次,洗液也倒入容量瓶中。
加水至刻度线,摇匀。
2、标定 NaOH 标准溶液准确称取 04 06 g 邻苯二甲酸氢钾基准试剂于 250 mL 锥形瓶中,加入 50 mL 蒸馏水溶解。
加入 2 3 滴酚酞指示剂,此时溶液为无色。
用待标定的 NaOH 标准溶液滴定至溶液呈微红色,且 30 秒内不褪色,即为终点。
记录消耗的 NaOH 标准溶液体积。
平行标定三份,计算 NaOH 标准溶液的平均浓度。
3、醋酸试样的测定用移液管准确移取 2500 mL 醋酸试样于 250 mL 容量瓶中,用蒸馏水稀释至刻度,摇匀。
用移液管准确移取 2500 mL 稀释后的醋酸溶液于 250 mL 锥形瓶中,加入 2 3 滴酚酞指示剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、原理
食品中的有机酸(弱酸)用标准碱液滴定时,被中和生成盐类。
用酚酞作指示剂,当滴定到终点(pH=8.2,指示剂显红色)时,根据消耗的标准碱液体积,计算出样品总酸的含量。
其反应式如下:RCOOH + NaOH→ RCOONa +H2O
二、样品的处理与制备
1.固体样品
将样品适度粉碎过筛,混合均匀,取适量的样品,加入少量无二氧化碳的蒸馏水,将样品溶解到250ml容量瓶中,在75-80℃水浴上加热0.5小时(若是果脯类,则在沸水中加热1小时),冷却、定容,用干燥滤纸过滤,弃去初液,收集滤液备用。
2.含二氧化碳的饮料、酒类
将样品于45℃水浴上加热30min,除去二氧化碳,冷却后备用。
3.调味品及不含二氧化碳饮料、酒类
将样品混合均匀后直接取样,必要时也可加适量水稀释,若混浊则需过滤。
4.咖啡样品
将样品粉碎经40目筛,取10g样于三角瓶,加75ml 80%乙醇,加塞放置16小时,并不时的摇动,过滤。
5.固体饮料
称取5g样品于研钵中,加入少量无CO2蒸馏水,研磨成糊状,用无C O2蒸馏水移入250ml容量瓶中定容,摇匀后过滤。
三.样品滴定
准确吸取制备的滤液50ml,加入酚酞指示剂2-3滴,用0.1mol/L标准碱液滴定至微红色30秒不褪色,记录用量,同时做空白实验。
以下式计算样品含酸量。
总酸度(%) =C×(V1-V2)×K ×V3×100
m V4
式中:
C---标准氢氧化钠溶液的浓度mol/L
V1---滴定所消耗标准碱液的体积ml
V2 ---空白所消耗标准碱液的体积ml
V3 ---样品稀释液总体积ml
V4---滴定时吸取的样液的体积ml
M---样品质量或体积(g或ml)
K---换算为适当酸的系数,即1mol氢氧化钠相当于主要酸的克数
因为食品中含有多种有机酸,总酸度测定结果通常以样品含量最多的那种酸表示。
例如一般分析葡萄及其制品时,用酒石酸表示,其K=0. 075;测柑橘类果实及其制品时,用柠檬酸表示,其K=0.064;分析苹果及其制品时,用苹果酸表示,其K =0.067;分析乳品、肉类、水产品及其制品时,用乳酸表示,其K=0.090;分析酒类、调味品,用乙酸表示,K=0.060。
四、注意事项:
1.样品浸泡,稀释用的蒸馏水中不含CO2,因为它溶于水生成酸性的H2CO3,影响滴定终点时酚酞的颜色变化,一般的做法是分析前将蒸馏水煮沸并迅速冷却,以除去水中的CO2。
样品中若含有CO2也有影响,所以对含有CO2的饮料样品,在测定前须除掉CO2。
2.样品在稀释用水时应根据样品中酸的含量来定,为了使误差在允许的范围内,一般要求滴定时消耗0.1mol/LNaOH不小于5ml,最好应在10~15ml左右。
3.由于食品中含有的酸为弱酸,在用强碱滴定时,其滴定终点偏碱性,一般pH在8.2左右,所以用酚酞做终点指示剂。
4.若样品有色(如果汁类)可脱色或用电位滴定法也可加大稀释比,按100ml样液加0.3ml酚酞测定。
各类食品的酸度以主要酸表示,但有些食品(如牛奶、面包等)也可用中和100g(ml)样品所需0.1mol/L(乳品)或1mol/L(面包)Na OH溶液的ml数表示,符号0T。
新鲜牛奶的酸度为16-180T,面包酸度为3-9 0T。
