《教师参考》新课标人教版(高中化学)必修2 :2.1.1 化学能转化为电能 同课异构课件2
高中化学第二节化学能与电能课件新人教必修2.ppt
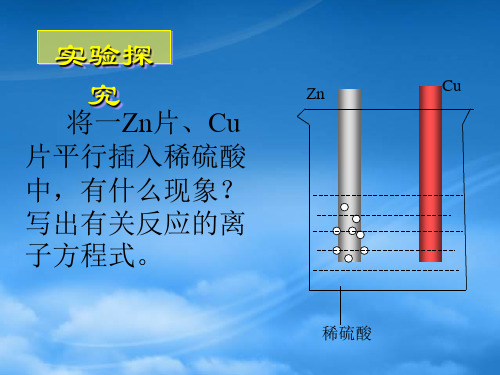
究
Zn
Cu
将一Zn片、Cu
片平行插入稀硫酸
中,有什么现象?
写出有关反应的离 子方程式。
稀硫酸
实验探 究
将Zn片、Cu片 上端连接插入稀硫 酸中,有什么现象? 为什么?
稀硫酸
实验探
Zn
Cu
究
稀硫酸
Zn
Cu 现象
(1)电流表指针有偏转
(2)铜片上有气泡产生
(3)锌片不断溶解
稀硫酸
Zn
ee-
Zn
Cu
(E) 酒精
(F) 稀硫酸Zn源自Cu(G)稀硫酸
稀硫酸
4、构成条件: (1)活泼性不同的两种金属
(或金属与非金属导体)做电极 (2)形成闭合回路
(3) 电解质溶液
(4) 自发的氧化还原反应
练习1:下列烧杯中盛放的都是稀硫酸, 在铜电极上能产生气泡的是哪个?写出 电极反应及总反应。
练习2:利用Fe + Cu2+=Fe2++Cu设计一个 原电池,画出示意图,写出电极反应。
探究
Cu
e-
稀硫酸
e-
H+
SO42-
H+ SO42-
H+
H+
Zn
Cu
ee-
H+ Zn2+
H+
稀硫酸
-
Zn ee-
Zn2+
+ Cu-Zn原电池:
Cu 负极:(氧化反应)
锌片:Zn-2e-=Zn2+
正极:(还原反应)
铜片:2H++2e-=H2↑
H+
总反应:
H+
《教师参考》新课标人教版(高中化学) 必修2同课异构课件1:1.2.2 元素周期律

化合价 + 1 + 2 + 3 + 4 + 5 +6 +7 0 -4 -3 -2 -1
附一:各主族元素的主要化合价
2015
+1 +2
+3
+4 -4
+5 +6 +7
-3
-2 -1
(除O) (除F)
RH4 RH3 H2R HR
R2O RO R2O3 RO2 R2O5 RO3 R2O7
附二:粒子半径大小比较一般规律
Tl
Pb Bi
Po
At Rn
Fr
Ra
主最低族元负素化合的最价
最高正价==
数高+正最化高合正价价与= 原 序最有子 数外何层1关81电系子?1数2
2015
13 14
最外层电子数 15 16 17
18
元素 名称
钠镁
铝
硅
磷
硫氯氩
元素
符号 Na Mg Al Si P S Cl Ar
电子 排布 2, 8, 1 2, 8, 2 2, 8, 3 2, 8, 4 2, 8,5 2, 8, 6 2, 8, 7 2, 8, 8
2 1 8 大→小
3
18
大→小
+1 +7 -4 -1
0
随着原子序数的递增,元素原子的电子层排
布、原子半径和化合价都呈现周期性变化
元素周期表中原子半径的变化规律
H
He
Li
Be
B
C 2015 N
O
F
Ne
Na
Mg Al
Si
P
S
Cl
Ar
化学能与电能课件-高一化学人教版(2019)必修第二册

即原电池的总反应
下列各种情况是否形成了原电池?
G
G
Fe
Ag Mg
Al
Zn
Cu
盐酸
A
G
Zn
Cu
CuSO4溶液
B
Zn
Cu
蔗糖溶液
D
H2SO4
E
盐酸
C
生铁
盐酸
F
装置是否为原电池的判断方法
练习
[例] X、Y、Z都是金属, 把X浸入Z的硝酸盐溶液中,X的表面 有Z析出, X与Y组成原电池时,Y是电池的负极。 X、Y、Z三种金属的活动性顺序为 ( C) A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
原电池
4、原电池的应用
④金属因发生原电池反应而腐蚀 ——金属防护问题
如何避免轮船船身被腐蚀,延长 其寿命? 通常在轮船的尾部和在船壳的水线以下部 分,装有一定数量的锌块,请解释原因
外 电子流向:负极 沿导线 正极
电
路 电流方向:正极 沿导线 负极
内 阳离子 正极
电 路
阴离子
负极
锌铜原电池的工作原理
负极(Zn) Zn - 2e- === Zn2+
工作原理 (反应方程式)
正极(Cu)
2H+ + 2e- === H2↑
总反应离子方程式: Zn + 2H+ === Zn2+ + H2↑
原因:轮船的船身一般是用铁做的, 装上锌块后,铁跟锌形成原电池,此 时锌作为负极发生氧化反应溶掉,而 铁作为正极被保护起来不受腐蚀。
高中化学(人教版必修二)教学课件:2.2化学能与电能

此时电池内总的反应式
。
电极 材料
Zn片
现象 电子 得失
Zn片 溶解
失
电极反应
原电池的电极
Zn-2e-= Zn2+ 负极
Cu片 有气 体产 生
得 2H++ 2e-= H2↑
正极
总的离子反应方程式 Zn+ 2H+ = Zn2+ + H2↑
Zn—Zn与稀硫酸进行实验. Zn—石墨与稀硫酸进行实验. Fe—Zn与稀硫酸进行实验. Cu—Zn与乙醇进行实验. Cu—Zn与一个西红柿(或一个苹果)进行实验. Cu—Zn与两个西红柿进行实验. Cu—Zn与橙汁进行实验.
病例分析
病例分析
病例分析
你能为她开一个药方吗?
原电池分析
电极反应式的书写 总反应方程式的书写 化学电池的反应本质:氧化还原反应
原电池电极名称的确定方法 ①根据电极材料的性质确定。 通常是活泼金属是负极,不活泼金属、碳棒、 化合物是正极。 ②根据电极反应的本身确定。
失电子的反应→氧化反应→负极 得电子的反应→还原反应→正极
A
原电池原理 一、原电池 1、定义:把化学能转变为电能的装置.
问题探究 你能找到原电池 的正负极吗?
“负极出电子,电子回正极”
必产生 失电子
的 氧化反应
必产生 得电子
的 还原反应
原电池
2、活泼金属→产生氧化反应→向外线路提供电子→原电 池的负极;不活泼金属(或石墨)→产生还原反应→接受 外线路提供的电子→原电池的正极。
(B )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
高中人教版化学必修二专题13 化学能转化为电能(教师版)

专题13 化学能转化为电能化学能转化为电能1.燃煤发电的能量转化(1)过程:化学能――→燃烧热能――→蒸汽机械能―――→发电机电能 (2)燃烧(氧化还原反应)是使化学能转换为电能的关键。
2.原电池 (1)实验(2(3)铜锌原电池工作原理:2(4)反应本质:原电池反应的本质是氧化还原反应。
(5)构成原电池的条件理论上,自发的氧化还原反应均可设计成原电池。
①两个活泼性不同的金属(或一个为金属,一个为能导电 的非金属)电极。
②具有电解质溶液。
③形成闭合回路。
【典例1】在如图所示的8个装置中,属于原电池的是 。
【答案】DFG【解析】图中A、B都只有一个电极,C中是两个活泼性相同的电极,E中酒精不是电解质溶液,H不能形成闭合回路,它们不属于原电池,属于原电池的只有D、F、G。
原电池原理的应用1.加快氧化还原反应的速率(1)原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
(2)实例:实验室用Zn 和稀硫酸反应制取氢气时,可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
2.比较金属活泼性强弱(1)原理:一般原电池中,活泼金属作负极,发生氧化反应,不活泼金属作正极,发生还原反应。
(2)实例:有两种金属A 和B ,用导线连接后插入稀硫酸中,观察到A 极溶解,B 极上有气泡产生。
由原电池原理可知,金属活动性:A >B 。
3.设计原电池(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料。
①电极材料:电极材料必须导电。
负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
(3)实例:以Fe +CuSO 4===FeSO 4+Cu 为例电极反应⎩⎪⎨⎪⎧负极反应:Fe -2e -===Fe2+正极反应:Cu 2++2e -===Cu 电极材料及电解质⎩⎪⎨⎪⎧(1)负极:Fe(2)正极:Cu 或C (比Fe 的活泼性差的金属或能导电的非金属)(3)电解质:CuSO 4溶液装置图【典例2】 有a 、b 、c 、d 四个金属电极,有关的实验装置及部分实验现象如下:A.a>b>c>d B.b>c>d>aC.d>a>b>c D.a>b>d>c【答案】C【解析】装置一是原电池,a极质量减小,说明a极金属易失去电子形成离子,故a极金属比b极金属活泼;装置二没有形成原电池,可知b比c活泼,且c位于金属活动性顺序表中氢的后面;装置三和四均形成原电池,易知d比c活泼,d比a活泼。
2020_2021学年高中化学第二章化学反应与能量第二节化学能与电能第1课时化学能转化为电能课件新人教版必修2

探究一
探究二
随堂演练
2.为将化学反应2Al+6H+ === 2Al3++3H2↑中的化学能转化为电能,
下列装置能达到目的的是(铝条均已除去了氧化膜)( )
探究一
探究二
随堂演练
解析:将化学反应2Al+6H+ === 2Al3++3H2↑中的化学能转化为电能,
需要形成原电池装置,且该原电池装置中铝为负极,电解质溶液为 非氧化性稀酸,据此判断B项符合题意。 答案:B
探究一
探究二
随堂演练
5.(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上
有气泡产生,再平行插入一块铜片,可观察到铜片
(填“有”
或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组
成一个原电池,负极为
,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2 mol·L-1 500 mL的稀硫酸,构成铜锌
探究一
探究二
随堂演练
知识归纳
1.比较金属的活动性强弱 (1)依据: 原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。 (2)应用: 如有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极 溶解,B极上有气泡产生,由原电池原理可知,金属活动性:A>B。 2.加快氧化还原反应速率 如实验室用Zn和稀硫酸反应制H2,常用粗锌,它产生H2的速率快。 原因是粗锌中的杂质和锌、稀硫酸形成原电池,加快了锌的腐蚀, 使产生H2的速率加快;若加入CuSO4溶液,Zn置换出Cu,Zn和附着在 锌片上的Cu形成原电池也可以加快反应速率。
探究一
探究二
随堂演练
解析:患者感觉到头疼是由于两颗假牙与口腔中电解质溶液形成 了原电池,两个假牙作电极,若将金假牙改为铝假牙,仍能形成原电 池,不能治疗其疾病。如果将两颗假牙换成同种金属材料,不能形 成原电池,便可以治疗其疾病;若将两颗假牙都做成特殊树脂的,树 脂不导电,不能形成原电池,也可治疗其疾病。
同步备课一体资料之化学人教必修2课件:第二章 化学反应与能量 第2节 第1课时化学能转化为电能(35张)
• 【自主思考】
• 1.原电池是如何构成闭合回路的?(请从电子流向 和离子移动方向分析)
• 提示 在外电路,电子从负极流出经导线流向 正极,在电解质溶液中,阳离子向正极移动,阴离 子向负极移动。
• 2.原电池中作负极的一定是活泼金属,作正极的一 定是不活泼金属吗?
• 提示 不一定。在原电池中的两极可以都是活 泼金属(如Zn-Fe-稀硫酸,Zn作负极),也可以都 是 以不 是活 一泼种金金属属和(如一C种u-能A导g-电A的gN非O金3,属C(如u作C负u-极C)-也可 AgNO3,Cu作负极)。
•(6)将铜片和锌片用导线连接插入酒精中,电流表指 针发生偏转( )
•(7)在铜—锌—稀硫酸原电池中,电子由锌通过导线流 向铜,再由铜通过电解质溶液到达锌( )
•(8)原电池中阳离子向正极移动( )
•(9)原电池中的负极反应一定是电极材料失电子( )
•答案 (1)√ (2)√ (3)√ (4)× (5)× (6)× (7)× (8)√ (9)×
• 2.下列装置中能够组成原电池的是________。
•解析 构成原电池的条件缺一不可:
•①②缺少一个电极;③中电极相同;⑤中酒精为非 电解质;⑧中不能形成闭合回路。
•答案 ④⑥⑦⑨
探究一、原电池的构成条件、工作原理及正负极的判断
【合作交流】
1.原电池是由哪几部分组成?各起什么作用? 提示 构成原电池需有两个活泼性不同的电极,将电极插 入电解质溶液中,两电极间用导线连接使之构成闭合回路。 电极的作用是导电,有些电池中电极材料会参加反应;导 线的作用是传导电子;电解质溶液的作用是通过自由离子 的移动传导电荷。
• (2)若将2中稀硫酸换作硫酸铜溶液,能否产生电 流?电极反应有何不同?
2019—2020学年人教新课标版高中化学必修二教师用书:2-2-1第一课时 化学能转化为电能 W
姓名,年级:时间:第二节化学能与电能第一课时化学能转化为电能一、一次能源和二次能源二次能源中的电能是应用最广泛,使用最方便,污染最小的能源。
二、化学能转化为电能1.燃煤发电的能量转化(1)过程:化学能错误!热能错误!机械能错误!电能(2)化石燃料的燃烧(氧化还原反应)是使化学能转换为电能的关键。
2.原电池(1)实验(2)原电池概念:将化学能转变为电能的装置(3)铜锌原电池工作原理电池总反应:Zn+H2SO4===ZnSO4+H2↑。
(4)反应本质:原电池反应的本质是氧化还原反应.(5)构成原电池的条件理论上,自发的氧化还原反应均可设计成原电池。
①两个活动性不同的电极(或一个为金属,一个为能导电的非金属)电极。
②具有电解质溶液.③形成闭合回路。
1.正误判断(1)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池( )(2)在铜—锌—稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌 ( )(3)原电池中阳离子向正极移动()(4)原电池中的负极反应一定是电极材料失电子()(5)把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快()[答案] (1)×(2)×(3)√(4)×(5)√2.下列叙述不正确的是()A.根据一次能源和二次能源的划分,氢气为二次能源B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源C.火力发电是将燃料中的化学能直接转化为电能的过程D.在火力发电过程中,化学能转化为热能实际上是氧化还原反应发生的过程,伴随着能量的变化[答案]A3.下列设备工作时,将化学能转化为电能的是()[答案]C4.(1)下列装置属于原电池的是________。
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是________________。
(3)此原电池反应的化学方程式为______________________.[答案](1)⑤(2)Fe 氧化Cu 电极上有气泡产生Fe+H2SO4===FeSO4+H2↑知识点一化学能转化为电能1.化学能直接转化为电能——原电池的实验探究2。
