材料科学基础知识点总结
材料科学基础复习知识点

1 简述刃型位错和螺型位错的区别答:不同点:1、柏氏矢量b垂直于位错线是刃型位错,b平行于位错线是螺型位错。
2、对刃型位错外加作用力F与外加切应力t一致,对螺型位错F与t垂直 3、刃型位错由于b 垂直于位错线,所以具有唯一的滑移面,而螺型位错的b平行于位错线,所以滑移面不是唯一的。
4、刃型位错的应力场既有正应力也有切应力,而螺位错的应力场只有切应力没有正应力。
5、刃型位错既能滑移又能攀移,螺位错只能滑移不能攀移。
6,刃型位错可以形成对称倾侧晶界螺型位错可形成扭转晶界。
相同点:1.都是已滑移与未滑移的交线。
2,当位错线沿滑移面滑过整个晶体时,就会在晶体表面沿柏氏矢量方向产生一个滑移台阶,其宽度等于柏氏矢量b。
常见晶体缺陷各举一例位错运动方式面心立方金属不全位错有哪些?位错线是什么?位错增殖机制:假定有一两端扎钉的位错线段AB,在t作用下AB受F=tb作用,所以AB发生滑移,但AB 固定所以AB发生弯曲当r=r(min) 位错线在t的作用下不断扩展,当位错线m,n点相遇时彼此抵消,原来整根位错线断成两部分外部是一个封闭的位错环里面是一段位错线AB,在t的作用下位错环不断向外拓展,AB不断重复上述过程,结果便放出大量位错环造成位错的增值。
扭折:位错交割生成的小曲折线段与原位错线在同一滑移面上。
割阶:位错交割生成的小曲折线段与原位错线不在同一滑移面上。
固熔体:是固态下一种组元熔解在另一种组元中形成的新相,其特点是固熔体具有熔剂组元的点阵类型。
相:是指在任一给定的物质系统中,具有同一化学成分,同一原子聚集状态和性质的均匀连续组成部分。
置换固熔体:熔质原子占据熔剂点阵的固熔体。
间隙固熔体:是由那些原子半径小于0.1mm的非金属元素熔入到熔剂金属晶体点阵的间隙中所形成的固熔体中间相:金属与金属,或金属与类金属之间所形成的化合物统称为金属间化合物。
由于它们常处在相图的中间位置上,故又称中间相。
间隙相:当非金属原子半径与过渡金属原子半径之比(Rx/RM)<0.59时化合物具有比较简单的结构称为简单间隙化合物,又称间隙相。
材料科学基础笔记1

第一章原子结构与键合此章主要掌握概念1.金属键(1)典型金属原子结构的特点是其最外层电子数很少,极易挣脱原子核的束缚而成为自由电子,并在整个晶体内运动,及弥漫于金属正离子组成的晶格之中而形成电子云。
这种由金属中的自由电子与金属正离子相互作用所构成的键合为金属键。
(2)绝大多数金属均以金属键方式结合,它的基本特点是电子的共有化,而且无方向性,无饱和性.(3)金属一般具有良好的到点和导热,以及良好的延展性的原因:自由电子的存在。
2.离子键大多数盐类、碱类和金属氧化物主要以离子键的方式结合,靠静电引力结合在一起。
3。
共价键共价键是由两个或多个电负性相差不大的原子通过共用电子对而形成的化学键。
共价键又分为非极性键和极性键两种.有方向性和饱和性。
4.范德瓦耳斯力是借助这种微弱的、瞬时的电偶极矩的感应作用,将原来具有稳定的原子结构的原子或分子结合为一体的键合,没有方向性和饱和性.5.氢键氢键是一种极性分子键,存在于HF、H2O、NF3等分子间,它的键能介于化学键与范德瓦耳斯力之间。
第二章固体结构重点:晶面指数和晶向指数、配位数以及致密度等一些概念、合金相结构的几种类型、间隙固溶体和间隙化合物和间隙相的异同点.主要是简答题按照原子或分子排列的特征可将固态物质分为两大类:晶体和非晶体.1.晶体结构的基本特征是,原子或分子或离子在三维空间呈周期性重复排列,即存在长程有序。
(各向异性)2.空间点阵:阵点在空间呈周期性规则排列,并具有完全相同的周围环境,这种由它们在三维空间规则排列的阵列称为空间点阵。
(概念题)3.晶格:为了便于描述空间点阵的图形,可用许多平行的直线将所有阵点连接起来,构成了一个三维几何架子。
(概念题)4。
晶胞:可在点阵中取出一个具有代表性的基本单元,作为点阵的组成单元。
(概念题)5。
选取晶胞的原则:a.选取的平行六面体应反映出点阵的最高对称性。
b.平行六面体内的棱和角相等的数目应最多。
c。
当平行六面体的棱边夹角存在直角时,直角数目应最多。
材料科学基础知识点总结(1)
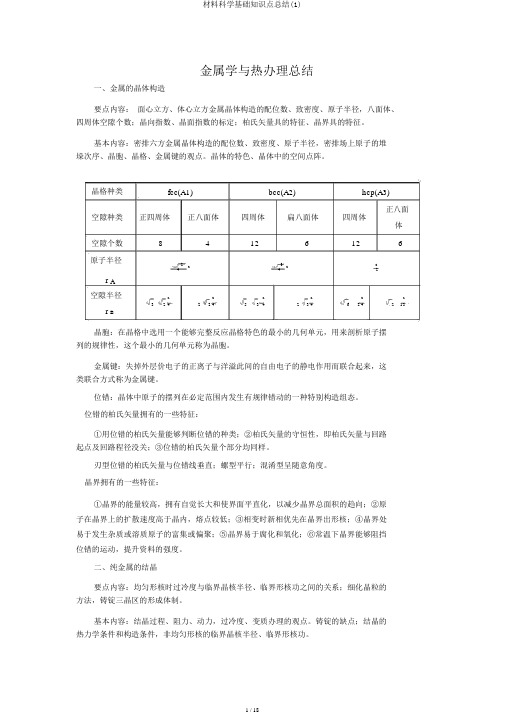
金属学与热办理总结一、金属的晶体构造要点内容:面心立方、体心立方金属晶体构造的配位数、致密度、原子半径,八面体、四周体空隙个数;晶向指数、晶面指数的标定;柏氏矢量具的特征、晶界具的特征。
基本内容:密排六方金属晶体构造的配位数、致密度、原子半径,密排场上原子的堆垛次序、晶胞、晶格、金属键的观点。
晶体的特色、晶体中的空间点阵。
晶格种类fcc(A1)bcc(A2)hcp(A3)空隙种类正四周体正八面体四周体扁八面体四周体正八面体空隙个数84126126原子半径2a3a a442r A空隙半径32a22a53a23a62a21a 444442r B晶胞:在晶格中选用一个能够完整反应晶格特色的最小的几何单元,用来剖析原子摆列的规律性,这个最小的几何单元称为晶胞。
金属键:失掉外层价电子的正离子与洋溢此间的自由电子的静电作用而联合起来,这类联合方式称为金属键。
位错:晶体中原子的摆列在必定范围内发生有规律错动的一种特别构造组态。
位错的柏氏矢量拥有的一些特征:①用位错的柏氏矢量能够判断位错的种类;②柏氏矢量的守恒性,即柏氏矢量与回路起点及回路程径没关;③位错的柏氏矢量个部分均同样。
刃型位错的柏氏矢量与位错线垂直;螺型平行;混淆型呈随意角度。
晶界拥有的一些特征:①晶界的能量较高,拥有自觉长大和使界面平直化,以减少晶界总面积的趋向;②原子在晶界上的扩散速度高于晶内,熔点较低;③相变时新相优先在晶界出形核;④晶界处易于发生杂质或溶质原子的富集或偏聚;⑤晶界易于腐化和氧化;⑥常温下晶界能够阻挡位错的运动,提升资料的强度。
二、纯金属的结晶要点内容:均匀形核时过冷度与临界晶核半径、临界形核功之间的关系;细化晶粒的方法,铸锭三晶区的形成体制。
基本内容:结晶过程、阻力、动力,过冷度、变质办理的观点。
铸锭的缺点;结晶的热力学条件和构造条件,非均匀形核的临界晶核半径、临界形核功。
相起伏:液态金属中,时聚时散,起伏不定,不停变化着的近程规则摆列的原子公司。
材料科学基础重点知识

第5章 纯金属的凝固1、金属结晶的必要条件:过冷度-理论结晶温度与实际结晶温度的差;结构起伏-大小不一的近程有序排列的此起彼伏;能量起伏-温度不变时原子的平均能量一定,但原子的热振动能量高低起伏的现象;成分起伏-材料内微区中因原子的热运动引起瞬时偏离熔液的平均成分,出现此起彼伏的现象。
结晶过程:形核和长大过程交替重叠在一起进行2、过冷度与液态金属结晶的关系:液态金属结晶的过程是形核与晶核的长大过程。
从热力学看,没有过冷度结晶就没有趋动力。
根据T R k ∆∝1可知当过冷度T ∆=0时临界晶核半径R *为无穷大,临界形核功(21T G ∆∝∆)也为无穷大,无法形核,所以液态金属不能结晶。
晶体的长大也需要过冷度,所以液态金属结晶需要过冷度。
孕育期:过冷至实际结晶温度,晶核并未立即产生,结晶开始前的这段停留时间3、均匀形核和非均匀形核均匀形核:以液态金属本身具有的能够稳定存在的晶胚为结晶核心直接成核的过程。
非均匀形核:液态金属原子依附于固态杂质颗粒上形核的方式。
临界晶核半径:ΔG 达到最大值时的晶核半径r *=-2γ/ΔGv 物理意义:r<rc 时, ΔGs 占优势,故ΔG>0,晶核不能自动形成。
r>rc 时, ΔGv 占优势,故ΔG<0,晶核可以自动形成,并可以稳定生长。
临界形核功:ΔGv *=16πγ3/3ΔGv 3 形核率:在单位时间单位体积母相中形成的晶核数目。
受形核功因子和原子扩散机率因子控制。
4、正的温度梯度:靠近型壁处温度最低,凝固最早发生,越靠近熔液中心温度越高。
在凝固结晶前沿的过冷度随离界面距离的增加而减小。
纯金属结晶平面生长。
负的温度梯度:过冷度随离界面距离的增加而增加。
纯金属结晶树枝状生长。
5、光滑界面即小平面界面:液固两相截然分开,固相表面为基本完整的原子密排面,微观上看界面光滑,宏观上看由不同位向的小平面组成故呈折线状的界面。
粗糙界面即非小平面界面:固液两相间界面微观上看高低不平,存在很薄的过渡层,故从宏观上看界面反而平直,不出现曲折小平面的界面。
材料科学基础材料结构的基本知识

负性很强的原子之间形成一个桥梁,把 两者结合起来,形成氢键。所以氢键可 表达为:
X–H——Y 三、混合键
实际材料中单一结合键并不多,大 部分材料的内部原子结合键往往是各种 键的混合。例如: (1)ⅣA族的Si、Ge、Sn元素的结合
材料科学基础材料结构的基本知识
是共价键与金属键的混合。 (2)陶瓷化合物中出现离子键与共价键 混合的情况。
四、结合键的本质与原子间距
固体原子中存在两种力:吸引力 和排斥力。它们随原子间距的增大而 减小。当距离很远时,排斥力很小, 只有当原子间接近至电子轨道互相重
材料科学基础材料结构的基本知识
叠时斥力才明显增大,并超过了吸引力。
在某一距离下引力和斥力相等,这一距
离r0相当于原子的平衡距离,称原子间距。 力(F)核能量(E)之间的转换关
键的形成——在凝聚状态下,原子间距 离十分接近,便产生了原子间的作用力, 使原子结合在一起,就形成了键。 键分为一次键和二次键: 一次键——结合力较强,包括离子键、 共价键和金属键。 二次键——结合力较弱,包括范德瓦耳 斯键和氢键。
材料科学基础材料结构的基本知识
一、一次键
离子键——当两类原子结合时,金属原 子的外层电子很可能转移到非金属原子 外壳层上,使两者都得到稳定的电子结 构,从而降低体系的能量,此时金属原 子和非金属原子分别形成正离子和负离 子,正负离子间相互吸引,使原子结合 在一起,这就是离子键。(如NaCl)
原子核外电子的分部与四个量子数 有关,且服从下述两个基本原理: (1)泡利不相容原理 一个原子中不 可能存在有四个量子数完全相同的两个 电子。 (2)最低能量原理 电子总是优先占 据能量低的轨道,使系统处于最低的能 量状态。
材料科学基础重点知识

《材料科学基础》重要知识点1、在离子晶体中,正、负离子的配位数大小由结构中正、负离子半径的比值决定。
2、聚合物的形成过程是分化和缩聚同时进行的一种动态平衡过程。
3、硅酸盐熔体的结构特点:多种聚合物同时并存,而不是一种独存。
正是由于这个特点,硅酸盐熔体的结构是长程无序的。
但每一个聚合体又是具有晶体结构的,即硅酸盐熔体中存在短程有序的负离子团。
4、影响聚合物聚合程度的因素(1)温度的影响:随温度升高,低聚合物浓度增加,而高聚合物浓度降低。
(2)熔体组成的影响:R为O/Si比的大小。
O/Si比R越大,低聚合物浓度越大,高聚合物浓度越小。
5、影响熔体粘度的主要因素是温度和化学组成。
粘度---温度关系:温度升高,粘度减小。
粘度—组成关系(1) O/Si比:硅酸盐熔体的粘度首先取决于硅氧四面体网络的聚合程度,即随O/Si比的上升而下降。
(2)一价碱金属氧化物①加入碱金属氧化物(Li2O、Na2O、K2O、Rb2O、Cs2O)降低硅酸盐熔体的粘度。
②碱金属氧化物的含量越高,硅酸盐熔体的粘度越小。
③不同的碱金属氧化物对粘度的影响大小也与碱金属氧化物的含量有关。
当R2O含量较低时(O/Si较低),加入的正离子半径越小,降低粘度的作用越大,其次序是:Li+>Na+>K+>Rb+>Cs+。
当熔体中R2O含量较高(O/Si比较高)时,R2O对粘度影响的次序是Li+<Na+<K+。
(3)二价金属氧化物:二价碱土金属氧化物(ⅡA族)一般降低硅酸盐熔体的粘度。
但不同的氧化物降低粘度的程度不同,其降低粘度的次序是:Ba2+>Sr2+>Ca2+>Mg2+,所以粘度大小次序为:Ba2+<Sr2+<Ca2+<Mg2+。
(4)阳离子配位数:阳离子配位数对粘度的影响是通过B2O3的研究而取得的。
①当B2O3含量较少(即Na2O/B2O3>1)时,粘度随含量升高而增加。
这是因为此时“游离”氧充足,故B3+处于[BO4]四面体状态,结构紧密。
张联盟材料科学基础(第2版)知识点总结笔记课后答案

第1章材料引言1.1复习笔记一、材料类型材料按其化学作用(或基本组成)分为金属材料、无机非金属材料、高分子材料(聚合物)和复合材料四大类。
1.金属材料(1)金属材料的定义金属材料是指由元素周期表中的金属元素组成的材料。
(2)金属材料的分类① 单质单质是指由一种金属元素构成的纯金属。
② 合金合金是指由两种或两种以上的金属元素,或金属元素与非金属元素形成的具有金属特性的新物质。
a.一次固溶体一次固溶体,又称端际固溶体,是指当合金的晶体结构保持溶剂组元,同时将外来组元引入晶体结构,占据主晶相质点位置一部分或间隙位置一部分后仍保持一个晶相的合金。
b.金属间化合物金属间化合物是指金属元素与其他金属元素或非金属元素之间形成的合金。
2.无机非金属材料(1)无机非金属材料的定义无机非金属材料是指由硅酸盐、铝酸盐、硼酸盐、磷酸盐、锗酸盐等原料和(或)氧化物、氮化物、碳化物、硼化物、硫化物、硅化物、卤化物等原料经一定的工艺制备而成的材料,是除金属材料、高分子材料以外所有材料的总称。
(2)无机非金属材料的分类① 传统无机非金属材料传统无机非金属材料是指由SiO2及硅酸盐化合物为主要成分制成的材料,包括陶瓷、玻璃、水泥和耐火材料等。
② 新型无机非金属材料新型无机非金属材料是指用氧化物、氮化物、碳化物、硼化物、硫化物、硅化物以及各种无机非金属化合物经特殊的先进工艺制成的材料,主要包括先进陶瓷、非晶态材料、人工晶体、无机涂层、无机纤维等。
3.有机高分子材料(聚合物)(1)高聚物的定义高聚物是指由一种或几种简单低分子化合物经聚合而组成的分子量很大的化合物。
(2)高聚物的分类① 按材料的来源分为天然高分子材料和合成高分子材料。
② 按性能和用途分为橡胶、纤维、塑料和胶粘剂等。
4.复合材料复合材料的分类(1)按基体材料分为金属基复合材料、陶瓷基复合材料、水泥、混凝土基复合材料、塑料基复合材料、橡胶基复合材料等。
(2)按增强剂形状分为粒子、纤维及层状复合材料。
839材料科学基础

2.5 共价晶体结构
第三章 晶体缺陷(★★★★)
什么是晶体缺陷?有几种存在方式? 3.1 点缺陷 点缺陷的形成有哪几种?离子晶体? 点缺陷的平衡浓度的形成原因?
真题再现
平衡浓度的公式
n 点C缺陷 的运动Aexp(
EV
)
N
kT
3.2 位错 刃型位错和螺型位错的特点,混合位错。 伯氏矢量的确定?位错型的确定?特性? 位错的运动?滑移、攀移,交割。要求会判断运动方向等问题
4.1 表象理论
菲克第一定律
J D d 物理意义,单位,使用条件
菲克第二定dx律 使用条件,理解其推导过程
化学扩散,自扩散 渗碳厚度计算
(x, t)
s
(s
0 )erf
( 2
x) Dt
x A Dt 或x2 BDt
薄膜扩散衰减分布
(x, t) M exp( x2 )
置换固溶体2中的D扩t 散 4Dt 柯肯达尔效应,互扩散系数
4.7 反应扩散
概念,不存在两相混合区的解释 4.8 离子晶体中的扩散
真题再现
第五章 材料的形变和再结晶(★★★★★)
5.1 弹性和粘弹性 了解弹性形变的本质 弹性模量的物理意义和其对材料的影响
真题再现
弹性不完整性的现象 粘性流动和粘弹性的概念,性质,粘弹性的物理模型
5.2 晶体的塑性变形 什么是滑移线和滑移带?什么是滑移系? fcc,bcc,hcp的滑移系各是什么,会产生什么影响
(三)晶体中的缺陷 1.点缺陷 2.位错 3.面缺陷
(四)固体中的扩散 1.扩散的表象理论 2.扩散的热力学 3.扩散的微观理论与机制 4.扩散激活能 5.影响扩散的因素 6.反应扩散 7.离子晶体中的扩散
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、基本知识点 1.结合键与晶体学基础(1)化学键包括离子键:静电吸引作用共价键金属键:金属正离子与自由电子之间的相互作用构成的金属原子间的结合力。
没有方向性和饱和性。
(理论包括自由电子模型和能带理论)
物理键包括
范德华键:包括3种,静电力、诱导力、色散力。
特点有:1、存在于分子或原子间的一种较弱的吸引力 2、作用能约为几十个kj/mol,比化学键小1-2数量级 3、一般没有方向性和饱和性。
氢键:存在于含氢的物质,与范德华健不同的是,氢键是有方向性和饱和性的较强的分子间力。
(2)晶体:是内部质点(原子、分子或离子)在三维空间以周期性重复方式作有规则的排列的固体,即晶体是具有格子构造的固体(1、有确定的熔点2、各向异性,即不同方向性能不同)。
非晶体:原子散乱分布或仅有局部区域的短程规则排列。
玻璃相:
相:材料中均匀而具有物理特性的部分,并和体系的其他部分有明显界面的称为“相”(3)空间点阵:把由一系列在三维空间周期性排列的几何点阵成为一个空间点阵
晶胞:组成各种晶体构造的最小体积单位
晶面:在晶体结构内部中,由物质质点所组成的平面晶向:穿过物质的质点所组成的直线方向晶格:晶系:晶向族
晶面族:在晶体中有些晶面上原子排列和分布规律是完全相同的,晶面间距相同,而晶面在空间的位向不同,这样一组等同晶面称为一个晶面族同素异构
(4)八面体间隙四面体间隙
配位数:指在晶体结构中,该原子或离子的周围与其直接相邻结合的原子个数或所有异号离子的个数
致密度:一个晶胞中原子所占体积与晶胞体积的比值晶胞中的原子数 2、材料的结构
固溶体:将外来组元引入晶体结构,占据主晶相质点位置一部分或间隙位置一部分,仍保持一个晶相,这种晶体称为固溶体(即溶质溶解在溶剂中形成固溶体)。
根据外来组元在主晶相中所处位置,可分为置换固溶体和间隙固溶体。
按外来组元在主晶相中的固溶度,可分为有限固溶体和无限固溶体。
置换固溶体:溶质取代了溶剂中原子或离子所形成的固溶体
聚合度(等规度):在聚合物中的有规立构聚合的百分含量 3、晶体结构缺陷
肖脱基缺陷:离位原子迁移到外表面或内界面处,这种空位称肖脱基空位
弗兰克尔缺陷(空位):离位原子迁移到晶体点阵的间隙中,则称为弗兰克尔空位
间隙原子:形成弗兰克尔空位的同时将形成等量的间隙原子,间隙原子可以是晶体本身固有的同类原子(称自间隙原子),也可以是外来的异类间隙原子。
置换原子:将晶体中的原子置换的外来原子
刃位错:在晶体中有一个刀刃状的多余半原子面,所以称为刃型位错。
(分正刃型位错和负刃型位错)(位错线和滑移方向垂直)螺位错:沿位错线原子面呈螺旋形,每绕轴一周,原子面上升一个原子间距,这种位错称螺型位错。
分为左旋和右旋(右手法则、左手法则)(位错线和滑移方向平行)
混合位错:曲线和滑移方向既不垂直又不平行,原子排列介于螺型和刃型位错之间,称为混合型位错
柏氏回路:从实际晶体中的任意一个原子出发,围绕位错线作一个闭合回路,要求回路的方向和位错线的正方向成右螺旋关系,回路的每一步都连接相邻的原子,作回路时应避开位错线附近原子严重错排的区域。
此回路称为柏氏回路
柏氏矢量:用形成位错的滑移矢量定义位错矢量,并称为柏氏矢量。
(以b表示,只有位错
才有柏氏矢量,矢量的模∣b∣称为位错强度)位错密度:指单位体积内位错线的总长度单位位错:穿过单位面积的位错数目ρA
全位错:柏氏矢量等于点阵矢量的位错(亦称完整位错)不全位错:柏氏矢量不等于点阵矢量的位错
扩展位错:两个不全位错之间夹着一片层错,这种两个不全位错加一片层错的位错称为扩展位错层错:
7、晶态固体材料中的界面晶界:多晶体中晶粒之间的界面
相界:异相界面两侧的区域属于不同相,因此简称为相界
孪晶界:最简单的特殊大角度晶界是共格孪晶界,如果界面上的原子正好坐落在两晶体的晶格结点上,这种晶界称为共格晶界。
两个晶粒的取向相对于某一晶面互为对称时,这两个晶体称为孪晶。
该对称面叫做孪晶面。
如果两晶粒的界面平行于孪晶面,且界面上的原子完全坐落在界面两侧晶体的点阵位置上,这种界面称为共格孪晶界共格相界:若界面原子同时处于两相点阵的节点上,即在相界面上两相原子完全相互匹配时,该相界称为共格界面
非共格相界:若两相原子排列差异很大或即使它们的排列相似但原子间距差异超过25%,这两种情况都产生非共格晶界
小角(度)晶界:两个晶粒之间的位向差小于10度,它们之间的晶界叫小角度晶界
大角(度)晶界:若两个晶粒之间的位向差大于10度,则称为大角度晶界
亚晶界:即属于小角度晶界(取向差一般小于2度)
二、基本要求
1、会画晶面及晶向及标出其指数
2、会判断位错反应、分析位错的运动和位错的交互作用
3、会用以下工具分析二元相图、三元相图截面图和投影图:热分析法、相律、杠杆定律、重心法则、相区相邻原则、直线法则
4、会应用材料科学的基本知识分析或解释实际生产中材料的凝固或结晶过程以及材料的性能(单晶、晶粒细化、定向凝固、铸造性能等)。
三、基本公式
1.公式六方晶系三轴-四轴换算公式 2.公式点缺陷平衡浓度计算公式 3.公式螺位错应力分量 4.公式刃位错应力分量
5.公式螺位错、刃位错及混合位错应变能公式 6、公式临界晶核半径 7.公式临界形核功 8.公式形核率
9.公式非均匀形核的临界晶核半径及临界形核功 10、公式成分过冷条件。
