2014高考化学一轮复习同步题库-难溶电解质的溶解平衡解读
2014届高考化学(广西专用)一轮复习:8-4 难溶电解质的溶解平衡.pdf

第讲 难溶电解质的溶解平衡 一、选择题 1.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( ) A.AgCl>AgI>Ag2CrO4 B.AgCl>Ag2CrO4>AgI C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl 解析 AgClc(Ag+)=c(Cl-),由Ksp(AgCl)=c(Ag+)·c(Cl-),则c(Ag+)=;AgI饱和溶液中,c(Ag+)=c(I-),由Ksp(AgI)=c(Ag+)·c(I-),则c(Ag+)=;Ag2CrO4饱和溶液中,c(Ag+)=2c(CrO),由Ksp(Ag2CrO4)=c2(Ag+)·c(CrO),则c(Ag+)=,代入数值,可以计算出三种盐的饱和溶液中c(Ag+)大小顺序为:Ag2CrO4>AgCl>AgI,C项正确。
答案 C 2.下列对沉淀溶解平衡的描述正确的是( )A.反应开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 解析 反应开始时,各离子的浓度没有必然的关系,A项不正确;沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,C项不正确;沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动,D项不正确。
答案 B 3.下列实验操作与预期实验目的或所得实验结论一致的是( ) 选项实验操作实验目的或结论A某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体说明该钾盐是K2CO3B向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤除去MgCl2溶液中少量FeCl3C常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生说明常温下Ksp(BaCO3)1,A错误; Ksp(CaF2)只随温度的变化而变化,B错误;因>1,故该体系有沉淀产生,C错误。
2014年高考化学一轮复习测试卷及解析(41):难溶电解质的溶解平衡

高考化学一轮复习测试卷及解析(41):难溶电解质的溶解平衡题组一溶解平衡与溶度积常数1.(2010·山东理综,15)某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是()A.K sp[Fe(OH)3]<K sp[Cu(OH)2]B.加适量NH4Cl固体可使溶液由a点变到b点C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和2.(2009·浙江理综,10)已知:25 ℃时,K sp[Mg(OH)2]=5.61×10-12,K sp[MgF2]=7.42×10-11。
下列说法正确的是()A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的K sp比在20 mL 0.01mol·L-1 NH4Cl溶液中的K sp小D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2题组二溶解平衡的应用3.判断正误(1)常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下,K sp(BaCO3)<K sp(BaSO4)()(2010·江苏-10C)(2)AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同()(2010·天津理综-4C) 4.(2010·海南,5)已知:K sp(AgCl)=1.8×10-10,K sp(AgI)=1.5×10-16,K sp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是()A.AgCl>AgI>Ag2CrO4B.AgCl>Ag2CrO4>AgIC.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl5.(2009·江苏,9改编)下列化学实验事实及其解释都正确的是()A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸C.向0.1 mol·L-1 FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性D.向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的K sp比AgI的K sp小6.(1)若把固体TiO 2·n H 2O 用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。
2014高考化学一轮复习课件专题七第四单元难溶电解质的沉淀溶解平衡(56张PPT)

适量的NaOH溶液
⑤恒温下向溶液中加入CaO,溶液的pH升高
⑥给溶液加热,溶液的pH升高 ⑦向溶液中加入Na2CO3溶液,其中固体质量增加
⑧向Байду номын сангаас液中加入少量NaOH固体,Ca(OH)2固体质量不变
A.①⑦ C.③④⑤⑥ 解析 B.①②⑦⑧ D.①③⑦⑧
②Ksp=c(Ca2+)·2(OH-),溶度积常数随温度变化而 c
容易实现。 ②沉淀的溶解度差别越大,越容易转化。 (2)实例:
NaCl NaBr AgNO3 ――→ AgCl( 白 色 沉 淀 ) ――→ AgBr( 淡 黄 色 沉 KI Na2S 淀)――→AgI(黄色沉淀)――→Ag2S(黑色沉淀)。
【典例2】
(2013· 扬州质检)已知下表数据:
物 质 Fe(OH)2 Cu(OH)2 Fe(OH)3
方法
2.沉淀的溶解 (1)酸溶解法:如CaCO3溶于盐酸,离子方程式为: CaCO3+2H+===Ca2++H2O+CO2↑ ____________________________________。 (2)盐溶解法:如Mg(OH)2溶于NH4Cl溶液,离子方程式为: Mg(OH)2+2NH4+===Mg2++2NH3· 2O H ______________________________________。
解度相差不是很大”。
必考点61 沉淀溶解平衡及其影响因素
1.内因 难溶电解质本身的性质,这是决定因素。 2.外因
(1)浓度:加水稀释,平衡向溶解的方向移动,但Ksp
不变。 (2)温度:绝大多数难溶电解质的溶解是吸热过程,升
高温度,平衡向溶解的方向移动,Ksp增大。
(3)相同离子:向平衡体系中加入难溶物相应的离子, 平衡逆向移动。
高三化学一轮复习精练 第26讲 难溶电解质的溶解平衡(含解析) 新人教版

第26讲难溶电解质的溶解平衡基础热身1.下列对沉淀溶解平衡的描述正确的是( )A.开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解2.在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时( )A.c(Ba2+)=c(SO2-4)B.c(Ba2+)=c(SO2-4)=[K sp(BaSO4)]1/2C.c(Ba2+)≠c(SO2-4),c(Ba2+)·c(SO2-4)=K sp(BaSO4)D.c(Ba2+)≠c(SO2-4),c(Ba2+)·c(SO2-4)≠K sp(BaSO4)3.[2013·广东六校联考] (双选)下列实验现象、解释与结论均正确的是( )4.[2012·江西六校第一次联考] 在溶液中有浓度均为0.01 mol·L的Fe、Cr、Zn +、Mg2+等离子,已知:K sp[Fe(OH)3]=2.6×10-39;K sp[Cr(OH)3]=7.0×10-31;K sp[Zn(OH)2]=1.0×10-17;K sp[Mg(OH)2]=1.8×10-11。
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小( )A.Fe3+B.Cr3+C.Zn2+ D.Mg2+5.[2013·广东六校联考] (双选)下列有关说法不正确...的是( )A.25 ℃时,0.1 mol·L-1的三种溶液的pH关系为:pH(NaHCO3)>pH(Na2CO3)>pH(CH3COONa) B.25 ℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等C.25 ℃时,BaCO3在纯水中的K sp比在Na2CO3溶液中的K sp大D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO-3)+2c(CO2-3)能力提升6.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图K26-1所示。
【步步高】2014届高考化学一轮复习 8-4 难溶电解质的溶解平衡 鲁科版

能正确表示 t1 时刻后 Ag+和 SO 2-4 浓度随时间变化关系的是
解析 t1 时刻 c(Ag+)=0.034 mol·L-1,c(SO2-4 )=0.017 mol·L-1;当加入 100 mL
mol·L-1 的 Na2SO4(aq)瞬间,c′(Ag+)=0.017
1 =2(0.017+0.02)
2.下列对沉淀溶解平衡的描述正确的是
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
B.2 mol·L-1 硫酸溶液
D.0.1 mol·L-1 硫酸溶液
5.下列实验操作与预期实验目的或所得实验结论一致的是
选项 实验操作
某钾盐溶于盐酸,产生能使澄清石灰水
A 变浑浊的无色无味气体
B
C
D
向含有少量 FeCl3 的 MgCl2 溶液中加入足
量 Mg(OH)2 粉末,搅拌一段时间后过滤
常温下,向饱和 Na2CO3 溶液中加少量
BaSO4 粉末,过滤,向洗净的沉淀中加稀
一、选择题
1.在下列液体中,BaSO4 的溶解度最大的是
A.1 mol·L-1 硫酸溶液
C.纯水
第四讲 难溶电解质的溶解平衡
解析 能使 BaSO4(s)Ba2+(aq)+SO2-4 (aq)平衡发生右移的因素,都能使 BaSO4 的 溶
解度增大,加入 H2SO4 溶液,由于同离子效应,使得平衡左移。 答案 C
6.已知 Ag2SO4 的 Ksp 为 2.0×10-5,将适量 Ag2SO4 固体溶于 100 mL 水中至刚好饱和,该过 程中 Ag+和 SO 2-4 浓度随时间变化关系如图所示饱和 Ag2SO4 溶液中[Ag+]=0.034
2014年高考化学真题之专题专题17 难溶电解质的溶解平衡
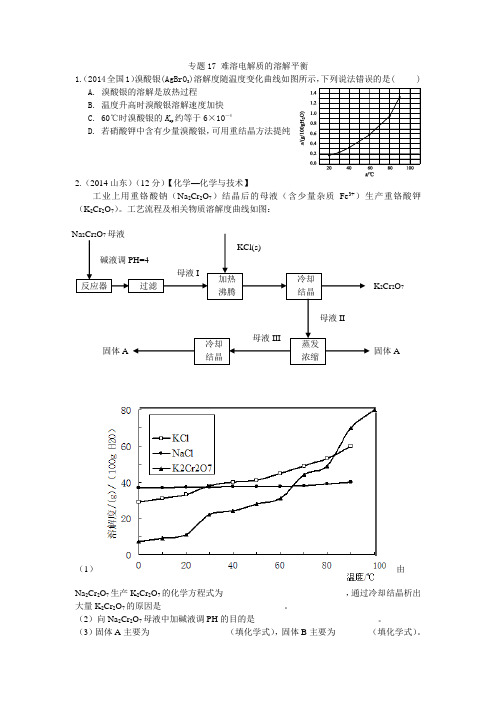
加热 沸腾 母液I KCl(s) 母液II 固体A 母液III 固体A 反应器 过滤 碱液调PH=4 冷却 结晶蒸发 浓缩 冷却 结晶 Na 2Cr 2O 7母液 K 2Cr 2O 7 专题17 难溶电解质的溶解平衡1.(2014全国1)溴酸银(AgBrO 3)溶解度随温度变化曲线如图所示,下列说法错误的是( )A. 溴酸银的溶解是放热过程B. 温度升高时溴酸银溶解速度加快C. 60℃时溴酸银的K sp 约等于6×10-4D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯2.(2014山东)(12分)【化学—化学与技术】工业上用重铬酸钠(Na 2Cr 2O 7)结晶后的母液(含少量杂质Fe 3+)生产重铬酸钾(K 2Cr 2O 7)。
工艺流程及相关物质溶解度曲线如图:(1)由Na 2Cr 2O 7生产K 2Cr 2O 7的化学方程式为____________________________,通过冷却结晶析出大量K 2Cr 2O 7的原因是____________________________。
(2)向Na 2Cr 2O 7母液中加碱液调PH 的目的是____________________________。
(3)固体A 主要为__________________(填化学式),固体B 主要为________(填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液______(填“I”“II”或“III”)中,既能提高产率又可使能耗最低。
3.(2014全国2)(15分)某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。
为确定其组成,进行如下实验:①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸溶液吸收。
高考化学一轮复习 第四节 难溶电解质的溶解平衡习题讲解课件
ppt精选
13
2.解析:实验①中为了不引入杂质离子,应加入氨水使 Fe3+沉淀,
而不能用 NaOH 溶液。实验②中根据溶解度数据可知 Mg(OH)2 能转化为 Fe(OH)3,因此在 MgCl2 溶液中加入足量 Mg(OH)2 除去 Fe3+,然后将沉淀一并过滤。实验③中利用 Fe3+极易水解
的特点,根据题意可知调节溶液的 pH=4 可使 Fe3+沉淀完全,
ppt精选
6
2.解析:②会生成 CaCO3,使 Ca2+浓度减小,错误;加入氢氧 化钠溶液会使平衡左移,有 Ca(OH)2 沉淀生成,但 Ca(OH)2 的溶度积较大,要除去 Ca2+,应把 Ca2+转化为更难溶的
CaCO3,③错误;恒温下 Ksp 不变,加入 CaO 后,溶液仍为 Ca(OH)2 的饱和溶液,pH 不变,④错误;加热,Ca(OH)2 的溶
为了不引入杂质离子,可使用 CuO、Cu(OH)2 等调节溶液的 pH。
答案:(1)Fe(OH)3 (2)氨水 不会引入新的杂质
解度减小,溶液的 pH 降低,⑤错误;加入 Na2CO3 溶液,沉
淀溶解平衡向右移动,Ca(OH)2 固体转化为 CaCO3 固体,固体
质量增加,⑥正确;加入 NaOH 固体平衡向左移动,Ca(OH)2
固体质量增加,⑦错误。
答案:A
ppt精选
7
考点二 [教材知识层面] 1.(1)Fe3++3NH3·H2O===Fe(OH)3↓+3NH4+ (2)Cu2++H2S===CuS↓+2H+ 2.(1)CaCO3+2H+===Ca2++CO2↑+H2O (2)Mg(OH)2+2NH+4 ===Mg2++2NH3·H2O 3.(1)沉淀溶解平衡 (2)AgCl AgBr (3)溶解度小 溶解度更 小 (4)①CaSO4+CO32-===CaCO3+SO42- ②ZnS+Cu2+===CuS+Zn2+
高考化学一轮复习 课时练24 难溶电解质的溶解平衡(含解析)新人教版
学习资料难溶电解质的溶解平衡基础巩固1.(2020山东日照校级期末联合考试)已知K sp(CaCO3)=2。
8×10—9,K a1(H2CO3)=4。
2×10—7、K a2(H2CO3)=5.6×10-11。
溶洞是碳酸盐类岩石受到溶有CO2的流水长年累月的溶蚀而形成的,反应的原理可表示为CaCO3+H2CO3Ca2++2HC O3-,该反应的平衡常数为( )A.3。
7×10—13B.6.7×10—3C.5×10—3D。
2.1×10-52.(2020北京东城区模拟)工业上常用还原沉淀法处理含铬废水(Cr2O72-和Cr O42-),常温下,其流程为:CrO42-(黄色)Cr2O72-(橙色)Cr3+(绿色)Cr(OH)3↓已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq) K sp=c(Cr3+)·c3(OH-)=10-32下列有关说法正确的是( )A.步骤①中当v(Cr O42-)=2v(Cr2O72-)时,说明反应2Cr O42-+2H+Cr2O72-+H2O达到平衡状态B.若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由黄色变橙色C.步骤②中,若要还原1 mol Cr2O72-,需要12 mol 的Fe2+D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽[当溶液中c(Cr3+)≤10—5 mol·L-1时,可视作该离子沉淀完全]3。
(2020山东淄博一模)常温下,用AgNO3溶液分别滴定浓度均为0。
01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解).已知K sp(AgCl)数量级为10-10。
下列叙述不正确的是( )A.图中Y线代表的Ag2C2O4B.n点表示AgCl的过饱和溶液C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀D.Ag2C2O4+2Cl-2AgCl+C2O42-的平衡常数为1.0×10-0.714.(2020山东枣庄期末)25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[—lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下K sp[Cu(OH)2]〈K sp[Fe(OH)2]。
高考化学热点《难溶电解质的沉淀溶解平衡》
【热点思维】【热点释疑】1、怎样判断沉淀能否生成或溶解?通过比较溶度积与非平衡状态下溶液中有关离子浓度幂的乘积-—离子积Q c的相对大小,可以判断难溶电解质在给定条件下沉淀生成或溶解的情况:Q c>K sp,溶液有沉淀析出;Q c=K sp,溶液饱和,沉淀的生成与溶解处于平衡状态;Q c〈K sp,溶液未饱和,无沉淀析出。
2、如何理解溶度积(K sp)与溶解能力的关系?溶度积(K sp)反映了电解质在水中的溶解能力,对于阴阳离子个数比相同的电解质,K sp的数值越大,难溶电解质在水中的溶解能力越强;但对于阴阳离子个数比不同的电解质,不能通过直接比较K sp数值的大小来判断难溶电解质的溶解能力。
3、沉淀溶解平衡有哪些常考的知识点?沉淀生成的两大应用①分离离子:对于同一类型的难溶电解质,如向含有等浓度的Cl-、Br—、I—的混合溶液中滴加AgNO3溶液,AgCl、AgBr、AgI中溶度积小的物质先析出,溶度积大的物质后析出.②控制溶液的pH来分离物质,如除去CuCl2中的FeCl3就可向溶液中加入CuO或Cu(OH)2等物质,将Fe3+转化为Fe(OH)3而除去。
【热点考题】【典例】实验:①0。
1 mol·L-1 AgNO3溶液和0.01 mol·L—1 NaCl 溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0。
1 mol·L—1 KI溶液,出现浑浊;③向沉淀c中滴加饱和KI溶液,沉淀变为黄色。
下列分析正确的是()A.通过实验①②证明浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl—(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶【答案】C【对点高考】【2014年高考上海卷第11题】向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中()A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)均保持不变C.c(Ca2+)、c(OH-)均减小D.c(OH-)增大、c(H+)减小【答案】B【解析】试题分析:碳化钙溶于水与水反应生成氢氧化钙和乙炔,反应的化学方程式为CaC2+2H2O→Ca(OH)2+HC≡CH↑。
高考化学一轮必刷题 专题32 难溶电解质沉淀溶解平衡(含答案解析)
专题32 难溶电解质沉淀溶解平衡1.在一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)Ca 2+(aq)+2OH -(aq),当向此悬浊液中加入少量生石灰时,始终保持温度不变,则下列说法正确的是 A .n(OH -)增大B .n(Ca 2+)增大C .c(Ca 2+)不变D .c(H +)增大2.下列实验中,对应的操作、现象及实验原理或结论均正确的是3.在25℃时,FeS 的K sp =6.3×10-18,CuS 的K sp =1.3×10-36,ZnS 的K sp =1.3×10-24。
下列有关说法中正确的是A .饱和CuS 溶液中Cu 2+的浓度为1.3×10-36 mol·L -1B .25℃时,FeS 的溶解度大于CuS 的溶解度C .向物质的量浓度相同的FeCl 2、ZnCl 2的混合液中加入少量Na 2S ,只有FeS 沉淀生成D.向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大4.已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:K 2SO4·MgSO4·2CaSO4(s)2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。
则下列说法错误的是A.向该体系中分别加入饱和NaOH溶液和饱和碳酸钠溶液,沉淀溶解平衡均向右移动B.分析可知T1>T2>T3C.升高温度,溶浸速率增大,平衡向右移动D.该物质的Ksp =c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO42-)/c(K2SO4·MgSO4·2CaSO4)5.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。
下列说法正确的是()A.温度一定时, Ksp (SrSO4)随c(SO42-)的增大而减小B.三个不同温度中,313 K时Ksp (SrSO4)最大C.363 K时,图中a点对应的溶液是不饱和溶液D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液6.某碱浸液中c(MoO42-)=0.80mol·L−1,c(SO42-)=0.04 mol·L−1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四讲难溶电解质的溶解平衡一、选择题1.已知:K sp(AgCl)=1.8×10-10,K sp(AgI)=1.5×10-16,K sp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是() A.AgCl>AgI>Ag2CrO4B.AgCl>Ag2CrO4>AgIC.Ag2CrO4>AgCl>AgID.Ag2CrO4>AgI>AgCl解析AgCl饱和溶液中,c(Ag+)=c(Cl-),由K sp(AgCl)=c(Ag+)·c(Cl-),则c(Ag+)=K sp(AgCl);AgI饱和溶液中,c(Ag+)=c(I-),由K sp(AgI)=c(Ag+)·c(I-),则c(Ag+)=K sp(AgI);Ag2CrO4饱和溶液中,c(Ag+)=2c(CrO2-4),由K sp(Ag2CrO4)=c2(Ag +)·c(CrO2-4),则c(Ag+)=32K sp(Ag2CrO4),代入数值,可以计算出三种盐的饱和溶液中c(Ag+)大小顺序为:Ag2CrO4>AgCl>AgI,C项正确。
答案 C2.下列对沉淀溶解平衡的描述正确的是() A.反应开始时,溶液中各离子浓度相等B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解解析反应开始时,各离子的浓度没有必然的关系,A项不正确;沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,C项不正确;沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动,D项不正确。
答案 B3.下列实验操作与预期实验目的或所得实验结论一致的是() 选项实验操作实验目的或结论A某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 说明该钾盐是K 2CO 3 B 向含有少量FeCl 3的MgCl 2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 除去MgCl 2溶液中少量FeCl 3C常温下,向饱和Na 2CO 3溶液中加少量BaSO 4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 说明常温下K sp (BaCO 3)<K sp (BaSO 4) DC 2H 5OH 与浓硫酸170 ℃共热,制得的气体通入酸性KMnO 4溶液 检验制得气体是否为乙稀解析 KHCO 3也符合题意,A 错误;Mg(OH)2能与FeCl 3反应生成Fe(OH)3,由于Fe(OH)3 的溶解度小于Mg(OH)2,发生沉淀的转化;由于K sp (BaSO 4)<K sp (BaCO 3),所以该反应不发生,不会出现预期实验结论;C 2H 5OH 与浓硫酸共热后,产物中有SO 2、CO 2等杂质气体,SO 2也能与酸性KMnO 4溶液发生氧化还原反应。
答案 B4.已知25 ℃时,K a (HF)=3.6×10-4,K sp (CaF 2)=1.46×10-10,现向1 L 0.2 mol·L -1HF 溶液中加入1 L 0.2 mol·L -1 CaCl 2溶液,则下列说法中,正确的是( )A .25 ℃时,0.1 mol·L -1 HF 溶液中pH =1B .K sp (CaF 2)随温度和浓度的变化而变化C .该体系中没有沉淀产生D .该体系中HF 与CaCl 2反应产生沉淀解析 氢氟酸是弱电解质,不能完全电离,故pH>1,A 错误;K sp (CaF 2)只随温度的变化 而变化,B 错误;因c (Ca 2+)·c 2(F -)K sp (CaF 2)>1,故该体系有沉淀产生,C 错误。
答案 D5.往含I -和Cl -的稀溶液中滴入AgNO 3溶液,沉淀的质量与加入AgNO 3溶液体积的关系如图所示。
则原溶液中c (I -)/c (Cl -)的比值为( )A.(V 2-V 1)V 1 B.V 1V 2 C.V 1(V 2-V 1)D.V 2V 1解析 根据I -+Ag +===AgI ↓(黄色),Cl -+Ag +===AgCl ↓(白色),结合图示,可知I -、Cl -消耗AgNO 3溶液的体积分别为V 1、(V 2-V 1),因此在原溶液中c (I -)c (Cl -)=V 1(V 2-V 1)。
答案 C6.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH ,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是( )A .K sp [Fe(OH)3]<K sp [Cu(OH)2]B .加适量NH 4Cl 固体可使溶液由a 点变到b 点C .c 、d 两点代表的溶液中c (H +)与c (OH -)乘积相等D . Fe(OH)3、Cu(OH)2分别在b 、c 两点代表的溶液中达到饱和解析 根据题意,图中曲线为沉淀溶解平衡曲线,曲线上的所有点对应的溶液都是达到 沉淀溶解平衡的溶液,D 正确;选取曲线上的b 、c 两点,当溶液中两种阳离子浓度相同 时,Fe(OH)3饱和溶液中的OH -浓度小于Cu(OH)2饱和溶液中的OH -浓度,所以 K sp [Fe(OH)3]<K sp [Cu(OH)2],A 正确;向Fe(OH)3饱和溶液中加入NH 4Cl 固体,促进了氢 氧化铁的溶解,溶液中铁离子浓度增大,B 错误;由于一定温度下的水溶液中,水的离 子积是一个常数,所以c 、d 两点代表的溶液中c (H +)与c (OH -)乘积相等,C 正确。
答案 B7.有关AgCl 沉淀的溶解平衡的说法中,不正确的是( )A .AgCl 沉淀的生成和溶解不断进行,但速率相等B .AgCl 难溶于水,溶液中没有Ag +和Cl -C .升高温度,AgCl 沉淀的溶解度增大D .向AgCl 沉淀中加入NaCl 固体,AgCl 沉淀的溶解度降低解析 AgCl 固体在溶液中达到溶解平衡后,溶解与沉淀速率相等,但不为0,一般说来, 升高温度,有利于固体物质的溶解,A 、C 正确;AgCl 难溶于水,但溶解的部分电离出 Ag +和Cl -,B 错误;向AgCl 沉淀中加入NaCl 固体,增大了Cl -浓度,促使溶解平衡向左移动,降低了AgCl 的溶解度,D 正确。
答案 B8.已知25 ℃时,AgI 饱和溶液中c (Ag +)为1.23×10-8 mol·L -1,AgCl 的饱和溶液中c (Ag +)为1.25×10-5mol·L -1。
若在5 mL 含有KCl 和KI 各为0.01 mol·L -1的溶液中,加入8 mL0.01 mol·L -1 AgNO 3溶液,下列叙述正确的是( )A .混合溶液中c (K +)>c (NO -3)>c (Ag +)>c (Cl -)>c (I -) B .混合溶液中c (K +)>c (NO -3)>c (Cl -)>c (Ag +)>c (I -)C .加入AgNO 3溶液时首先生成AgCl 沉淀D .混合溶液中c (Cl -)c (I -)约为1.03×10-3解析 KCl 、KI 混合溶液中加入AgNO 3溶液,先生成AgI ,再生成AgCl ,因为 K sp (AgI)<K sp (AgCl),AgNO 3+KI===AgI ↓+KNO 3,n (KI)=0.01 mol·L -1×5×10-3 L = 5.0×10-5 mol ,消耗n (AgNO 3)=5.0×10-5 mol ,AgNO 3+KCl===AgCl ↓+KNO 3,过量 的AgNO 3为0.01 mol·L -1×8×10-3 L -5.0×10-5 mol =3.0×10-5 mol ,则KCl 过量,生成AgCl 为3.0×10-5mol ,由此得出反应后溶液中的溶质KNO 3、KCl ,生成AgCl 、AgI沉淀,验证A 错误;B 正确;混合溶液中c (Cl -)= 0.01 mol·L -1×5×10-3 L -3.0×10-5 mol5×10-3 L +8×10-3 L=0.01×213 mol·L -1=1.54×10-3 mol·L -1,c (Ag +)=K sp (AgCl )c (Cl -)=(1.25×10-5mol·L -1)21.54×10-3 mol·L -1=1.01×10-7 mol·L -1,由此计算c(I-)=K sp(AgI)c(Ag+)=(1.23×10-8 mol·L-1)21.01×10-7 mol·L-1=1.50×10-9 mol·L-1,则c(Cl-)c(I-)=1.54×10-3 mol·L-11.50×10-9 mol·L-1=1.03×106,D错误。
答案 B二、非选择题9.已知难溶电解质在水溶液中存在溶解平衡:M m A n(s)m M n+(aq)+n A m-(aq)K sp=c m(M n+)·c n(A m-),称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25 ℃)①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol ·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④________________________________________________________________________。
(1)由题中信息K sp越大,表示电解质的溶解度越________(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:_________________________________________。
(3)设计第③步的目的是______________________________________________________。
