高考化学方程式书写真题汇编
2024全国高考真题化学汇编:原电池

2024全国高考真题化学汇编原电池一、单选题 1.(2024甘肃高考真题)化学与生活息息相关,下列对应关系错误的是D .D2.(2024全国高考真题)一种可植入体内的微型电池工作原理如图所示,通过CuO 催化消耗血糖发电,从而控制血糖浓度。
当传感器检测到血糖浓度高于标准,电池启动。
血糖浓度下降至标准,电池停止工作。
(血糖浓度以葡萄糖浓度计)电池工作时,下列叙述错误的是A .电池总反应为6126261272C H O O 2C H O +=B .b 电极上CuO 通过Cu(Ⅱ)和Cu(Ⅱ)相互转变起催化作用C .消耗18mg 葡萄糖,理论上a 电极有0.4mmol 电子流入D .两电极间血液中的Na +在电场驱动下的迁移方向为b→a 二、多选题 3.(2024山东高考真题)由下列事实或现象能得出相应结论的是24N O 为基元反应,将盛有棕色变浅三、解答题 4.(2024江苏高考真题)贵金属银应用广泛。
Ag 与稀3HNO 制得3AgNO ,常用于循环处理高氯废水。
(1)沉淀Cl -。
在高氯水样中加入24K CrO 使24CrO -浓度约为31510mol L --⨯⋅,当滴加3AgNO 溶液至开始产生24Ag CrO 沉淀(忽略滴加过程的体积增加),此时溶液中Cl -浓度约为 1mol L -⋅。
[已知:()10sp K AgCl 1.810-=⨯,()12sp 24K Ag CrO 2.010-=⨯](2)还原AgCl 。
在AgCl 沉淀中埋入铁圈并压实,加入足量10.5mol L -⋅盐酸后静置,充分反应得到Ag 。
Ⅱ铁将AgCl 转化为单质Ag 的化学方程式为 。
Ⅱ不与铁圈直接接触的AgCl 也能转化为Ag 的原因是 。
Ⅱ为判断AgCl 是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤, [实验中必须使用的试剂和设备:稀3HNO 、3AgNO 溶液,通风设备](3)Ag 的抗菌性能。
2024全国高考真题化学汇编:认识晶体
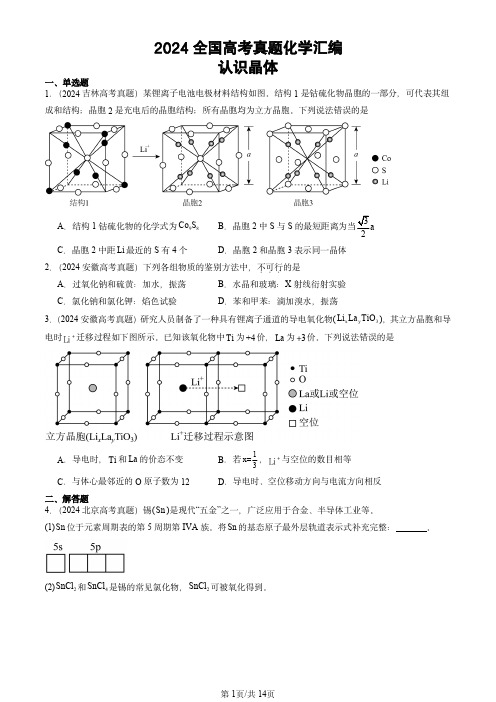
2024全国高考真题化学汇编认识晶体一、单选题1.(2024吉林高考真题)某锂离子电池电极材料结构如图。
结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。
下列说法错误的是A .结构1钴硫化物的化学式为98Co SB .晶胞2中S 与S 的最短距离为当3a 2C .晶胞2中距Li 最近的S 有4个D .晶胞2和晶胞3表示同一晶体2.(2024安徽高考真题)下列各组物质的鉴别方法中,不可行...的是A .过氧化钠和硫黄:加水,振荡B .水晶和玻璃:X 射线衍射实验C .氯化钠和氯化钾:焰色试验D .苯和甲苯:滴加溴水,振荡3.(2024安徽高考真题)研究人员制备了一种具有锂离子通道的导电氧化物(x y 3Li La TiO ),其立方晶胞和导电时+Li 迁移过程如下图所示。
已知该氧化物中Ti 为+4价,La 为3 价。
下列说法错误的是A .导电时,Ti 和La 的价态不变B .若1x=3,+Li 与空位的数目相等C .与体心最邻近的O 原子数为12D .导电时、空位移动方向与电流方向相反二、解答题4.(2024北京高考真题)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:。
(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是。
②4SnCl 的Sn Cl —键是由锡的轨道与氯的3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ,由于固体之间反应慢,未明显发生反应。
2023年高考化学一轮复习考点过关检测卷06 离子方程式的书写(讲解版)

检测卷六 离子方程式的书写规范1.下列离子方程式书写正确的是( )A .CaCO 3与稀硝酸反应:CO 2-3+2H +===H 2O +CO 2↑ B .FeSO 4溶液与溴水反应:2Fe 2++Br 2===2Fe 3++2Br -C .NaOH 溶液与过量H 2C 2O 4溶液反应:H 2C 2O 4+2OH -===C 2O 2-4+2H 2O D .C 6H 5ONa 溶液中通入少量CO 2:2C 6H 5O -+CO 2+H 2O===2C 6H 5OH +CO 2-3 【答案】B【解析】 CaCO 3是难溶物,离子方程式中不能拆成离子形式,A 项不正确;Fe 2+有还原性,Br 2有氧化性,两者发生氧化还原反应,B 项正确;H 2C 2O 4过量,因此生成的产物为NaHC 2O 4,离子方程式为H 2C 2O 4+OH -===HC 2O -4+H 2O ,C 项不正确;由于酸性:H 2CO 3>C 6H 5OH>HCO -3,因此产物中得到的应为NaHCO 3,D 项不正确。
2.下列有关离子方程式正确的是 A .用铜作电极电解KCl 溶液:2Cl -+2H 2O高温H 2↑+Cl 2↑+2OH -B .用稀硝酸洗涤试管内壁的银镜:Ag+NO 3-+4H + =Ag ++NO↑+2H 2OC .少量Mg(OH)2溶于FeCl 3溶液:3Mg(OH)2(s)+2Fe 3+(aq)⇌2Fe(OH)3(s)+3Mg 2+(aq)D .少量SO 2通入Ca(ClO)2溶液:Ca 2++2ClO -+2SO 2+2H 2O = CaSO 4↓+SO 24-+2Cl -+4H + 【答案】C【解析】A .铜电极是活性电极,电解时铜失去电子,故A 不正确;B .电荷不守恒,正确离子方程式为:3Ag+NO 3-+4H + =3Ag ++NO↑+2H 2O ,故B 不正确; C .少量Mg(OH)2溶于FeCl 3溶液,转化为氢氧化铁沉淀,离子方程式为:3Mg(OH)2(s)+2Fe 3+(aq)⇌2Fe(OH)3(s)+3Mg 2+(aq),故C 正确;D .将少量SO 2通入Ca (ClO )2溶液中,二氧化硫被次氯酸根氧化为硫酸根,HClO 被还原为氯离子,故离子方程式:SO 2+3ClO -+Ca 2++H 2O=CaSO 4↓+Cl -+2HClO ,故D 不正确; 故答案为C 。
高考化学复习高考离子方程式真题.docx

高中化学学习材料唐玲出品2009年高考真题——离子反应及离子方程式1.(2009年广东卷)下列离子方程式正确的是A .铁与稀HNO 3反应:Fe+2H +=Fe 2++H 2↑B .小苏打与氢氧化钠溶液混合:HCO -3+OH -=CO 2↑+H 2OC .氯化钙与碳酸氢钾溶液混合:Ca 2++CO 2-3=CaCO 3↓D .CuSO 4溶液与Ba(OH)2溶液混合:Cu 2++SO 2-4+2OH -+Ba 2+=BaSO 4↓+Cu(OH)2↓2.(2009年广东卷)下列离子方程式正确的是A .向盐酸中滴加氨水:H + + OH - = H 2OB .Fe (OH )3溶于氢碘酸:Fe (OH )3 + 3H + = Fe 3+ + 3H 2OC .铜溶于稀硝酸:3Cu + 8H + + 2NO 3- = 3Cu 2+ + 2 NO ↑+ 4H 2OD .向Na2S2O3溶液中通入足量氯气:S 2O 32-+2Cl 2+3H 2O =2SO 32-+4Cl -+6H +3.(2009年江苏卷)在下列各溶液中,离子一定能大量共存的是A .强碱性溶液中:K +、、Al 3+、Cl -、SO 2-4B .含有0.1 mol ·L -1 Fe 3+的溶液中:K +、Mg 2+、I -、NO -3C .含有0.1 mol ·L -1Ca 2+的溶液中:Na +、K +、CO 2-3、Cl- D .室温下,Ph=1的溶液中:Na +、Fe 3+、NO -3、SO 2-44.(2009年江苏卷)下列离子方程式与所述事实相符且正确的是A .漂白粉溶液在空气中失效:ClO -+CO 2+H 2O=HClO+HCO -3B .用浓盐酸与MnO 2反应制取少量氯气:MnO 2+2H ++2Cl -∆Mn 2++Cl 2↑+2H 2OC .向NaAlO 2溶液中通入过量CO 2制Al(OH)3 22232()AlO CO H O Al OH -++=↓HCO -3D .在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na 2FeO 4;3ClO —+2Fe (OH )3===2FeO 42—+3Cl —+H 2O+4H +5.(2009年上海卷)下列离子方程式正确的是A .H 2SO 4与Ba (OH )2溶液反应:Ba 2++OH -+H ++SO 2-4→BaSO 4↓+H 2OB .CuSO 4溶液吸收H 2S 气体:Cu 2++H 2S →CuS ↓+2H+ C .AlCl 3溶液中加入过量的浓氨水:Al 3++4NH 3·H 2O →AlO -2+4NH +4+2H 2OD .等体积、等浓度的Ba (OH )2稀溶液与NH 4HCO 3稀溶液混合:Ba 2++2OH -+NH +4+HCO -3→BaCO 3↓+NH 3·H 2O+H 2O6.(2009年全国1卷)下列各组离子,在溶液中能大量共存、加入NaOH 溶液后加热既有气体放出又有沉淀生成的一组是A .Ba 2+、NO 3-、NH 4+、Cl -B .Ca 2+、HCO 3-、NH 4+、AlO 2-C .K +、Ba 2+、Cl -、HSO 3-D .Mg 2+、NH 4+、SO 42-、K +7.(2009年全国1卷)下列表示溶液中发生反应的化学方程式错误..的是 A .2Al+2NaOH+2H 2O 2NaAlO 2+3H 2↑B .2KMnO 4+HCOOK+KOH 2K 2MnO 4+CO 2↑+H 2OC .MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2OD .K 2Cr 2O 7+6FeSO 4+7H 2SO 4 Cr 2(SO 4)3+3Fe 2(SO 4)3+K 2SO 4+7H 2O8. (2009年全国2卷)含有a mol FeBr 2的溶液中,通入x mol Cl 2。
(完整版)高考陌生情景中化学方程式的书写技巧与真题训练
高考陌生情景中化学方程式的书写技巧与真题训练陌生情景中的化学方程式书写,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。
配平要遵循质量守恒定律(原子守恒、元素守恒、物料守恒),对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应还要遵循电荷守恒规律。
【解题技巧】关键结合题目信息、流程图信息并熟记常见的氧化产物和还原产物判断生成物。
1. 熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物2.掌握书写信息型氧化还原反应的步骤(3步法)第1步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第2步:根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
第3步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
3.氧化还原反应方程式的配平:步骤:①标出化合价变化了的元素的化合价。
②列变化:分别标出化合价升高数和化合价降低数③根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
④利用元素守恒,观察配平其他物质4.“补缺”的技巧(1)可能出现的情况:H+→H2O(酸性)、OH-→H2O(碱性)、H2O→H+(中性或酸性)、H2O→OH-(中性或碱性)(2)绝不可能出现的情况:H+→OH- 或者OH-→H+题型1 氧化还原反应型的化学方程式和离子方程式的书写1、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________________。
高考必备-高中化学方程式汇编大全

学习好资料 欢迎下载 2011年高考必备--高中化学方程式汇编 无机化学部分 。 非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si) 1. 氧化性: 氟气与氢气在暗处混合即爆炸 F2 + H2 === 2HF 氟气与水相遇 2F2 +2H2O===4HF+O2 氢气在氯气中燃烧 钠在氯气中剧烈燃烧(白烟 铁在氯气中剧烈燃烧(深棕色烟) 铜丝在氯气中剧烈燃烧(浅棕色烟)
磷在氯气中燃烧生成白色烟雾(白雾) (白烟)
铁在纯氧中剧烈燃烧,火星四射 氯化亚铁溶液中通入氯气Cl2 +2FeCl2 ===2FeCl32Fe2+ + Cl2 = 2Fe3+ + 2Cl- 新制氯水注入盛溴化钠溶液的试管中 2Cl2+2NaBr===2NaCl+Br2Cl2 + 2Br- = Br2 + 2Cl- 新制氯水注入盛碘化钠溶液的试管中 Cl2 +2NaI ===2NaCl+I2 氯气和二氧化硫同时通入水中 Cl2+SO2 +2H2O===H2SO4 +2HCl 硫与氢气共热 硫与铜共热 铁与硫加热反应
氮气和氢气反应(工业合成氨) 镁可与氮气反应 2. 还原性 硫燃烧 氮气与氧气在放电下反应 2NO + O2 2NO2 S+6HNO3(浓)===H2SO4+6NO2↑+2H2O 3S+4 HNO3(稀)===3SO2+4NO↑+2H2O
PX3+X2===PX5
C+CO2===2CO (生成水煤气) (制得粗硅)
(X2表示F2,Cl2,Br2) 学习好资料 欢迎下载 Si+2NaOH+H2O===Na2SiO3+2H2↑ 3.(碱中)发生歧化(一个价态生成两个价态的反应称为歧化) Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化) Cl2+2NaOH===NaCl+NaClO+H2O (制取漂白剂的反应)工业制取漂白粉的反应: 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 2Ca(OH)2 + 2Cl2 ===2Ca2++2ClO-+ 2Cl-+ 2H2O 漂白粉的失效:Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO 2HClO 2HCl + O2↑ 金属单质(Na,Mg,Al,Fe)的还原性
高中化学方程式汇编 2
高中化学方程式汇编无机化学部分非金属单质(F 2,Cl 2,O 2, S, N 2 , P, C, Si ) 1. 氧化性F 2 + H 2 === 2HF2F 2 +2H 2O===4HF+O 2 Cl 2+H 22HCl Cl 2+2Na 2NaCl 3Cl2+2Fe 2FeCl 3Cl 2+CuCuCl 2Cl 2+2FeCl 2===2FeCl 32Cl 2+2NaBr===2NaCl+Br 2 Cl 2 +2NaI ===2NaCl+I 2Cl 2 +SO 2 +2H 2O===H 2SO 4 +2HCl 2O 2+3Fe Fe 3O 4S+H 2H 2S Fe+S FeS S+2Cu Cu 2SN 2 + 3H 2催化剂 高温高压2NH 32. 还原性 S+O 2SO 2 N 2+O 22NO 4P+5O 22P 2O 52P+3X 22PX 3(X 2表示F 2,Cl 2,Br 2)PX 3+X 2===PX 5 2C+O 2(少量)2CO C+O 2(足量)CO 2C+CO22COC+H 2OCO+H 2(生成水煤气)Si+O 2SiO 2(制得粗硅)Si+2NaOH+H 2O===Na 2SiO 3+2H 2↑ 3.(碱中)歧化Cl 2+H 2O===HCl+HClO (加碱或光照促进歧化) Cl 2+2NaOH===NaCl+NaClO+H 2O 2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 金属单质(Na ,Mg ,Al ,Fe )的还原性 4Na+O 2===2Na 2O 2Na 2O+O 22Na 2O 2 2Na+O 2Na 2O 22Na+S===Na 2S (爆炸) 2Na+2H 2O===2NaOH+H 2↑ Mg+H 2SO 4===MgSO 4+H 2↑2Mg+ O 22MgO 2Al + 3Cl22AlCl 3 4Al+3O 22Al 2O 32Al+6HCl===2AlCl 3+3H 2↑2Al+3H 2SO 4===Al 2(SO 4)3+3H 2↑2Al+6H 2SO 4(浓)Al 2(SO 4)3+3SO 2↑+6H 2O(Al 、Fe 在冷浓的H 2SO 4、HNO 3中钝化) Al+4HNO 3(稀)===Al(NO 3)3+NO ↑+2H 2O 2Al+2NaOH+2H 2O===2NaAlO 2+3H 2↑2Al + Fe 2O 3 高温2Fe + Al 2O 32Al +Cr 2O 3 高温2Cr+ Al 2O 3 4Al +3MnO 2高温3Mn+2Al 2O 33Fe + 4H 2O(g)高温Fe 3O 4 + 4H 2Fe+2HCl===FeCl 2+H 2↑Fe+CuCl 2===FeCl 2+Cu非金属氢化物(HF,HCl,H 2O,NH 3) 1.还原性 MnO 2 + 4HCl(浓)MnCl 2 +Cl 2↑+ 2H 2O2NH 3+3Cl 2===N 2+6HCl 8NH 3+3Cl 2===N 2+6NH 4Cl4NH 3+3O 2(纯氧)===2N 2+6H 2O高老师4NH 3 +5O24NO+6H 2O4NH 3+6NO===5N 2+6H 2O(用氨清除NO) 2.酸性4HF+SiO 2===SiF 4+2H 2O(HF 保存在塑料瓶的原因) 3.碱性NH 3+HCl===NH 4Cl NH 3+HNO 3===NH 4NO 3 2NH 3+H 2SO 4===(NH 4)2SO 4NH 3+NaCl+H 2O+CO 2===NaHCO 3+NH 4Cl (此反应用于工业制备小苏打,苏打) 4.不稳定性 2H 2O 2===2H 2O+O 2↑ 非金属氧化物1.低价态的还原性 2SO 2 + O 2催化剂 加热2SO 32SO 2+O 2+2H 2O===2H 2SO 4(SO 2在大气中缓慢发生的反应)SO 2+X 2+H 2O===H 2SO 4+2HX (X 表示Cl 2,Br 2,I 2) SO 2+H 2O 2===H 2SO 4SO 2+2FeCl 3+2H 2O===H 2SO 4+2FeCl 2+2HCl2NO+O 2===2NO 22CO+O 22CO 2 CO+CuOCu+CO 23CO+Fe 2O 3 2Fe +3CO 2 CO+ H 2O高温CO 2+H 22.氧化性NO 2+2KI+H 2O===NO+I 2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO 2) 2Mg+CO 22MgO+C(CO 2不能扑灭由Mg ,Ca ,Na ,K 等燃烧的火灾)3.与水的作用 SO 2+H 2O===H 2SO 3 SO 3+H 2O===H 2SO 4 3NO 2+H 2O===2HNO 3+NO N 2O 5+H 2O===2HNO 3 4.与碱性物质的作用SO 2+(NH 4)2SO 3+H 2O===2NH 4HSO 32NH 4HSO 3+H 2SO 4==(NH 4)2SO 4+2H 2O+2SO 2↑ SO 2+Ca(OH)2===CaSO 3+H 2O(不能用澄清石灰水鉴别SO 2和CO 2可用品红鉴别) SO 3+Ca(OH)2===CaSO 4+H 2OCO 2+2NaOH(过量)===Na 2CO 3+H 2O CO 2(过量)+NaOH===NaHCO 3CO 2+Ca(OH)2(过量)===CaCO 3↓+H 2O 2CO 2(过量)+Ca(OH)2===Ca(HCO 3)2CO 2+2NaAlO 2+3H 2O===2Al(OH)3↓+Na 2CO 3 CO 2+C 6H 5ONa+H 2O===C 6H 5OH ↓+NaHCO 3 SiO 2+CaO高温CaSiO 3SiO 2+2NaOH===Na 2SiO 3+H 2O (强碱缓慢腐蚀玻璃) SiO 2+CaCO 3高温CaSiO 3+CO 2↑ SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑金属氧化物1.低价态的还原性FeO+4HNO 3===Fe(NO 3)3+NO 2↑+2H 2O 2.氧化性MgO ,Al 2O 3几乎没有氧化性,很难被还原为Mg ,Al.,一般通过电解制Mg 和Al Fe 2O 3+3H 2 高温2Fe+3H 2OFe 3O 4+4H 2高温3Fe+4H 2O(制还原铁粉)3.与水的作用Na 2O+H 2O===2NaOH2Na 2O 2+2H 2O===4NaOH+O 2↑ 3. 与酸性物质的作用Na 2O+CO 2===Na 2CO 32Na 2O 2+2CO 2===2Na 2CO 3+O 2Na 2O 2+H 2SO 4(冷稀)===Na 2SO 4+H 2O 2 MgO+SO 3===MgSO 4MgO+H 2SO 4===MgSO 4+H 2OAl 2O 3+3H 2SO 4===Al 2(SO4)3+3H 2O Al 2O 3+2NaOH===2NaAlO 2+H 2O (Al 2O 3是两性氧化物) FeO+2HCl===FeCl 2+3H 2OFe 2O 3+6HCl===2FeCl 3+3H 2OFe 3O 4+8HCl===FeCl 2+2FeCl 3+4H 2O含氧酸1.氧化性HClO+H 2SO 3===H 2SO 4+HCl HClO+H 2O 2===HCl+H 2O+O 2 C + 2H 2SO 4(浓)2H 2O+CO 2↑+2SO 2↑MnO 2Cu + 2H2SO4(浓)CuSO4 + 2H2O+SO2↑浓H2SO4+Fe(Al) 室温下钝化H2SO4(浓)+2HBr===SO2↑+Br2↑+2H2OH2SO4+Fe===FeSO4+H24HNO3(浓)+C CO2↑+4NO2↑+2H2O4HNO3(稀)+Fe(不足)===Fe(NO3)3+NO↑+2H2O8HNO3(稀)+3Fe(过量)===3Fe(NO3)2+2NO↑+4H2O 2.还原性2H2SO3+O2===2H2SO43.酸性2HNO3+CaCO3===Ca(NO3)2+H2O+CO2↑(用HNO3和浓H2SO4不能制HI,HBr,SO2等还原性气体)4.不稳定性:2HClO===2HCl+O2↑4HNO3=======4NO2↑ + O2↑ + 2H2O碱1.低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32.与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===Na2SiO3+H2O2NaOH+Al2O3===2NaAlO2+H2ONaOH+HCl===NaCl+H2O3NaOH+AlCl3===Al(OH)3↓+3NaClNaOH+Al(OH)3===NaAlO2+2H2ONaOH+NH4Cl===NaCl+NH3↑+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3·H2OAl(OH)3+NH4Cl(或NH3·H2O不溶解)3.不稳定性Mg(OH)2MgO+ H2O2Al(OH)3Al2O3+ 3H2O2 Fe(OH)3Fe2O3+ 3H2OCu(OH)2CuO+ H2O盐1.氧化性2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2 (用于雕刻铜线路版) 2FeCl3+2KI===2FeCl2+2KCl+I2↓FeCl2+Mg===Fe+MgCl22.还原性2FeCl2+Cl2===2FeCl33Na2SO3+2HNO3(稀)===3Na2SO4+2NO↑+H2O2Na2SO3+O2===2Na2SO43.与碱性物质的作用MgCl2+2NH3·H2O===Mg(OH)2↓+NH4ClAlCl3+3NH3·H2O===Al(OH)3↓+3NH4ClFeCl3+3NH3·H2O===Fe(OH)3↓+3NH4Cl5.与酸性物质的作用Na2CO3+HCl===NaHCO3+NaCl(逐滴加少量盐酸) NaHCO3+HCl===NaCl+H2O+CO2↑3Na2CO3+2AlCl3+3H2O==2Al(OH)3↓+3CO2↑+6NaCl 3Na2CO3+2FeCl3+3H2O==2Fe(OH)3↓+3CO2↑+6NaCl 6NaHCO3+Al2(SO4)3===2Al(OH)3↓+6CO2↑+6NaCl 3NaHCO3+FeCl3===Fe(OH)3↓+3CO2↑+ 3NaCl3NaAlO2+AlCl3+6H2O===4Al(OH)3↓+ 3NaCl6.不稳定性Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2ONH4Cl HCl↑+ NH3↑NH4HCO3NH3↑+H2O↑+CO2↑2KClO32KCl+3O2↑2NaHCO3Na2CO3+H2O+CO2↑2Ca(HCO3)2CaCO3+H2O+CO2↑CaCO3高温CaO+CO2↑MgCO3高温MgO+CO2↑有机化学部分CH4+2O2CO2+2H2OCH4+Cl2CH3Cl+HClCH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HClCHCl3+Cl2CCl4+HClCH4C+2H2高温加热或光照高老师CH2=CH2 + Br2CH2BrCH2BrnCH2=CH2催化剂nCH3–CH=CH2催化剂CH2=CH2 + H2O催化剂CH3CH2OHCaC2 + 2H2O Ca(OH)2 +↑+Br2CHBr=CHBrCHBr=CHBr+Br2CHBr 2 CHBr2+ HCl H2C=CHCln H2C=CHCl催化剂+ Br2 +HBr+ HNO3+ H2O+ 3H2催化剂△+3HNO3浓硫酸△+3H2OCH3CH2Br + H2OCH3CH2OH + HBrCH3CH2Br +NaOH CH2=CH2↑+NaBr + H2O2CH3CH2OH + 2Na2CH3CH2ONa + H2↑2CH3CH2OH + O22CH3CHO + 2H2O+ NaOH+ H2O+CO2 + H2O+ NaHCO3+ 3Br2↓ + 3HBrCH3CH2CHO + H2催化剂△CH3CH2CH2OH2CH3CHO+O2催化剂△2CH3COOHCH3CHO+2[Ag(NH3)2]OH H2O+2Ag↓+3NH3↑+ CH3COONH4CH3CHO+2Cu(OH)2Cu2O↓+2H2O+CH3COOH2CH3COOH + Cu(OH)2 = (CH3COO)2Cu + 2H2OCH3COOH+CH3CH2OH CH3COOC2H5+ H2OCH2OH─CHOH─CHOH─CHOH─CHOH─CHOC12H22O11 + H2O催化剂C6H12O6 + C6H12O6蔗糖葡萄糖果糖(C6H10O5)n + nH2O催化剂nC6H12O6淀粉葡萄糖+3NaOH3C17H35COONa+ΔCH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O催化剂2CH3CHO+O2 2CH3COOHCH2-CH2nCH3CH-CH2nHC≡CHHC≡CH催化剂△CH-CH2nClHC≡CHBrFe浓H2SO455-60℃—NO2CH3|NaOH△醇△Cu△—OH —ONa—ONa—OH––NO2|NO2O2N––CH3––BrBr––浓硫酸△CH2–OH|CH–OH|CH2–OHC17H35COO─ CH2C17H35COO─CHC17H35COO─CH2高老师。
2020版领军高考化学真题透析专题2.4陌生化学方程式的书写(高效演练)
陌生化学方程式的书写1、为测定水中溶氧量,向一定量水样中加入过量MnSO4和适量碱溶液,生成MnO(OH)2沉淀,写出O2将Mn2+氧化成MnO(OH)2的离子方程式。
【答案】O2+2Mn2++4OH-===MnO(OH)2↓【解析】碱性条件下,O2将Mn2+氧化成MnO(OH)2沉淀,离子方程式为O2+2Mn2++4OH-===MnO(OH)2↓。
2、在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。
其反应的离子方程式是。
【答案】2Cl2 + H2O + CaCO3 === Ca2+ +2Cl- + 2HClO + CO2↑【解析】氯气与水反应生成盐酸和次氯酸,盐酸再与石灰石反应生成CO2,离子方程式为:2Cl2 + H2O + CaCO3 === Ca2+ +2Cl- + 2HClO + CO2↑。
3、煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1。
反应一段时间后溶液中离子浓度的分析结果如下表。
子写出NaClO2溶液脱硝过程中主要..反应的离子方程。
【答案】4NO+3ClO2-+2OH- 323K 4NO3-+2H2O+3Cl-【解析】从表中可判断NaClO2溶液脱硝过程中主要..反应是生成NO3−,NaClO2溶液显碱性,离子方程式为:4NO+3ClO2-+2OH- 323K 4NO3-+2H2O+3Cl-4、已知:写出该步反应的化学方程式:。
【答案】【解析】FePO4转化为LiFePO4,铁元素由+3价降低到+2价,只有H2C2O4中碳元素的化合价升高,生成CO2。
5、已知:2Fe2+ + Br2=2Fe3+ +2Br-。
若将0.1 mol Cl2通入100 mL FeBr2溶液中,溶液中有三分之一的Br-被氧化成Br2,则此反应离子方程式是。
高考化学离子方程式题集
学习好资料 欢迎下载 离子离子方程式
1.(宁夏)下列反应的离子方程式正确的是 A.锌片插入硝酸银溶液中: Zn+Ag+=Zn2++Ag B.碳酸氢钙溶液加到醋酸中: Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O C.少量金属钠加到冷水中: Na+2H2O=Na++OH-+H2↑ D.氢氧化铜加到盐酸中: Cu(OH)2+2H+=Cu2++2H2O 2.(江苏)下列离子方程式书写正确的是 A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32 3.(上海)下列离子方程式中正确的是 A.H2SO4与Ba(OH)2溶液反应:Ba2++2OH—+2H+十SO42-→ BaSO4↓+2H2O B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-→CaCO3↓+ CO32-+2H2O C.Na2CO3溶液中通入少量CO2: CO32-+ CO2+ H2O→2HCO3- D.CH3COOH溶液与NaOH溶液反应: H++ OH—→H2O 4.(江苏)下列文字表述与反应方程式对应且正确的是 A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓ B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑ C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯:+ Br2FeBr3Br+ HBr 5.(江苏)下列离子方程式正确的是 A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+ 电解H2↑+ Cl2↑ B.用银氨溶液检验乙醛中的醛基: CH3CHO +2Ag(NH3)2+ + 2OH-水浴加热CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + CO32- D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- == 5SO42- + 2Mn2+ 3H2O 6.(四川)能正确表示下列反应的离子方程式是 A.足量硫酸铝与纯碱反应:2322333)(2332COOHAlOHCOAl B.硫酸铜与烧碱反应:2424)(2SOOHCuOHCuSO 学习好资料 欢迎下载 C.苯酚与碳酸钠反应:OHCOOHCCOOHHC2256235622
近5年有机化学(大题)高考真题汇编带答案
近5年有机化学高考真题汇编带答案2019年高考化学有机真题汇编1.(2019年高考化学全国III卷) [化学——选修5:有机化学基础] (15分)氧化白藜芦醇W具有抗病毒等作用。
下面是利用Heck反应合成W的一种方法:回答下列问题:(1)A的化学名称为(2)中的官能团名称是?(3)反应③的类型为,W的分子式为(4)不同条件对反应④产率的影响见下表:上述实验探究了和对反应产率的影响。
还可以进一步探究等对反应产率的影响(5)X为D的同分异构体,写出满足如下条件的X的结构简式①含有苯环~②有三种不同化学环境的氢,个数比为6∶2∶1③1 mol的X与足量金属Na反应可生成2 g H2(6)利用Heck反应,由苯和溴乙烷为原料制备,写出合成路线。
(无机试剂任选) 2.(2019年高考化学全国II卷) [化学——选修5:有机化学基础] (15分)环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。
下面是制备一种新型环氧树脂G的合成路线:已知以下信息:$回答下列问题:(1)A是一种烯烃,化学名称为,C中官能团的名称为、(2)由B生成C的反应类型为(3)由C生成D的反应方程式为(4)E的结构简式为、(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式、①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于3.(2019年高考化学全国I卷 15分) [化学——选修5:有机化学基础]]化合物G是一种药物合成中间体,其合成路线如下:回答下列问题:(1)A中的官能团名称是(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。
写出B的结构简式,用星号(*)标出B中的手性碳(3)写出具有六元环结构、并能发生银镜反应的B的同分异构体的结构简式____________________________________________________________(不考虑立体异构,只需写出3个)(4)反应④所需的试剂和条件是(5)⑤的反应类型是^(6)写出F到G的反应方程式(7)设计由甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)制备的合成路线 (无机试剂任选):4. (2019年高考化学北京卷 15分)抗癌药托瑞米芬的前体K的合成路线如下。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学方程式书写专题训练
1.(2020国Ⅲ26)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验
室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
c中化学反应的离子方程式是 ,采用冰水
浴冷却的目的是 。
1.【答案】 Cl2+2OH−=ClO−+Cl−+H2O;避免生成NaClO
3
2. (2020江苏18)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制
备 NaClO的离子方程式为__________________________________________;用于环境杀菌消毒
的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减
弱,其原因是 。
2.【答案】22Cl2OHClOClHO;NaClO溶液吸收空气中的CO2后产生
HClO,HClO见光分解
3.(2020山东20)某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹
持装置略):
