李狄-电化学原理-第四章-电极过程概述
电极过程动力学 第4章 电化学步骤的动力学

对于阴极反应 对于阳极反应
a 2.3RT lg i0
nF a 2.3RT lg i0
W
'W1
W1 1
'W2
W2
F
4 3
W1' W1 F
F
F
W2' W2 F
x
(4.1)
§4.1 电极电势对电化学步骤反应速度的影响
§4.1.2 改变电极电势对电极反应速度的影响
▪ 设电极反应为
O + ne
R
设在所选用电势坐标的零点(即0 = 0)处阳极和阴极反应的活化能分别为
W10和W20。根据反应动力学基本理论,此时
(4.16)式表明,决定“电化学极化“数值的主要因素是外电流与交换
电流的相对大小。
§4.2 平衡电势与电极电势的“电化学极化”
§4.2.2 电极电势的电化学极化
1.|I| << i0
即,通过外电流( I )远小于电极体系 的交换电流( i0 )。例如在一个 i0 = 10 安/厘米2的电极体系中。通过Ic = 0.1 安/ 厘米2的阴极外电流,则从图4.6可以看 到,只要电极电势稍稍偏离平衡数值, 以致的数值略有不同,就足以引起这种
RT
0 平
)
nFKacR
(4.10a)
ic
nFKc0cO
exp( nF
RT
平0 )
nFKccO
(4.10b)
其中
Ka
K
0 a
exp( nF
RT
0 平
)
,Kc
Kc0
exp( nF
RT
0 平
)
在 = 平0时体系处于在平衡状态,此时应有ia= ic;若忽略活度系数的影响, 则有cO =cR 。将这些关系代入(4.10a,b)式,得
02-电极过程简介
物质的传递速度可以用流量来表示, 物质的传递速度可以用流量来表示,即单位时间 流量来表示 内通过单位截面积的物质的量。 内通过单位截面积的物质的量。
若只考虑一维方向, 方向, 的传质流量为: 若只考虑一维方向,即x方向, 粒子 的传质流量为: 方向 粒子i的传质流量为
J i ( x) = J id ( x) + J ic ( x) + jim ( x) ∂Ci Zi F ∂E = − Di + Ci v( x) − Ci D ∂x RT ∂x
O +e- →R
如果电子交换速率较快(可逆过程) 如果电子交换速率较快(可逆过程),而传质速 度慢,则电流受传质速度控制。 度慢,则电流受传质速度控制。 如果溶液中加入大量的支持电解质(如KCl), 如果溶液中加入大量的支持电解质( ), 可以消除迁移电流, 可以消除迁移电流,在紧靠近电极表面的溶液内 对流作用也可忽略不计。 部,对流作用也可忽略不计。 因此,仅由扩散控制,称为扩散过程, 因此,仅由扩散控制,称为扩散过程,相应的电 扩散过程 流为扩散电流。实际上,许多电化学也如此。 流为扩散电流。实际上,许多电化学也如此。
暂态阶段:流过电极的电流(总电流) 暂态阶段:流过电极的电流(总电流)包括的范 围比稳态时大。 围比稳态时大。
法拉弟电流
由电极表面的氧化或者还原反应所产生的。 由电极表面的氧化或者还原反应所产生的。
非法拉弟电流
如双电层的充电电流,不符合法拉弟定律。 如双电层的充电电流,不符合法拉弟定律。
双电层充电电流(非法拉弟电流)可表示为: 双电层充电电流(非法拉弟电流)可表示为:
∂C i ( x, t ) J i ( x ) = − Di ∂x
Fick第一定律。 第一定律。 第一定律
电化学第四章:电极溶液界面的结构性质讲解

例如在同一电极电位下,同一种溶液中,析氢反应
2H 2e H 2
在铂电极上进行的速度比在汞电极上进行的速度大 107 倍以 上。
溶液中表面活性物质或络合物的存在也能改变电极反应速度 如水溶液中苯并三氮唑的少量添加,就可以抑制铜的腐蚀 溶解
分电容,即
(3.C24d)
dq
d
式中, 为C微d分电容。它表示引起电极电位微小变化时 所需要引入电极表面的电量,从而也表征了界面上电极电
位发生微小变化时所具备的储存电荷的能力。
根据微分电容的定义和李普曼方程,很容易从电毛细 曲线求得微分电容值,因为q Nhomakorabea所以
C(d3.25)
2 2
已知可以根据电毛细曲线确定零电荷电位 ,从而0可
- - + - + - +- -
--++
-
+ -
-+
++ --
+-++- --
二、电毛线曲线的微分方程
q ( ) i (3.6)
这就是用热力学方法推导出的电毛细曲线的微分
方程,通常称为李普曼(Lippman)公式。式中q的
单位为 J/cm。
, C 的cm单2 位为V, 的单位为
q ( ) i (3.6)
以利用式(3.24)求得任一电极电位下的电极表面剩余电荷密度q,
即
q
q (30.2d6q) 0 Cdd
因此可以计算从零电荷电位 到某一0 电位
电容值 ,即
Ci
电化学研究方法第四章

C [1 ( ) ]
0 O
t
1 2
DR 1 RT RT t 2 整理: ln( ) ln( 1 ) nF DO nF t2
0
4-11
4-11为产物可溶时,φ-t方程式,表示了可逆电极过程的规律。
DR 1 RT 0 ln( ) 2 1 当 t 时, 2 4 nF DO 4
C
0 O
的概念,非常重要。从4-5式可以看出
1 2
t
1 2
C0 (0, t ) ~ t 成直线关系,直线的截距= CO
1 2
0
,随着t的推移,表面浓度 C0 (0, t )不断下降, 达到一定时间表面浓度下降为0。
0 ) 定义:恒电位极化时,电极表面浓度由起始浓度( CO
下降到0所需时间叫过渡时间,用 表示。
2-17
ii,2-17式对x求导,令 X 0 得:
0 CO C P 1 ( ) X 0 ( ) 2 [CO ( X 0) O ] X DO P
4-4
iii,引入电极表面边界条件:电化学极化方式的边界条件
CO ( X , t ) i nFDO [ ] X 0 常数 X
→④对X求导,令X=0→⑤边界条件进行Laplace变换后代入
独立方程直接代入 引入新函数的边界条件转换再经Laplace变换后代入
浓度直接反演 →⑥表面浓度表达式的Laplace变换式→⑦反演 代入 i 再反演 注意:4-5、4-6只使用了
CO ( X , t ) i nFDO [ ] X 0 常数 X
CR ( X , t ) i nFDR [ ]X 0 常数 X
边界条件,对恒电流阶跃,可逆、不可逆都适用。
第四章电催化与电催化电极

在电极表面上,由另一个H3O+ 离子在吸附氢原子的位置上 放电,从而直接生成氢分子,并从电极表面上脱附下来:
MH+H3O+ +e→H2+H2O+M (酸性介质) MH+H2O+e→H2+M+OH - (中性或碱性介质)
㈡析氢机理
⒈迟缓放电理论: 电化学反应是整个析氢反应过程的控制步骤。
能催化电极反应的或者说对电极反应起加速作用 的物质称为电催化剂。
2、电催化的本质:
通过改变电极表面修饰物(或表面状态)或溶液相中的修 饰物,大范围的改变反应的电极电势与反应速率,使电极除具 有电子传递功能外,还能促进和选择电化学反应.
3、电催化反应的共性
反应过程包含两个以上的连续步骤,且在电极表面生成化学 吸附中间产物。许多由离子生成分子或使分子降解的电极反 应都属于此类反应。分成两类:
吸附机理分为两类:
2.反应物首先在电极上进行解离式或缔合式化学吸附,随后 吸附中间物或吸附反应物进行电子传递或表面化学反应。
例如甲酸的电化学氧化:
HC 2 M O M O H H M COOH
M H M H e
M CO M O C 2 H O H e 或
HCOOH M M CO H2O M H2O M OH H e M CO M OHCO2 H e
目前已知的电催化剂主要为过渡金属及其化合物。
设计关键:选择过渡金属中心原子
特点:过渡金属的原子结构中都含有空余的d轨道和未成对 的d电子,通过催化剂与反应物的接触,催化剂空余d轨道上 将形成各种特征的吸附键,达到分子活化的目的,从而降低了 复杂反应的活化能。
主要为含有Ti, Ir, Pt, Ni, Ru等金属或合金及其氧化物。如 RuO2/Ti电极, RuO2-TiO2电极, Pt/Ti电极,Pt/GC电极
电化学原理第四版李荻课件

THANKS
感谢您的观看。
05
CHAPTER
超级电容器技术与应用
利用电极与电解质界面形成的双电层或电极表面快速可逆的氧化还原反应来储存能量。
基本原理
充电速度快、功率密度高、循环寿命长、温度范围宽、绿色环保等。
特点
优点
能量密度高、充放电速度快等。
工作原理
通过电极表面快速可逆的氧化还原反应来储存能量,电极材料通常采用金属氧化物或导电聚合物。
充电过程
正极板上的二氧化铅和负极板上的铅在电解液的作用下,分别生成硫酸铅和水,同时有电子在外电路中流动,形成充电电流。
放电过程
硫酸铅和水在正极板和负极板上分别还原成二氧化铅和铅,同时有电子在外电路中流动,形成放电电流。
镍镉电池
01
以氢氧化镍作为正极,氢氧化镉作为负极的一种碱性蓄电池。具有大电流放电特性好、耐过充和过度放电等优点,但存在记忆效应和环保问题。
在放电过程中,铝阳极与水和电解质中的氢氧根离子发生反应生成氢氧化铝和氢气,同时释放出电子产生电流;空气中的氧气在阴极接受电子被还原成氢氧根离子。充电时,逆向反应进行,氢氧化铝得电子被还原成铝沉积在阳极上。
优缺点
铝空气电池具有高的理论比能量、低成本和环境友好等优点;但是存在铝阳极自腐蚀、氢氧化铝沉积等问题导致电池性能衰减。
铂、钯等贵金属具有良好的催化活性和稳定性,广泛应用于燃料电池、有机合成等领域。
铂族金属催化剂
通过合金化可以改善贵金属的催化性能和降低成本,如铂钌合金、铂铑合金等。
贵金属合金催化剂
纳米级贵金属催化剂具有高比表面积和优异的催化活性,应用于电催化、光催化等领域。
贵金属纳米催化剂
03
非贵金属氮化物催化剂
电化学原理思考题答案-北航李荻版
电化学原理思考题答案-北航李荻版(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--2.为什么不能测出电极的绝对电位我们平常所用的电极电位是怎么得到的答:电极电位是两类导体界面所形成的相间电位,相间电位中的内电位是无法直接测量的,故无法直接测出电极的绝对电位,我们平常所用的电极电位都是相对电极电位。
不对,虽然有电位差,但是没有电流通过,所以不能转化为电能。
17、描述腐蚀原电池的特点所在。
①阴、阳极区肉眼可分或不可分,或交替发生;②体系不稳定? 稳定,腐蚀过程是自发反应;③只要介质中存在氧化剂 (去极化剂),能获得电子使金属氧化,腐蚀就可发生;④腐蚀的二次产物对腐蚀影响很大;⑤电化学腐蚀离不开金属/电解质界面电迁移,电子由低电位金属或地区传荷到电位高的金属或地区,再转移给氧化剂;⑥腐蚀电池包括阴极、阳极、电解质溶液和电路四部分,缺一不可;⑦阴极、阳极反应相对独立,但又必须耦合,形成腐蚀电池;⑧ia=ic ,无净电荷积累;⑨腐蚀电池不对外作功,只导致金属腐蚀破坏的短路原电池。
原电池和电解池装置原电池电解池电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀粗铜金属作阳极,精铜作阴极,CuSO4溶液作除电子转移步骤之外,其他电极过程的单元步骤能否用电流密度来表示它们的速度为什么因为J=zFvr对于我们所讨论的某一反应来说,zF为常数,故J与vr成正比。
这就是说,在电化学中总是习惯于用电流密度来表示反应速度。
由于在稳态下接续进行的各步骤速度都一样,所以在讨论液相传质等步骤时,也可用电流密度来表示它们的反应速度。
因此,在电化学中实际上已经将电流密度变成反应速度的同义语了。
己知电极反应在25℃时的反应速度为 A/cm2。
根据各单元步骤活化能计算出电子转移步骤速度为 X 10-2mol/m2s,扩散步骤速度为 mol/m2s。
试判断该温度下的控制步骤。
若这一控制步骤的活化能降低了12kJ/mol,会不会出现新的控制步骤?[解〕因为电极反应速度可用电流密度表示,即J=nFv,所以对电子转移步骤,其反应速度可表示为j电子=nFv电子。
电极过程简明教程
电极过程简明教程
《电极过程简明教程》
电极过程是一种将电能转换成化学能的方法,是电化学反应的基础。
它是一种重要的能源转换技术,用于制造电池、燃料电池、电解槽等。
下面介绍一下电极过程的基本原理和步骤。
原理:电极过程通过电化学反应将电能转换成化学能,其中电解质在电极表面发生氧化还原反应,从而将电能转换成化学能。
步骤:
1.准备电极:首先准备好电极,电极可以是金属电极或非金属电极,根据不同的电极材料,选择合适的电解质。
2.准备电解质:将电解质加入电极中,以便发生电化学反应。
3.连接电源:将电极连接到电源,使电流流过电极,从而发生电化学反应。
4.观察反应:观察电极表面的反应,以确定电极过程的进行情况。
以上就是电极过程的基本原理和步骤,它是一种重要的能源转换技术,可以用于制造电池、燃料电池、电解槽等。
电化学原理第四版李荻课件
电化学原理第四版李荻课件电化学原理是研究电荷在电解质溶液中移动和电化学反应的科学。
本文将详细介绍电化学原理第四版李荻课件的内容和特点。
1. 引言电化学原理是追溯到18世纪的一门研究电化学现象的学科。
通过电化学原理的学习,我们可以深入了解电解质溶液中的电荷运动规律以及电化学反应的机理。
2. 基础概念电化学原理第四版李荻课件首先介绍了一些基础概念,包括电流、电荷、电势差等。
这些基础概念对于理解电化学原理的后续内容至关重要。
3. 电解质溶液的离子电导性本节介绍了电解质溶液中离子电导性的相关理论和实验方法。
电解质溶液中的离子在电场的作用下会发生迁移,并导致电流的流动。
通过测量电导率可以了解电解质溶液的离子浓度和活度系数等信息。
4. 电极反应与电极电势本节重点探讨了电极反应与电极电势的关系。
电极反应是电化学反应的基础,通过对不同电极反应的理解,可以揭示电化学反应的动力学过程。
而电极电势则是用来描述电极反应的热力学属性。
5. 电化学动力学电化学动力学研究了电化学反应的速率与反应条件之间的关系。
本节主要介绍了电化学动力学的基本原理和数学表达式,包括电荷传递系数、极化现象等内容。
6. 脉冲伏安法脉冲伏安法是一种常用的电化学测量技术,可以用于研究电化学反应的动力学和热力学过程。
本节详细介绍了脉冲伏安法的原理、仪器设计和实验步骤等内容。
7. 电化学计量电化学计量是利用电化学方法测量溶液中化学物质含量的技术。
本节主要介绍了电化学计量的原理、电化学分析方法的分类以及常用的电化学测量技术。
8. 电化学电源与电解池电化学电源和电解池是电化学实验的核心设备。
本节着重介绍了电化学电源和电解池的结构和工作原理,以及常见的电化学电源和电解池的种类和特点。
9. 应用与展望电化学原理在许多领域都有广泛的应用,如能源存储、电镀、电池等。
本节将展示一些电化学原理的应用案例,并对未来的发展进行展望。
总结:通过对电化学原理第四版李荻课件的介绍,我们深入了解了电化学原理的基本概念和相关理论。
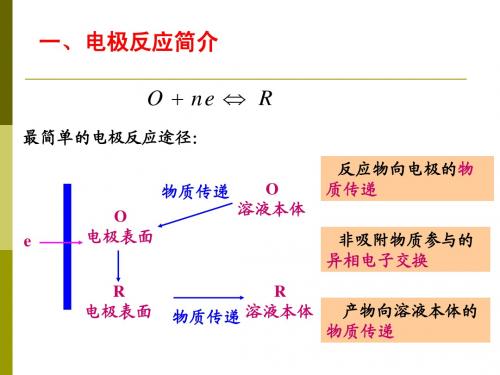
电极过程概述
面转化步骤。
例如银氰络合离子在阴极还原的电极过程,包
括4个单元步骤: (1) 液相传质步骤
Ag(CN)32-(溶液深处)→Ag(CN)32-(电极表 面附近)
(2) 前置转化步骤 Ag(CN)32-→Ag(CN)2-+CN-
(3) 电化学步骤(电子转移) Ag(CN)2-+e→Ag(吸附态)+2CN-
在连续进行的各个单元步骤中,除速度控制步骤 外,可以认为其余的步骤反应速度是非常快的。 如果远远大于控制步骤,则可以近似地认为它们 处于平衡状态。可以用热力学方法而不必用动力 学处理这些步骤,即认为它们处于可逆状态。应 当注意的是电极过程中的控制步骤并不是固定不 变的。随着条件的变化,可能由原来起控制步骤 的分部反应步骤转化为由另一个分部反应步骤起 控制步骤作用。
(5) 镀液的稳定性 如果满足以上5个条件,则认为此电解液的性 能较好。
四、极化曲线的分析
例1:P35 图3-1 例2:下图为18℃时,某甲基磺酸盐镀锡溶的 极化曲线,开路电位分别是 1#:-445mv ; 2#:-430mv ;通过分析得出镀液的分散能力 2#好于1#
2#施罗得 1#国巨
Dk (A/dm2)
析出超电势用η析来表示 对于阴极: η析=φ平- φ析 对于阳极: η析=φ析- φ平 二、析出电势的测定
P36
三、电解时的电极反应 电解时,如果溶液中有几种离子在阴极进 行还原或在阳极进行氧化时,则析出电势 大的优先在阴极进行还原反应,反之,析 出电势小的优先在阳极进行氧化反应。
例题:
在25℃时,用铜电极电解0.1M的CuSO4和 0.1M的ZnSO4溶液,当电流密度为0.01A/cm2 时,氢在铜上的析出超电势为0.584 v,而锌 与铜的析出超电势很小可以忽略不7
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重点要求 极化概念、 极化概念、产生原因及基本规律 测量极化曲线的基本原理 电极过程特征
一.电极的极化 电极的极化 可逆电极(reversible electrode):氧化还 可逆电极 : 原反应速度相等, 原反应速度相等,物质交换和电荷交换 平衡 。 i净 = 0 不可逆电极(irreversible electrode): 不可逆电极 : 电荷交换平衡, 电荷交换平衡,物质交换不平衡 i净 = 0 电荷交换不平衡, 电荷交换不平衡,物质交换不平衡 i净 ≠ 0
极化的基本规律
Ve >> V反 电荷积累:负电荷 电荷积累 负电荷 电荷积累:正电荷 电荷积累 正电荷 Cathodic polarization Anodic polarization Cation Anion 负移 正移 阴极极化 阳极极化
由于电子传递与电极反应这一对矛盾: 由于电子传递与电极反应这一对矛盾 V反 0 理想极化电极 ideal polarized electrode Pt电极 滴汞电极 电极,滴汞电极 电极 滴汞电极(DME) V反很大 理想不极化电极 ideal unpolarized electrode 甘汞电极(SCE) 甘汞电极
Pt
e
双电层
e
双电层
+
Pt
= E + (ηC +ηa ) + IR
E超
V
R反应
I
ϕ c平-η c
R溶液
I
ϕ a平+η a
IR
V
原电池与电解池的比较 原电池 阴极(+)→负移 负移 阴极 阳极(-)→正移 正移 阳极 E>V 电解池 阳极→正移 阳极 正移 阴极→负移 阴极 负移 E<V
四.电极过程的基本历程 电极过程的基本历程
Electrolytic Cell
极化(polarization):有电流通过时,电 :有电流通过时, 极化 极电位偏离平衡电位的现象 过电位(overvoltage):在一定电流密度下, :在一定电流密度下, 过电位 电极电位与平衡电位的差值 极化值:有电流通过时的电极电位( 极化值:有电流通过时的电极电位(极 化电位) 化电位)与静止电位的差值 ∆ϕ = ϕ −ϕ静
−
前 转 置 化
− (CN)2 +e →Ag(吸 态 + CN− Ag 附 ) 2
电 转 子 移
Ag(吸 态 →Ag(结 态 附 ) 晶 )
− −
新 生 相 成
2C ( 极 面 →2C (溶 )质 N 电 表 ) N 液传
速度控制步骤
速度控制步骤 (rate-determining step):串连的 : 各反应步骤中反应速度最慢的步骤。 各反应步骤中反应速度最慢的步骤。 浓差极化(concentration polarization):液相传 浓差极化 : 质步骤成为控制步骤时引起的电极极化。 质步骤成为控制步骤时引起的电极极化。 电化学极化(electrochemical polarization):由 电化学极化 : 于电化学反应迟缓而控制电极过程所引起的电 极极化。 极极化。
阴极极化
不锈钢在硫酸中的极化电 法
按 制 号 控 信 分
控 电 法 恒 位 ) 制 位 ( 电 法
稳 法 态
按 极 程 征 电 过 特 分
暂 法 态
经典恒电流法测量极化曲线
电化学反应速度的表示方法
O+ ne ⇔R
按异相化学反应速度表示: 按异相化学反应速度表示:
准平衡态 (quasi-equilibrium) 当电极反应以一定速度的进行时, 当电极反应以一定速度的进行时,非 控制步骤的平衡态几乎未破坏, 控制步骤的平衡态几乎未破坏,这种状 态叫做准平衡态 准平衡态。 态叫做准平衡态。 对准平衡态下的过程可用热力学方法 而无需用动力学方法处理, 而无需用动力学方法处理,使问题得到 简化。 简化。
五.电极过程的特征 电极过程的特征 异相催化反应 电极可视为催化剂 ,可以人为控制 复杂的多步骤的串连过程, 复杂的多步骤的串连过程,其动力学规 律取决于速度控制步骤
金属极化过程
Electrode polarization occurs when pore space is blocked by metallic particles.
Again charges accumulate when an electric field is applied.
The result is two electrical double layers which add to the voltage measured at the surface
采用电流表示: 采用电流表示:
1 dc v= S dt
1 dc i = nFv = nF ⋅ S dt
极化图(polarization diagram) 三.极化图 极化图 极化图: 极化图:把表征电极过程特征的阴极极 化曲线和阳极极化曲线画在同一个坐标 系中,这样组成的曲线图叫极化图。 系中,这样组成的曲线图叫极化图。
原电池极化规律
V =ϕC −ϕa − IR
= (ϕc平- c ) −(ϕa平+ a ) − IR η η
Zn
e
双电层
e
双电层
+
Cu
= E −(ηC +ηa ) − IR
E超
V
E
R反应
I
ϕ a平+η a
R溶液
I
ϕ c平-η c
IR
V
电解池极化规律
V =ϕa −ϕc + IR
= (ϕa平+ a ) −(ϕc平- c ) + IR η η E
二.极化曲线 极化曲线
极化曲线(polarization curve) :过电位(或 过电位( 电极电位) 电极电位)随电流密 度变化的关系曲线。 度变化的关系曲线。 极化度 (polarizability):极 : 化曲线上某一点的斜 率
dη dϕ 。 di di
阳极极化
电极过程的基本历程 液相传质步骤 前置的表面转化步骤 简称前置转化 电子转移步骤或称电化学反应步骤 随后的表面转化步骤简称随后转化 新相生成步骤或反应后的液相传质步骤
例
Ag(CN) (溶 ) Ag(CN) ( 极 面 传 液→ 电 表 )质
2− 3 2− 3
Ag(CN) →Ag(CN) +CN
2− 3 − 2
极化产生的原因 电流流过电极时,产生一对矛盾作用: 电流流过电极时,产生一对矛盾作用: 极化作用—电子的流动在电极表面积累电 极化作用 电子的流动在电极表面积累电 使电极电位偏离平衡状态; 荷,使电极电位偏离平衡状态; 去极化作用—电极反应吸收电子运动传递 去极化作用 电极反应吸收电子运动传递 的电荷,使电极电位恢复平衡状态。 的电荷,使电极电位恢复平衡状态。 极化是由上述两种作用联合作用的结果。 极化是由上述两种作用联合作用的结果。
