第五章 热量衡算
热量衡算

硫酸铝制备技术一、硫酸铝制备方法:目前,国内制备硫酸铝两种方法:铝土矿法+硫酸、氢氧化铝+硫酸第一种:有铁硫酸铝制备方法:用硫酸直接处理铝土矿(或粘土)的方法而制得硫酸铝,其化学反应式为: H2Al(SiO4)2·H2O+3H2SO4=Al2(SO4)3+2H4SiO4+H2O特点:原材料铝土矿便宜,但铁含量高,且不易脱除,目前,山东等铝土矿资源丰富的地方大量生产。
第二种:无铁硫酸铝制备方法:氢氧化铝+硫酸制备2Al(OH)3+3H2SO4 = Al2(SO4)3 + 6H2O + Q氢氧化铝粉出厂已脱铁,铁含量低,故硫酸铝铁含量低。
生产的硫酸铝有固体硫酸铝和液体硫酸铝。
固体硫酸铝的Al2O3含量15.8~17%,而氢氧化铝粉中Al2O3含量64~65%,运1吨氢氧化铝粉相当运4吨固体硫酸铝。
而本地浓硫酸价格相对便宜,所以,用氢氧化铝粉和浓硫酸反应生产成本低。
二、硫酸铝的反应形式- 1 -硫酸铝反应形式有两种:一种常压反应(老基地),一种带压反应(新基地)常压反应所用设备一般用玻璃钢反应釜,通蒸汽一般有两种:一种通过故泡器通蒸汽(催化剂长岭分公司),故泡器起到搅拌的作用;另一种直接通蒸汽,用工业风搅拌(齐鲁)。
带压反应所有设备一般有三种:搪瓷反应釜、搪铅通过胶泥贴耐酸瓷砖、锆反应釜(国内第一家,存在风险)。
带压反应的理论基础热量衡算:(1)、2Al(OH)3+3H2SO4 = Al2(SO4)3 + 6H2O + Q2 3 1 6 Q-1284kj/mol -194.5Kcal/mol -3435Kj/mol -285.83Kj/molQ=△RH=-285.83*6-3435+1284*2+3*194.5*4.18=-142.95kj/mol故此反应为放热反应整年反应的热量为Q反:Q反=-142.95*25000*50*3.353*1000/342=-1751869000Kj/年(2)对产物Al2(SO4)3 (1年的产量)从0℃升至140℃所需要的热量Q Al2(SO4)3Q Al2(SO4)3=CM△T 其中C=0.35Kcal/Kg.℃Q Al2(SO4)3=CM△T =0.35*4.2*25000*50*3.353*(140-0)=862559250kj/年对水的吸热(从0℃升至140℃)所需要的热量Qk100℃蒸汽r1=539Kcal/kg,H1=639.1Kcal/kg- 2 -140℃蒸汽r2=512.3Kcal/kg,H1=653Kcal/kgMH20=1324+10117=11441T故Q水=CM△T+R1*M+(H2-H1)*M=M*(4.2*100+539*4.2+13.9*4.2)=11441*4.2*(100+539+13.9)*1000=3.137*1010KJ(4)、浓硫酸稀释所放出的热量Q稀Q稀=(3677×103/98)*21021*4.2=3.313*1010KJ(5)对整个反应(时间为一年)需向反应釜提供的热量Q提Q提=Q放-Q吸=(3.313+0.175-0.086-3.137)×1010=0.265×1010KJ/年故反应无需向反应气补充蒸汽三、化工原材料性质及产品质量指标本项目原料主要有氢氧化铝粉浓硫酸,其规格及来源见下表。
化工节能技术第五章第一讲

蒸气进入冷凝器中被全部冷
凝,因此塔顶馏出液组成及
回流液组或均与第1层板的上
升蒸气组成相同,即
y1=xD=已知值 由于离开每层理论板的
气液两相是互成平衡的,故
可由y1用气液平衡方程求得x1。 由于从下一层(策2层)板的上
升蒸气组成y2与x1符合精馏段 操作关系,故用精馏段操作
线方程可
y2
R R 1
x1
(1)热量充分回收利用:据调查炼化企业,小于1000C的余 热占57%,1200C-2000C的占37%,大于2000C的占6%。一般 1500C以下的低温余热占一半以上,如何加以利用是值得 研究的。
(2)减少蒸馏过程所需能耗:在很大程度上取决于回流比 大小,可能的条件下,尽量减少操作回流比。
(3)严格控制产品的质量规格:不盲目的追求高纯度。
5.1 蒸馏过程能量消耗及节能
精馏过程能耗较大,如原油精馏燃料消耗占全厂的15%40%。
精馏系统能量利用率低,95%左右被塔顶冷凝器的冷却水 带走,能量利用率仅5%左右。
涉及的能量项:原料带入;加热热源输入;塔顶回流带 入;塔顶产品带出;冷却水带出;塔底产品带出;热损 失,七项。
5.1 蒸馏过程能量消耗及节能
在精馏系统中,塔顶蒸汽用热泵提高它的温位,并作为再沸 器的热源,有效的回收蒸汽的冷凝潜热,用于过程本身,提 高了热效率。因此,热泵精馏是一种很有前途的有效节能技 术。
用于化工生产中的热泵,主要是蒸汽压缩式热泵,低温蒸汽 借助于压缩装置来提高其温位。
分为两类:机械压缩式热泵,螺杆式压缩机或离心式透平压 缩机。由于压缩比大,余热温位提高较大,热泵精馏多采用 此种型式;蒸汽喷射式热泵,利用0.8MPa以上的较高压蒸汽 从喷嘴处高速喷出,所产生的卷带抽吸作用,降低温位的蒸 汽吸入,混合后以0.4MPa以下的低蒸汽从喷射器中喷出,作 为热原使用,设备简单,但节能效果不如压缩式热泵。
热量衡算
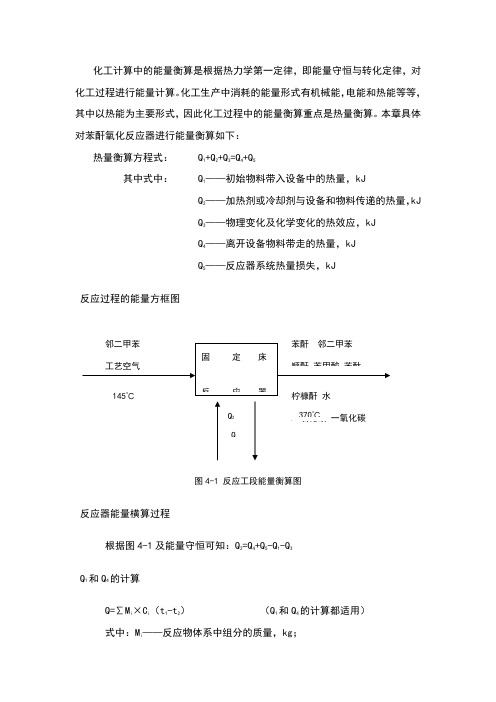
化工计算中的能量衡算是根据热力学第一定律,即能量守恒与转化定律,对化工过程进行能量计算。
化工生产中消耗的能量形式有机械能,电能和热能等等,其中以热能为主要形式,因此化工过程中的能量衡算重点是热量衡算。
本章具体对苯酐氧化反应器进行能量衡算如下:热量衡算方程式: Q1+Q2+Q3=Q4+Q5其中式中: Q1——初始物料带入设备中的热量,kJQ2——加热剂或冷却剂与设备和物料传递的热量,kJQ3——物理变化及化学变化的热效应,kJQ4——离开设备物料带走的热量,kJQ5——反应器系统热量损失,kJ反应过程的能量方框图图4-1 反应工段能量衡算图反应器能量横算过程根据图4-1及能量守恒可知:Q2=Q4+Q5-Q1-Q3Q1和Q4的计算Q=∑Mi×Ci(t1-t2)(Q1和Q4的计算都适用)式中:Mi——反应物体系中组分的质量,kg;C i ——组分i 在0-T℃时的平均比热容,KJ/; t 1,t 2——反应物系在反应前后的温度,℃。
物料进入设备时的温度为145℃,热量衡算的基准为145℃,△T=0,则: Q 1=0查得各物项平均比热容数据: (kJ/kg.℃)表4-1 各物相平均比热容所以: ()21i i 4t C M Q t -=∑=××(370-145)+××225+××225+××225+××225+××225+××225+××225+××225+××225+××225=.4kJ 过程Q 3的计算过程热效率可以分为两类:一类是化学过程的热效率即化学反应速率;另一类是物理过程热效率。
物料化学变化过程,除化学反应外,往往伴随着物料状态变化热效率,但本工艺流程中物理过程热效率较低,可以忽略不计,该过程皆为放热反应,则过程热效率可以由下式计算:主反应:C 8H 10+3O 2→C 8H 4O 3+3H 2O + Q 3-1=×103×=×103kJ/h副反应:CH 3C 6H 4CH 3+→C 4H 2O 3(顺酐)+4CO 2+4H 2O + Q 3-2=×103×=×103kJ/hCH 3C 6H 4CH 3+3O 2→C 6H 5COOH (苯甲酸)+CO 2+2H 2O +Q3-3=×103×=×103kJ/hCH3C6H4CH3+2O2→C8H6O2(苯酞)+2H2O +Q3-4=×103×=×103kJ/hCH3C6H4CH3+→C5H5O3(柠槺酐)+3CO+3H2O +Q3-5=×103×=×103kJ/hCH3C6H4CH3+→8CO+5H2O +Q3-6=×103×=×103kJ/hCH3C6H4CH3+→8CO2+5H2O +Q3-7=×103×=×103kJ/h 继而得到:Q 3 = Q3-1+Q3-2+Q3-3+Q3-4+Q3-5+Q3-6+Q3-7 =×103kJ/hQ5的计算该反应中的热损失按5%计算,即:Q 5=5%×(Q1+Q3)=5%×(0+×103)=×103kJ/hQ2的计算Q2为熔岩移出反应器的热量,由反应器热量守恒可知:Q 2=Q4+Q5-Q1-Q3=.8kJ/h反应器能量衡算表根据以上计算列出氧化反应工段能量衡算表格如下:表4-2 反应工段能量衡算表(吸收热量为“+”,释放热量为“-”)。
热量衡算的方法

热量衡算的方法嘿,咱今儿就来说说热量衡算的方法!这可真是个有意思的事儿呢。
你想想看,热量就像一群调皮的小精灵,在各种过程中跑来跑去。
要把它们搞清楚,那可得有点本事。
先说第一种方法,类比一下,就好像我们数一群乱跑的小鸡,得一只一只去数。
我们要仔细分析每个过程中热量的输入和输出,不能放过任何一个小细节。
就像警察破案一样,不放过任何蛛丝马迹。
比如说,一个化学反应,热量从反应物进来,又从生成物出去,咱就得把这进进出出的热量都算清楚咯。
还有一种方法呢,就像是给热量小精灵们建一个家,把它们都归置好。
我们要考虑各种能量的转换,比如热能变成了机械能,或者电能变成了热能。
这就好比你有一堆玩具,要把它们分类放好,汽车放一起,娃娃放一起。
这样才能清楚地知道热量都跑哪儿去了。
咱再想想啊,热量衡算就像一场游戏,你得掌握规则才能玩得转。
比如说,不同的物质有不同的热容,这就好比不同的游戏角色有不同的技能。
你得知道怎么利用这些热容来计算热量的变化。
有时候啊,这热量衡算也会让人头疼呢。
就像解一道很难的数学题,得绞尽脑汁。
但你可别灰心,只要耐心去算,总能找到答案。
而且啊,热量衡算在好多地方都用得到呢!工厂里生产东西,要算热量;家里开空调、用暖气,也得考虑热量啊。
这就像我们每天都要吃饭一样自然和重要。
你说,要是不把热量衡算弄清楚,那不是乱套了吗?那生产出来的东西质量能好吗?咱家里的能源能合理利用吗?所以啊,这热量衡算的方法可得好好学,好好用。
总之啊,热量衡算的方法就像是一把钥匙,能打开很多知识的大门。
咱可不能小瞧它,得认真对待,就像对待我们最喜欢的宝贝一样。
这样,我们才能在热量的世界里游刃有余,把一切都掌握在手中!这就是热量衡算的方法,大家可得记住咯!。
物料衡算和热量衡算

3 物料衡算和热量衡算计算基准年产 4500 吨的二氯甲烷氯化吸取,年工作日 330 天,每天工作 24 小时,每 小时产二氯甲烷:物料衡算和热量衡算反响器的物料衡算和热量衡算本反响为强放热反响,如不把握反响热并移走,温度会急剧上升,产生猛烈的燃烧反响, 是氯化物发生裂解反响。
由此可以通过参与过量的甲烷得到循环气,以之作为稀释剂移走反 应热。
〔一〕 计算依据〔1〕 二氯甲烷产量为: kg/h ,即: kmol/h ; 〔2〕 原料组成含: Cl 2 96%,CH 495%;(3) 进反响器的原料配比〔摩尔比〕: Cl 2:CH 4:循环气=1: (4) 出反响器的比例: CH 2Cl 2:CHCl 3=1:〔质量比〕(CHCl 3+CCl 4)/CH 2Cl 2=〔摩尔比〕;(5) 操作压力: 〔表压〕;(6) 反响器进口气体温度 25o C ,出口温度 420o C 。
〔二〕 物料衡算反Cl 2应CH 3Cl CH 2Cl 2 CHCl 3CH 4CCl 4 HCl假设循环气不参与反响,只起到带走热量的作用。
则设进口甲烷为 X kmol/h ,=h出反响器的一氯甲烷Y kmol/h,氯化氢Z kmol/h。
由进反响器的原料配比〔摩尔比〕Cl2:CH4:循环气=1:原料组成含: Cl2 96%,CH495%。
由CH2Cl2:CHCl3=1:〔质量比〕可得CHCl3每小时产量为:×=h由(CHCl3+CCl4)/CH2Cl2=〔摩尔比〕可得CCl4的量为×-=h用元素守衡法则:Cl 元素守衡=Y+×2+×3+×4+Z ①H 元素守衡4X=3Y+×2++Z ②C 元素守衡X=Y+++ ③解方程①①③得X=hY=hZ=h (1)所以反响器进口原料中各组分的流量:Cl2: ×=h=h 〔纯〕=h=h 〔含杂质〕CH4: h=h 〔纯〕=h=h 〔含杂质〕循环气流量:3×= kmol/h= Nm3/h其中:CH3Cl:kmol/hN2:×4%+×3%= kmol/hCO2:×2%= kmol/h可知:= 得进口Cl2为kmol/h3 CH 4:---= kmol/h进口气体总量: ++= kmol/h(2) 反响器出口中各组分流量:CH 3Cl : kmol/h CH 2Cl 2: kmol/h CHCl 3 : kmol/h CCl 4: kmol/h HCl : kmol/h 循环气: kmol/h出口气体总量:++++= kmol/h(3) 出口气体中各组分的含量:CH 3Cl : ×100%=%CH 2Cl 2:×100%=%CHCl : ×100%=% CCl 4: ×100%=% HCl : ×100%=% N 2:×100%=%CO 2: ×100%=% CH 4: ×100%=%表 3—1 反响器物料平衡组分kmol/h反响器进口组成%〔mol 〕 kg/h反响器出口kmol/h组成%〔mol 〕 kg/hCH 4 Cl 2 CH 3Cl CH 2Cl 22 2CHCl 3 CCl 4 HClN 2 CO 2 总计100 100〔三〕 热量衡算以 25℃为基准温度由《氯碱工业理化常数手册》查得如下数据:420℃时,由《氯碱工业理化常数手册》查得如下数据:物质n(kmol)CH 3ClCH 2Cl 2CHCl 3CCl 4HClN COΔt = 420-25=395℃输入焓:∑输入H = 0表 3—2 反响物料标准摩尔生成焓Δf/〔kJ/mol 〕 物质输入 输出CH 4Cl 2CO 2CH 3Cl CH 2Cl 2 CHCl 3 CCl 4HCln(kmol) Δf0 -100Δ f =∑ 生成物 n Δ H θ-∑ f m 反响物n Δ H θ=-×106 kJ f m 表 3—3 生成物的标准摩尔定压热容/(J ﹒K -1﹒mol -1)输出焓:∑ 输出 H = ∑nΔt = ×106 kJ℃时,由《氯碱工业理化常数手册》查得如下数据:物质n(kmol) CH4CH3Cl N2CO2考虑4%热损失,则×106×〔1-4%〕=则Q = Q放出带出循环气能带走的热量恰好为反响气放出的热量,是反响温度保持在420℃左右可以维持反响顺当进展。
热量衡算1

H m,C6 H5CH3 g CP ,C6H5CH3 l dT HV ,C6H5CH3 CP ,C6H5CH3 g dT 42780 kJ/kmol
283 384
384
323
H m , C 6 H 6 l
323
283
3.3.2 热力学数据表及性质图
5.温熵图
查取不同压力下物质的沸点、饱和蒸汽焓(熵) 值、饱和液体焓(熵)值以及过热蒸汽焓(熵)值等。 主要在冷冻系统(动力循环系统)的设计中使用。
3.3.2 热力学数据表及性质图
6.蒸汽的焓熵图
3.3.2 热力学数据表及性质图
7.溶液的焓浓图
某些物料,如NaOH 和CaCl2等水溶液,在稀 释时明显放热。在进行这 类物料的热平衡计算时, 最方便的方法是使用焓浓 图。图中查得的焓值已包 括了浓缩热,不用再单独 计算浓缩热。
V1 0.241kmol V2 0.111kmol
L2 0.389 kmol
热平衡式 Q ni H mi 出 - ni H mi 入
各组分焓值的计算 输入: H m,C H l 0
6 6
H m,C6H5CH3 l 0
输出:
H m,C6 H6 g C P ,C6 H6 l dT H V ,C6H6 C P ,C6 H6 g dT 37602 .17 kJ/kmol
3.3.3 物理过程的热量衡算
例1 某锅炉产生800kPa的饱和水蒸汽,现有两股 不同温度的水作为锅炉进水,其中20℃的水流量为 80kg/min,60℃的水流量为50kg/min。试求锅炉 每分钟的供热量。
20℃、80kg ·min-1 60℃、50kg· min-1 800kPa水蒸气,130kg· min-1
化工计算-能量衡算

800kPa水蒸气,130kg·min-1
第五节 无化学反应过程的能量 衡算
根据题意可知锅炉每分钟产生130kg的水蒸气,由饱和水 蒸气表知当压力为800kPa时,其温度为170.4℃,比焓为2773 kJ·kg-1。20℃的水比焓为83.74kJ·kg-1,60℃的水比焓为251.21 kJ·kg-1,代入式 Q=H2-H1,可求每分钟需供热量:
第二节 能量的基本形式
三、内能(U) 内能表示除了宏观的动能和位能外物质所具
有的能量,其大小与分子运动有关。 对于纯组分物质,内能可表示成与温度和摩尔体 积间的函数关系:
U nf (T ,Vm )
我们只能计算内能的差,或计算相对于某个参考
态的内能,而无U法2 计U算1 内n能TT12 的Cv,绝mdT对值。
化学反应过程的能量衡算
第一节 概述
一、能量衡算的意义 选择最佳操作条件,制定既经济又合理的能量消耗方案。
二、能量衡算的理论依据 热力学第一定律 :能量既不能产生,也不能消灭
第一节 概述
三、能量衡算的应用 了解工艺过程在加热、冷却和动力等诸方面的 能量平衡及其损耗情况,从而确定设备的尺寸、 载热体的用量、冷却和动力等诸方面
KA T1 T2
qm,hc p,h
tm
120 70
120 T2 '
39.1 [(T '2 20) (120 t2 ')] / 2
t '2 67.6℃ T '2 60.5 ℃
强化传热过程的途径
根据总传热速率方程: Q KAtm
1、增大传热面积——翅片管或翅片壁面可有效增大传热面积。
第四节 能量衡算的基本方法
例:两股不同温度的水用作锅炉进水,它们流量及温度分别是 A:120 kg·min-1,30℃; B:175 kg·min-1,65℃,
热量衡算

热量衡算一、2#氨塔水冷器进口温度 t=115℃,压力 P=29.0 MPa 入塔气NH3含量 Z1=3.6 %出塔气NH3含量 Z2=14.2 %氨产量 G=10000 Kg/h进塔气量 V进= G(1+Z2)/(Z2-Z1)=[10000*(1+14.2%)]/[17*(14.2%-3.6%)]=6337.4 kmol/h=141957.8 Nm3/h出塔气量 V出=V进-G/17=6337.4-10000/17=5749.2 kmol/h=128781.3 Nm3/h 取 Cp=7.85 kcal/kmol.℃带入水冷器热量 Q入=V出.Cp.t=5749.2*7.85*115=5190090.3 kcal/h=519009.03 kcal/t.NH3二、3#氨塔水冷器进口温度t=145℃入塔气NH3含量Z1=3.5 %出塔气NH3含量Z2=15.0 %氨产量 G=10500 Kg/h进塔气量 V进=G(1+Z2)/(Z2-Z1)=[10500*(1+15%)]/[17*(15%-3.5%)]=6176.5 kmol/h=138352.9 Nm3/h出塔气量 V出=V进-G/17=6176.5-10500/17=5558.8 kmol/h=124517.6 Nm3/h取 Cp=7.85 kcal/kmol.℃带入水冷器热量 Q入=V出.Cp.t=5558.8*7.85*145=6327304 kcal/h=602600 kcal/t.NH3三、甲醇塔1、1#甲醇塔(后期)气体流量 G=20000 Nm3/h塔出口温度200℃进塔co%含量Z1=6.5%出塔co%含量Z2=2.3%甲醇塔转化率α=(6.5-2.3)/6.5*100%=64.6%塔出口气量V出=V进-2*V进.Z.α=20000-20000*6.5%*64.6%*2 =18320 Nm3/h=817.9 kmol/h取Cp=7.1 kcal/kmol.℃带入水冷器热量Q入=V出.Cp.t=817.9*7.1*200=1161382 kcal/h2、2#甲醇塔入塔气量40000 Nm3/h气体出塔温度145℃进塔气co%含量5.5%出塔气co%含量1.5%co转化率α=(5.5-1.5)/5.5*100%=72.7%塔出口气体量V出=V进-2*V进.Z1.α=40000-2*40000*5.5%*72.7% =36801 Nm3/h=1642.9 kmol/h取Cp=7.1 kcal/kmol.℃带入水冷器热量Q入=V出.Cp.t=1642.9*7.1*145=1691377 kcal/h3、3#甲醇塔入塔气量23000Nm3/h入塔气co%含量6.0%出塔气co%含量2.0%气体出塔温度150℃co转化率α=(6.0-2.0)/6.0*100%=66.7%塔出口气体量V出=V进-2*V进*Z1*α=23000-2*23000*6.0%*66.7% =21159 Nm3/h=944.6 kmol/h取Cp=7.1 kcal/kmol.℃带入水冷器热量Q入=V出.Cp.t=944.6*7.1*150=1006001 kcal/h氨塔、甲醇塔气体带入水冷器热量如下:如果部分热能回收利用,则需在水冷器前增加一个换热器,换热器出口气体温度能降至80℃,以3#氨塔为例,回收热能为Q回=5558.8*7.85*(145-80)=2836377 kcal/h如果用25℃的水回收,每小时用70吨水,则水升高的温度为:△t=2836377/(1000*70)≈40℃即水可加热到65℃左右。
