有机化学第20章 蛋白质和核酸
2019-2020学年高中化学专题5生命活动的物质基础第二单元氨基酸蛋白质核酸学案

第二单元氨基酸蛋白质核酸1.认识氨基酸的组成、结构特点和主要化学性质,了解氨基酸、蛋白质与人体健康的关系。
2.了解蛋白质的组成、结构和性质,认识人工合成多肽、蛋白质、核酸等的意义,体会化学科学在生命科学发展中所起的重要作用。
氨基酸[学生用书P70]1.结构氨基酸的官能团为—NH 2(氨基)和—COOH(羧基)。
2.常见的氨基酸俗名结构简式系统命名甘氨酸H2NCH2COOH 氨基乙酸丙氨酸α氨基丙酸谷氨酸α氨基1,5戊二酸苯丙氨酸α氨基苯丙酸(1)物理性质固态氨基酸主要以内盐形式存在,熔点较高,不易挥发,难溶于有机溶剂。
常见的氨基酸均为无色结晶,熔点在200 ℃以上。
(2)化学性质①两性在氨基酸分子中,—COOH是酸性基团,—NH2是碱性基团,在酸性条件下主要以阳离子形态存在;在碱性条件下主要以阴离子形态存在,其反应关系为②成肽反应在酸或碱的存在下加热,氨基酸分子之间通过一个分子的—COOH和另一个分子的—NH2间脱去一分子水,缩合形成含有肽键的化合物。
例如:③显色反应氨基酸溶于水,加入0.1%的茚三酮溶液,水浴加热,溶液变为紫色(检验氨基酸的存在)。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)氨基酸分子中的—COOH能电离出H+显酸性,—NH2能结合H+显碱性。
( )(2)成肽反应的规律为—COOH脱羟基,—NH2脱氢。
( )(3)肽键可表示为。
( )(4)氨基酸的氢原子数为奇数,烃的氢原子数为偶数。
( )答案:(1)√(2)√(3)√(4)√2.氨基酸不能发生的反应是( )A.酯化反应B.与碱的中和反应C.成肽反应D.水解反应答案:D3.一种二肽的结构简式为,合成这种二肽的氨基酸是( )解析:选D。
利用二肽水解可得对应氨基酸。
1.氨基酸的两性氨基酸分子中含有酸性官能团—COOH和碱性官能团—NH2。
氨基酸分子中的氨基能结合H+,能与酸反应;而羧基能电离出H+,能与碱反应。
核酸化学
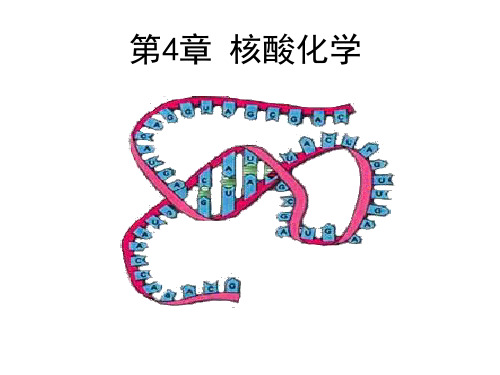
2.DNA双螺旋特征
(1)主链:两条平行的多核 苷酸链,以相反的方向,(即 一条由3΄向5΄,另一条由5΄向 3΄),围绕着同一个(想象的) 中心轴,以右手旋转方式构成 一个双螺旋形状。疏水的碱基 位于螺旋的内侧,亲水的磷酸 基和脱氧核糖以磷酸二酯键相 连成的骨架位于外侧。糖环平 面与中心轴平行,碱基平面与 中心轴相垂直。
• DNA三股螺旋结构常出现在 DNA复制、转录、重组的起始位 点或调节位点,如启动子区。 第三股链的存在可能使一些调控 蛋白或RNA聚合酶等难以与该区 段结合,从而阻遏有关遗传信息 的表达。
(3)四股螺旋DNA
•形成条件--串联重复的鸟苷酸 •基本结构单元--鸟嘌呤四联体 •碱基之间靠 Hoogsteen 键连接 •已有实验结果表明--真核细胞端 粒中存在四链结构
第4章 核酸化学
生物大分子
生物大分子是指生命体 内一些组织结构复杂的高分 子,它们是生命活动的主要 物质基础,因而被称为生命 物质。主要类型有蛋白质、 核酸、多糖、脂类。 生物大分子大多数是由 简单的组成结构聚合而成的, 蛋白质的组成单位是氨基酸, 核酸的组成单位是核苷 酸……
第1节 核酸的种类、分布与化学组成
DNA超螺旋的形成
DNA正常的双螺旋结构 处于能量最低状态,双 螺旋中没有张力而处于 松弛状态。如果这种正 常双螺旋额外增加或减 少螺旋圈数,就会使双 螺旋内的原子偏离正常 的位置而产生张力,这 样正常的双螺旋就发生 扭曲而形成超螺旋。超 螺旋总是向着抵消初级 螺旋改变的方向发展。
大多数原核生物 : 1)共价封闭的环状 双螺旋分子 2)超螺旋结构:双 螺旋基础上的螺旋化
Erwin Chargaff (1905-1995)
(二)DNA的一级结构 由4种脱氧核苷酸 dAMP 、 dGMP 、 dCMP 、 dTMP 按 照 一定的排列顺序通 过磷酸二酯键连接 而成的没有分支的 多核苷酸链。
生命力学说 有机化学

生命力学说有机化学全文共四篇示例,供读者参考第一篇示例:生命力学说是一种涵盖生物学、化学和物理学理论的综合性学说,其核心概念是生命是一种特殊的物质形式,遵循自然定律而存在的。
有机化学则是研究有机物的化学性质和构造的学科,是生命力学说的重要支撑和基础。
本文将介绍生命力学说和有机化学之间的关系,以及它们对我们理解生命的意义和奥秘的贡献。
生命力学说认为,生命是一种物质形态,是由一系列特定的有机分子和化学反应组成的。
这些有机分子包括碳水化合物、脂质、蛋白质和核酸等,它们在细胞内相互作用,形成了生命的基本单位。
有机化学则是研究这些有机分子的结构、合成和反应规律的学科,它帮助我们理解这些生物分子是如何构成和功能的。
有机化学的基本原理主要源自于生命力学说的理论基础。
生命力学说认为,生命是基于物质基础的,生物体内的化学反应是根据物质和能量的规律而进行的。
有机化学通过研究有机分子的结构与性质,揭示了生物分子是如何在细胞内发挥作用的。
蛋白质是由氨基酸组成的,它们在细胞内通过氨基酸的序列和立体构型来确定其功能和结构。
有机化学的研究成果为我们揭示了蛋白质是如何通过特定的氨基酸序列来进行分子识别和信号传导的。
生命力学说和有机化学的结合,不仅帮助我们理解生命的结构和功能,也为我们揭示了生命的起源和演化的机理。
生命力学说认为,生命是由非生物物质演化而来的,生命的起源是化学反应和物质演化的结果。
有机化学的研究表明,生命的起源是在地球的早期环境中,通过一系列的化学反应和自组装过程逐步形成的。
核酸可能是通过核苷酸的合成和聚合过程逐步形成的,这些化学过程在极端环境中可能也会发生。
生命力学说和有机化学的结合,也为我们医学和生物技术的发展提供了重要的指导和理论基础。
有机化学的研究成果为我们开发新药物和治疗方法提供了重要的思路和方法。
通过有机化学的方法合成新型抗生素和抗肿瘤药物,提高了药物的效果和人体的耐受性。
生命力学说的理论指导也为我们设计生物工程和合成生物学的新技术提供了重要的理论基础。
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
高中化学选修五第四章蛋白质和核酸知识点

第三节蛋白质和核酸一、氨基酸1、氨基酸的分子结构氨基酸是羧酸分子烃基上的氢原子被氨基(—NH2)取代后的产物。
氨基酸的命名是以羧基为母体,氨基为取代基,碳原子的编号通常把离羧基最近的碳原子称为α碳原子,离羧基次近碳原子称为β碳原子,依次类推。
2、氨基酸的物理性质常温下状态:无色晶体;熔、沸点:较高;溶解性:能溶于水,难溶于有机溶剂。
3、氨基酸的化学性质(1)甘氨酸与盐酸反应的化学方程式:;(2)甘氨酸与氢氧化钠反应的化学方程式:氨基酸是两性化合物,基中—COOH为酸性基团,—NH2为碱性基团。
(3)成肽反应两个氨基酸分子(可以相同也可以不同)在酸或碱存在下加热,通过一分子的氨基和另一分子的羧基脱去一分子水,缩合形成含有肽键的化合物,称为成肽反应。
【习题一】下列对氨基酸和蛋白质的描述正确的是()A.氨基酸和蛋白质遇重金属离子均会变性B.蛋白质水解的最终产物是氨基酸C.α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽D.氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动【分析】A.重金属盐能使蛋白质发生变性;B.氨基酸是组成蛋白质的基本单位,蛋白质水解的最终产物是氨基酸;α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,生成4种二肽;D.氨基酸中-COOH和NaOH反应生成羧酸根离子,应该向正极移动。
【解答】解:A.重金属盐能使蛋白质发生变性,但不能使氨基酸发生变性,故A错误;B.氨基酸通过发生水解反应生成蛋白质,所以蛋白质最终水解产物是氨基酸,故B正确;C.氨基酸生成二肽,是两个氨基酸分子脱去一个水分子,当同种氨基酸脱水,生成2种二肽;是异种氨基酸脱水:可以是α-氨基丙酸脱羟基、α-氨基苯丙酸脱氢;也可以α-氨基丙酸脱氢、α-氨基苯丙酸脱羟基,生成2种二肽。
所以共有4种,故C错误;D.氨基酸中-COOH和NaOH反应生成羧酸根离子,带负电荷,该向正极移动,故D错误;故选:B。
【习题二】下列叙述错误的是()A.氨基酸在一定条件下可发生缩聚反应B.氨基酸具有两性C.天然蛋白蛋水解的最终产物均为α-氨基酸D.饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析【分析】A.氨基酸在一定条件下可发生缩聚反应形成多肽;B.氨基酸中有氨基和羧基,氨基能与酸反应,羧基能与碱反应;C.天然蛋白质是α-氨基酸形成的;D.硫酸铜是重金属盐.【解答】解:A.氨基酸可发生缩聚反应形成多肽,故A正确;B.氨基酸分子中有氨基(-NH2)和羧基(-COOH),既能够和与酸反应,又能与碱反应,故B正确;C.天然蛋白质水解的最终产物是α-氨基酸,故C正确;D.硫酸铜是重金属盐,蛋白质遇硫酸铜发生变性,故D错误。
人教版高中化学选择性必修第3册教学设计 第四章 第三节 核酸

第四章第三节《核酸》教学设计一、课标解读《核酸》是《普通高中化学课程标准(版)》中模块3《有机化学基础》主题3“生物大分子及合成高分子”中二级标题“生物大分子”的内容,在新人教版教材中位于选择性必修3第四章第三节。
【内容要求】(1)了解脱氧核糖核酸、核糖核酸的结构特点和生物功能;(2)认识人工合成核酸的意义,体会化学科学在生命科学发展中所起的重要作用。
【学业要求】(1)能辨识核糖核酸、脱氧核糖核酸中的磷酯键,能基于氢键分析碱基的配对原理;(2)能说明核糖核酸、脱氧核糖核酸对于生命遗传的意义。
二、教材分析本节内容首先基于宏观视角认识核酸的组成结构,再基于化学键视角来认识核酸的形成过程,进而显化核酸的水解以及形成过程,进一步深化研究复杂有机物大分子结构的学习方法,结合我国在核酸的相关研究,增强文化自信。
本节内容注重凸显“宏观辨识与微观探析”、“证据推理与模型认知”、“社会责任”等化学核心素养。
教材首先介绍人们认识核酸组成时所采用的方法。
让学生进一步认识到,研究复杂的大分子时,可以通过化学反应使共价键断裂,将其分解成较小片段,然后通过分析产物来推测大分子的组成和结构。
这一方法在前两节糖类和蛋白质的学习中已有所体现,教材在这里通过正文叙述和图4-15“核酸的水解产物示意图”将其进一步显性化,在介绍相关知识的同时,让学生了解化学研究的方法,以提高其“证据推理与模型认知”的学科核心素养。
在根据实验结果进行逆向分析的基础上,教材指出核酸是戊糖、碱基和磷酸这三种基本组分通过缩合反应形成的生物大分子(缩合聚合物),并以示意图的形式直观呈现了核酸与其基本组分之间的转化和层次关系。
学生在高中生物课中学习的DNA双螺旋结构,以及选择性必修2“物质结构与性质”教材中的相关内容,为本节介绍核酸的结构奠定了知识基础。
因此,本节教材和教学主要从化学角度分析核酸独特结构的形成原因,通过图4-19展现氢键在DNA形成过程中的作用。
新教材高中生物高效作业3蛋白质和核酸含解析浙科版必修第一册
新教材高中生物高效作业浙科版必修第一册:蛋白质和核酸[A级新教材落实与巩固]1.DNA分子的基本组成单位——脱氧核苷酸中含有( B )A.核糖、磷酸、碱基 B.脱氧核糖、磷酸、碱基C.葡萄糖、磷酸、碱基 D.核糖、磷酸、腺苷【解析】构成DNA的基本单位是脱氧核苷酸,每分子脱氧核苷酸是由一分子脱氧核糖、一分子磷酸和一分子碱基(A、T、G、C中的一种)形成的,故选B。
2.同位素示踪技术是生物学研究中常用的手段,如果仅要求标记生物细胞中的核酸,而不标记蛋白质,应标记的同位素是( A )A.32P B.14CC.35S D.3H【解析】核酸与蛋白质相比,特有的元素是P,因此如果仅要求标记生物细胞中的核酸,而不标记蛋白质,应标记的同位素是32P,H和C是二者共有的元素,难以区分标记化合物,DNA中不含有S。
3.下列有关核酸的叙述,不正确的是( B )A.核酸是由C、H、O、N、P等元素组成的B.核酸的基本组成单位是氨基酸C.核酸存在于细胞核和细胞质中D.核酸有DNA和RNA两种【解析】核酸是由C、H、O、N、P等元素组成的,A正确;核酸的基本组成单位是核苷酸,B错误;核酸存在于细胞核和细胞质中,DNA主要分布在细胞核中,RNA主要分布在细胞质中,C正确;核酸分为DNA和RNA两种,D正确。
4.分析一种可溶性有机小分子样品,发现这种样品中含有C、H、O、N等元素,这种样品很可能是( D )A.葡萄糖 B.蛋白质C.脂肪酸 D.氨基酸【解析】葡萄糖的组成元素只有C、H、O,不含N元素,A不符合题意;蛋白质是大分子有机物,B不符合题意;脂肪酸的组成元素只有C、H、O,不含N元素,C不符合题意;氨基酸的组成元素为C、H、O、N等,且为小分子有机物,D符合题意。
5.下列有关氨基酸的描述,正确的是( B )A.氨基酸是构成蛋白质的基本单位,由氨基和羧基组成B.每种氨基酸至少具有一个氨基和一个羧基C.人体内的氨基酸必须从食物中获取D.每个氨基酸分子都只含有C、H、O、N四种元素【解析】每种氨基酸分子至少都含有一个氨基和一个羧基,且都有一个氨基和一个羧基连接在同一个中央碳原子上,这个碳原子还连接一个氢和一个R基团,A错误;每种氨基酸至少具有一个氨基和一个羧基,B正确;人体内的氨基酸分为必需氨基酸和非必需氨基酸,其中必需氨基酸必须从食物中获取,C错误;氨基酸的基本组成元素是C、H、O、N,有的还含有S、P等元素,D错误。
生物化学名词解释
练习题一、名词解释1.复性:蛋白质的变性作用如果不过于剧烈,则是一种可逆过程,变性蛋白质通常在除去变性因素后,可缓慢地重新自发折叠成原来的构象,恢复原有的理化性质和生物活性,这种现象成为复性2. 等电点(pI)当蛋白质溶液在某一定pH值时,使某特定蛋白质分子上所带正负电荷相等,成为两性离子,在电场中既不向阳极也不向阴极移动,此时溶液的pH值即为该蛋白质的等电点(isoelectric point,pI)。
3. 同工酶存在于同一种属或不同种属,同一个体的不同组织或同一组织、同一细胞,具有不同分子形式但却能催化相同的化学反应的一组酶,称之为同工酶(isoenzyme)4. 诱导契合:诱导契合学说:酶的活性中心在结构上具柔性,底物接近活性中心时,可诱导酶蛋白构象发生变化,这样就使使酶活性中心有关基团正确排列和定向,使之与底物成互补形状有机的结合而催化反应进行。
5. 变构效应:有些酶分子表面除了具有活性中心外,还存在被称为调节位点(或变构位点)的调节物特异结合位点,调节物结合到调节位点上引起酶的构象发生变化,导致酶的活性提高或下降,这种现象称为别构效应6. 糖酵解:糖酵解是将葡萄糖降解为丙酮酸并伴随着ATP生成的一系列反应,是生物体内普遍存在的葡萄糖降解的途径。
该途径也称作Embden-Meyethof-Parnas途径,简称EMP途径。
8. β-氧化脂肪酸在体内氧化时在羧基端的β-碳原子上进行氧化,碳链逐次断裂,每次断下一个二碳单位,即乙酰CoA,该过程称作β-氧化。
9. 半保留复制DNA在复制时,两条链解开分别作为模板,在DNA聚合酶的催化下按碱基互补的原则合成两条与模板链互补的新链,以组成新的DNA分子。
这样新形成的两个DNA分子与亲代DNA分子的碱基顺序完全一样。
由于子代DNA分子中一条链来自亲代,另一条链是新合成的,这种复制方式称为半保留复制10. 转录转录是在 DNA的指导下的RNA聚合酶的催化下,按照碱基配对的原则,以四种核苷酸为原料合成一条与模板DNA互补的RNA 的过程。
蛋白质课件新人教版
氨基酸残基构成的疏水性肽链片段,能够肯定的
是这些片段(
)。(见细胞测试83题)
A .贯穿于膜脂质双层中
B .是功能蛋白分子的活性中心
C .以小亚基的形式构成功能蛋白复合体
D.螺旋化形成中空的管道,以利于物质通过
氨基酸的紫外光吸收
各种氨基酸在可见光区都没有光吸收, 而在紫外光区仅色氨酸、酪氨酸和苯丙氨酸 有吸收能力。其中色氨酸的最大吸收波长为 279nm,酪氨酸的最大吸收波长为278nm, 苯丙氨酸的为259nm。利用紫外光法可以 测定这些氨基酸的含量。
蛋白质在280nm的紫外光吸收绝大部 分是由色氨酸和酪氨酸所引起的。因此测定 蛋白质含量时,用紫外分光光度法测定蛋白 质在280nm的光吸收值是一种既简便而又 快速的方法。
氨基酸的化学反应
1.α-氨基参加的反应 (1)与亚硝酸反应:氨基酸在室温下与亚硝酸作 用生成氮气。 (2)与酰化试剂反应:氨基酸的氨基与酰氯或酸 酐在弱碱溶液中发生作用时,氨基即被酰基化。
Cα如是不对称C(除Gly),则: 1. 具有两种立体异构体 [D-型和L-型] 2. 具有旋光性 [左旋(-)或右旋(+)]
2005年12.组成蛋白质的氨基酸的α--碳原子是不对
称的,但 除外。( ) A.丙氨酸 B.组氨酸 C.甘氨酸 D.谷氨酸
2001年42.天然蛋白质中不存在的氨基酸是_____。
氨基酸分子有的亲水,有的疏水。 在水相中,蛋白质分子中含有的疏水 氨基酸部分往往折叠到蛋白质大分子 的内部而远离水相;在强疏水环境中, 例如在细胞膜的脂类层中就暴露在大 分子的外面而与脂类分子相邻。
蛋白质分子中亲水类氨基酸的部 分在水相中大多露在蛋白质分子的表 面与水接触。
2007年60.构成跨膜区段的蛋白质的氨基酸大部分是:
《有机化学》课程教学大纲
《有机化学》教学大纲适用专业:应用生物技术专业总学时:65课时(一)课程的性质及任务《有机化学》是高等农、林、牧等专业的一门重要基础课,是理论和实践并重的课程。
它主要研究有机化合物的组成、分类、结构和性质。
揭示有机化合物之间的相互联系及变化规律,其任务是使学生掌握各种有机化合物的结构和性质。
熟悉一些常见有机化合物的命名、鉴别、合成方法和用途,为今后《生物化学》的学习打下良好基础。
(二)教学基本要求本课程重点讲授各类烃的衍生物的分类和命名,结构和性质、合成和鉴别,烃的部分由于高中时已作较详细的介绍,可以略讲,碳水化合物蛋白质、核酸部分在生物化学中还要作详细的介绍,也可以略讲。
要求学生掌握各类烃的衍生物的命名、结构、官能团和性质,熟悉它们的合成和鉴别,了解它们之间的相互联系和用途。
实验部分要求学生掌握有机化学实验的基本操作方法和技能,熟悉有机化合物的合成实验、提取实验和性质实验,做到理论教学和实验相结合,增强学生的感性认识,巩固所学理论,提高实践技能。
(三)理论教学内容第一章绪论§1-1有机化学的研究对象§1-2共价键§1-3有机化合物分类第二章开链烃§2-1烷烃一、烷烃的同系列和同分异构体现象二、烷烃的命名三、烷烃的结构与构象四、烷烃的物理和化学性质§2-2烯烃一、乙烯的结构二、烯烃的命名和异构现象三、烯烃的物理性质、化学性质四、诱导效应与马氏规律的解释§2-3炔烃一、乙炔的结构二、炔烃的命名和异构现象三、炔烃的物性质、化学性质§2-4二烯烃一、二烯烃的分类和命名二、1,3—丁二烯的分子结构三、共轭体系与共轭效应四、1,3—丁二烯的化学性质教学目的要求:要求重点掌握烷烃、烯烃、炔烃的命名、结构和性质,熟悉有关的杂化轨道理论和同分异构体现象。
第三章环烃§3-1环烷烃一、环烷烃的分类和命名二、环烷烃的物理性质、化学性质三、环烷烃的稳定性和分子结构的关系四、环烷烃的顺序异构和环已烷的构象§3-2芳香烃一、芳香烃的分类和命名二、苯的分子结构三、单环芳烃的物理性质、化学性质四、苯环上亲电取代的定位规律五、稠环芳烃六、休克尔规则与非苯芳烃本章教学目的要求:了解各类环烃的分类和命名,掌握环烷烃、芳香烃的结构和性质,重点掌握苯环上的亲电取代反应规律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.氨基酸羧基的反应
氨基酸分子中羧基的反应主要利用它能成酯、成酐、 成酰胺的性质。
OHPCl5
RCHCOOH NH2
C6H5CH2OH H+
R'NH2
LiAlH4
- CO2
RCHCOONH2
RCHCOCl
NH2 RCHCOOCH2C6H5
NH2 RCHCONHR'
R
L-氨基酸
用D/ L体系表示——在费歇尔投影式中氨基位于横键 右边的为D型,位于左边的为L型。
COOH H2N H
R
COOH H NH2
R
L--氨基酸
D--氨基酸
COOH H2N H
H OH CH3
L-苏氨酸
CHO HO H
H OH CH2OH
D-苏阿糖
用 R、S 命名的则 L 构型的氨基酸多为 S 型, 只有L-半光胺酸为 R 型。
组成肽和蛋白质的结构单元分子
—— - 氨基酸
一、分类、命名
1、分类
按烃基类型可分为脂肪族氨基酸,芳香族氨基酸,含杂 环氨基酸。 按分子中氨基和羧基的数目分为中性氨基酸,酸性氨基 酸,碱性氨基酸。
2、命名: 多按其来源或性质而命名。
二、氨基酸的构型
COOH
COOH
HO H
CH3 L-乳酸
H2N
H
酪胺酸
NH2 CH2CH COOH
N H
*色胺酸
Met Ser pro Tyr Trp
等电点
5.47 5.68 6.30 5.66 5.89
结构
II 酸性
NH2 HOOC CH2CH COOH
NH2 HOOC (CH2)2CH COOH
III 碱性
NH2 H2N (CH2)4CH COOH
NH2 HN CHN(CH2)2CH COOH
NH2
H
溶液PH>等电点
R CH COO NH3
等电点
H R CH COOH
OH
NH3
溶液PH<等电点
1°等电点为电中性而不是中性(即pH=7),在溶液中加入电 极时其电荷迁移为零(氨基酸不向电场的任何一极移动)。
中性氨基酸 酸性氨基酸 碱性氨基酸
pI = 4.8~6.3 pI = 2.7~3.2 pI = 7.6~10.8
NH3
H2N N NH2 CH2CH COO
名称
缩写
门冬胺酸 Asp 谷胺酸 Glu
*赖胺酸 精胺酸
Lys Arg
组胺酸 His
等电点
2.77 3.22
9.74 10.76 7.59
三、氨基酸的性质
1、氨基酸的酸-碱性
O R CH C-OH
NH2
O R CH C-O
NH3
R CH COOH NH3
部分水解。 8.了解酶的一般概念。
第一节 氨基酸
分子中既含有氨基,又含有羧基的化合物统称 为氨基酸。
CH3CHCOOH
NH2 -amino acid
NH2CH2CH2COOH -amino acid
NH2CH2CH2CH2COOH
COOH NH2
-amino acid
o-amino benzoic acid
第二十章
蛋白质和核酸
本章要求:
1.掌握氨基酸的两性和等电点,与茚三酮的反应。 2.掌握蛋白质的性质:两性和等电点,变性,鉴定。 3.理解多肽的一般结构。 4.了解核苷酸、核酸(RNA、DNA)。 5.了解氨基酸的制法。 6.了解二十种常见氨基酸的名称、分类和结构。 7.了解多肽结构的测定法(N端、C端的测定法),
氨基酸分子中的氨基能酰基化成酰胺。
R
R
R' COCl + NH2 CH COOH
R' C NH CH COOH + HCl
O
乙酰氯、醋酸酐、苯甲酰氯邻苯二甲酸酐等都可用作酰化剂。
在蛋白质的合成过程中为了保护氨基则用苄氧甲酰氯作为酰化剂。
O
R
CH2 O C Cl + NH2 CH COOH
O
R
CH2 O C NH CH COOH
2°以两性离子形式存在的氨基酸浓度最大。 3°等电点时,偶极离子在水中的溶解度最小,易结晶析出。
3、氨基酸的物理性质
1)α-氨基酸都是无色结晶。 2)等电点时以两性离子形式存在的氨基酸浓度 最大,易结晶析出。所以,氨基酸具有高熔点 及不溶于有机溶剂的特点。
4、氨基酸氨基的反应
(1)氨基的酰基化
COOH
H2N
H
CH2SH
20种氨基酸可组成无数蛋白质:
结构
名称
缩写
等电点
I、中性 (*为必要氨基酸,人体内不能合成,只能从食物中得到)
NH2CH2COOH
NH2 H3CHC COOH
NH2 (H3C)2HC CH COOH
NH2 C2H5HC CH COOH
CH3
甘胺酸
Gly
丙胺酸
Ala
*颉胺酸 Val
(2)氨基的烃基化
氨基酸与RX作用则烃基化成N-烃基氨基酸:
NO2
R
NO2
F + NH2 CH COOH
NO2 R
NO2
NH CH COOH
(3)与亚硝酸反应
R CH COOH + HNO2 NH2
R CH COOH + N2 + H2O OH
反应是定量完成的,衡量的放出N2,测定N2的 体积便可计算出氨基酸中氨基的含量。
H
OH
R CH COOH
R CH COO
NH2
NH2
通常以内盐存在:
O R CH C-O
NH3
2、氨基酸的等电点
在氨基酸水溶液中加入酸或碱,至使羧基和氨基的离子化程 度相等(即氨基酸分子所带电荷呈中性——处于等电状态) 时溶液的pH值称为氨基酸的等电点。常以pI表示。
R CH COOH NH2
OH R CH COO
*亮胺酸 Leu *苯丙胺酸 Phe
半光胺酸 Cys *苏胺酸 Thr
谷胺酸
Gln
天冬胺酸 Asn
等电点
6.02 5.48 5.07 5.6 5.56 5.07
结构
名称
缩写
NH2 CH3S(CH2)2CHCOOH
NH2 HOCH2CHCOOH
*蛋胺酸 丝胺酸
COOH N
脯胺酸
H
HO
NH2 CH2CH COOH
*异亮胺酸 Ile
5.97 6.00 5.96 5.98
结构
名称
缩写
NH2 (H3C)2HCH2C CH COOH
NH2 C6H5H2C CH COOH
NH2 HSH2C CH COOH
NH2 H3CHC CH COOH
OH
O
NH2
H2NC (CH2)2CHCOOH
O
NH2
H2NC CH2CHCOOH
(4)与茚三酮反应
α-氨基酸在碱性溶液中与茚三酮作用,生成显蓝色或 紫红色的有色物质,是鉴别α-氨基酸的灵敏的方法。
CO
H2O
CO
CO
茚三酮
C
O OH
C C O OH
水合茚三酮
C
O OH
C
+ RCHCOOH
C O OHNH2来自COO CC NC
CO
C HO
RCHO
+ CO2 3 H2O
脯氨酸在同样条件下呈黄色。
