第2节_阿伏加德罗定律推导
合集下载
阿伏伽德罗定律及其推论ppt课件.ppt
1.下列说法中正确的是 [
]
A.相同状况下,
气体的摩尔体积约等于22.4L/mol
B.标准状况下,22.4L的任何气体中都
约含有6.02×1023个分子
C.0℃,101kPa条件下,5.6LNH3中约 含有6.02×1023个原子
D.100℃、101kPa条件下,
22.4L水蒸气的质量等于18g
2.同温同压下,物质的量为0.2mol的 N2O(气)和NO2(气),它们的 [ CD ] A.质量相同,体积不同 B.体积相同,分子数不同 C.分子数相同,质量不同 D.体积相同,原子数相同
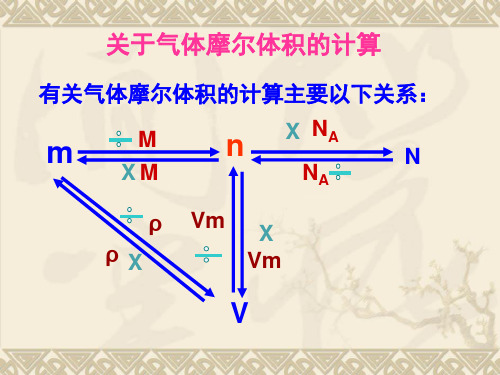
m
M
n X NA
N
XM
NA
ρ Vm X
ρX
Vm
V
1.利用气体摩尔体积,进行质量与体积 间的相互计算
【例题1】8.5g氨在标准状况时体积是多少升? 解:氨的式量是17,氨的摩尔质量是17g/mol
n(NH3)=
m(NH3) M(NH3) =
8.5g 17g/mol = 0.5mol
V(NH3)=22.4L/mol×0.5mol=11.2L
等于摩尔质量比。
练习:
ρ1∶ρ2=M 1∶M 2
在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(①③④ )
①CO2②H2③Cl2④HCl⑤N2
推论5
恒温恒容下,
气体的压强比等于它们的物质的量之比。
即:p1∶p2=n1∶n2
三、关于气体摩尔体积的计算
有关气体摩尔体积的计算主要以下关系:
解得:x=8g m(CO2)=30g-8g=22g
V(CO2)=17.6L-6.4L=11.2L
答:CO的质量为8g,CO2的质量为22g; CO的体积为6.4L,CO2的体积为11.2L。
阿伏加德罗定律推导 PPT课件 人教课标版

深圳市西乡中学
化学课堂演示
29.04.2019
气体摩尔体积 是阿伏加德罗定律的特例
温度 阿伏加德 罗定律 气体摩尔 体积 同温 压强 同压 气体的量 同分子数 气体的 体积 同体积
0℃
1大气压
1mol
22.4L
深圳市西乡中学房燕玲
29.04.2019
介绍:克拉珀龙方程:PV=nRT
R=8.314 Pa· m 3· mol-1· K-1
2. 同温同压下,任何气体密度比
1 M 1 2 M 2
(T、P相同)
练习二
三、阿伏加德罗定律的推论:
依据:=nRT 或
m RT PV= M
3. 同温同压下,气体体积之比 等于物质的量之比
V1 n1 V2 n2
(T、P相同)
练习三
三、阿伏加德罗定律的推论:
依据:PV=nRT 或
深圳市西乡中学房燕玲
推导五
29.04.2019
练习五
1. 在一定温度和压强下,10体积气体A2跟30体 积B2化合生成20体积某气体C,则C的化学式 为( C ) (A)AB (B)A2B (C)AB3 (D)AB2 2. 关于同温同压下等体积的CO2和CO的叙述: ①质量相等②密度相等③所含分子数相等④ 所含碳原子数相等,其中正确的是( C ) (A)①②③④ (B)②③④ (C)③④ (D)③
深圳市西乡中学房燕玲
推导四
29.04.2019
练习四
3. 在某温度时,一定量的元素 A的气态氢 化物(AH3),在一定体积的密闭容器 中完全分解成两种气态单质,此时压强
增 加 75% , 则 A 的 单 质 的 一 个 分 子 中
有 4 个A原子。
化学课堂演示
29.04.2019
气体摩尔体积 是阿伏加德罗定律的特例
温度 阿伏加德 罗定律 气体摩尔 体积 同温 压强 同压 气体的量 同分子数 气体的 体积 同体积
0℃
1大气压
1mol
22.4L
深圳市西乡中学房燕玲
29.04.2019
介绍:克拉珀龙方程:PV=nRT
R=8.314 Pa· m 3· mol-1· K-1
2. 同温同压下,任何气体密度比
1 M 1 2 M 2
(T、P相同)
练习二
三、阿伏加德罗定律的推论:
依据:=nRT 或
m RT PV= M
3. 同温同压下,气体体积之比 等于物质的量之比
V1 n1 V2 n2
(T、P相同)
练习三
三、阿伏加德罗定律的推论:
依据:PV=nRT 或
深圳市西乡中学房燕玲
推导五
29.04.2019
练习五
1. 在一定温度和压强下,10体积气体A2跟30体 积B2化合生成20体积某气体C,则C的化学式 为( C ) (A)AB (B)A2B (C)AB3 (D)AB2 2. 关于同温同压下等体积的CO2和CO的叙述: ①质量相等②密度相等③所含分子数相等④ 所含碳原子数相等,其中正确的是( C ) (A)①②③④ (B)②③④ (C)③④ (D)③
深圳市西乡中学房燕玲
推导四
29.04.2019
练习四
3. 在某温度时,一定量的元素 A的气态氢 化物(AH3),在一定体积的密闭容器 中完全分解成两种气态单质,此时压强
增 加 75% , 则 A 的 单 质 的 一 个 分 子 中
有 4 个A原子。
阿伏加德罗定律及推论

阿伏加德罗定律及其推论
一、阿伏加德罗定律
同温同压下,相同体积的任何气体都含 有相同数目的分子。
1、注意: (1)“三同”定“一同”。
(2)适用于任何气态物质。 既适用于单一气体,又适用于混合气体。
(3)标准状况下的气体摩尔体积是阿伏加德罗定律 的一个特例。 温度 压强 气体的量 气体的 体积 阿伏加德 同温 同压 同分子数 同体积 罗定律 气体摩尔 1mol 22.4L 0℃ 1大气压 体积
M
④
___
=MA×a%+MB×b%+MC×c%+……
③ STP时, M = ρ×22.4
ρ 1 M1 D ρ 2 M2
1. 已知空气中按体积分数计,氮气约占78%, 氧气约占21%,其余1%为稀有气体Ar(其他气 体都近似折算为氩)。试求空气的平均相对分 子质量。
2 在一定温度下,某物质W按下式分解:
气体Ⅱ
P1V1 P2V2
n1RT1
n2RT2
同温同压:
T1=T2
P1=P2
V 1 N 1 n 1 同 T、P: = = V2 N2 n2
二、阿伏加德罗定律的几个推论
推论1:同温同压下,任何气体的体积之比等于 物质的量之比(等于所含的分子数之比) V 1 N 1 n 1 同 T、P: = = V2 N2 n2
例、在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(①③④ )
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
例5、某气体A对氧气的相对密度为0.5,求 ①A的是式量是多少? ②A气体对空气的相对密度是多少?(同温同压 下) A的式量为:16;
A气体对空气的相对密度为:0.55
在标准状况下,将1.40gN2、1.60gO2、4.00gAr三种气 体混合,所得混合气体的体积是多少?
一、阿伏加德罗定律
同温同压下,相同体积的任何气体都含 有相同数目的分子。
1、注意: (1)“三同”定“一同”。
(2)适用于任何气态物质。 既适用于单一气体,又适用于混合气体。
(3)标准状况下的气体摩尔体积是阿伏加德罗定律 的一个特例。 温度 压强 气体的量 气体的 体积 阿伏加德 同温 同压 同分子数 同体积 罗定律 气体摩尔 1mol 22.4L 0℃ 1大气压 体积
M
④
___
=MA×a%+MB×b%+MC×c%+……
③ STP时, M = ρ×22.4
ρ 1 M1 D ρ 2 M2
1. 已知空气中按体积分数计,氮气约占78%, 氧气约占21%,其余1%为稀有气体Ar(其他气 体都近似折算为氩)。试求空气的平均相对分 子质量。
2 在一定温度下,某物质W按下式分解:
气体Ⅱ
P1V1 P2V2
n1RT1
n2RT2
同温同压:
T1=T2
P1=P2
V 1 N 1 n 1 同 T、P: = = V2 N2 n2
二、阿伏加德罗定律的几个推论
推论1:同温同压下,任何气体的体积之比等于 物质的量之比(等于所含的分子数之比) V 1 N 1 n 1 同 T、P: = = V2 N2 n2
例、在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(①③④ )
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
例5、某气体A对氧气的相对密度为0.5,求 ①A的是式量是多少? ②A气体对空气的相对密度是多少?(同温同压 下) A的式量为:16;
A气体对空气的相对密度为:0.55
在标准状况下,将1.40gN2、1.60gO2、4.00gAr三种气 体混合,所得混合气体的体积是多少?
阿伏加德罗定律及推论

0℃
1大气压 1mol
22.4L
课堂练习
1.判断下列说法是否正确?为什么?
(1)1L N2 和1L O2 在同温同压下所含分子数相同; (2)1mol N2 和1mol O2 所占体积相同; (3)1mol N2 和1mol O2 所含分子数相同; 2. 3mol O2 和2mol O3 分子数之比为————;
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
例5、某气体A对氧气的相对密度为0.5,求 ①A的是式量是多少? ②A气体对空气的相对密度是多少?(同温同压
下)
A的式量为:16;
A气体对空气的相对密度为:0.55
练一练
1.同温同压下,等质量的二氧化硫和二氧化 碳相比较,下列叙述中,正确的是(AD) (A)密度比为16:11 (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16
2. 一个密闭容器中盛有11gCO2时,压强为 1×104Pa.如果在相同温度下,把更多的CO2充 入容器中,使容器内压强增至5×104Pa,这时容 器内气体的分子数约为( C)
A.3.3×1025
B. 3.3×1024
C. 7.5×1023
D. 7.5×1022
气体状态方程: PV= n R T
1.505x1023个氧分子在标准状况下所占
的体积约是
A
A.5.6 L C.2.8L
B.0.56 L D.11.2L
2.同温同压下两个容积相等的贮气瓶,一 个装有C2H4,另一个装有C2H2和C2H6的混 合气体,两瓶内的气体一定具有相同的
A.质量 C.碳原子数
B.原子总数 C
D.密度
一、阿伏加德罗定律
P1V1 = n1RT1
阿伏加德罗定律及推论

阿伏加德罗定律及其推论
一、阿伏加德罗定律
同温同压下,相同体积的任何气体都含 有相同数目的分子。
1、注意: (1)“三同”定“一同”。
(2)适用于任何气态物质。 既适用于单一气体,又适用于混合气体。
(3)标准状况下的气体摩尔体积是阿伏加德罗定律 的一个特例。 温度 压强 气体的量 气体的 体积 阿伏加德 同温 同压 同分子数 同体积 罗定律 气体摩尔 1mol 22.4L 0℃ 1大气压 体积
2 在一定温度下,某物质W按下式分解:
由生成物组成的混合气体对氢气的相对 密度为18,则W的相对分子质量为 [ ] A.63 B.36 C.126 D.252 A
3.在标准状况下,9.6gSO2和O2组成的 混合气体,体积为4.48L,则此混合气体 中SO2和O2的物质的量之比为 [ C ] A . 2∶ 1 B . 1∶ 2 C . 1∶ 1 D.以上任何比
0.2mol
V(H2 ) n(H 2)
22.4 L
0.200mol×22.4L V(H2)== == 4.48L 1mol 答:最多可收集到4.48L(标准状况)氢气。
例3:13克锌与足量的稀盐酸完全反应,最多可收 集到多少体积(标准状况)的氢气?
解法3: Zn + 2HCl === ZnCl2 + H2↑ 65g 1mol 65 g 22.4L 1mol V(H2 ) n(H 13 g 0.2mol 2)
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
练习: 1:1 1.在标准状况下,22.4LCO和17gNH3的体积之比为_____ 1:1 所含原子数之比为______. 1:2 所含分子数之比为______,
2.在标准状况下:①2gH2 ②分子数为3.01x1023的CO2 ③0.8molHCl④1.12LCl2 ⑤5mol H2O ①③②④⑤ 体积由大到小的顺序是 3.标准状况下,等体积的氧气和某气体质量比为 1:2.5,则该气体的摩尔质量是多少? 80g/mol
一、阿伏加德罗定律
同温同压下,相同体积的任何气体都含 有相同数目的分子。
1、注意: (1)“三同”定“一同”。
(2)适用于任何气态物质。 既适用于单一气体,又适用于混合气体。
(3)标准状况下的气体摩尔体积是阿伏加德罗定律 的一个特例。 温度 压强 气体的量 气体的 体积 阿伏加德 同温 同压 同分子数 同体积 罗定律 气体摩尔 1mol 22.4L 0℃ 1大气压 体积
2 在一定温度下,某物质W按下式分解:
由生成物组成的混合气体对氢气的相对 密度为18,则W的相对分子质量为 [ ] A.63 B.36 C.126 D.252 A
3.在标准状况下,9.6gSO2和O2组成的 混合气体,体积为4.48L,则此混合气体 中SO2和O2的物质的量之比为 [ C ] A . 2∶ 1 B . 1∶ 2 C . 1∶ 1 D.以上任何比
0.2mol
V(H2 ) n(H 2)
22.4 L
0.200mol×22.4L V(H2)== == 4.48L 1mol 答:最多可收集到4.48L(标准状况)氢气。
例3:13克锌与足量的稀盐酸完全反应,最多可收 集到多少体积(标准状况)的氢气?
解法3: Zn + 2HCl === ZnCl2 + H2↑ 65g 1mol 65 g 22.4L 1mol V(H2 ) n(H 13 g 0.2mol 2)
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
练习: 1:1 1.在标准状况下,22.4LCO和17gNH3的体积之比为_____ 1:1 所含原子数之比为______. 1:2 所含分子数之比为______,
2.在标准状况下:①2gH2 ②分子数为3.01x1023的CO2 ③0.8molHCl④1.12LCl2 ⑤5mol H2O ①③②④⑤ 体积由大到小的顺序是 3.标准状况下,等体积的氧气和某气体质量比为 1:2.5,则该气体的摩尔质量是多少? 80g/mol
阿伏加德罗定律及其推论

状态1:P1M1=ρ1RT1 状态2:P2M2=ρ2RT2
① ②
① PM RT T —: 1 1 1 1 1 1 ② P2 M 2 2 RT2 2T2
3
第二部分 经典例题赏析 第二部分:经典例题 德 律 其推 考查 1.(1999年上海)由CO2、H2和CO组成的混合气在同温 同压下与氮气的密度相同 则该混合气体中CO2、 同压下与氮气的密度相同。则该混合气体中 H2和CO的体积比为( ) A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
知识点回顾 阿伏加德罗定律及其推论的内容 4.阿伏伽德罗定律的推论3: 同温、同压、同体积时: 气体质量之比等于构成气体物质分子的摩尔质量之比。 5.阿伏伽德罗定律的推论4: 同温、同体积、同质量时: 气体的压强之比等于构成气体物质分子的摩尔质量的反比。 气体的压强之比等于构成气体物质分子的摩尔质量的反比 6.阿伏伽德罗定律的推论5: 同温、同压时: 气体的密度之比等于构成气体物质分子的摩尔质量之比。
4
m1 M 1 m2 M 2
知识点精讲 ① P1V1 m1M2RT1 m1M2T1 —— : —— = ———— = ———— ② P2V2 m2M1RT2 m2M1T2 5.阿伏伽德罗定律的推论4: 同温、同体积、同质量时: 体 质量时 (T1 = T2,V1 = V2,m1 = m2 )
P1 M 2 P2 M 1
知识点精讲 克拉伯龙方程的变形形式 m PV RT M m1 状态1:PV RT 1 1 M1 1 状态2: P2V2
m2 RT2 M2
知识点精讲 ① P1V1 m1M2RT1 m1M2T1 —— : —— = ———— = ———— ② P2V2 m2M1RT2 m2M1T2 3.阿伏伽德罗定律的推论2: 同温 同压 同质量时:(T1 = T2,P1 = P2,m1 = m2 ) 同温、同压、同质量时:
阿伏加德罗定律及推论第二节3
(2)同温同压下气体密度大小的比较 ρ1/ρ2=M1/M2
(3)气体的相对密度 ρ1/ρ2=M1/M2=D
例题1、同温同压下,等质量的SO2和CO2相比 较,下列叙述中正确的是(B ) A、 密度之比为1:1 B 、体积之比为11:16 C、 体积之比为1:1 D 、密度之比为11:16
例题2、等质量的CO2和CO分别装入同温同体 积的容器求下列比例
(1)密度之比
1:1
(2)所含分子数之比 7:11
(3)所含氧原子之比 14:11
(4)压强之比
7:11
3、混合气体的平均摩尔质量
(1) M混=m总/n总
例、1molH2和2molO2的M混? 例、氮气和氧气体积之比为4:1时气体的M混? M(混)=Ma×A%+Mb×B%+……
(2)通过M混求气体比例
例、H2和O2混合气体的M混=10g/mol,求 两气体的物质的量之比?
11:4 “十字交叉法”
例题3、由CO2、H2和CO组成的混合气体在同 温同压下与氮气的密度相同,该混合气体中CO2、 H2和CO的体积比正确的是( C ) A、 44:8:14 B、 22:1:14 C、 13:8:29 D、 26:14:28
1、阿伏加德罗定律及推论
阿伏加德罗定律:同温同压下相同体积的 任何气体含有相同的分子数。 推论:
(1)等温、等压下 V1/V2=n1/n2=N1/N2 (2)等温、等容下 P1/P2=n1/n2=N1/N2 (3)等温、等量下 P1/P2=V2/V1
2、气体的密度
(1)标准状况下气体密度的求算 ρ=M/Vm
XY2+3O2══XO2+2YO2,冷却后,在标准状况下测得 生成物的体积为672mL,密度为2.56g/L,则:
(3)气体的相对密度 ρ1/ρ2=M1/M2=D
例题1、同温同压下,等质量的SO2和CO2相比 较,下列叙述中正确的是(B ) A、 密度之比为1:1 B 、体积之比为11:16 C、 体积之比为1:1 D 、密度之比为11:16
例题2、等质量的CO2和CO分别装入同温同体 积的容器求下列比例
(1)密度之比
1:1
(2)所含分子数之比 7:11
(3)所含氧原子之比 14:11
(4)压强之比
7:11
3、混合气体的平均摩尔质量
(1) M混=m总/n总
例、1molH2和2molO2的M混? 例、氮气和氧气体积之比为4:1时气体的M混? M(混)=Ma×A%+Mb×B%+……
(2)通过M混求气体比例
例、H2和O2混合气体的M混=10g/mol,求 两气体的物质的量之比?
11:4 “十字交叉法”
例题3、由CO2、H2和CO组成的混合气体在同 温同压下与氮气的密度相同,该混合气体中CO2、 H2和CO的体积比正确的是( C ) A、 44:8:14 B、 22:1:14 C、 13:8:29 D、 26:14:28
1、阿伏加德罗定律及推论
阿伏加德罗定律:同温同压下相同体积的 任何气体含有相同的分子数。 推论:
(1)等温、等压下 V1/V2=n1/n2=N1/N2 (2)等温、等容下 P1/P2=n1/n2=N1/N2 (3)等温、等量下 P1/P2=V2/V1
2、气体的密度
(1)标准状况下气体密度的求算 ρ=M/Vm
XY2+3O2══XO2+2YO2,冷却后,在标准状况下测得 生成物的体积为672mL,密度为2.56g/L,则:
人教版高一化学必修一1.2阿伏伽德罗定律.PPT(共27张PPT)
3、平均摩尔质量的计算方法
①.依据定义式:M=m总/n总 例1、由8gO2和28gN2组成的混合气体的 平均相对分子质量是——28—.8—
例2、150 ℃时 (NH4)2CO3完全分解生成气 态混合物的平均相对分子质量—2—4 ——
②.依据物质的量分数(体积分数)计算
M=m=总/nn1%总===.Mm1n+nnn11总11++n.MMm2n%1212++++.nMnnmn232总.n2+3M+总+Mn2mn4+234+n%n3n.3.总MMM33+3++nn4nn.4M4%总M4.M4 4 =V1%.M1+ v2%.M2+ V3%.M3+ V4%.M4
14
练习1、某金属粉末的混合物11g,加入到
足量的稀H2SO4中,标况下产生的气体体
积为11.2L,则此混合物可能是( AB )
A.Al和Mg
B.Al和Zn
C.Zn和Fe
D.Mg和Zn
练习2、由CO2、H2和CO组成的混合气在同 温同压下与氮气的密度相同,则该混合气体
中CO2、H2和CO的体积比为(CD)
A.7d B.5d C.2.5d D.2d
在标准状况下,CO和CO2混合气体的平均 摩尔质量为32g/mol,求混合气体中CO和 CO2的体积之比。 法1:
解:设CO的体积分数为a,则CO2 的为1-a 28a+44 ×(1-a)=32 a=0.75 1-a=0.25
V(CO) /V(CO2) =0.75/0.25=3/1
同温同压下:若m1=m2 则n1xM1=n2xM2
V1 xM1=
阿伏加德罗定律推论
12.用NA表示阿伏加德罗常数 下列说法正确的是 BC] . 表示阿伏加德罗常数,下列说法正确的是 下列说法正确的是[ A.18g水所含总电子数为 A 水所含总电子数为8N . 水所含总电子数为 B.标准状况下,22.4L氯气中所含的氯原子数 .标准状况下, 氯气中所含的氯原子数 为2NA C.醋酸的摩尔质量与NA个醋酸分子的质量在 .醋酸的摩尔质量与 数值上相等 D.12g金属镁变为镁离子时,失去电子数目 金属镁变为镁离子时, . 金属镁变为镁离子时 为0.1NA
m(NH3) 8.5g n(NH3)= = = 0.5mol 17g/mol M(NH3)
V(NH3)=22.4L/mol×0.5mol=11.2L / × 氨在标准状况时的体积是11.2L。 答:8.5g氨在标准状况时的体积是 氨在标准状况时的体积是 。
练习: 练习: 在标准状况下, 在标准状况下,将1.40gN2、1.60gO2、4.00gAr 三种气体混合,所得混合气体的体积是多少? 三种气体混合,所得混合气体的体积是多少?
10.在一定温度下,某物质W按下式分解: .在一定温度下,某物质 按下式分解 按下式分解:
由生成物组成的混合气体对氢气的相对 密度为18, 密度为 ,则W的相对分子质量为 [ A 的相对分子质量为 A.63 B.36 C.126 D.252 . . . .
]
11.某玻璃瓶质量为54g,在一定温度和压强下 .某玻璃瓶质量为 , 气体后其质量为60.6g,在相同 充满 CO2气体后其质量为 , 条件下 如装满CO,其质量为 [ B ] 如装满 , A.60.6g B.58.2g C.56.2g D.48.4g . . . .
14.在标准状况下空气的密度为1.293g/L, .在标准状况下空气的密度为 , 空气的平均摩尔质量约为____。 空气的平均摩尔质量约为 29g/mol 某碳氢化合物 。 的摩尔质量与空气平均摩尔质量之比为2∶ , 的摩尔质量与空气平均摩尔质量之比为 ∶1, 该碳氢化合物中碳、氢原子个数之比为2∶ , 该碳氢化合物中碳、氢原子个数之比为 ∶5, 则它的化学式为____。 则它的化学式为C4H10。 15.如果ag某气体中有 个该物质的分子, .如果 某气体中有 个该物质的分子, 某气体中有b个该物质的分子 22.4bc 阿伏加德罗常数以N 代表, 阿伏加德罗常数以 A代表, aNA L 该气体在标准状况下的体积为____ 则cg该气体在标准状况下的体积为 该气体在标准状况下的体积为 16.如果ag氦气中含 个分子,则阿伏加德罗常数 .如果 氦气中含 个分子, 氦气中含b个分子
人教课标版 阿伏加德罗定律推导PPT
练习五
2. 同温同压下,等质量的二氧化硫和二氧 化碳相比较,下列叙述中,正确的是 (A)密度比为16:11 ( A、 D ) (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16
深圳市西乡中学房燕玲
推导五
2019/4/10
练习五
3. 同温同压下,将1体积的CO2和2体积的 CO进行比较,则CO2与CO的: (1)分子数之比为 1:2 ; (2)原子数之比为 3:4 ; (3)质量之比为 11:14 (4)物质的 量之比为 1:2 。 (5)密度之比为 11:7 (6)摩尔质量 之比为 11:7 。
深圳市西乡中学房燕玲
推导五
2019/4/10
练习五
1. 在一定温度和压强下,10体积气体A2跟30体 积B2化合生成20体积某气体C,则C的化学式 为( C ) (A)AB (B)A2B (C)AB3 (D)AB2 2. 关于同温同压下等体积的CO2和CO的叙述: ①质量相等②密度相等③所含分子数相等④ 所含碳原子数相等,其中正确的是( C ) (A)①②③④ (B)②③④ (C)③④ (D)③
1mol任何气体只有在标准状况下 其体积才约是22.4升吗?
思考:
1mol任何气体只有在 标准状况下其体积才 约是 22.4 升吗? nRT 1 8 . 314 273 V 22 . 4 升
P
5 1 . 01 10
例:1mol任何气体在常温下(25℃), 1.106×105Pa压强时
nRT 1 8 . 314 298 V 22 . 4 升 5 P 1 . 106 10
深圳市西乡中学房燕玲
2019/4/10
三、阿伏加德罗定律的推论
依据:PV=nRT 等于式量之比 或 1. 同温同压下,同体积任何气体的质量比
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
计算混合气体的平均式量
例题:
1. 800mL的某气体,在标准状况下,质量 是1克,求这种气体的式量。 2. 某有机物气体在标准状况下密度为1.16 克/升,求这种气体的式量。 3. 某有机物气体在同温同压下对氢气的相 对密度为2.69,求该气体的式量。
例题
1. 在空气中N2、O2、Ar的体积分数分别为 78%,21%,约1%,求空气的平均式量 2. 计算在150℃,碳酸铵分解后的混合气 体的平均式量。 3. 已知氮气和氧气的混合气体其平均式量 为31,求氮气和氧气的体积比。
阿伏伽德罗定律推论的推导
理想气体状态方程
PV=nRT
R为常数
m RT M PV= ρ
P=
M
RT
三、阿伏加德罗定律的推论:
依据:PV=nRT 1.同温同压下,气体体积之比 等于物质的量之比
V1 n1 = V2 n2
(T、P相同)
三、阿伏加德罗定律的推论:
依据:PV=nRT 2.同温同体积下,气体的压强之比等于 物质的量之比
练习四
3. 在某温度时,一定量的元素A的气态氢 化物(AH3),在一定体积的密闭容器 中完全分解成两种气态单质,此时压强 增 加 75%, 则 A的 单 质 的 一个 分 子中 有 4 个A原子。
练习五
1. 现有两种气体,它们的分子量分别为 MA:MB (1)当两种气体质量相同时,标准状 况下A与B的体积比为 MB:MA ,密度 比为 MA:MB ,所含分子数比 为 MB:MA 。 (2)当两种气体(同温同压)的体积 相同时,A和B的质量比为 MA:MB 。
M 1 m1 = M 2 m2
(T、P、V相同)
三、阿伏加德罗定律的推论:
依据:PV=
ρ
M RT
5.同温同压下,任何气体密度比 等于式量之比
ρ1 M 1 = ρ2 M 2
(T、P相同)
四、求气体物质的式量的常用方法
1. 由气体的体积和质量求式量 2. 由标准状况下密度求式量 摩尔质量=密度×22.4 3. 根据气体的相对密度求式量(相对密度 指两种气体密度的比值,用D表示) D = d1/d2 = M1/M2 4. 计算混合气体的平均式量( M )
练习三
同温同压下,同物质的量的乙炔气体 (C2H2)与苯蒸气(C6H6)体积比是 (B) (A)3:1 (B)1:1 (C)1:3 (D)2:3
练习四
1. 在某温度下,将0.1摩Cl2和0.4摩H2充入 容积为2升的密闭容器中,测得其压强 为1大气压,点火充分反应后再恢复到 原来温度时,容器内的压强是( C ) (A)0.2大气压 (B)0.6大气压 (C)1个大气压 (D)无法确定
练习五
2. 同温同压下,等质量的二氧化硫和二氧 化碳相比较,下列叙述中,正确的是 、 ( A、D ) (A)密度比为16:11 (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16
练习五
3. 同温同压下,将1体积的CO2和2体积的 CO进行比较,则CO2与CO的: 1: (1)分子数之比为 1:2 ; : (2)原子数之比为 3:4 ; : (3)质量之比为 11:14 (4)物质的 : 量之比为 1:2 。 (5)密度之比为 11:7 (6)摩尔质量 : : 之比为 11:7 。
练习四
2. 将H2、O2、N2三种气体分别装在三个容积相等 的容器中,当温度和密度完全相同时,三种气 体压强(P)的大小关系正确的是( B ) (A)P(H2)=P(O2)=P(N2) (B)P(H2)>P(N2)>P(O2) (C)P(H2)>P(O2) >P(N2) (D)P(N2)>P(O2) >P(H2)
P1 n1 = P2 n2
(T、V相同)
三、阿伏加德罗定律的推论:
m 依据: PV= RT M
3.同温同压下,相同质量的任何气体的体 积与其式量 成反比
V1 M 2 = V2 M 1
(T、P、m相同 )
三、阿伏加德罗定律的推论
依据:
m RT PV= M
4.同温同压下,同体积任何气体的质量比 等于式量之比
阿伏加德罗定律
化学课堂演示
2010-9-25
阿伏伽德罗定律:同温同压,相同体 积的任何气体都含有相同数目的分子。
同温同压下,气体的物质的量之 比等于体积之比:n1/n2=V1/V2。
阿伏伽德罗定律的推论:
1、同温同压下,气体的物质的量(分子数)之比等于 n1/n2=N1/N2=V1/V2 气体的体积比: 2、同温同容下,气体的物质的量(分子数)之比等于 气体的压强比: n1/n2=N1/N2=P1/P2 3、同温同压下,气体的密度之比等于其摩尔质量之比: ρ1/ ρ2= M1/M2 4、同温同压同容下,气体的质量比等于气体的摩尔质 量比: m1/m2=M1/M2
练习一
1. 同温同压下,相同体积(或分子数或物质 的量)的下列气体中,质量最大的是( ) C (A)氦气 (B)氢气 (C)氧气 (D)氮气 2. 某气体的质量是同温同压同体积氢气质量 的22倍,则该气体的式量是( ) (A)22 (B)66 D (C)88 (D)44
练习二
1. 同温同压下,体积相同的下列气体,密 度与其它三者不同的是(D ) (A)N2 (B)C2H4 (C)CO (D)H2S 2. 同温同压下,密度相同的气体组是( A ) (A)CO、N2 (B)NO、CH4 (C)C2H4、NO (D)SO2、Cl2
练习五
在一定温度和压强下,10体积气体A2跟30体 积B2化合生成20体积某气体C,则C的化学式 为( C ) (A)AB (B)A2B (C)AB3 (D)AB2 2. 关于同温同压下等体积的CO2和CO的叙述: ①质量相等②密度相等③所含分子数相等④ 所含碳原子数相等,其中正确的是( C ) (A)①②③④ (B)②③④ (C)③④ (D)③ 1.
