2018年高考化学真题分类汇编水溶液中的离子平衡
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年高考化学真题分类汇编
专题8水溶液中的离子平衡(选修4)
Ⅰ—弱电解质的电离
1.[2018天津卷-3]下列叙述正确的是
A. 某温度下,一元弱酸HA的K a越小,则NaA的K h(水解常数)越小
B. 铁管镀锌层局部破损后,铁管仍不易生锈
C. 反应活化能越高,该反应越易进行
D. 不能用红外光谱区分C2H5OH和CH3OCH3
【答案】B
【解析】A.根据“越弱越水解”的原理,HA的K a越小,代表HA越弱,所以A-的水解越强,应该是NaA的K h(水解常数)越大。选项A错误。B.铁管镀锌层局部破损后,易形成
锌铁原电池,因为锌比铁活泼,所以锌为负极,对正极铁起到了保护作用,延缓了铁管的
腐蚀。选B正确。C.反应的活化能越高,反应越难进行。选项C错误。D.红外光谱是用来检测有机物中的官能团或特定结构的,C2H5OH和CH3OCH3的官能团明显有
较大差异,所以可以用红外光谱区分,选项D错误。
【考点】水解平衡常数与电离平衡常数的关系、金属的防护、活化能、红外光谱与化学键。
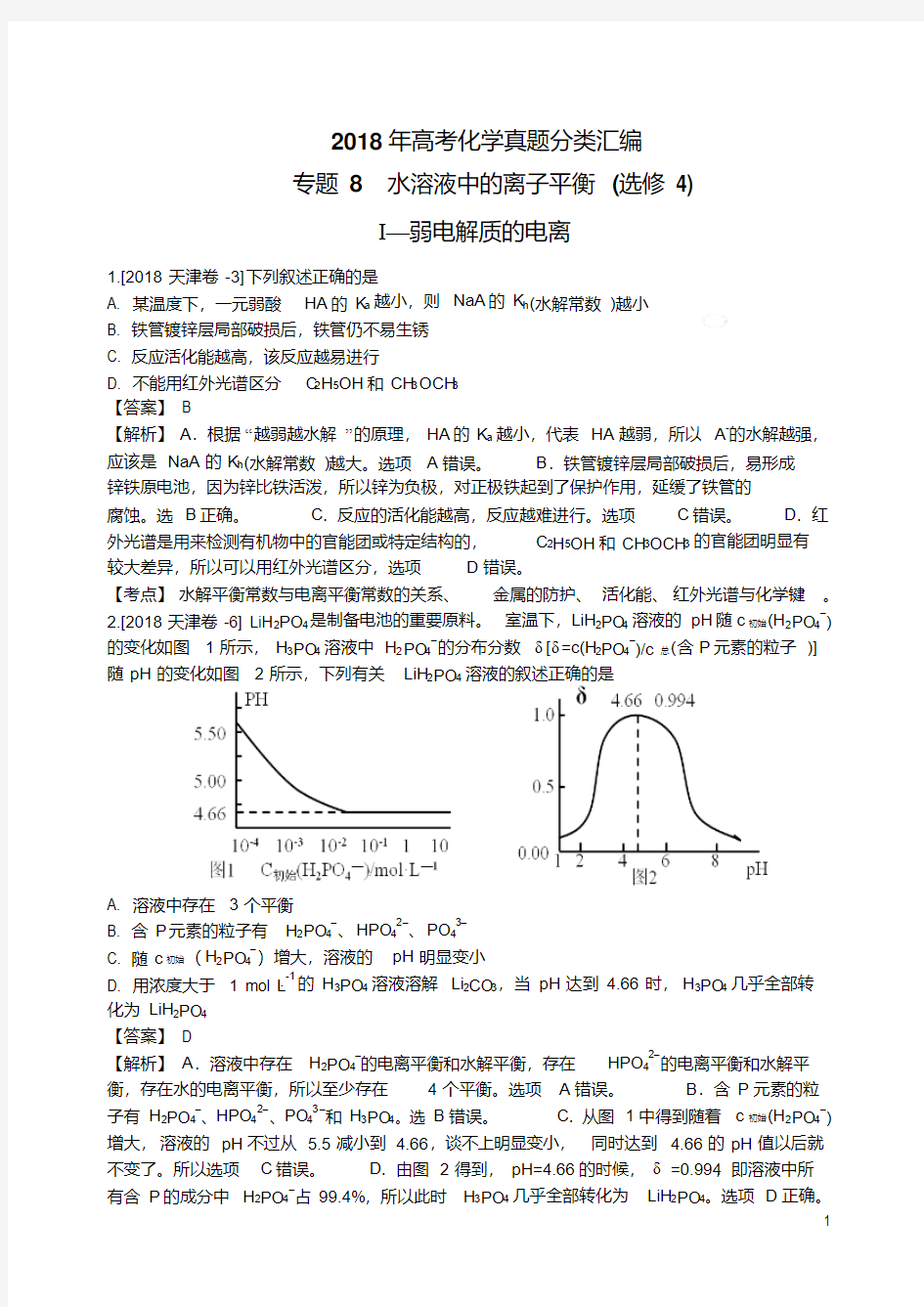
2.[2018天津卷-6] LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ[δ=c(H2PO4–)/c总(含P元素的粒子)]
随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是
A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转D. 用浓度大于 1 mol·
化为LiH2PO4
【答案】D
【解析】A.溶液中存在H2PO4–的电离平衡和水解平衡,存在HPO42–的电离平衡和水解平衡,存在水的电离平衡,所以至少存在4个平衡。选项A错误。B.含P元素的粒子有H2PO4–、HPO42–、PO43–和H3PO4。选B错误。C.从图1中得到随着c初始(H2PO4–)增大,溶液的pH不过从 5.5减小到 4.66,谈不上明显变小,同时达到 4.66的pH值以后就不变了。所以选项C错误。D.由图2得到,pH=4.66的时候,δ=0.994,即溶液中所
有含P的成分中H2PO4–占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4。选项D正确。
【考点】H3PO4的分步电离;H2PO4–在溶液中的电离及一定条件下电离与水解的平衡。随
c(H2PO4–)的增大,溶液的pH有一定的下降,但是达到一定程度后就基本不变了。主要是
因为H2PO4–存在电离和水解,浓度增大电离和水解都会增加,影响会互相抵消。
3.[2018浙江卷-18]相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A. pH相等的两溶液中:c(CH3COO—)=c(Cl—)
B. 分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同
C. 相同浓度的两溶液,分别与金属镁反应,反应速率相同
D. 相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):
c(CH3COO—)=c(Cl—)
【答案】A
【解析】同温时,依电荷守恒有:盐酸溶液中:c(H+)= c(Cl—)+ c(OH—);醋酸溶液中:c(H+)= c(CH3COO—)+ c(OH—),当盐酸和醋酸两种溶液的pH相等时,它们的c(H+)、c(OH—)分别相等,故c(CH3COO—)=c(Cl—),A正确;因醋酸为弱酸,在溶液中只有部分电离,当
盐酸和醋酸两种溶液的pH相等、体积相等时,醋酸的物质的量比盐酸多,消耗的NaOH 的物质的量多,所以B错误;因醋酸为弱酸,在溶液中只有部分电离,当盐酸和醋酸
两种溶液的浓度相等时,分别与金属镁反应,盐酸的反应速率快,故C错误;盐酸和醋酸两种溶液分别与NaOH固体反应后呈中性的溶液中分别有:c(Na+)+c(H+)= c(Cl-)+
c(OH-)或c(Na+)= c(Cl-);c(Na+)+c(H+)= c(CH3COO-)+ c(OH-)或c(Na+)= c(CH3COO-),但两种溶液中的c(Na+)前者大,故c(Cl—)>c(CH3COO—),故D错误。
【考点】水溶液中的离子平衡
10-5,4.[2018江苏卷-14]H2C2O4为二元弱酸,K a1 (H2C2O4 ) =5.4×
10-2,K a2 (H2C2O4 ) =5.4×
设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4-) +c(C2O42-)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·
L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关
系一定正确的是
L-1 H2C2O4溶液:c(H+ ) =0.1000 mol·
L-1+c(C2O42- )+c(OH-)-c(H2C2O4 )
A. 0.1000 mol·
B. c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42- ) >c(H+ )
L-1+ c(C2O42-) -c(H2C2O4)
C. pH = 7的溶液:c(Na+ ) =0.1000 mol·
D. c(Na+ ) =2c(总)的溶液:c(OH-) -c(H+) = 2c(H2C2O4) +c(HC2O4-)
【答案】AD
【解析】A.H2C2O4溶液中的电荷守恒为c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),0.1000 mol·L-1H2C2O4溶液中0.1000mol/L=c(H2C2O4)+ c(HC2O4-)+ c(C2O42-),整理两式得:c(H+)=0.1000mol/L-c(H2C2O4)+c(C2O42-)+c(OH-),A正确; B.c(Na+)=c(总)时溶液中溶质为NaHC2O4,HC2O4—既存在电离平衡又存在水解平衡,HC2O4—水解的离子方
程式为HC2O4—+H2O H2C2O4+OH—,HC2O4—水解常数(K h)与H2C2O4电离常数(K a)有如下关系:
10-2)=10-12/5.4<5.4×10-5,所以,HC2O4-的电离程K h×K a = K w,则K h= K w / K a =10-14/(5.4×
度大于水解程度,则c(C2O42-)c(H2C2O4),B错误;C项,滴入NaOH溶液后,溶液中的电荷守恒为c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),室温pH=7即c(H+)=c(OH-),则c(Na+)=c(HC2O4-)+2c(C2O42-)=c(总)+c(C2O42-)-c(H2C2O4),由于溶液体积变大,c(总)0.1000mol/L,C错误;D项,c(Na+)=2c(总)时
溶液中溶质为Na2C2O4,溶液中的电荷守恒为c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)
