盐酸左氧氟沙星氯化钠注射液生产过程质量控制
氧氟沙星注射液生产工艺规程

制药有限公司氧氟沙星注射液生产工艺规程颁发单位:GMP办公室工艺规程批准程目录1. 剂型、规格 (3)2. 生产工艺流程 (3)3. 操作过程及工艺条件 (4)4.质量控制要点 (7)5.设备一览表、主要设备生产能力 (7)6.工艺过程中的SOP (8)7.中间产品的控制 (9)8.验证工作要点 (9)9.工艺验证的具体要求 (10)10.工艺卫生和环境卫生 (10)11.劳动组织及岗位定员 (10)一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。
10ml:0.2g二、流程图:氧氟沙星注射液生产工艺流程图三、操作过程及工艺条件1 生产前的检查与确认1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3 所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。
1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在30%-65%)。
2 洗瓶、干燥灭菌2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。
在理瓶室将安瓶的合格品摆满瓶盘。
2.2粗洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯化水洗安瓿瓶内外壁。
将安瓿瓶盘对称放置,固定在甩水机上,启动甩水机,甩水处理8分钟,至安瓶甩干。
重复上述操作。
2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的注射用水清洗安瓿瓶内外壁,重复粗洗步骤。
定时检查安瓿的清洁度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。
2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,消除热原。
2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。
氧氟沙星氯化钠注射液配制工艺的研究

氧氟沙星氯化钠注射液配制工艺的研究作者:许茹画来源:《科学与财富》2019年第02期摘要:目的:通过全方位的对比试验,优化氧氟沙星氯化钠注射液(100mL:0.2g+0.9g)的配置生产工艺。
方法:通过对注射液配置过程中的注射用水温度、pH值,加料顺序等项目的考察,同时对不同工艺所产成品的相关物质与该批氧氟沙星原料的有关物质进行比较,找出工艺稳定,适宜工业化大生产的制剂工艺。
结果:氧氟沙星在酸性环境下溶解迅速,成品有关物质稳定,质量可靠。
结论:加酸工艺可以解决氧氟沙星氯化钠注射液(100mL:0.2g+0.9g)成品有关物质偏高,不稳定的现象,工艺简单,能耗降低,适宜于工业化大生产。
关键词:氧氟沙星;氧氟沙星氯化钠注射液;盐酸氧氟沙星氯化钠注射液在临床输液当中应用是非常广泛的,但是现在我国对于该药品的制备并没有一个统一的标准,其原因在于国家药典当中的标准也在不断发生变化,这也导致了当前氧氟沙星氯化钠注射液的质量无法得到保证的问题。
在最新的国家药典当中,氧氟沙星氯化钠注射液的ph值范围进一步放宽,为3.5-7.5之间,同时有关物质的成分标准也得到了提高,。
但是在水中,氧氟沙星是一种难溶的物质,但是在酸性环境下则易溶,在本次研究当中,针对水温、ph值和加酸顺序进行对比,以此来保证溶液质量、节约成本,生成稳定的配制工艺。
1 实验环节1.1 不加酸配制工艺简介取有刻度的烧杯,其中加入注射用水1L,然后将其加入设定温度的恒温水浴锅当中,保证温度达到相同状态后,结合配制处方加入氯化钠溶液,并进行搅拌,在其溶解后就可以加入氧氟沙星,搅拌至完全溶解,之后补充注射用水1L,之后将半成品取样进行检验,其余半成品要经过过滤后加入输液瓶,在115摄氏度环境下进行0.5h的灭菌,之后冷却。
1.2 加酸的配制工艺取有刻度的烧杯,其中加入注射用水1L,然后将其加入设定温度的恒温水浴锅当中,保证温度达到相同状态后,结合配制处方加入氯化钠溶液,并进行搅拌,加入稀盐酸到适当的酸度,之后加入氧氟沙星,搅拌至完全溶解,之后补充注射用水1L,之后将半成品取样进行检验,其余半成品要经过过滤后加入输液瓶,在115摄氏度环境下进行0.5h的灭菌,之后冷却。
氯化钠注射液生产过程质量控制要点推荐word范文
每箱
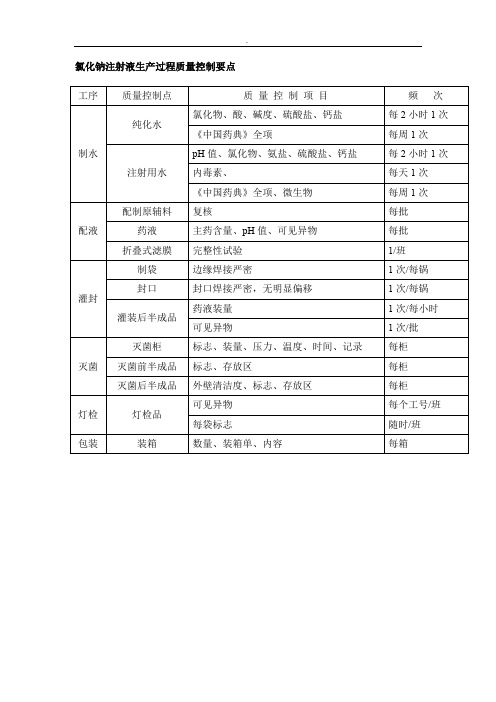
氯化钠注射液生产过程质量控制要点
工序
质量控制点
质量控制项目
频次
制水
纯化水
氯化物、酸、碱度、硫酸盐、钙盐
每2小时1次
《中国药典》全项
每周1次
注射用水
pH值、氯化物、氨盐、硫1次
《中国药典》全项、微生物
每周1次
配液
配制原辅料
复核
每批
药液
主药含量、pH值、可见异物
每批
折叠式滤膜
完整性试验
1/班
灌封
制袋
边缘焊接严密
1次/每锅
封口
封口焊接严密,无明显偏移
1次/每锅
灌装后半成品
药液装量
1次/每小时
可见异物
1次/批
灭菌
灭菌柜
标志、装量、压力、温度、时间、记录
每柜
灭菌前半成品
标志、存放区
每柜
灭菌后半成品
外壁清洁度、标志、存放区
每柜
灯检
灯检品
可见异物
每个工号/班
每袋标志
随时/班
包装
装箱
氯化钠注射液成品质量标准
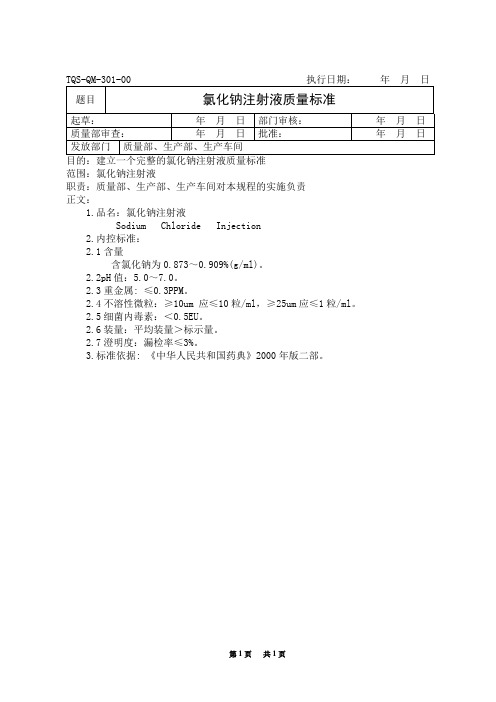
3.标准依据: 《中华人民共和国药典》2000年版二部。
Sodium ChlorideInjection
2.内控标准:
2.1含量
含氯化钠为0.873~0.909%(g/ml)。
2.2pH值:5.0~7.0。
2.3重金属:≤0.3PPM。
2.4不溶性微粒:≥10um应≤10粒/ml,≥25um应≤1粒/ml。
2.5细菌内毒素:<0.5EU。
2.6装量:平均装量>标示量。
TQS-QM-301-00执行日期: 年 月 日
题目
氯化钠注射液质量标准
起草:
年 月 日
部门审核:
Байду номын сангаас年 月 日
质量部审查:
年 月 日
批准:
年 月 日
发放部门
质量部、生产部、生产车间
目的:建立一个完整的氯化钠注射液质量标准
范围:氯化钠注射液
职责:质量部、生产部、生产车间对本规程的实施负责
正文:
1.品名:氯化钠注射液
左氧氟沙星质量标准

左氧氟沙星质量标准左氧氟沙星是一种广谱抗生素,常用于治疗呼吸道、泌尿道、肠道和皮肤软组织感染。
作为一种重要的药物,左氧氟沙星的质量标准显得尤为重要。
质量标准是评价药物质量优劣的重要标准,合理的质量标准可以保证药物的疗效和安全性,因此,左氧氟沙星的质量标准应受到重视。
首先,左氧氟沙星的理化性质是确定其质量标准的重要依据。
理化性质包括外观、溶解性、熔点、纯度等指标,这些指标直接关系到药物的质量。
例如,左氧氟沙星的外观应为白色或类白色结晶性粉末,溶于水,几乎不溶于乙醇。
此外,左氧氟沙星的熔点、纯度也是质量标准的重要指标。
只有合格的理化性质,才能保证药物的质量。
其次,左氧氟沙星的药效和安全性是质量标准的核心内容。
药效和安全性是药物的基本属性,直接关系到患者的治疗效果和用药安全。
因此,左氧氟沙星的质量标准应包括对药效和安全性的要求。
药效方面,左氧氟沙星应具有较强的抗菌活性,对感染病原体有较好的杀菌作用。
安全性方面,左氧氟沙星应具有较低的毒副作用,对人体的损害较小。
只有具备良好的药效和安全性,才能保证左氧氟沙星的质量标准。
最后,左氧氟沙星的生产工艺和质量控制是保证质量标准的重要保障。
生产工艺直接关系到药物的质量,合理的生产工艺可以保证药物的稳定性和纯度。
质量控制是对生产过程中各个环节的监控,包括原料药的采购、生产工艺的控制、成品药的检验等。
只有严格执行生产工艺和质量控制要求,才能保证左氧氟沙星的质量标准。
综上所述,左氧氟沙星的质量标准是一个综合性的评价体系,包括理化性质、药效和安全性、生产工艺和质量控制等多个方面。
只有全面考虑,合理确定质量标准,才能保证左氧氟沙星的质量,为患者的治疗提供有效的保障。
希望生产企业和监管部门能够加强对左氧氟沙星质量标准的管理,共同维护药物市场的良好秩序,保障患者的用药安全和疗效。
浅析药用氯化钠生产过程中的质量控制

2017年04月浅析药用氯化钠生产过程中的质量控制王东强(天津长芦海晶集团有限公司,天津300457)摘要:为了提高药用氯化钠的纯度,保证其质量,提出一种药用氯化钠生产过程的质量控制方法。
首先详细分析了药用氯化钠的各个生产过程,然后对易出现的质量问题进行了分析,并提出了针对性的解决方案,从而保证了药用氯化钠的质量。
关键词:药用氯化钠;生产过程;质量控制;氯化钠是人体各项生理活动中不可缺少的一种化合物,相关研究表明,钠离子在成年人体内中的总量约为60克[1],其中80%左右分布在细胞外液中,氯离子在细胞外液中也有着广泛的分布[2]。
氯化钠的生理功能主要包括:(1)使细胞外液的渗透压保持合理的状态;(2)对人体内的酸碱平衡进行调节;(3)参与生成消化液;因此,在医学应用中,高纯度的氯化钠溶液更多的被当作人体的电解质补充液,补充人体中失去的水分和电解质[3]。
此外,氯化钠溶液还可以与其它药剂一起配制氯化钠注射液使用,产生不同的功效。
因此,如何提高药用氯化钠的纯度已经成为药用氯化钠生产过程中的一个核心课题,受到了越来越多人们的重视。
1药用氯化钠的生产过程原盐是药用氯化钠的主要生产原料。
原盐是由盐田晒制的海盐或者湖盐,其主要成分为氯化钠。
原盐在结晶的过程中会不可避免的夹杂着大量的泥沙和可溶性的钙盐、镁盐等杂质。
为了消除这些杂质,获得高纯度的药用氯化钠,需要对原盐的杂质进行过滤去除。
由于氯化钠的溶解度不会随着温度的变化而发生较大改变,因此,不能通过重结晶的方法获取高纯度的氯化钠,需要首先对原盐进行溶解,将不溶于水的杂质进行沉淀去除,然后再利用化学方法消除其它可溶性的钙盐、镁盐等杂质。
具体的生产过程如下所述:(1)Na 2SO 4的清除:在原盐溶液中加入BaCl 2溶液,它能够将溶液中的SO 42-转变为易沉淀的BaSO 4沉淀物,Na +转变为NaCl 。
相关化学反应式为:BaCl 2+Na 2SO 4=BaSO 4↓+2NaCl 。
如何有效进行药用氯化钠生产过程中的质量控制
如何有效进行药用氯化钠生产过程中的质量控制摘要:本文针对药用氯化钠的生产过程进行剖析,包括清除SO42-、清除Ca2+、清除Mg2+、其他杂质去除等,通过研究去杂质阶段的控制、过滤阶段的控制、生产过程水的控制、生产过程的空气控制等质量控制措施,目的在于提升人们对药用氯化钠生产过程的控制,提升药用氯化钠的生产质量。
关键词:药用氯化钠;生产过程;质量控制氯化钠是维持人体各项机能正常运转的重要物质,通常情况下,成年人体内钠离子的总量在60g左右,并且大部分钠离子都是在细胞外液当中,是调节细胞内外渗透压的重要物质。
氯离子也是维持人体机能的重要物质,和钠离子类似,也是广泛分布于细胞外液当中。
药用氯化钠溶液可以起到调节人体电解质平衡的作用,使人体钠离子和氯离子含量始终保持在合理范围内。
1药用氯化钠的生产过程药用氯化钠的生产过程其实就是一个去除杂质的过程,这是因为药用氯化钠的生产原料主要是原盐,原盐在最初结晶的过程中,会携带许多类型的杂质,包括泥沙、各类结晶物等。
这种原盐溶液是无法作为药用氯化钠的,因此在药用氯化钠生产的过程中,需要对这些杂质进行除杂,具体除杂过程可以分为以下几方面内容。
1.1清除SO42-SO42-是原盐溶液中非常常见的杂质类型,这是因为在原盐结晶时,周围环境比较复杂,所以会形成中性盐Na2SO4,其中的SO42-进入人体后会影响细胞的内外渗透压情况,尤其是过量SO42-进入人体后,会造成严重的影响,因此在生产药用氯化钠的时候需要将SO42-清除掉,通常可以在原盐溶液中通入BaCl2溶液,Na2SO4会和BaCl2反应生成BaSO4,BaSO4属于白色沉淀物质,并且另外一种生成物为NaCl,没有生成新的杂质,所以该方法得到了非常充分的应用[1]。
1.2清除Ca2+在原盐溶液当中Ca2+的含量也是非常多的,Ca2+进入人体之后,很容易与人体内的其他离子反应生成沉淀物质,尤其是药用氯化钠通常会直接注入人体静脉,这样很有可能会威胁到人体健康。
氧氟沙星注射液的制备及质量控制
实测浓度 ( B D C8) ! " ( //4 J # ( #4/ ) ( #"4 J # ( ’"0 4 ( #’) J # ( ’"#
在 #、 " ( 0 ( " 留样观察 本品经 ’’!F 热压灭菌 "#C=> 后, "#、 各取 ! 瓶按上述方法测定浓度 G ( B D C8) , 灭菌前 )#、 /#、 ’#! 天, 结果见表 &。 浓度 G . # ( &##0* ; 表& 序号 ’ & " 0 留样浓度观察结果 (时间: 天) # # ( &##/ # ( &##) # ( &##4 # ( &##! "# # ( &##4 # ( &#’’ # ( &##) # ( &##0 # ( &#’& # ( &##4 )# # ( &#’" # ( &#’# # ( &#’& # ( &#’0 # ( &##5 # ( &#’’ /# # ( &##/ # ( &#’’ # ( &#’! # ( &##4 # ( &#’" # ( &#’’ ’#! # ( &##4 # ( &#’0 # ( &#’& # ( &#’’ # ( &#’! # ( &#’&
参考文献(1条) 1.国家药典委员会 中国药典(二部) 2000
本文链接:/Periodical_yjmzyxyxb200106090.aspx
氧氟沙星注射液的制备及质量控制
氧氟沙星注射液质量标准
氧氟沙星注射液质量标准氧氟沙星注射液是一种广泛应用于临床的抗菌药物,具有广谱、强效、耐受性好等特点。
为了确保氧氟沙星注射液的质量安全,保障患者用药的有效性和安全性,制定了相应的质量标准。
一、外观和性状。
氧氟沙星注射液应为无色或微黄色透明液体,无异物悬浮物和沉淀物,有特有的氟味。
在光线下应无色淡黄色沉淀。
二、主要成分。
氧氟沙星注射液的主要成分是氧氟沙星,其化学名称为(6S)-6-氟-1-[(2S)-2-环丙基]-7-(3-氨基-1-环丙基)-1,4-二氢喹啉-4-酮。
每支注射液含有氧氟沙星200mg。
三、规格。
氧氟沙星注射液的规格为每支2ml,每盒10支。
四、质量控制。
1. 氧氟沙星注射液的生产应符合《药品生产质量管理规范》中有关注射剂的相关要求。
2. 原料药应符合国家药典规定的质量标准,严格把关原料药的采购和质量控制。
3. 生产过程中应严格按照标准操作规程进行,确保生产过程的严谨和规范。
4. 对成品进行严格的质量检验,确保每批产品符合国家药典规定的质量标准。
五、贮存。
氧氟沙星注射液应存放在阴凉干燥处,避免阳光直射。
贮存期内,应避免冻结和高温,保持温度在15-25摄氏度之间。
六、包装。
氧氟沙星注射液应采用无菌玻璃制品包装,每支注射液应独立包装,包装完好,无破损。
七、使用。
使用氧氟沙星注射液前应先检查包装是否完好,观察外观和性状是否符合要求。
使用时应严格按照医嘱用药,避免过量使用或长期使用。
八、注意事项。
1. 使用氧氟沙星注射液时,应注意过敏史和禁忌症,避免不必要的风险。
2. 使用过程中如出现不良反应,应及时就医并停止使用氧氟沙星注射液。
总结,氧氟沙星注射液作为一种重要的抗菌药物,在临床应用中具有重要意义。
为了确保其质量安全和有效性,制定了相应的质量标准,包括外观和性状、主要成分、规格、质量控制、贮存、包装、使用和注意事项等方面。
只有严格按照这些标准要求进行生产、贮存和使用,才能保证患者用药的安全有效。
盐酸左氧氟沙星氯化钠注射液生产过程质量控制
制参数研 究。结果
选择杂质低的原料 , 在原料 、 制剂生产过程 及 临床使 用过程 中采取避 光措施 , 中间产品 p 将 H控 制 对生产过程 中的工 艺条件加 以控制 , 可有效提 高 盐酸 左氧 氟沙星氯化 钠 注射 液 的质
在 4 1~ . . 4 5范围内为 宜。结论
量 , 少 其 临 床 不 良反 应 的 发 生 。 减
Ke od :eooai hdoho d ; de erat n ; ulyC nr yw r sL vf xc yrclr e A v ̄ eco sQ at ot l l n i i i o
盐酸左氧氟沙星为氟喹诺 酮类药物 , 有选择性抑 制细 具 菌螺旋 酶( N yae 的作用 , 有抗 菌谱 广 、 D A grs ) 具 抗菌 作用 强 的特 点 , 目前广泛应用于临床 。但其制剂 产品临床应 用不 良 反应较 多 , 且其不 良反应多与其杂质含 量及种类相关 。据 文 献报道…杂 质的来源 主要分 为 2个 途径 , 是工艺 杂质 , 一 即
A src: jc v T e r n eot u rcs aa tr f eooai H doh r eadSdu ho d - b t t0bet e od tmiet pi m poes r e vf xc yrcl i n oim C l eI a i e h m p me o L l n od i r n
t lo h rc s i g c n i o a d i l ia d e s e ci n c n b e u e . r f e p o e s o d t n- n sc i c a v re ra t a e r d c d o t n i t n l o
关键词 : 盐酸左氧氟沙星 ; 良反应 ; 不 质量控 制 中图分类号 :1 7 1 文献标识码 : 文章编号 :6 2— 7 8 2 1 0 0 5 0 12 . : 9 A 1 7 7 3 o a i d o ho iea d S du C lr eIjcini r d cinp o es u lyc nrl v f x cnHy rc l d n o im ho i et p o u t rc s t oL l r d n o n o
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pH 6. 0 0. 008 0. 019 0. 019 未检出 0. 010 0. 022 0. 022 未检出
2. 4 不同厂家原料质量对比情况 不同厂家的原料因生产 工艺存在一定差异,故其杂质种类及数量也不尽相同。选用 不同厂家的原料进行对比检验。综合比较,③的杂质 A 最 小; ①、③杂质 B 最小; ①、②的杂质 E 最小; 其他厂家原料杂 质 B 及 E 峰面积均较大; ③及⑤的原料药右旋异构体含量同 比其他厂家偏高,检验结果见表 4。
0. 014 0. 014 0. 014
0. 008 0. 007 0. 009
0. 007 0. 007 0. 007
未检出 未检出 未检出
0. 24
0. 24
0. 24
2. 3 不同 pH 值对产品有关物质影响的试验 按照处方配 制盐酸左氧氟沙星氯化钠注射液 5 L,原液灌装 5 瓶; 剩余药
液用 NaOH 分别调节 pH 至 4. 5、5. 0、5. 5、6. 0 左右,各灌装 5 瓶,压盖。每个条件留 2 瓶,剩余 3 瓶做好标记随同产品灭 菌。灭菌前、后产品一起检验有关物质及右旋异构体。由检 测结果可见,pH 值不同,杂质含量不同。产品灭菌前后,随 着 pH 值的升高,杂质 B 及杂质 E 均有所升高,尤其是 pH 在 5. 0 以上时,杂质 B 明显升高; 灭菌后比灭菌前杂质略有升 高; 在 pH 为 4. 1 ~ 4. 5 之间,灭菌前后各杂质均无明显变化。 本次试验中,均未检出 N - 氧化杂质,结果见表 3。
右旋异构体 ( %) 0. 24 0. 16 0. 30 0. 21 0. 38
3 讨论与小结
不同的工艺控制手段一定程度上决定着盐酸左氧氟沙
星注射剂的有关物质及异构体的量,从而对不良反应存在显
著影响。
3. 1 控制制剂质量必须先控制原料质量。制剂厂家在选择
原料时应注意比较其杂质,特别是要选用与不良反应有关的
2. 2 药液存放时间试验 分别取正常灌装的产品以及盛放 在不锈钢容器中密封药液,各存放 8、10、12、14 h 后,对比检 验有关物质及光学异构体的区别。结果可知,药液与不锈钢 容器的接触时间长短对杂质 A、B 及 E、右旋异构体均无明显 影响,N - 氧化杂质均未检出,具体实验数据见表 2。
表 2 药液存放时间试验各杂质一览表
条件下时,这个降解产物会有明显的增加。杂质 B 及 N - 氧 化杂质存在光毒性,与盐酸左氧氟沙星的不良反应有一定关 系[2],杂质 A 及 E 与盐酸左氧氟沙星不良反应的相关性未 查找到相关文献。
为降低盐酸左氧氟沙星氯化钠注射液的不良反应,针对 盐酸左氧氟沙星引起不良反应的可能因素,以杂质 B 及 N - 氧化杂质等有关物质及光学异构体为指标,设计系列试验, 进行相关研究分析。
表 1 光照试验各杂质一览表
有关物质 杂质 A( % ) 杂质 B( % ) 杂质 E( % ) N - 氧化杂质 右旋异构体( % )
0d 0. 017 0. 007 0. 011 未检出 0. 25
光照 5 d 0. 014 0. 109 0. 120 未检出 0. 25
光照 10 d 0. 018 0. 200 0. 220 未检出 0. 25
表 4 不同厂家原料各杂质峰面积一览表
生产厂家 ①
杂质 A ( %) 0. 040
② 0. 030
③ 未检出
④ 0. 010
⑤ 0. 026
杂质 B ( %) 未检出 0. 008 未检出 0. 010 0. 007
杂质 E N - 氧化杂质
( %) 0. 006 未检出 0. 006 未检出 0. 050 未检出 0. 039 未检出 0. 035 未检出
·452·
齐鲁药事·Qilu Pharmaceutical Affairs 2012 Vol. 31,No. 8
盐酸左氧氟沙星氯化钠注射液生产过程质量控制
倪华丽1,2 ,董 旭2 ,黄桂华1
( 1. 山东大学药学院,山东 济南 255012; 2. 山东齐都药业有限公司,山东 淄博 255400)
摘要: 目的 确定盐酸左氧氟沙星氯化钠注射液最佳生产过程参数,减少临床不良反应的发生。方法 通过光照试 验、药液存放时间试验、药液 pH 值试验、不同厂家原料对比进行盐酸左氧氟沙星氯化钠注射液的最佳生产过程质量控 制参数研究。结果 选择杂质低的原料,在原料、制剂生产过程及临床使用过程中采取避光措施,将中间产品 pH 控制 在 4. 1 ~ 4. 5 范围内为宜。结论 对生产过程中的工艺条件加以控制,可有效提高盐酸左氧氟沙星氯化钠注射液的质 量,减少其临床不良反应的发生。
有关物质 正常灌装 杂质 A( % ) 0. 039 杂质 B( % ) 0. 007 杂质 E( % ) 0. 007 N - 氧化杂质 未检出 右旋异构体( % ) 0. 24
存放 8 h 0. 040 0. 006 0. 007 未检出 0. 24
存放 10 h 存放 12 h 存放 14 h
Key words: Levofloxacin hydrochloride; Adverse reactions; Quality Control
盐酸左氧氟沙星为氟喹诺酮类药物,具有选择性抑制细 菌螺旋酶( DNA gyrase) 的作用,具有抗菌谱广、抗菌作用强 的特点,目前广泛应用于临床。但其制剂产品临床应用不良 反应较多,且其不良反应多与其杂质含量及种类相关。据文 献报道[1]杂质的来源主要分为 2 个途径,一是工艺杂质,即 生产中可能带入的起始原料、试剂、中间体、副产物和异构体 等; 二是降解产物,即药品在贮藏、运输、使用过程中由于自 身性质不稳定而产生的各种杂质。
N - 氧化杂质 未检出 未检出 未检出 未检出
杂质 A( % ) 0. 008 0. 009 0. 008 0. 009
杂质 B( % ) 灭菌后
杂质 E( % )
0. 004 0. 016
0. 004 0. 009 0. 009 0. 021 0. 018 0. 016
N - 氧化杂质 未检出 未检出 未检出 未检出
表 3 不同 pH 值对比试验各杂质一览表
有关物质 pH 4. 1( 原液) pH 4. 5 pH 5. 0 pH 5. 5
杂质 A( % ) 0. 008 0. 009 0. 008 0. 008
杂质 B( % ) 灭菌前
杂质 E( % )
0. 004 0. 016
ቤተ መጻሕፍቲ ባይዱ
0. 004 0. 005 0. 008 0. 016 0. 016 0. 017
关键词: 盐酸左氧氟沙星; 不良反应; 质量控制 中图分类号: R927. 1 文献标识码: A 文章编号: 1672 - 7738( 2012) 08 - 0452 - 03
Quality control of Levofloxacin Hydrochloride and Sodium Chloride Injection in production process NI Hua-li1,2 ,DONG Xu2 ,HUANG Gui-hua1
选取不同厂家的盐酸左氧氟沙星原料药进行对比研究,
齐鲁药事·Qilu Pharmaceutical Affairs 2012 Vol. 31,No. 8
·453·
确定不同原料生产工艺对产品杂质的影响; 同时选取不同工 艺条件进行对比研究,确定不同的制剂生产工艺对产品杂质 的影响因素。 1 仪器与试剂 1. 1 仪 器 Agilent1200 高 效 液 相 色 谱 仪 ( 美 国 安 捷 伦 公 司) 。 1. 2 试剂 盐酸左氧氟沙星对照品( 中国药品生物制品检 定所) ,盐酸左氧氟沙星杂质 A、杂质 B、杂质 E 及 N - 氧化杂 质 ( 上虞京新药业有限公司) ,盐酸左氧氟沙星( 上虞京新药 业有限公司、浙江普洛康裕制药有限公司、浙江司太立制药 有限公司、河南天方药业股份有限公司、江西大地制药有限 责任公司) ,盐酸左氧氟沙星氯化钠注射液( 山东齐都药业有 限公司) ,盐酸( 莱阳市康德化工有限公司) ,三乙胺( 天津市 广成化学试剂有限公司) ,乙腈( 天津市科密欧化学试剂有限 公司) ,甲醇( 天津市科密欧化学试剂有限公司) 。( 说明: 下文 中分别用①、②、③、④、⑤代替各盐酸左氧氟沙星原料药生产 厂家名称,代号排列顺序与中文厂家排列顺序无对应关系) 。 2 方法与结果 2. 1 光照试验 取盐酸左氧氟沙星氯化钠注射液置光照度 为 2 500 ~ 3 000 Lx 光照箱中放置 10 d,分别于第 5 天及第 10 天取出数瓶,连同避光保存样品一起对比检验有关物质及光 学异构体。结果杂质 B 及 E 受光照的影响较大,杂质 B 在光 照 5 d 及 10 d 的峰面积分别为 0 天的 16 倍及 29. 4 倍,杂质 E 在光照 5 d 及 10 d 的面积百分比分别为 0 d 的 10. 9 倍及 20. 0 倍。光照对杂质 A 及光学异构体几乎无影响。本试验 中均未检出 N - 氧化杂质,考察结果见表 1。
( 1. School of Pharmaceutical Sciences,Shandong University,Jinan 250012,China; 2. Shandong Qidu Pharmaceutical Co. ,Ltd. ,Zibo 255400,China)
Abstract: Objective To determine the optimum process parameter of Levofloxacin Hydrochloride and Sodium Chloride Injection for reduction of clinical adverse reaction. Methods The optimum process parameter was investigated through light test, test of liquid storage time and different pH and comparison of raw materials from different manufactures. Results It was appropriate to select materials low in impurity,take measures to avoid light and control the pH of intermediate product to 4. 1 ~ 4. 5. Conclusion The quality of Levofloxacin Hydrochloride and Sodium Chloride Injection can be effectively improved through control of the processing condition,and its clinical adverse reaction can be reduced.
