共聚焦显微镜结构
激光扫描共聚焦显微镜

1、 选择好适宜的荧光探针。 原则上讲,无论是荧光素还是荧光标记抗体均 可用于LSCM 。如果打算用2种以上荧光标记物,要 注意它们是否激发光波长及发射光波长能区别开, 还要注意是否与LSCM的激发器相匹配,要根据现有 的激发波长来选择荧光标记物。
• 不同的荧光探针在不同标本的效果常有差异,故除综合 考虑以上因素以外,有条件者应进行染料的筛选,以找 出最适的荧光探针。
6.观察活细胞、活组织:LSCM在不损伤
细胞的前提下,对活组织、活细胞进行观 察和测量,这不仅省去了繁琐的样品前期 处理过程(如脱水、脱蜡、染色等);而且观 察过的样品还可以继续用于其他的研究。 这种功能对于细胞培养、转基因研究尤为 重要。这可以说是LSCM最大的优势。
7. 生化成分精确定位观察配合专用的分子探 针,对于要检测的成分不仅可以定位到细 胞水平,还可以定位到亚细胞水平和分子 水平。
2015/6/12
激光扫描共聚焦显微镜:以激光作为激发光源,采用 光源针孔与检测针孔共轭聚焦技术,对样本进行断层扫 描,以获得高分辨率光学切片的荧光显微镜系统.
形态学研究:组织细胞 标本的抗原免疫荧光检 测,凋亡检测…
目的结构是用荧光探针标记的, 都可以用激光共聚焦显微镜观察
分子生物学:荧光原位杂交对DNA 和RNA定量,外源基因在真核细胞 的表达及定位,蛋白质相互作用 (FRET)…
4. 采 用点扫描技术将样品分成无数个点,用十分细小的激光 束逐点逐行扫描成像,再通过电脑组合成一个整体。传统的 光镜在场光源下一次成像,标本上每一点都会受到相邻点的 衍射光和散射光的干扰。这两种图像的清晰度和精密度是无 法相比的。
5.光电倍增管:检测设定范围内的光信号,并将光信号转换成 电 信号,相当于相机中的CCD或胶卷。 PMT只能检测到信号的强弱,不能记录信号的颜色,记录 的 结果通过信号强度和填充颜色表示。PMT单位用电压值V 表示,数值越大代表信号倍增越大,提高倍增会同时增加图 像的正常信号强度和噪声信号强度,使图像的信噪比下降。
共聚焦显微镜简介及免疫荧光染色

临床医学研究中心
德国Leica激光扫描共聚焦显微镜SP5 II简介
基本参数
型号:德国Leica SP5 II 激光器:4个 发射波长400nm-800nm 物镜:10倍 20倍 63倍 通道:多通道 多色
系统:windows 7+LAS AF 活体细胞装置:配有
二、间接免疫荧光染色(FITC标记)
(4)滴加二抗 次日用PBS(5min×3)冲洗后,滴加用 PBS稀释的FITC标记的羊抗兔/鼠二抗, 37℃孵育60 min(避光)。 (5)染核并封片 用PBS(5min×3)冲洗后,滴加DAPI染 核5min, PBS冲洗(5min×3),滴加抗荧 光淬灭封片液。 (6)激光共聚焦显微镜拍照
日常保养及注意事项
短时间的停顿工作时,无需关闭系统。 只是做一些分析图片等工作时,无需打开激光器控 制钥匙,以减少激光器的损耗。 请避免使用外界存储设备(U盘,移动硬盘等), 以免电脑受病毒感染。 请不要安装包含杀毒软件在内的任何未经软件生产 商授权和经Leica工程师认可的软件。
(1)将A549细胞细胞培养于35 mm 激光共聚焦 培养皿中间的圆形凹槽里; (2)染色前吸除培养皿的培养液,用PBS洗2-3 次; (3)向培养皿中轻轻滴入Lyso-Tracker Red或 Fluo-4/AM工作液200μL,使其覆盖凹槽里 全部细胞; (4)37 ℃、5%CO2 培养箱中孵育30 min; (5)吸除染液,用PBS洗2-3次; (6)再用800μL的PBS覆盖凹槽里全部细胞, 用激光扫描共聚焦显微镜观察Ca2+的变 化。
Leica网上课程������ ������ ������ ������ ������
������
激光扫描共聚焦显微镜技术

多通道同时检测,可实时检测细胞的 生理活动和形态变化:
• 生理学研究:如细胞内各种离子浓度随时 间的变化情况.
• 活细胞多种标记物同时进行成像,动态观 察不同形态学事件的发生。如分泌颗粒的 分泌过程。Leabharlann 三、激光扫描共聚焦显微镜的应用
vestigial apterous CiD (cyanine 5).
透明质酸
• The role of hyaluronan in renal stone disease
• Hyaluronan is expressed by proliferating renal tubular cells in subconfluent cultures (2 days post-seeding). At cell-cell contact (4 days post-seeding) this staining starts to fade away to completely disappear when the tight junctions are assembled (5-6 days post-seeding). The hyaluronan receptor CD44 is also expressed at the luminal surface in subconfluent cultures (2 days post-seeding), at cell-cell contact CD44 is targeted to lateral spaces, whereas at confluence (6 days post-seeding), CD44 is exclusively expressed at basal domains of the plasma membrane.
激光扫描共聚焦荧光显微镜的成像原理和基本结构 显微镜操作规程

激光扫描共聚焦荧光显微镜的成像原理和基本结构显微镜操作规程(激光扫描共聚焦荧光显微镜)是一种利用计算机、激光和图像处理技术获得生物样品三维数据、先进的分子细胞生物学的分析仪器。
紧要用于察看活细胞结构及特定分子、离子的生物学变化,定量分析,以及实时定量测定等。
成像原理接受点光源照射标本,在焦平面上形成一个轮廓分明的小的光点,该点被照射后发出的荧光被物镜收集,并沿原照射光路回送到由双向色镜构成的分光器。
分光器将荧光直接送到探测器。
光源和探测器前方都各有一个针孔,分别称为照明针孔和探测针孔。
两者的几何尺寸一致,约100—200nm;相对于焦平面上的光点,两者是共轭的,即光点通过一系列的透镜,终可同时聚焦于照明针孔和探测针孔。
这样,来自焦平面的光,可以会聚在探测孔范围之内,而来自焦平面上方或下方的散射光都被挡在探测孔之外而不能成像。
以激光逐点扫描样品,探测针孔后的光电倍增管也逐点获得对应光点的共聚焦图像,转为数字信号传输至计算机,终在屏幕上聚合成清楚的整个焦平面的共聚焦图像。
每一幅焦平面图像实际上是标本的光学横切面,这个光学横切面总是有确定厚度的,又称为光学薄片。
由于焦点处的光强宏大于非焦点处的光强,而且非焦平面光被针孔滤去,因此共聚焦系统的景深貌似为零,沿Z轴方向的扫描可以实现光学断层扫描,形成待察看样品聚焦光斑处二维的光学切片。
把X—Y平面(焦平面)扫描与Z轴(光轴)扫描相结合,通过累加连续层次的二维图像,经过专门的计算机软件处理,可以获得样品的三维图像。
即检测针孔和光源针孔始终聚焦于同一点,使聚焦平面以外被激发的荧光不能进入检测针孔。
激光共聚焦的工作原理简单表达就是它接受激光为光源,在传统荧光显微镜成像的基础上,附加了激光扫描装置和共轭聚焦装置,通过计算机掌控来进行数字化图像采集和处理的系统。
基本结构(激光扫描共聚焦显微镜系统)紧要包括扫描模块、激光光源、荧光显微镜、数字信号处理器、计算机以及图像输出设备等。
共聚焦看细胞线粒体

共聚焦看细胞线粒体共聚焦显微镜(Co-localization microscopy)是一种高分辨率显微镜技术,可以用来研究细胞内不同分子的空间分布和相互关系。
在细胞内,线粒体是一个重要的细胞器,参与细胞的能量代谢和调节细胞死亡等关键功能。
因此,通过共聚焦显微镜观察细胞线粒体可以深入了解细胞的生理状态和功能。
线粒体是细胞内的一个重要细胞器,其主要功能是通过氧化磷酸化反应产生细胞所需的能量分子ATP。
线粒体含有自己的基因组,具有一定的自主复制和分裂能力。
在正常的细胞中,线粒体呈现为一个独立的、连续的网状结构,被广泛分布在细胞的质膜下。
然而,在一些疾病或生理状态下,线粒体的形态和功能可能发生变化。
通过共聚焦显微镜观察细胞线粒体可以获得高分辨率的图像,揭示线粒体的形态和分布。
共聚焦显微镜利用激光光源和特殊的探测器,可以在不同深度上获取细胞内的荧光信号。
通过标记线粒体的特定成分,如线粒体膜蛋白或线粒体DNA,可以将线粒体从其他细胞器中区分出来。
同时,通过共聚焦显微镜观察线粒体与其他分子的共聚焦信号,可以研究线粒体与其他细胞器或分子的相互作用。
线粒体与细胞的其他细胞器和分子之间存在密切的相互关系。
例如,线粒体与内质网相互紧密联系,共同参与细胞内蛋白质的合成和折叠。
通过共聚焦显微镜观察线粒体与内质网的共聚焦信号,可以了解它们之间的相互作用和调控机制。
另外,线粒体还与细胞核之间存在着协同调节的关系。
通过观察线粒体与细胞核的共聚焦信号,可以研究细胞核与线粒体之间的信号传递和调控网络。
线粒体的功能异常与多种疾病的发生和发展密切相关。
通过共聚焦显微镜观察线粒体的形态和功能变化,可以揭示与疾病发生相关的机制。
例如,在某些神经系统疾病中,线粒体的形态和动力学异常是导致细胞死亡的关键因素。
通过共聚焦显微镜观察线粒体与细胞核、细胞质以及其他细胞器的相互作用,可以研究细胞内信号传递和调控网络的异常。
这些研究有助于深入了解疾病的发生机制,并为疾病的预防和治疗提供新的靶点和策略。
激光共聚焦显微镜原理
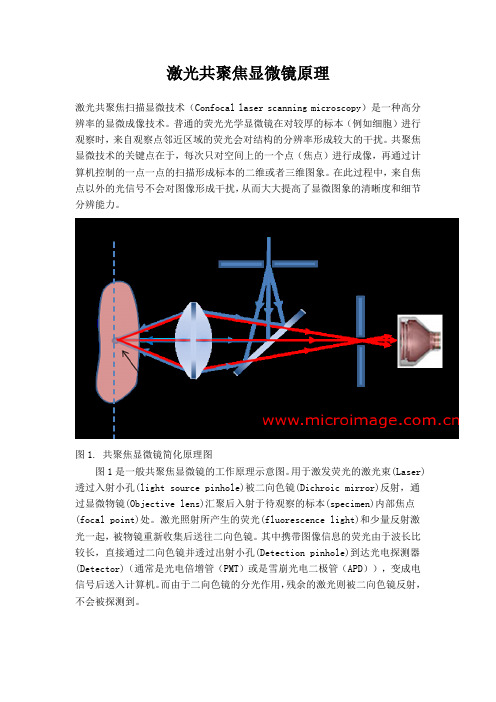
激光共聚焦显微镜原理激光共聚焦扫描显微技术(Confocal laser scanning microscopy)是一种高分辨率的显微成像技术。
普通的荧光光学显微镜在对较厚的标本(例如细胞)进行观察时,来自观察点邻近区域的荧光会对结构的分辨率形成较大的干扰。
共聚焦显微技术的关键点在于,每次只对空间上的一个点(焦点)进行成像,再通过计算机控制的一点一点的扫描形成标本的二维或者三维图象。
在此过程中,来自焦点以外的光信号不会对图像形成干扰,从而大大提高了显微图象的清晰度和细节分辨能力。
图1. 共聚焦显微镜简化原理图图1是一般共聚焦显微镜的工作原理示意图。
用于激发荧光的激光束(Laser)透过入射小孔(light source pinhole)被二向色镜(Dichroic mirror)反射,通过显微物镜(Objective lens)汇聚后入射于待观察的标本(specimen)内部焦点(focal point)处。
激光照射所产生的荧光(fluorescence light)和少量反射激光一起,被物镜重新收集后送往二向色镜。
其中携带图像信息的荧光由于波长比较长,直接通过二向色镜并透过出射小孔(Detection pinhole)到达光电探测器(Detector)(通常是光电倍增管(PMT)或是雪崩光电二极管(APD)),变成电信号后送入计算机。
而由于二向色镜的分光作用,残余的激光则被二向色镜反射,不会被探测到。
图2. 探测针孔的作用示意图图2解释了出射小孔所起到的作用:只有焦平面上的点所发出的光才能透过出射小孔;焦平面以外的点所发出的光线在出射小孔平面是离焦的,绝大部分无法通过中心的小孔。
因此,焦平面上的观察目标点呈现亮色,而非观察点则作为背景呈现黑色,反差增加,图像清晰。
在成像过程中,出射小孔的位置始终与显微物镜的焦点(focal point)是一一对应的关系(共轭conjugate),因而被称为共聚焦(con-focal)显微技术。
眼科角膜共聚焦显微镜检查操作技术

眼科角膜共聚焦显微镜检查操作技术角膜共聚焦显微镜(CMTF)全称为扫描裂隙角膜共聚焦显微镜,简称共焦显微镜,是近年来发展起来的一种活体显微检查技术。
1955年Minsky发明了第一台用于研究脑神经网络的共焦显微镜,Cavanagh等于1986年将其应用于眼科的动物实验,又于1989年首次用于活体人眼的观察。
此后,共焦显微镜在角膜病的基础研究和临床工作中得到广泛应用,使角膜病的研究和诊断水平向前推进了一大步。
一、基本原理角膜共聚焦显微镜的原理是利用共姬焦点技术,运用光扫描对活体组织进行三维空间的显示和实时的观察,其获得图像的扫描范围为300μm×400μm,厚约5um,放大倍数100o倍,X、Y、Z轴由三轴机器杆控制,移动范围可精确到小于IUn1。
与普通的光学显微镜相比,它具有高分辨率和图像高对比度的特点,能够在细胞水平对活体角膜进行无创伤的动态观察。
临床主要有两种类型:TandenISCanning共焦显微镜和Confoscan裂隙扫描型共焦显微镜。
目前共焦显微镜已由录像系统转化为数码摄像系统,使图像更为清晰、完整,图片摄取速度更快捷,如Confoscan2.0共焦显微镜。
近来,激光角膜共焦显微镜也已用于临床,其图像清晰、分辨率高至1um、可对角膜病变和角膜缘疾病进行多层次立体及连续动态观察。
我科首次应用激光共焦显微镜(HRTII/RCM)对正常人活体角膜缘和角膜中央组织结构进行了观察,获得了传统光学共焦显微镜无法获得的图像和效果,填补了活体观察角膜缘的空白。
共焦显微镜由三大部分组成:①主机:由一个一维的扫描裂隙装置和一个与图像光路相一致的物体聚集盘组成,在一维的光切面上做三维的点状分层扫描。
②光学传输系统:把连续、同步的光扫描信号传到计算机屏幕和录像机磁带上。
③计算机分析系统:对记录在录像带上的图像进行分析、处理得到较清晰的图片资料。
对角膜的各层细胞数、大小、面积进行统计和数据分析。
尼康共聚焦显微镜使用手册

尼康共聚焦显微镜使用手册一、引言尼康共聚焦显微镜是一种高级光学显微镜,广泛应用于生物、医学、材料科学等领域。
本使用手册将介绍尼康共聚焦显微镜的基本结构、操作方法以及常见故障处理方法,帮助用户熟练掌握该设备的使用技巧。
二、基本结构1. 光学系统:尼康共聚焦显微镜采用共聚焦技术,具有优秀的深度分辨能力和高倍率成像功能。
光学系统包括目镜、物镜和共聚焦激光扫描系统。
2. 机械系统:显微镜的机械系统包括标本平台、焦平面控制系统和Z轴控制系统,可以实现对标本的精确控制。
3. 软件系统:尼康共聚焦显微镜配备专业的成像和数据处理软件,能够对观察到的图像进行实时处理和分析。
三、操作方法1. 打开电源:将显微镜连接至电源,并按下电源开关,待系统启动完成后即可进入操作界面。
2. 调整标本:将待观察的标本放置在标本平台上,并利用X、Y、Z轴控制系统进行精确定位。
3. 开启激光扫描:根据需要选择合适的激光波长和功率,通过软件系统开启激光扫描功能。
4. 观察和成像:通过目镜观察标本,同时可使用软件系统进行图像实时采集和处理,以获取清晰的成像结果。
5. 关机和维护:在完成观察后,依次关闭激光扫描、软件系统和电源,同时对显微镜进行常规维护和清洁工作。
四、常见故障处理1. 图像模糊:可能是由于物镜未对焦或标本未平整导致,可通过调节焦平面控制系统和Z轴控制系统来改善。
2. 激光无法启动:检查激光源和激光器是否连接良好,保证激光通道畅通。
3. 软件无响应:重新启动软件或检查计算机连接是否正常,如有需要可进行软件更新或重新安装。
五、注意事项1. 使用前需仔细阅读本手册,并按照操作步骤进行操作,避免操作失误导致设备损坏或人员受伤。
2. 对于激光器等高功率模块,应特别注意安全防护,避免直接暴露于激光光束下。
3. 定期对显微镜进行清洁和维护,保持设备的良好状态。
六、结语通过阅读本使用手册,相信您已经对尼康共聚焦显微镜有了更全面的了解,并能够熟练操作和维护该设备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
共聚焦显微镜结构
共聚焦显微镜(Confocal Microscope)结构由以下部分组成:光源、物镜、扫描组件和探测器。
1. 光源:共聚焦显微镜的光源通常是激光。
激光可以提供高功率、高亮度和高单色性的光源,而且其光斑大小和功率可以调整,从而满足样本需求。
常见的激光波长包括405nm、488nm、561nm和640nm。
2. 物镜:共聚焦显微镜的物镜分为扫描物镜和探测物镜两种。
扫描物镜是一种高数值孔径的物镜,可以将激光经过的样本分辨成小于0.2微米的亚细胞结构。
探测物镜还可以提供更高的数值孔径,使其可以采集更多的荧光信号,提高成像质量。
3. 扫描组件:共聚焦显微镜的扫描组件主要包括扫描镜、扫描镜驱动器、反射镜和光栅。
扫描镜是一个开口的极限高速振镜,驱动器可以使扫描镜快速前后横向移动。
反射镜可将激光聚焦到样本上,收集反射的荧光光信号。
光栅可以将反射的荧光光信号进一步分离出来。
4. 探测器:共聚焦显微镜的探测器分为放大器管(PMT)和光电二极管(PIN)。
PMT可以将荧光光信号转换成电信号,可采集到更广泛的波长范围。
而PIN具有较快的响应速度和较低的噪音水平,可以更好地适应高速成像。
