透明质酸酶抑制实验
透明质酸酶的作用机制

透明质酸酶的作用机制全文共四篇示例,供读者参考第一篇示例:透明质酸酶是一种酶类蛋白质,也被称为玻尿酸酶,其主要功能是降解或分解透明质酸分子。
透明质酸是一种多糖,是一种在人体皮肤组织中具有重要功能的成分。
它存在于胶原蛋白和弹力蛋白中,并与它们一起维持着皮肤的弹性和水分,使皮肤看起来光滑紧致。
透明质酸酶主要作用于皮肤组织中的透明质酸。
透明质酸酶通过水解透明质酸分子,使其分解成较小的片段或单糖单元。
这样,透明质酸酶能够促进透明质酸的新陈代谢和再生,从而增强皮肤组织的弹性和保湿性能。
透明质酸酶通过分解透明质酸,使其能够更容易地被皮肤吸收。
透明质酸是一种高分子聚合物,分子量较大,难以穿透皮肤屏障,因此透明质酸酶在皮肤表面的作用非常重要。
透明质酸酶可以将透明质酸分子分解成较小的片段,这些片段更容易被皮肤吸收,从而提高了透明质酸在皮肤组织中的有效性。
透明质酸酶还具有促进胶原蛋白和弹力蛋白合成的作用。
透明质酸酶通过促进透明质酸的新陈代谢和再生,增强了皮肤组织中透明质酸的含量,从而进一步促进了胶原蛋白和弹力蛋白的合成。
这些蛋白质是皮肤组织中主要的支撑结构,能够增强皮肤的弹性和紧致度,减少皱纹和松弛现象。
透明质酸酶的作用机制还包括抑制黑色素的形成。
透明质酸酶能够调节皮肤中黑色素的合成,减少黑色素在皮肤表面的沉淀,有助于减少皮肤色斑和暗沉现象。
透明质酸酶在皮肤美白和均匀肤色方面具有一定的作用,能够帮助皮肤恢复明亮光泽。
透明质酸酶在皮肤保养和美容方面具有重要作用。
它能够降解透明质酸、促进胶原蛋白和弹力蛋白的合成、调节黑色素的形成,从而改善皮肤的弹性、保湿性能和肤色,使皮肤看起来更加年轻健康。
透明质酸酶可以被广泛应用于护肤品和美容产品中,是一种非常重要的皮肤保养成分。
第二篇示例:透明质酸酶是一种重要的酶类蛋白质,它在机体中发挥着重要的生理作用。
透明质酸是一种多糖,在皮肤组织中占有很大比例,具有保湿和塑性的作用。
透明质酸酶主要起到分解透明质酸的作用,从而保持皮肤组织的弹性和光泽。
透明质酸酶催化透明质酸水解的最适反应条件

透明质酸酶催化透明质酸水解的最适反应条件透明质酸水解是一种重要的生物酶反应,它不但可以控制多种重要的生物过程,还可以用于制备药物和食品。
在这种反应中,透明质酸酶(TZase)是一种参与此类反应的重要酶,它可以催化透明质酸水解反应,并可以改变反应条件,影响反应结果。
因此,透明质酸酶催化透明质酸水解的最佳反应条件是控制反应产物质量的关键环节。
首先,研究者需要了解反应条件,例如反应温度和pH值,这将有助于判断TZase的最佳活性。
研究表明,TZase的最佳活性属于酸性条件,TZase的最适反应温度一般为30-50°C,当温度高于50°C时,该酶的活性会急剧下降,而低于30°C时,TZase的活性会逐渐减少。
另外,TZase在pH4.5-7.5范围内有较高活性,最适宜的pH值是6.0-7.0。
其次,TZase酶的最适反应条件还可以通过添加有机离子来改变。
研究发现,增加有机离子,例如取代性离子或阴离子,对提高TZase的活性有一定的促进作用。
比如说,番茄红素的取代性离子可以增加TZase的活性,而K+和Cl-等阴离子则可以抑制TZase的活性。
此外,TZase的活性也可以通过配体的添加来改变,有利于提高TZase的最佳活性及反应产物的质量。
最后,TZase最适反应条件还可以通过调节反应体系的溶剂种类来改变。
研究发现,大多数有机溶剂会抑制TZase的活性,但一些特定的溶剂,如乙腈,可以改善TZase的活性,有利于催化透明质酸水解反应。
综上所述,透明质酸酶催化透明质酸水解的最适反应条件包括:反应温度30-50°C,反应pH值6.0-7.0,添加有机离子及有效的配体,以及调节反应体系的溶剂种类等。
这些反应条件可以有效提高TZase的活性,促进反应的高效性,从而帮助研究者更好地控制反应结果。
掌握了透明质酸酶催化的最佳反应条件,可以改善现有的应用技术,提高药物和食品的质量,并可以应用于新的药物开发和食品加工技术中。
酶的竞争性抑制实验报告

酶的竞争性抑制实验报告一、实验目的本实验旨在通过酶活性测定,探究酶竞争性抑制作用,以及抑制剂强度对该作用的影响。
二、实验原理酶是一种特殊的蛋白质,它能够促进生物体内特定反应的进行,而可以抑制其作用的物质被称为抑制剂。
当抑制剂添加到酶的反应系统中时,它会阻止酶的作用,从而减少酶的活性,也会减少酶反应系统的活性,这就是酶的竞争性抑制作用。
三、实验材料和方法1.实验材料:含有氯化钠400mmol/L、磷酸二氢钠100mmol/L、十四烷酸钠10mmol/L及水的缓冲液500ml、细胞色素C20mmol/L (或者乳酸脱氢酶10U/ml)、抑制剂50ml(可根据实验需要选择不同的抑制剂)。
2.实验方法:(1)将缓冲液500ml加入离心瓶中,加热至37℃;(2)加入细胞色素C20mmol/L(或者乳酸脱氢酶10U/ml),搅拌均匀;(3)分别将抑制剂添加量分别为0ml、5ml、10ml、15ml、20ml,搅拌均匀;(4)将每组离心瓶中的液体稀释至200ml,然后将离心瓶中的液体取出,用光度计测定每组液体的光度值;(5)计算每组液体的酶活性,并与未加入抑制剂的组进行比较。
四、实验结果(1)未加入抑制剂的液体的光度值为0.4565;(2)加入5ml抑制剂后,液体的光度值为0.3576;(3)加入10ml抑制剂后,液体的光度值为0.2697;(4)加入15ml抑制剂后,液体的光度值为0.1818;(5)加入20ml抑制剂后,液体的光度值为0.0939。
五、实验讨论实验结果显示,随着抑制剂添加量的增加,液体的光度值也随之减小。
这说明,随着抑制剂的添加,酶的活性也随之降低,从而证明了酶的竞争性抑制作用。
此外,实验结果表明,随着抑制剂的添加量的增加,酶的活性也随之减小,这也说明了抑制剂的强度对酶的竞争性抑制作用有重要的影响。
透明质酸酶和C3F8诱导兔眼玻璃体后脱离的实验研究

2 3 —2 4 6 7 64
建立 成功 ; 免疫 组织 化 学 染 色显 示 患病 组 S I C D小 鼠 的骨髓 微 血管 管 腔很 小 , 至 无 管 腔 , 甚 可见 许 多 细 小
分支 , 血管 形 态幼 稚 ; 正 常 组 小 鼠 骨髓 组 织 的微 血 而 管 管腔 大 , 支 少 见 , 态较 成 熟 。治 疗 组 小 鼠 与正 分 形
k ma l d 19 ,9 6 1 7 e i.Bo , 9 7 8 ( ):8 0—1 7 o 85
2 P d o T , Ru z S, B c e ,e 1 I c e s d a g o e e i n t e b n a r i ik rR ta . n r a e n ig n ss i h o e
患病组 与 正 常组 比较 , <0 0 , 异 有 显 著 统 计 学 P .1差
意义 , 明 HL一6 / C D小 鼠急 性 髓 系 白血 病 模 型 说 0SI
谷胱甘肽在个人护理产品的作用
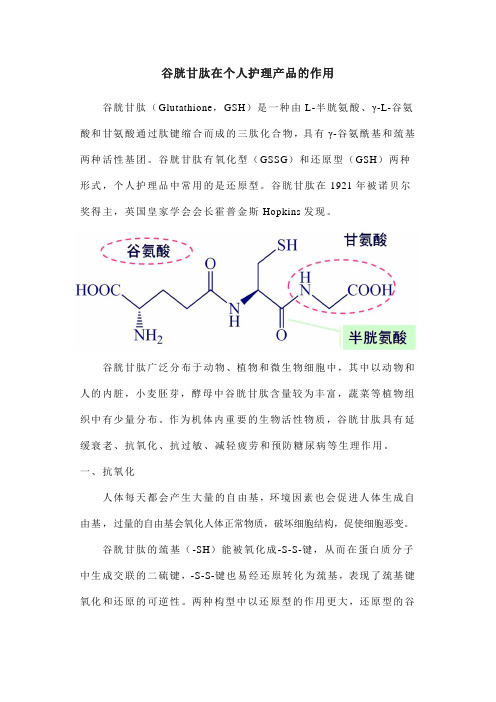
谷胱甘肽在个人护理产品的作用谷胱甘肽(Glutathione,GSH)是一种由L-半胱氨酸、γ-L-谷氨酸和甘氨酸通过肽键缩合而成的三肽化合物,具有γ-谷氨酰基和巯基两种活性基团。
谷胱甘肽有氧化型(GSSG)和还原型(GSH)两种形式,个人护理品中常用的是还原型。
谷胱甘肽在1921年被诺贝尔奖得主,英国皇家学会会长霍普金斯Hopkins发现。
谷胱甘肽广泛分布于动物、植物和微生物细胞中,其中以动物和人的内脏,小麦胚芽,酵母中谷胱甘肽含量较为丰富,蔬菜等植物组织中有少量分布。
作为机体内重要的生物活性物质,谷胱甘肽具有延缓衰老、抗氧化、抗过敏、减轻疲劳和预防糖尿病等生理作用。
一、抗氧化人体每天都会产生大量的自由基,环境因素也会促进人体生成自由基,过量的自由基会氧化人体正常物质,破坏细胞结构,促使细胞恶变。
谷胱甘肽的巯基(-SH)能被氧化成-S-S-键,从而在蛋白质分子中生成交联的二硫键,-S-S-键也易经还原转化为巯基,表现了巯基键氧化和还原的可逆性。
两种构型中以还原型的作用更大,还原型的谷胱甘肽可使生物酶中的-S-S-键还原成-SH,从而恢复或提高它们的活性。
两分子GSH可在谷胱甘肽过氧化物酶GPX的作用下氧化为一分子的GSSG(氧化型谷胱甘肽),同时中和自由基H2O2形成无害的水和氧分子,从而保护细胞膜的结构和功能免受过氧化物的干扰和损伤。
GSSG在谷胱甘肽还原酶的作用下还原成GSH,同时将递氢体NADPH 氧化为NADP+(烟酰胺腺嘌呤二核苷磷酸),从而形成一个氧化还原循环,避免氧化损伤。
二、抗过敏研究了谷胱甘肽的体外抗过敏活性,主要是通过透明质酸酶抑制实验。
图1 谷胱甘肽对透明质酸酶的抑制作用结果如图1所示,谷胱甘肽对透明质酸酶的抑制率随浓度的增大而增大,当浓度低于3 mg/ml时,透明质酸酶的抑制率与谷胱甘肽的浓度呈线性关系,并且随着谷胱甘肽浓度的增大,透明质酸酶抑制率变化较大;在浓度高于3 mg/ml时,抑制率随谷胱甘肽浓度的增加而增加缓慢。
八种常见食用菌的抗过敏和抗氧化活性成分研究

于治 疗疾病 的 观念正 在从药 物治疗 转变 到注重 利 用食 物来保 持健 康 、 预 防疾病 的发 生 。研 究发现 ,
植物 性食物 中除含 人 体需 要 的各种 营养 素 外 , 还
1 材料 与 方 法
1 . 1 实验 原料
蘑菇 、 草菇 、 平菇 、 金针菇 、 杏鲍 菇 、 鸡腿 菇 、 海
一
32 —
2 0 1 3 No . 3
Cu l i n a r y S c i e n c e J o u r n a l o f Ya n g z h o u Un i v e r s i t y
Vo 1 . 3 0 S u m No . 1 1 1
长期食 用 的食 品 中, 天 然抗 过 敏 成分 的毒性 远远
家, 过 敏 的多发 l 生和常 见性使 其 成 为影 响人类 健 康 的社会 问 题 。过 敏不 但 影 响人 类 的正 常生 活 , 而且会 危及 生 命 。因此 , 过 敏 性 疾病 已经 成 为最 受人们 关注 的 公共 卫 生 问 题之 一 。 目前 , 针对 食
随着 环 境 污染 的加 剧 和 人 们 生 活 习 惯 的改
医药 名著 均有 记 载 J 。现代 医学 研究 表 明 , 食 用
变, 过敏 性疾 病 的发 病率 正逐年增 加 , 严重影 响到
人 们 的生活 、 工作 和学 习。在美 国 、 日本等发 达 国
菌 具有增 强人 体的免 疫机能 、 抗肿 瘤 、 抗 过敏 等作 用 。但 目前对食 用 菌在抗过 敏成 分方 面的利 用还 不 充分 , 有关食 用菌 抗过敏 方面 的文献 报道很 少 , 食 用菌 的开发 利用 还受 到极 大 限制 。鉴于传 统合 成 的抗 过敏 药物存 在 毒 性 和不 安 全 性 , 而 在人 们
透明质酸酶的研究进展_苏康

1.3 微生物透明质酸酶
透明质酸裂解酶是微生物致病过程中的毒力因 子,通常与宿主组织直接接触或使病菌逃过其防卫 机制。透明质酸裂解酶降解宿主基质中的透明质酸, 使得宿主易患气性坏疽、脑膜炎、滑膜炎、增生、肾炎、 霉浆菌症、牙周疾病、乳腺炎、肺炎、败血症、梅 毒及毒性休克综合症等病症[21-23]。宿主体内的高分 子量透明质酸参与免疫调节且具有抗炎活性,而微 生物产生的透明质酸裂解酶将其所含高分子量透明 质酸裂解成寡聚透明质酸,成为诱导炎症反应的因 子,在宿主体内为微生物的生长塑造环境。
众多毒液来源的透明质酸酶中关于蜜蜂毒液透 明质酸酶(Bee venom hyaluronidase,BVH)的研究
2014年第3期
苏康等 :透明质酸酶的研究进展
17
较早且较为深入,究其缘由是因为蜜蜂毒液中透明 质酸酶的含量相对较高。BVH 是首个经 cDNA 克隆 于大肠杆菌表达所得的真核生物来源的透明质酸酶, 是一种透明质酸 4-糖苷裂解酶(E.C.3.2.1.35),归属 于糖苷裂解酶 56 家族,作用终产物为四糖[13]。该 酶是由 349 个氨基酸组成的 40.746 kD 的糖蛋白,糖 含量在 7%,蛋白结构中有 4 个半胱氨酸构成的二硫 键和 3 个糖基化位点[14]。Markovic-Housley 等[15]将 BVH 与 HA 四聚体合成结晶,晶体分析显示蛋白进 行(β/α)7 折叠而非常规的(β/α)8 折叠,酶与 HA 结合位点位于保守氨基酸丰富的 C 末端,催化过程 中谷氨酸为质子给予体,HA 结构中的羧基基团为亲 核体。除蜜蜂外,来自于虎头蜂、黄蜂等其他蜂类 的透明质酸酶也有所研究。虎头蜂毒液中的透明质 酸酶经 cDNA 克隆序列测定 :含 331 个氨基酸,与 BVH 有 56% 的 序 列 相 似 性[16]。SDS-PAGE 以 及 质 谱分析鉴定到黄蜂 P.paulista 毒液中有 4 种不同分子 结构的透明质酸酶,通过蛋白质组学分析已将其中 含量最高的 Hyal III 进行测序,建构 3D 结构。Hyal III 含有 288 个氨基酸,分子量在 44.340,pI 9.50[17]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Elson-Morgan 改良法
一、实验原理
透明质酸酶是Ⅰ型过敏反应的参与者,透明质酸酶与炎症、过敏有强相关性,研究报道各种肥大细胞释放组胺的药物能调节透明质酸酶活性,一些抗敏药物有强抑制透明质酸酶活性,因此抑制透明质酸酶活性作为研究抗过敏作用的指标。
二、试剂和仪器
1、透明质酸酶:浓度500U/ml,现配现用,不能过夜,用醋酸缓冲液做溶剂;
2、透明质酸钠:0.5mg/ml,一次配制,多次使用,用醋酸缓冲液做溶剂;
3、Buffer:溶液A(0.2 mol/L 醋酸 11.55ml冰醋酸溶于1L蒸馏水中)4.8ml
溶液B(0.2 mol/L醋酸钠 16.4g无水醋酸钠或27.2g三水合醋酸钠溶于1L蒸馏水中)45.2ml,混合稀释至100ml,配制成PH=5.6的醋酸缓冲液;
4、乙酰丙酮溶液:50ml 1.0mol/L 碳酸钠溶液和3.5ml乙酰丙酮溶液混合均匀(临用现配)
5、P-DAB显色剂:0.8g 对二甲氨基苯甲醛溶于15ml浓盐酸和15ml无水乙醇混合均匀。
6、氯化钙溶液CaCl2:2.5mol/L
7、氢氧化钠溶液NaOH:5 mol/L
样品参考浓度1.2mg/ml
三、试验步骤
四、计算
透明质酸酶抑制率(%)=[(C-D)-(A-B)]/ (C-D) ×100%
试中:A—(透明质酸酶+样品+透明质酸钠)试样溶液的OD值
B—(醋酸缓冲液+样品+醋酸缓冲液)试样空白的OD值
C—(透明质酸酶+去离子水+透明质酸钠)对照溶液的OD值 D—(醋酸缓冲液+去离子水+醋酸缓冲液)对照空白的OD值。
