6.蛋白酶
蛋白酶合成抑制剂激活重构胚的原理

蛋白酶合成抑制剂激活重构胚的原理全文共四篇示例,供您参考第一篇示例:蛋白酶合成抑制剂是一类能够抑制蛋白质合成的物质,它们对细胞的蛋白质合成过程起着重要的调控作用。
而在胚胎发育阶段,蛋白酶合成抑制剂则能够通过激活重构胚来发挥作用。
重构胚是指受精卵发育到囊胚阶段,之后再经过其他因素的处理使其发育状态发生改变的一种胚胎形态。
在胚胎植物学和动物学的研究中,如何激活和重构囊胚具有重要的理论和实践意义。
在这里,我们将探讨蛋白酶合成抑制剂激活重构胚的原理。
1. 蛋白酶合成抑制剂的作用机制蛋白酶合成抑制剂主要通过抑制蛋白质合成过程中的转录或翻译步骤来发挥作用。
这些抑制剂在细胞内能够与特定的蛋白酶结合,阻断其对特定底物的作用,从而影响蛋白质的合成。
在重构胚的形成中,蛋白酶合成抑制剂可以影响到特定蛋白的合成,进而调控胚胎发育状态的改变。
2. 蛋白酶合成抑制剂激活重构胚的作用机理蛋白酶合成抑制剂能够激活重构胚的原理涉及多个方面的调控机制。
蛋白酶合成抑制剂可能通过调控特定基因的表达来影响胚胎发育过程。
这些基因可能与胚胎发育的方向、速度和整体形态等方面有关,蛋白酶合成抑制剂的作用能够改变这些基因的表达水平,从而影响胚胎的重构状态。
蛋白酶合成抑制剂对蛋白质合成的影响也可能导致细胞内蛋白质降解与合成失衡,进而触发细胞内部的应激反应。
这种应激反应可能引发一系列信号通路的激活,从而影响胚胎的发育状态。
蛋白酶合成抑制剂还可能通过影响细胞内蛋白修饰的方式来调控胚胎的状态。
蛋白质的翻译后修饰等过程对胚胎发育过程中的信号传导和基因表达等有着重要作用,蛋白酶合成抑制剂的作用可能通过调控这些修饰过程来影响胚胎的状态变化。
3. 蛋白酶合成抑制剂激活重构胚的应用前景在生物学研究领域,蛋白酶合成抑制剂激活重构胚的原理已经引起了研究人员的广泛关注。
基于这一原理,科学家们希望通过操纵蛋白酶合成抑制剂的作用,来实现对胚胎发育状态的精准调控。
这将有助于深入理解胚胎发育过程中的分子机制,对相关疾病的研究也具有重要的意义。
胶内酶解

一、试剂准备1.30mmol/L K3Fe(CN)6铁氰化钾9.9 mg K3Fe(CN)6溶于1mL Milli-Q水2.100mmol/L Na2S2O3硫代硫酸钠24.8 mg Na2S2O3溶于1mL Milli-Q水3.200mmol/L NH4HCO3碳酸氢铵0.079g NH4HCO3溶于5 mL Milli-Q水4. 覆盖液(酶解缓冲液)40mmol/L NH4HCO3, 10% ACN200ul 200mmol/L NH4HCO3, 100ul ACN, 700ul Milli-Q水5. 萃取液50%ACN,0.1% TFA6. 胰蛋白酶贮存液:胰蛋白酶溶于50mM醋酸溶液中(1mL Milli-Q水加入冰醋酸2.86 uL),浓度1ug/uL,即每管20ug,溶于20uL 50mM醋酸溶液中。
工作液:使用覆盖液稀释至10ng/uL7. 脱色液银染脱色液:30mmol/L K3Fe(CN)6与100mmol/L Na2S2O3 1:1混合考染脱色液:50%ACN, 40mmol/L NH4HCO3以上试剂单独存放在质谱准备室,不要使用其他来源的药品、试剂,其中脱色液需现用现配。
二、实验步骤1. 切胶用剪刀剪断Tip(进口Tip),将蛋白质斑点从凝胶上切下,置于0.5 mL EP管内(进口产品),每管加Milli-Q水400 uL振荡洗涤2min,吸出液体后重复一次,以保证酸液被洗净。
2. 脱色银染样品:每管加入现配脱色液50-80uL(视胶粒大小而定),静置2min左右,当胶粒由棕黑色变成亮黄色(与脱色液颜色相同时),迅速加入400uL Milli-Q水终止反应,重新加入400uL Milli-Q水振荡洗涤一次,吸出多余的液体。
(3%H2O2/25mM NH4HCO3/H2O)考染样品:每管加入现配脱色液50-80uL(视胶粒大小而定),静置2min左右,待胶粒蓝色褪却时,加入400uL Milli-Q水终止反应,重新加入400uL Milli-Q水振荡洗涤一次,吸出多余的液体。
组织蛋白酶k免疫组化

组织蛋白酶k免疫组化
组织蛋白酶K免疫组化是一种常用的免疫组化技术,主要用于检测组织中的特定蛋白。
以下是关于组织蛋白酶K免疫组化的一些基本信息:
1. 原理:组织蛋白酶K是一种特定的蛋白酶,它可以切割某些特定的蛋白结构。
在免疫组化实验中,通过使用特定的抗体来标记目标蛋白,然后使用组织蛋白酶K来切割这些标记的蛋白,从而释放出被标记的片段。
这些被释放的片段可以被其他方法检测和定量。
2. 应用:组织蛋白酶K免疫组化常用于检测组织中的特定蛋白,如细胞周期蛋白、肿瘤标志物等。
3. 优点:
可以检测到非常低浓度的目标蛋白。
可以区分不同的目标蛋白结构。
可以与其他免疫组化技术相结合,提高检测的灵敏度和特异性。
4. 缺点:
需要特定的抗体和组织蛋白酶K。
实验步骤相对复杂。
可能存在交叉反应的问题。
5. 注意事项:
在实验前,需要确保所使用的抗体和组织蛋白酶K都是特异性的。
在实验过程中,需要严格控制反应条件,以确保结果的准确性。
生物化学课件第六章 酶(化学)

相对专一性
酶的专一性
结构专一性
(表6-3)
绝对专一性
立体异构专一性
7
相对专一性(relative specificity)
①族专一性(基团专一性) A — B 作用于一类或一些结构很相似的底物。
②键专一性 CAH2—OHB
α-葡萄糖
5
OH
苷酶
OHO
O
1
O
R
+H2O
OH
酯酶:R—C—O—R′ + H2O
脂肪(:水)水解酶
16
(二)酶的命名
2、惯用名: 通常只取一个较重要的底物名称和作用方式。
乳酸:NAD+氧化还原酶
乳酸脱氢酶
对于催化水解反应的酶一般在酶的名称上省去反应类 型。如水解蛋白的酶称蛋白酶,水解淀粉的酶叫??
有时为了区分同一类酶还在前面加上来源。 如胃 蛋白酶、胰蛋白酶、木瓜蛋白酶等
17
氧转水 裂异合
12
(一)酶的分类:
1. 氧化还原酶:催化氧化还原反应的酶。
AH2 + B
A + BH2
(1)脱氢酶类:催化直接从底物上脱氢的反应。
(2)氧化酶类 ①催化底物脱氢,氧化生成H2O2: ②催化底物脱氢,氧化生成H2O:
(3)过氧化物酶
(4)加氧酶(双加氧酶和单加氧酶)
13
(一)酶的分类
1个 Fe3+ 每秒能催化6×10-4个 H2O2的分解
同一反应,酶催化反应的速度比一般催化剂的反应
速度要大106~1013倍(表6-1)。
6
2.酶的特性:——生物催化剂
(1)催化效率极高
(2)高度的专一性:
酶对底物具有严格的选择性称为酶的专一(特异)性。 如:蛋白酶只能催化蛋白质的水解,酯酶?? 淀粉酶??
常用蛋白酶切割位点
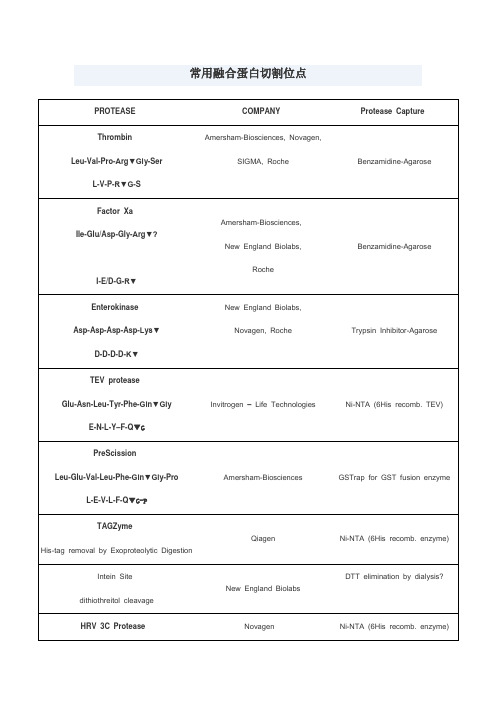
Trypsin Inhibitor-Agarose
TEV protease
Glu-Asn-Leu-Tyr-Phe-Gln▼Gly
E-N-L-Y–F-Q▼G
Invitrogen – Life Technologies
Ni-NTA (6His recomb. TEV)
PreScission
Ile-Glu/Asp-Gly-Arg▼?
I-E/D-G-R▼
Amersham-Biosciences,
New England Biolabs,
Roche
Benzamidine-Agarose
Enterokinase
Asp-Asp-Asp-Asp-Lys▼
D-D-D-D-K▼
New England Biolabs,
3.羧肽酶(分A和B型),一般的题目中没有特别指明的话就是两种类型的功能都具备,可以从羧基端切除氨基酸(若羧基端的第1个或第2个氨基酸为Pro的则不能切除)。
4.溴化氰处理,专一性的切割甲硫氨酸羧基端的肽键。
L-E-V-L-F-Q▼G-P
Novagen
Ni-NTA (6His recomb. enzyme)
SUMO Protease
recognize the tertiary structure of the ubiquitin-like (UBL) protein, SUMO
Invitrogen – Life Technologies,
Ni-NTA (6His recomb. enzyme)
Intein Site
dithiothreitol cleavage
New England Biolabs
生物化学试卷

一、填空题(每空分,共10分)1、蛋白质在等电点时,以_________离子形式存在,净电荷为______________。
2、维持DNA双螺旋稳定的力是_____________和__________。
3、缺乏VitB1可能引起___________疾病,夜盲症是由于缺乏__________引起的。
4、蛋白酶按其化学组成可分为____________和____________。
5、糖酵解途径中的关键酶是__________、_____________、和_______________。
6、脂肪酸β—氧化包括__________步连续反应,其产物是_______________。
7、脑中氨的主要去路是_________________。
8、体内高能磷酸化合物的生成方式有_________________和______________。
9、体内胆红素的主要来源是______________随______________排泄。
10、血浆中调节酸碱平衡最重要的缓冲系统是_______________其缓冲固定酸的主要物质是_____________。
二、是非判断题(每题1分,共10分)1、含有两个氨基的氨基酸,其PH值大于。
( )2、DNA变性的实质是磷酸二酯键的断裂。
( )3、酶的必需基团全部都位于活性中心外,可分为结合基团和催化基团。
( )4、葡萄糖是小分子有机化合物,它进入细胞是通过简单的扩散过程。
( )5、人体对维生素的需要量很少,但由于机体不能合成或者合成量较少,必须经常由食物供给。
( )6、糖无氧氧化能够产生ATP,故糖酵解是正常人获得能量的主要方式。
( )7、所有的肝外组织都能生成酮体,也都能利用酮体。
( )8、胆固醇在体内不能彻底分解为CO2+H2O。
( )9、食物蛋白质营养价值的高低取决于含必需氨基酸的种类、数量和比例。
( )10、成人每日需饮水1200ml,才能维持体内水平衡。
( )三、名词解释(每个2分,共20分)1、电泳2、酶的竞争性抑制作用3、DNA变性4、呼吸链5、糖异生6、脂肪动员7、乳酸循环8、结合胆红素9、氮总平衡10、必需氨基酸四、选择题(每题1分,共30分)A型题(选择一个正确答案)1、下列属于亚氨基酸的是A、甘氨酸B、脯氨酸C、组氨酸D、色氨酸E、谷氨酸2、测定血清标本的含氮量为10g/L,蛋白质的含量是多少A、10g/LB、16g/LC、62.5g/LD、45.5g/LE、72.5g/L3、DNA双螺旋结构错误的是A、二条链方向相反B、螺旋的直径为2nmC、为右手螺旋,每个螺旋为10个碱基对D、维持螺旋稳定的主要力量是肽键E、螺旋每上升一圈高度为4、某种酶活性需以-SH基为必需基团,能保护此酶不被氧化的物质是A、两价阳离子B、还原型谷胱甘肽C、尿素D、氧化型谷胱甘肽E、胱氨酸5、关于糖酵解的描述正确的是A、糖酵解过程所有反应都是可逆的B、最终产物是丙酮酸C、能产生36或38个ATPD、其反应过程都是在线粒体中进行的E、其反应过程都是在胞液中进行的6、糖酵解时哪一对代谢物提供~P使ADP生成ATPA、3—P—甘油醛及磷酸果糖B、1、3—二磷酸甘油酸及磷酸烯醇式丙酮酸C、1、3—二磷酸甘油酸及3—P—甘油醛D、6—P—葡萄糖及1、3—二磷酸甘油酸E、1、6—二磷酸果糖及1、3—二磷酸甘油酸7、催化底物直接以氧为受氢体的酶是A、乳酸脱氢酶B、过氧化物酶C、琥珀酸脱氢酶D、氨基酸氧化酶E、细胞色素氧化酶8、一分子丙酮酸在线粒体内彻底氧化生成C2O和H2O产生多少分子ATPA、12B、14C、15D、18E、389、在线粒体中进行脂酸碳链加长时,二碳单位的供体是A、乙酰CoAB、琥珀酰CoAC、丙酰CoAD、丁酰CoAE、丙二酰CoA10、一分子软脂酸彻底氧化生成ATP分子数是A、129B、130C、131D、12E、1511、酮体合成过程中的关键酶是A、HMGCOA合成酶B、HMGCoA裂解酶C、HMGCoA还原酶D、硫解酶E、脱羧酶12、含有较多稀有碱基的是A、DNAB、tRNAC、mRNAD、rRNAE、cAMP13、有机磷农药可与酶活性中心上的哪种基团结合,使酶的活性受抑制A、—SHB、NH3C、—OHD、—COOHE、—CH314、下列可能影响氧化磷酸化运行的因素是A、NAD+量B、FAD量C、ADP/ATP比值↑D、草酰乙酸的量E、葡萄糖15、DNA分子中的碱基特点是A、A=T G=CB、G与C之间有二条氢键C、C+G=A+TD、A与T之间有三条氢键E、A=U G=CX型题(选择二个或二个以上正确答案)16、酶的活性中心哪些正确A、酶的必需基团都位于活性中心内B、有的酶活性中心外也存在必需基团C、抑制剂都是与酶活性中心的必需基团结合D、有的抑制剂与酶活性中心外必需基团结合也可抑制酶活性E、构成酶活性中心的必需基团在一级结构上彼此都是相邻的17、糖酵解途径的关键酶是A、已糖激酶B、3-P-甘油醛脱氢酶C、丙酮酸激酶D、烯醇化酶E、磷酸果糖激酶18、氨的运输形式是A、NH3B、谷氨酰胺C、尿素D、谷氨酸E、丙氨酸19、下列关于三羧酸循环正确的是A、此循环有三个关键酶催化B、经一周循环,乙酰COA的二个碳被消耗掉C、循环过程中,没有脱下CO2D、此循环是糖有氧氧化的必经途径E、每循环一周产生15分子ATP20、胞液中NADH通过何种途径进入线粒体A、3—磷酸甘油穿梭B、柠檬酸—丙酮酸穿梭C、苹果酸—天冬氨酸穿梭D、葡萄糖—丙酮酸穿梭E、草酰乙酸—α—酮戊二酸穿梭21、肝脏对物质代谢的作用有A、维持血糖浓度的平衡B、维持酸碱平衡C、合成尿素D、合成脂肪酸E、合成多种蛋白质22、磷酸戊糖途径的生理意义是A、产生NADPH+H+B、产生NADH+H+C、产生核糖D、提供少量能量E、合成肝糖元23、脂肪酸的活化需A、HSCoAB、乙酰CoAC、ATPD、NADE、NADP+24、下列哪些是酮体A、乙酰CoAB、乙酰乙酸C、γ-氨基丁酸D、β—羟丁酸E、丙酮25、合成脂肪酸需要A、乙酰CoAB、NADPH+H+C、NADH+H+D、ATPE、GTP26、下列哪些为非必需氨基酸A、赖氨酸B、甲硫氨酸C、甘氨酸D、亮氨酸E、谷氨酸27、结合胆红素的叙述错误的是A、凡登白试验直接阳性B、水溶性较大C、可随尿液排出D、易透过生物膜E、与血浆清蛋白结合28、哪些维生素与能量代谢有关A、VitB2B、VitB6C、VitPPD、VitB12E、叶酸29、参与体内酸碱平衡调节的有A、肝B、肾C、心D、肺E、血液30、无机盐的生理功能是A、构成组织和体液的成分B、维持酸碱平衡C、维持神经肌肉的应激性D、维持酶活性E、参与体内某些主重要化合物的合成五、问答题(共30分)1、糖有氧氧化的基本过程和生理意义。
碱性蛋白酶

碱性蛋白酶产品概述奥迪尔碱性蛋白酶是经原生质体诱变方法选育的枯草杆菌通过深层发酵、提取及精制而成的一种蛋白水解酶。
广泛应用于制革、丝绸、食品、医疗、酿造等行业。
产品原理碱性蛋白酶活性成分属于一种丝氨酸内切碱性蛋白酶,它能水解蛋白质分子肽链生成多肽或氨基酸,在有机溶剂中它还可催化多肽的合成。
产品特性1.温度范围:有效温度范围20-60℃,最适温度范围在35-45℃。
2.PH值范围:有效pH范围6-11,最适pH值范围9.5-10.5产品性状1.产品规格:固体100000u/g,200000u/g粉末(颗粒状);液体100000u/ml液体酶pH(25℃):7.0-9.0,容重:≤1.25g/ml;固体酶细度(0.4mm标准筛通过率):≥80%。
2.酶活力定义:1g固体酶粉(或1ml液体酶),在40℃±0.2℃、pH10.5条件下,1min水解酪蛋白产生1μg酪氨酸,为1个酶活力单位,以u/g(u/ml)表示。
3.产品标准:执行中华人民共和国国家标准GB/T23527-2009应用方法1.碱性蛋白酶用于皮革加工具有简化工序、缩短周期、提高成品质量、增加的率、降低生产成本等优点。
用于浸水工序的加酶量为0.02-0.1%(按原料质量计,酶活力以10万u/ml计,下同),20-25℃作用12-20小时;用于皮革软化的加酶量为0.05-0.2%,35-38℃作用3-6小时;用于脱毛的加酶量为0.1-0.3%,20-35℃作用12-20小时。
以上使用pH均为9-11.2.碱性蛋白酶用于丝绸脱胶有丝素不受损伤、不起毛丝和蓬松的效果。
原料经过前处理,按0.8-2.4%加酶,pH9-11,40-50℃的条件下作用30-60min。
3.碱性蛋白酶用于软骨素生产,可有效提高收率和纯度。
原料在碱提取后,按照0.2-0.6%的添加量,pH8-10,温度40-50℃的酶解条件作用4-8小时。
4.碱性蛋白酶用于肝素钠的生产,可提高分子均一性和产品纯度。
蛋白酶产生菌的分离

蛋白酶产生菌的分离、活化选育、发酵及酶活力的测定许多细菌和霉菌产生蛋白酶,细菌中的芽孢杆菌是常见的蛋白酶产生菌。
本实验将土壤样品悬液加热处理,杀死非芽孢细菌及其它微生物后进行划线分离得到芽孢杆菌,将其接种到酪蛋白平板进行培养,根据酪蛋白平板的水解圈做初筛。
也可直接将细菌或霉菌接种到酪蛋白平板进行培养,分离筛选其它蛋白酶产生菌。
本实验主要包括:蛋白酶产生菌的分离纯化、产酶微生物菌种的选育、产酶微生物的发酵与酶活力的测定、蛋白酶产生菌的生长及生长曲线、培养基优化。
通过本实验项目,使学生学会从自然界中分离蛋白酶产生菌的方法,菌种的纯化技术、高产菌的选育技术;了解蛋白酶产生菌的生长情况,学会绘制其生长曲线;学会培养基优化的方法;了解蛋白酶的性质及蛋白酶的测定原理;掌握蛋白酶的发酵及酶活力测定方法。
1 实验材料1.1 实验样品校园内土壤样品1.2实验仪器与材料牛肉膏蛋白胨培养基平板、酪蛋白平板、无菌水(带玻璃珠)、芽孢染色液番红;显微镜、恒温水浴锅、酒精灯、接种针、游标卡尺、无菌移液管、无菌试管、血球计数板、试管、三角烧瓶、烧杯、量筒、,玻棒、电子天平、牛角匙、高压蒸汽灭菌锅、pH试纸( pH 5.5—9.0)、棉花、牛皮纸、记号笔、麻绳、纱布、培养皿、胶头滴管、分光光度计(应符合GB9721的规定)等。
2实验方法与步骤 2.1 培养基的配制方法1.称量按培养基配方比例依次准确地称药品放入烧杯中。
2.溶化在上述烧杯中可先加入少于所需要的水量,用玻棒搅匀,然后,在石棉网上加热使其溶解。
待药品完全溶解后,补充水分到所需的总体积。
3.调pH4.分装按实验要求,可将配制的培养基分装入试管内或三角烧瓶内。
5.包扎塞好棉花的试管和锥形瓶应盖上厚纸用绳捆扎,用记号笔注明培养基名称、组别、日期。
6.灭菌将上述培养基以1.02kg/cm2(15磅/英寸2),121.3℃, 15-20min高压蒸汽灭菌。
如因特殊情况不能及时灭菌,则应放入冰箱内暂存。
