第三章 腐蚀动力学
腐蚀动力学.

六、混合电位理论
混合电位理论在腐蚀理论中地位极为重要, 他与腐蚀动力学方程一起构成了现代腐蚀 动力学的理论基础。
混合电位理论有两个基本假设: (1)任何电化学反应都能分成两个或两 个以上的氧化反应分和还原分反应; (2)电化学反应过程中不可能有净电荷 积累。
自腐蚀电位:金属在腐蚀介质中处于自腐蚀状 态下的电位称为自腐蚀电位,简称腐蚀电位。
O2 2H2O 4e 4OH
O2 4H 4e 2H2O
(2)氢离子的还原反应
2H 2e H 2O
(3)高价金属离子的还原反应
Fe3 e Fe2
(4)氧化性阴离子的还原反应
2 Cr2O7 14H 6e 2Cr 3 7H2O
极化行为通常用极化曲线来描述。极化曲线 是表示电极电位与极化电流强度或极化电流密度i 之间关系的曲线。
曲线的倾斜程度表示 极化程度,曲线倾斜 程度越大,极化程度 越大,电极过程就越 难进行。
图1 极化曲线示意图
三、腐蚀极化图
1、 腐蚀极化图 腐蚀极化图是一种电位—电流图,它是把 表征腐蚀电池特征的阴、阳极极化曲线画 在同一张图上构成的。 腐蚀电位是一种 不可逆的非平衡 电位,需由实验 测得。
0 a
当电极上有电流通过时,电极将发生极化。
阴极极化:
e EC EC EC C
nFC nFC iC i i i [exp( ) exp( )] RT RT
0
阳极极化:
Ea Ea E a
e a
0
ia i i i [exp(
nFa
0 1
将单电极反应的电化学极化方程代入,得:
当过电位大于
第三章 电化学腐蚀热力学
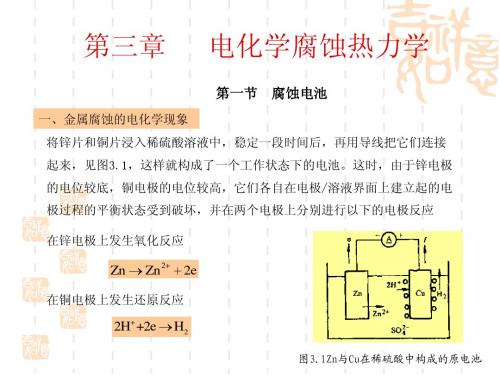
4、金属表面膜的不完整性 如果表面初生膜不完整即不致密有孔隙或破损,则孔隙下或破损处的金属相对 于完整表面来说,具有较负的电极电位,成为微电池的阳极而遭受腐蚀。 腐蚀电池与一般原电池的区别 (1)它是一种短路了的电池。 (2)工作时也产生电流,但其电能不能被利用,而是以热的形式散失掉了。
第二节 金属电化学腐蚀倾向的判断
3在忽略液界电位和金属接触电位的情况下电池的电动势e应等于阴极正极的电位减去阳极负极的电位即ceaecaacaacaee??eeeeee?电位为的金属腐蚀自发进行电位为的金属不发生自发腐蚀平衡态tpg?在化学热力学中利用反应的吉布斯函数值的大小来判断反应的方向和限度
第三章
一、金属腐蚀的电化学现象
电化学腐蚀热力学
O 2 + 2H 2 O + 4e = 4OH -
氧电极
b)氢分子在铂上夺取电子生成氢离子,其电化学反应为
1/ 2H 2 + e=H +
氢电极
氧电极和氢电极常统称为气体电极。气体电极的特点是作为电极的固体金 属或非金属材料本身并不参与电极反应,只起导电的作用。 绝对电极电位 金属浸在电解质溶液中会建立起双电层,使金属与溶液之间产生电位差。 绝对电极电位目前尚无法测得。 相对电极电位 所用的参考电极为某温度下的标准氢电极,并视其电位为零,由此而测得 的各种电极电位称为氢标电位(SHE)。还常选用甘汞电极,银-氯化银 电极,铜-硫酸铜电极等作为参考电极。
腐蚀电池一般会引起金属或金属构件的局部宏观浸蚀破坏。宏观腐蚀电池有 如下几种构成方式。 1、异种金属接触电池 当两种不同的金属或合金相互接触(或用导线连接起来)并处于某种电解质 溶液中,由于其电极电位不同,故电极电位较负的金属将不断遭受腐蚀而溶 解,而电极电位较正的金属却得到了保护。这种腐蚀称为接触腐蚀或电偶腐 蚀。两种金属的电极电位相差愈大,电偶腐蚀也愈严重。
腐蚀动力学模型

腐蚀动力学模型
腐蚀动力学模型是指基于大量实验数据和理论分析建立的一套数学模型,用于解释,
预测和优化腐蚀过程中金属材料的失效行为。
腐蚀动力学模型包括电化学腐蚀模型,应力
腐蚀开裂模型,高温氧化腐蚀模型等多种形式,但它们的基本原理都是相似的。
电化学腐蚀模型是最常见的一种腐蚀动力学模型,它是基于诸如极化曲线,极化电阻,电化学阻抗谱等电化学测试数据建立的。
在电化学腐蚀模型中,腐蚀速率是由电流密度,
金属表面的电位和溶液组成的。
通过对模型参数的优化来拟合实验数据,可以准确地预测
腐蚀速率的变化和确定最优腐蚀防护措施。
应力腐蚀开裂模型是另一种常见的腐蚀动力学模型,它是基于金属材料的裂纹成长原
理建立的。
在应力腐蚀开裂模型中,金属材料在经历应力作用时,可能出现裂纹,然后裂
纹逐渐扩展到材料内部而导致失效。
应力抑制因子,应力浓度因子和应力强度因子是应力
腐蚀开裂模型中的重要参数,它们可以用来评估材料的抗应力腐蚀开裂性能,并且指导相
关腐蚀防护技术的研发。
高温氧化腐蚀模型是一种专门用于研究高温下金属材料的氧化失效行为的腐蚀动力学
模型。
该模型基于氧化层生长的规律和反应动力学原理,考虑到高温,压力,气氛成分,
表面能等因素,可以预测金属材料在高温环境下的氧化速率,氧化层厚度和质量损失等信息,为热工装备的长期运行提供保障。
总之,腐蚀动力学模型是充满挑战又具有广阔应用前景的一个研究领域。
随着新材料
和新工艺的不断涌现,腐蚀动力学模型也将不断更新和完善,为各种工业领域的腐蚀防护
和材料设计提供更加可靠和有效的支持。
腐蚀与防护 第三章金属在某些环境中的腐蚀

dy K
y
dt y
积分得 y2 2Kt A
K为常数,K K( T )
典型(diǎnxíng)金属为:Fe,
Cu等
共五十九页
t
15
3.对数规律
金属在某些条件下,其氧化速度(sùdù)更缓慢,服从对 数关系:
dy dt
K ey
积分得e y Kt A1
取对数y ln( Kt ) A
上式表明,形成(xíngchéng)的膜很薄就会强烈阻碍氧化作用。
观缺陷内,这样局部内压力越来越大,发展(fāzhǎn)成高压,使 缺陷开裂,扩展向四周,引起钢内部出现大量微裂纹和鼓泡, 使钢强度、韧性急剧降低,产生永久脆化,最终导致设备破 坏——氢侵蚀
钢材发生氢腐蚀时,产生的是微裂纹,宏观上很难发 现,结果是突然断裂。
22
共五十九页
发生氢腐蚀必须满足(mǎnzú)的条件:
30
共五十九页
六、烟气露点腐蚀
燃烧时燃料(ránliào)中的硫分被氧化,在热装置的低温部
位与水反应生成H2SO4而产生的腐蚀称为烟气露点腐蚀或 硫酸露点腐蚀。由于这种腐蚀发生在露点以下,也称为露
点腐蚀。
烟气中的SO3来源
1.由硫酸分解而成
2.由SO2与火烟中的氧结合而成
3.由于触媒的作用,SO2被氧化成SO3
Fe2O3组成的致密的保护膜,减缓了氧化速度。 当温度超过570℃时,所形成的氧化膜由内至外依次
为:
FeO → Fe3O4 → Fe2O3 由于FeO结构疏松(shū sōnɡ),易于破裂,保护作用不强,氧化作 用反而增强。因此,采用合金化的办法,加入少量Cr, Al, Si等
元素,加入合金元素后,往往是选择氧化或生成复合氧化物联 合作用。
腐蚀动力学.

Ea K=A exp (- ) RT
当电极处于平衡状态时,
E E i i i nFAb exp( ) CO nFAf exp( ) CR RT RT
0
0 a
0 a
i 为交换电流密度
由电化学理论可知:电极电位的变化是通过 改变反应的活化能来影响反应速率,当电极 电位比平衡电位高,即 E >0,氧化反应的活 化能减小 nF E 。还原反应的活化能则增 加 nF E。
0
即
Ea E nF E
0 a
Ea E nF E
0 a
E nF E nF E 0 i nFAbCO exp( ) i exp( ) RT RT
0 a
E nF E nF E 0 i nFAf CR exp( ) i exp( ) RT RT
M吸附+mH2O M n mH2O ne
(3)水化金属离子从双电层溶液侧向溶液深处迁移
2. 阴极过程
阴极过程是指溶液中的氧化剂与金属阳极溶解后 所释放出来转移到阴极区的电子发生还原反应。
电化学腐蚀的基本条件是腐蚀电池和去极化剂 同时存在
去极化剂:能消除或抑制原电池阳极或阴极极化 的物质 电化学腐蚀的阴极去极化剂有:H+、O2、NO3-、 Cr2O72-、高价金属离子及一些易被还原的有机化合 物 (1)溶解氧的还原反应
极化是电极反应的阻力,其本质是电极过 程存在某些较慢步骤,限制了电极反应速度。
2、极化的原因及类型 根据极化产生的原因极化可分为活化极化(电 化学极化)、浓差极化和电阻极化。
(1)电化学极化
由于电子的运动速度远远大于电极反应得失电子速 度而引起的。在阴极上有过多的负电荷积累,在阳极上 有过多的正电荷积累,因而出现了电极的电化学极化。 (2)浓差极化 阳极溶解得到的金属离子,将会在阳极表面的液层 和溶液本体间建立浓度梯度,金属离子向溶液本体扩散, 如果扩散速率小于金属的溶解速率,阳极附近金属离子 浓度会升高,产生浓差极化。
3.0 金属电化学腐蚀过程动力学.

(1)电化学极化
由于电子进入阴极的 速率大于阴极电化学反应
放电的速率,即去极化剂
与电子结合的速度比电子 自外电路输到阴极表面的 速度慢,因此电子在阴极 发生积累,结果使阴极的 电极电位降低,发生阴极 的电化学极化。
M
(2)浓差极化
去极化剂向阴极表面迁移的
速度比它在阴极表面还原反应的
速度慢,或者阴极反应产物离开 阴极表面速度缓慢。这既阻碍去 极化剂向阴极表面的迁移,也阻 碍阴极表面还原反应的顺利进行, 从而使电子在阴极表面上积累, 引起阴极电位向负的方向移动, 发生阴极的浓差极化。 M
电流密度与腐蚀速率的关系也可以表示成下式:
i nFv
3.2 腐蚀速度与极化作用
处于热力学平衡状态的电极体系: 氧化还原反应速度相等,电荷交换及物质交换都处于动态平衡中 平衡电位:电极上没有电流流过,净反应速度为零,电 极上不会有额外的物质积累和电荷积累的状态。
电极上有电流通过,有净反应发生,表明电极失去了原有 的平衡状态,电极电位偏离平衡电位。
1 2 3 4 5 1 2 腐蚀电池的电极过程 腐蚀速度与极化作用 极化动力学方程 混合电位及腐蚀电位
3.1 腐蚀电池的电极过程
阳极反应过程 电池体系的电化学 反应(电池反应) 阴极反应过程 反应物质在溶液 中的传递过程
3.1 腐蚀电池的电极过程
一. 阳极过程 1 金属原子离开晶格转变为表面吸附原子 2 表面吸附原子越过双电层进行放电转变为水化阳离子 3 水化金属阳离子从双电层溶液侧向溶液深处迁移 二. 阴极过程
3.2 腐蚀速度与极化作用
四. 极化曲线
为了使电极 电位随通过的 电流强度或电 流密度的变化 情况更清晰准 确,经常利用 电位一电流图 或电位一电流 密度图。
第三章 金属电化学腐蚀的热力学原理
第三章金属电化学腐蚀的热力学原理§3-1 腐蚀原电池1.腐蚀原电池是指导致金属材料的破坏而不能对外做有用功的短路原电池。
电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2(图3-1)电极反应方程式阳极:Fe →Fe2+ +2e阴极:2H+ +2e →H2O2 + 4H+ +4e →2H2O(图3-2)电化学腐蚀发生的根本原因是由于介质中存在着平衡电极电位高于金属的平衡电极电位的氧化性物质。
2.腐蚀原电池的组成及工作过程1)组成:阳极、阴极、电解质溶液、外电路。
2)工作过程:①金属阳极溶解过程如Fe →Fe2+ +2e②溶液中氧化性物质的阴极还原过程如2H+ +2e →H2③电子和离子的定向流动过程以上三个过程是彼此独立进行的,但又是串联在一起的,因而只要其中的某个过程的进行受到阻滞,则金属的腐蚀速度就会减缓。
3.电化学腐蚀的次生过程腐蚀电池工作过程中,阳极附近金属离子(如Fe2+)浓度增大,阴极附近的pH升高,则随着离子的迁移发生如下反应:Fe2+ + 2OH- →Fe(OH)2 ↓或者进一步被氧化为:4Fe(OH)2+ O2 +2H2O →Fe(OH)3↓即铁在含氧水溶液中腐蚀的次生过程。
如图所示是铁在含氧水溶液中的腐蚀及其次生过程。
(图3-3 P22)4.腐蚀原电池的分类按照电极的大小,被破坏金属的表观形态,腐蚀电池可分为三类:1)超微电池腐蚀:金属表面上存在的超微观的(原子大小的)电化学不均一性引起,可以认为阴阳极是等电位,导致金属材料的均匀腐蚀。
2)微电池腐蚀:金属表面存在许多微小的阴极和阳极区域而形成的腐蚀电池,导致金属腐蚀。
形成原因多种多样。
3)宏电池腐蚀:腐蚀电池的尺寸较大,可用肉眼明显区分出阴阳极区域的腐蚀电池。
5.盐滴实验(例题)腐蚀现象是非常复杂的,形成的腐蚀电池也可能不是一种类型,下面以盐滴实验为例说明:在打磨过的钢片上,滴一滴含有酚酞和铁氰化钾的氯化钠溶液,可观察到液滴覆盖的整个区域上立刻出现粉红色和蓝色的小斑点,原因:发生电池反应,阳极Fe →Fe2+ +2e3Fe2+ + 2Fe(CN)62-→Fe3[Fe(CN)6]2(蓝色)阴极O2 + 2H2O + 4e →4OH-使酚酞显红色。
金属腐蚀学 -电化学腐蚀动力学PPT课件
Ca
E a
E E e,O2 /OH
e,Fe/ Fe2
0.163
13%
0.805 (0.463)
Cc
E c
E E e,O2 /OH
e,Fe/ Fe2
1.105
87%
0.805 (0.463)
24
第24页/共27页
引用及版权声明
本课件的内容涉及到引用国内外学者的专著、教材、论文、课件、报告及一些网站 等,没有逐一注释,向相关者表示感谢!
ic
n 2
H2
iC ia ic
i
ic iA ia
i
iC( EcP)= ic( EcM)- ia( EcG)
iA( EaQ)= ia( EaN)- ic( EaF)
4
第4页/共27页
实测极化曲线与理想极化曲线的比较
• 当iC= ic(体系电位达到Ec0)或iA= ia (体系电位达到Ea0)
时,进一步增加阴极极化电流或阳极极化电流,体系
7
第7页/共27页
利用腐蚀原电池自身电流变化进行极化曲线的测量
断路:Ea0、Ec0 接通:R外↓,I ↑
若不极化,R总=0,I→∞ 极化: R →0 , I → I max
I ↑,电位差减小
测定腐蚀极化图的装置
R外=0 , R溶液, R总≠0 : 实际测量 两极化曲线不会相交
理论上:交点S,对应体系的腐蚀电位Ecorr 和 腐蚀电流Icorr
流差值由外电流来补偿
阴极极化: 阳极极化:
iC= ic- ia iA= ia- ic
3
第3页/共27页
实测极化曲线与理想极化曲线的关系
E
M ia Mn+ ne
金属腐蚀学 -电化学腐蚀动力学4
电极 Ni/Ni2+ Sn/Sn2+ Pb/Pb2+ Fe/Fe3+ H2/H+ Cu/Cu2+ Cu/Cu+ Hg/Hg2+ Ag/Ag+ Pd/Pd2+ Pt/Pt+ Au/Au3+ Au/Au+
E0(SHE)/V -0.25 -0.136 -0.126 -0.036 0.0 +0.337 +0.521 +0.789 +0.799 +0.987 +1.2 +1.5 +1.7
H aH bH lg i
14
不同金属电极的影响主要反映在对aH的影响上
1)高ηH金属(aH=1.0-1.5V):Pb, Cd, Hg, Ti, Zn, Bi, Sn 控制步骤:电极上H+的迟缓放电;
2)中ηH金属(aH=0.5-1.0V):Fe, Co, Ni, Cu, Ag 控制步骤:吸附H的电化学脱附;
3)电化学步骤(快)+ 电化学脱附(慢) 4)电化学步骤(慢)+ 电化学脱附(快)
缓慢放电 机理
电化学脱 附机理
6
2. 析氢过电位
析氢电位——在一定电流密度下(i1),氢在阴极
析出的电位( E ) H /H2
氢过电位——在一定电流密度下,氢的平衡电位 Ee,H /H2
和析氢电位
E H
之间的差值
O2+2H2O+ 4e-4OH可能的反应机制:
O2+ e- O2 O2 - +H2O + e- HO2 - + OH-
HO2 - +H2O + 2e- 3OH-
27
在酸性溶液中,氧分子还原的总反应为 O2+4H++ 4e-2H2O
第三章2析氢腐蚀和吸氧腐蚀
四、氢去极化腐蚀概况
• 一般来说,电势较负金属在氧化性较弱的 酸和非氧化性酸中以及电极电位很负的金 属(如Mg)在中性或碱性溶液中的腐蚀都 属于氢去极化的腐蚀。 • 当金属中含有电位比金属电位更正的杂质 时,如果杂质上的氢过电位低,则阴极反 应过程将主要发生在杂质表面上进行,杂 质就成为阴极区。此时,杂质的氢过电位 的高低对基体金属的腐蚀有很大影响。
返回
7
析氢腐蚀的特征
• (1)浓度极化小,原因: • a. 去极化剂是带电的,半径很小的氢离子,在溶 液中有较大的迁移速度和扩散速度; • b. 去极化剂的浓度大; • C. 还原产物氢分子以气泡形式离开电极而析出, 使金属表面附近的溶液得到了较充分的搅拌作用。 • (2)与溶液的pH值关系很大。 • (3)与金属材料本身的性质和表面状态有关。 • (4)与阴极面积有关。 • (5)与温度有关。
过对 程于 是铝 属、 于不 阳锈 极钢 控等 制易 的钝 过化 程金 。属 , 腐 蚀
15
五、减小析氢腐蚀的途径
阴极控制:
1. 减少或消除金属中的有害杂质,特别是析氢
过电位小的阴极性杂质;
2. 加入氢过电位高的成分,如Hg、Zn、Pb等;
3. 加入缓蚀剂增大析氢过电位,如若丁等;
4. 降低活性阴离子成分如Cl-、S2-等的浓度。
1
3.6.1 析氢腐蚀
一、析氢腐蚀定义:
由氢离子作为去极剂的阴极过程,在其还原析 氢气的同时,消耗金属中的电子,导致腐蚀的发 生 。亦称为氢去极化腐蚀。
发生析氢腐蚀的必要条件:
腐蚀电池中的阳极金属氧化电位a必须低于氢 的析出电位 H+/H2,即a< H+/H2。
2
3
二、析氢腐蚀步骤
