【高中化学】化学中常用的去除杂质的10种方法
常见的化学除杂方法

常见的化学除杂方法化学除杂是指利用特定的化学反应或方法,去除混合物中的杂质。
常见的化学除杂方法包括离子交换、沉淀、溶剂抽提、蒸馏、吸附等。
下面将详细介绍这些方法。
离子交换是一种常见的化学除杂方法,它利用固定在其中一种材料上的离子交换树脂,将混合物中的杂质离子与树脂上的其他离子进行交换,从而实现杂质的去除。
离子交换常用于水处理、药物提纯等领域。
沉淀是通过加入适当的化学试剂,造成混合物中一些组分发生沉淀而实现除杂的方法。
沉淀方法常用于金属离子的去除。
例如,可以加入碳酸钙来沉淀出含钙的杂质。
溶剂抽提是指通过将混合物溶解在不同溶剂中,利用溶剂之间的相互不溶性,将杂质从混合物中分离出来。
溶剂抽提方法常用于有机化合物的提纯。
例如,可以将含有苯酚的混合物溶解在乙醚中,利用苯酚在乙醚中的较大溶解度,将其从混合物中分离。
蒸馏是一种通过升温和冷却使混合物中不同沸点的组分分离的方法。
蒸馏方法常用于分离液体混合物中的组分。
例如,可以利用水和酒精的不同沸点,通过蒸馏将酒精从混合物中分离出来。
吸附是一种利用物质表面对混合物中一些组分的选择性吸附能力,将其分离出来的方法。
吸附方法常用于分离气体混合物中的组分。
例如,可以利用活性炭对空气中的有机物进行吸附,将其从混合物中去除。
此外,还有一些其他的化学除杂方法,如萃取、凝固、透析等。
萃取是利用化学试剂的溶解性差异,将目标组分从混合物中萃取出来的方法。
凝固是通过降低温度使混合物中一些组分凝固而分离的方法。
透析是一种利用半透膜将溶液中的溶质与溶剂分离的方法。
总之,化学除杂方法是根据混合物的特性和杂质的性质选择合适的方法进行分离和去除。
这些方法在化学实验和工业生产中都有广泛应用,为提高产品纯度和质量起到重要作用。
【高中化学】化学物质分离提纯的常用方法总结

【高中化学】化学物质分离提纯的常用方法总结化学物质分离提纯的常用方法如下:1.结晶和重结晶:利用物质在溶液中溶解度随温度变化较大,如nacl,kno3。
2.酿造加热法:在沸点上差值小。
乙醇中(水):重新加入新制的cao稀释大部分水再酿造。
3.过滤法:溶与不溶。
4.升华法:sio2(i2)。
5.萃取法:如用ccl4来萃取i2水中的i2。
6.熔化法:fe粉(a1粉):熔化在过量的naoh溶液里过滤器拆分。
7.增加法:把杂质转化成所需要的物质:co2(co):通过热的cuo;co2(so2):通过nahco3溶液。
8.稀释法:用作除去混合气体中的气体杂质,气体杂质必须被药品稀释:n2(o2):将混合气体通过铜网稀释o2。
9.转化法:两种物质难以直接分离,加药品变得容易分离,然后再还原回去:al(oh)3,fe(oh)3:先加naoh溶液把al(oh)3溶解,过滤,除去fe(oh)3,再加酸让naalo2转化成a1(oh)3。
页面查阅:高中化学知识点总结10.纸上层析(不作要求)11.杂质气化法:并使相同物质中的杂质转变为气体而除去。
例如(括号内的物质为所除去的杂质):氧化铜(碳粉),cao(caco3)12,.洗涤法:使不溶性固体于可溶性固体分离(相对而言)如:nacl含kcl可用nacl 饱和溶液洗涤;木炭粉含糖可用水洗涤。
化学物质拆分纯化的原则:物质分离提纯的原则在进行物质的分离提纯时,选择试剂和实验措施应遵循以下四个原则:1、不减(无法导入崭新杂质)。
2、不减(不减少被提纯试剂)。
3、极易拆分。
4、易复原。
备注:1、固?固混合拆分型:灼热、热分解、升华、结晶(或重结晶)。
2、固?液混合分离型:过滤、盐析、蒸发。
3、液?液混合拆分型:提炼、分液、酿造、渗析。
4、气?气混合分离型:洗气。
常用的化学除杂试剂及除杂方法汇总

常用的化学除杂试剂及除杂方法汇总(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如小学资料、初中资料、高中资料、大学资料、文言文、中考资料、高考资料、近义词、反义词、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this store provides you with various types of practical materials, such as primary school materials, junior high school materials, senior high school materials, university materials, classical Chinese, senior high school examination materials, college entrance examination materials, synonyms, antonyms, other materials, etc. If you want to know different data formats and writing methods, please pay attention!常用的化学除杂试剂及除杂方法汇总除杂题是高中化学的常见题,它灵活多变,能够综合考察学生的解题能力。
实用文库汇编之高中化学常见物质除杂方法归纳
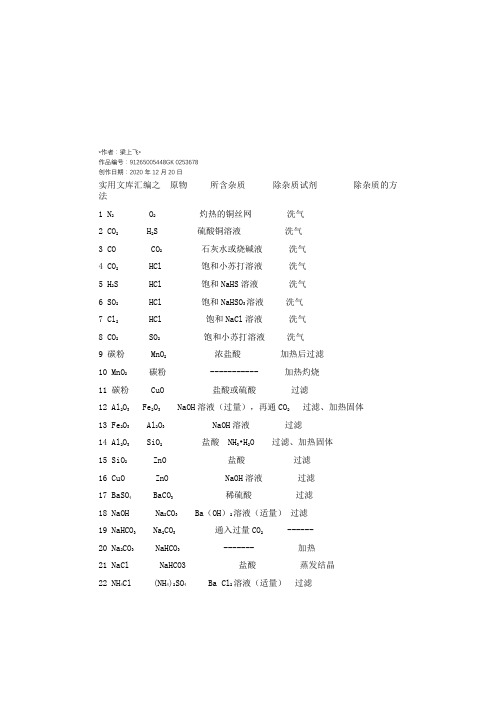
*作者:梁上飞*作品编号:91265005448GK 0253678创作日期:2020年12月20日实用文库汇编之原物所含杂质除杂质试剂除杂质的方法1 N2 O2灼热的铜丝网洗气2 CO2 H2S 硫酸铜溶液洗气3 CO CO2石灰水或烧碱液洗气4 CO2 HCl 饱和小苏打溶液洗气5 H2S HCl 饱和NaHS溶液洗气6 SO2 HCl 饱和NaHSO3溶液洗气7 Cl2 HCl 饱和NaCl溶液洗气8 CO2 SO2饱和小苏打溶液洗气9 碳粉 MnO2浓盐酸加热后过滤10 MnO2碳粉 ----------- 加热灼烧11 碳粉 CuO 盐酸或硫酸过滤12 Al2O3 Fe2O3 NaOH溶液(过量),再通CO2过滤、加热固体13 Fe2O3 Al2O3 NaOH溶液过滤14 Al2O3 SiO2盐酸 NH3•H2O 过滤、加热固体15 SiO2 ZnO 盐酸过滤16 CuO ZnO NaOH溶液过滤17 BaSO4 BaCO3稀硫酸过滤18 NaOH Na2CO3 Ba(OH)2溶液(适量)过滤19 NaHCO3 Na2CO3通入过量CO2 ------20 Na2CO3 NaHCO3 ------- 加热21 NaCl NaHCO3 盐酸蒸发结晶22 NH4Cl (NH4)2SO4 Ba Cl2溶液(适量)过滤23 FeCl3 FeCl2通入过量Cl2 -----24 FeCl3 CuCl2铁粉、Cl2过滤25 FeCl2 FeCl3铁粉过滤26 Fe(OH)3胶体 FeCl3(半透膜)渗析27 CuS FeS 稀盐酸或稀硫酸过滤28 I2 NaCl ------ 升华29 NaCl NH4Cl ------- 加热30 KNO3 NaCl 蒸馏水重结晶31 乙烯 SO2、H2O 碱石灰洗气32 乙烷乙烯溴水洗气33 溴苯溴稀NaOH溶液分液34 硝基苯 NO2稀NaOH溶液分液35 甲苯苯酚 NaOH溶液分液36 乙醛乙酸饱和Na2CO3溶液蒸馏37 乙醇水新制生石灰蒸馏38 苯酚苯 NaOH溶液、CO2分液39 乙酸乙酯乙酸饱和Na2CO3溶液分液40 溴乙烷乙醇蒸馏水分液41 肥皂甘油食盐过滤42 葡萄糖淀粉(半透膜)渗析气体除杂的原则:(1)不引入新的杂质(2)不减少被净化气体的量注意的问题:(1)需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。
化学除杂方法

化学除杂方法
化学除杂方法是指通过化学反应将杂质转化为可分离的物质,从而达到除杂的目的。
常用的化学除杂方法有:
1. 沉淀法:通过加入适当的沉淀剂,使杂质转化为沉淀,然后过滤分离。
2. 酸碱法:通过加入酸或碱,使杂质转化为可溶性盐或气体,然后分离。
3. 氧化还原法:通过加入氧化剂或还原剂,使杂质转化为气体或沉淀,然后分离。
4. 络合法:通过加入络合剂,将杂质转化为可溶性络合物,然后分离。
5. 吸附法:通过使用吸附剂吸附杂质,然后分离。
6. 分液法:通过将混合物中的液体和固体或两种不相溶的液体分开,达到除杂的目的。
7. 蒸馏法:通过将混合物中的不同组分在不同的温度下进行蒸馏,达到除杂的目的。
8. 结晶法:通过将混合物中的可溶性固体在溶剂中的溶解度随温度变化而分离,达到除杂的目的。
9. 磁铁法:通过磁铁将混合物中的磁性物质和无磁性物质分离。
10. 渗析法:通过使用半透膜袋将混有离子或分子杂质的胶体分离,达到除杂的目的。
不同的化学除杂方法适用于不同的杂质和物质,需要根据实际情况选择合适的方法。
高中化学除杂方法

高中化学除杂方法高中化学除杂方法指的是通过物理或化学手段将混合物中的杂质分离出来,使得混合物中只剩下所需的纯净物质的方法。
以下是高中化学常用的几种除杂方法:1. 过滤法过滤法是最常见的除杂方法之一。
通过将固体颗粒混合物放置在过滤纸上,溶液通过过滤纸孔隙,而固体颗粒则被滞留在过滤纸上,从而达到分离纯净溶液的目的。
常用的过滤器还有玻璃棉等。
2. 蒸馏法蒸馏法是利用液体混合物的不同沸点进行分离的方法。
混合物经过加热蒸发,再通过冷凝器冷却凝结,从而区分其沸点不同的组分。
蒸馏法适用于分离液体混合物,如酒精和水的分离等。
3. 结晶法结晶法是通过溶解物质在溶液中的溶解度差异来分离物质的方法。
将溶液加热使其溶解,然后冷却慢慢结晶,使得溶质从溶液中析出。
通过过滤或离心等方式分离出结晶物质。
4. 萃取法萃取法是利用两种不同的溶剂把混合物中的成分分离开来的方法。
通过不同成分在不同溶剂中的溶解度差异,使得目标成分可以被其中一种溶剂提取出来,从而达到分离的目的。
5. 色谱法色谱法是一种物质分离和分析的方法,通过分配系数差异分离组分。
常见的色谱方法有气相色谱、液相色谱等。
这些方法通过将需分析物质溶解在载气或溶剂上,并通过固定相与移动相的不同作用力来实现分离目的。
6. 电解法电解法是利用电流对混合物进行分解和分离的方法。
通过将混合物溶解在适当电解质溶液中,外加电流后,根据不同物质的导电性与电解过程中物质的还原反应和氧化反应,来达到分离的目的。
7. 气体吸附法气体吸附法利用吸附剂对混合物中的组分进行吸附的方法。
混合物通过吸附剂时,吸附剂与不同组分吸附能力不同,可以实现物质的分离。
除了以上几种常用的除杂方法,还有一些其他的方法,如离心、凝胶电泳、析出法等。
每种除杂方法都有其适用的场合和实验条件,教师或实验者在实验中要根据具体情况合理选择、使用这些除杂方法。
高中化学除杂方法
(1)洗气法:此法适用于除去气体有机物中的气体杂质。
如除去乙烷中的乙烯,应将混合气体通入盛有稀溴水的洗气瓶,使乙烯生成1,2-二溴乙烷留在洗气瓶中除去。
不能用通入酸性高锰酸钾溶液中洗气的方法,因为乙烯与酸性高锰酸钾溶液会发生反应生成CO2混入乙烷中。
除去乙烯中的SO2气体可将混合气体通入盛有NaOH溶液的洗气瓶洗气。
(2)转化法:将杂质转化为较高沸点或水溶性强的物质,而达到分离的目的。
如除去乙酸乙酯中少量的乙酸,不可用加入乙醇和浓硫酸使之反应而转化为乙酸乙酯的方法,因为该反应可逆,无法将乙酸彻底除去。
应加入饱和Na2CO3溶液使乙酸转化为乙酸钠溶液后用分液的方法除去。
溴苯中溶有的溴可加入NaOH溶液使溴转化为盐溶液再分液除去。
乙醇中少量的水可加入新制的生石灰将水转化为Ca(OH)2,再蒸馏可得无水乙醇。
一.常见除杂1..N 2(O 2) ——灼热的铜丝 2Cu+O 2=2CuO2.CO 2(H 2S)——用饱和NaHCO 3溶液 NaHCO 3+H 2S=NaHS+H 2O+CO 2↑3.CO 2(CO)——灼热的氧化铜 CuO+CO=Cu+CO 24.CO 2(HCl)——用饱和NaHCO 3溶液 NaHCO 3+HCl=NaCl+H 2O+CO 2↑5.H 2S(HCl)——用饱和NaHS 溶液 NaHS+HCl=NaCl+H 2S6.SO 2(HCl)——用饱和NaHSO 3溶液 NaHSO 3+HCl=NaCl+H 2O+SO 2↑7.Cl 2(HCl)——用饱和食盐水,HCl 易溶而Cl 2不溶8.MnO 2(碳粉)——1.将混合物在氧气中点燃 C+O 2=CO 22.通入灼热的氧化钙 C+CaO=Ca+CO 2↑(条件:高温)3.通入灼热的氧化铁 3C+2Fe 2O 3=3CO 2↑+ 4Fe9.碳粉(MnO 2)——加浓盐酸MnO 2+4HCl(浓)=MnCl 2+Cl 2↑+2H 2O10.C(CuO )——加稀盐酸CuO+2HCl=CuCl 2+H 2O11.Al 2O 3(Fe 2O 3)方法一:将固体混合物溶于过量的氢氧化钠溶液,过滤除去氧化铁,留下滤液。
高中化学常见的除杂方法
高中化学常见的除杂方法
除杂是化学实验中必不可少的一步,它确保化学物质的纯度,也是化学实验成功的重要保障。
高中化学实验中,可以选用以下几种除杂方法:
首先,离心分离是最常用的除杂方法,其主要原理是物质在离心的拉力作用下,由于毛细管萘的不同,从而使物质分离。
离心分离常用于悬浮液中杂质的分离,分离效果良好,但要求分离物在温度、pH 和水溶性等条件下无溶解变化。
其次,沉淀法也可用于除杂。
其基本原理是:一定的pH、温度和电导率条件下,物质的溶解度差异,当溶于水的化合物当pH、温度或电导率等条件发生变化时,分子结构相应地发生变化,当分子结构变化到某一程度时,将变为沉淀物而不再溶于水,最终形成沉淀物,从而实现杂质与所需物质的分离。
此外,凝胶过滤是也是除杂的一种方法。
u凝胶过滤是利用滤材中凝胶体系(常用蔗糖凝胶)结合与物质进行化学作用,从而进行分
离。
此方法的特点是快速、简单、清洁,且精准度高、可控性强,因
此非常适合于生物物质的除杂,同时也可以用于细胞的分离。
最后,也是最重要的一种,萃取法也是一种除杂法,即将混有欲
分离物质的混合液在不同溶剂中温和搅拌,然后把两种溶剂分开,并
用其中一种溶剂去溶解组分物,另一种则用来回收,从而实现分离物
质的除杂。
萃取手段灵活多变,简便、安全易行,常用于酸碱物质的
分离及分集其中的某一成分,以达到分离和提纯的目的。
因此,要想进行准确的化学实验,除杂是必不可少的一步,高中
的学生在实验中广泛运用。
离心分离、沉淀法、凝胶过滤以及萃取法等,都是实验中常用的除杂方法,学生在这方面一定要加强理论学习,多多练习,才能取得更好的化学实验结果。
常见高中化学气体除杂方法和规律小结
常见高中化学气体除杂方法和规律小结高中化学中,气体除杂是一个重要的实验操作和理论知识。
下面将对常见的高中化学气体除杂方法和规律进行小结。
1.热力学效应:在一定温度和压力下,气体的溶解度与温度和压力成正比。
根据这一规律,可以利用升温或降压来除去气体溶解。
2.冷凝法:将气体冷却到低温,使其在低温下形成液体或固体状态,然后通过物理的分离方法,如过滤、沉淀等,将溶液中的其他杂质除去,得到纯净的气体。
常用的冷凝法有冰浴法、冷凝管法等。
3.洗涤法:利用溶液对气体溶解度的影响来除去杂质。
将气体通入溶解着杂质的溶液中,杂质会与溶液发生化学反应,形成新的物质,然后通过物理分离方法,如沉淀、过滤等,将溶液中的杂质除去,得到纯净的气体。
常用的洗涤法有饱和盐溶液洗涤法、酸洗法、碱洗法等。
4.吸附法:利用杂质在吸附剂表面的吸附性质来除去杂质。
将气体通过吸附剂床层时,吸附剂表面的活性位点能与杂质发生吸附作用,将杂质吸附在吸附剂上,从而除去杂质,得到纯净的气体。
常用的吸附剂有活性炭、沸石、分子筛等。
5.膜分离法:利用气体分子大小和传输速率不同来分离气体。
通过选择性透过性好的膜,使其中一种或几种气体通过膜,而其他气体被阻挡在膜上,从而实现气体分离。
常用的膜分离法有渗透膜法、气体扩散法等。
6.组合应用:根据气体的物理、化学性质以及所需要纯化程度的不同,可以将以上方法进行组合应用,以达到更好的气体除杂效果。
总之,常见的高中化学气体除杂方法有热力学效应法、冷凝法、洗涤法、吸附法和膜分离法。
使用这些方法可以有效地除去气体中的杂质,得到纯净的气体。
不同的方法适用于不同的气体和杂质,需要根据实际情况进行选择和操作。
高中化学除杂方法
(1)洗气法:此法适用于除去气体有机物中的气体杂质。
如除去乙烷中的乙烯,应将混合气体通入盛有稀溴水的洗气瓶,使乙烯生成1,2-二溴乙烷留在洗气瓶中除去。
不能用通入酸性高锰酸钾溶液中洗气的方法,因为乙烯与酸性高锰酸钾溶液会发生反应生成CO2混入乙烷中。
除去乙烯中的SO2气体可将混合气体通入盛有NaOH溶液的洗气瓶洗气。
(2)转化法:将杂质转化为较高沸点或水溶性强的物质,而达到分离的目的。
如除去乙酸乙酯中少量的乙酸,不可用加入乙醇和浓硫酸使之反应而转化为乙酸乙酯的方法,因为该反应可逆,无法将乙酸彻底除去。
应加入饱和Na2CO3溶液使乙酸转化为乙酸钠溶液后用分液的方法除去。
溴苯中溶有的溴可加入NaOH溶液使溴转化为盐溶液再分液除去。
乙醇中少量的水可加入新制的生石灰将水转化为Ca(OH)2,再蒸馏可得无水乙醇。
灼3用26.SO2(HCl)——用饱和NaHSO3溶液NaHSO3+HCl=NaCl+H2O+SO2↑7.Cl2(HCl)——用饱和食盐水,HCl易溶而Cl2不溶8.MnO2(碳粉)——1.将混合物在氧气中点燃C+O2=CO22.通入灼热的氧化钙C+CaO=Ca+CO2↑(条件:高温)3.通入灼热的氧化铁3C+2Fe2O3=3CO2↑+4Fe9.碳粉(MnO2)——加浓盐酸MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O10.C(CuO)——加稀盐酸CuO+2HCl=CuCl2+H2O11.Al2O3(Fe2O3)方法一:将固体混合物溶于过量的氢氧化钠溶液,过滤除去氧化铁,留下滤液。
Al2O3+2OH-=2AlO2-+H2O向滤液中通入过量的CO2,过滤得到Al(OH)3,加热使Al(OH)3分解。
AlO2-+2H2O+CO2=Al(OH)3+HCO3-2Al(OH)3====Al2O3+3H2O方法二:将固体混合物溶于过量的盐酸溶液中,是混合物完全溶解。
Al2O3+6H+=2Al3++3H2OFe2O3+6H+=2Fe3++3H2O2、加入过量NaOH溶液,过滤除去沉淀Fe(OH)3,Fe3++3OH-=Fe(OH)3Al3++4OH-=AlO-+2H2O3、向滤液中通入过量的CO2,过滤得到Al(OH)3,加热使Al(OH)3分解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【高中化学】化学中常用的去除杂质的10种方法
化学实验中同学们在去杂质的时候有时候总是去除不干净,编辑们整理了去杂质的的10个方法。
希望对你有帮助。
1.杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用酚钠易溶于水,使之与苯分开。
欲除去na2co3中的nahco3可用加热的方法。
2.稀释冲洗法:欲除去二氧化碳中混有的少量氯化氢和水,可以并使混合气体先通过饱和状态碳酸氢钠的溶液后,再通过浓硫酸。
3.沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入过量铁粉,待充分反应后,过滤除去不溶物,达到目的。
4.冷却升华法:欲除去碘中的沙子,可以使用此法。
5.溶剂萃取法:欲除去水中含有的少量溴,可采用此法。
6.溶液结晶法(结晶和重结晶):欲除去硝酸钠溶液中少量的氯化钠,可以利用二者的溶解度相同,减少溶液温度,并使硝酸钠结晶划出,获得硝酸钠纯晶。
7.分馏蒸馏法:欲除去乙醚中少量的酒精,可采用多次蒸馏的方法。
8.分液法:欲将密度相同且又互不相溶的液体混合物拆分,可以使用此法,例如将苯和水拆分。
9.渗析法:欲除去胶体中的离子,可采用此法。
如除去氢氧化铁胶体中的氯离子。
10.综合法:欲除去某物质中的杂质,可以使用以上各种方法或多种方法综合运用。
