苏教版高中化学选修六7.1《硫酸亚铁铵的制备》同步检测
硫酸亚铁铵的制备与纯度检验

硫酸亚铁铵的制备与纯度检验
硫酸亚铁铵(FeSO4(NH4)2·6H2O)是一种常用的实验室试剂,它可以通过以下简单的实验制备:
(1)将过量的铁粉(Fe)加入稀硫酸中,产生铁酸铁和二氧化硫的反应:
Fe + H2SO4 → FeSO4 + H2↑
其中,生成的 FeSO4 即为硫酸亚铁,而 Fe2(SO4)3 可以被 NH4OH 还原为 Fe(OH)2,进而形成FeSO4(NH4)2·6H2O。
(2)将硫酸亚铁溶液(约 10 g/L)滴加进热浓氨水中,直至析出 Fe(OH)2 沉淀完全溶解,形成无色透明的溶液。
(3)将溶液转移至蒸发皿中,加热蒸干,形成硫酸亚铁铵的晶体。
2、纯度检验
为了验证所制备的硫酸亚铁铵的纯度,我们可以进行以下测试:
(1)鉴定化合物的外观和颜色:硫酸亚铁铵应该是无色的晶体,如果出现任何其他颜色,可能表示存在杂质。
(2)测定水分含量:硫酸亚铁铵的晶体应该很干燥,最好含水量小于 1.5%。
可以在
低温干燥箱中烘干样品,并比较干燥前后的重量变化。
(3)测试悬浮物:将硫酸亚铁铵加入水中,若有悬浮物,则说明存在其他不溶于水的物质。
(4)进行溶解度测试:硫酸亚铁铵应该可以很容易地溶解在水中,如果出现困难,则表示所制备的化合物可能并不纯净。
(5)用化学方法确定硫酸亚铁铵的含量:可以通过沉淀法或氧化还原法测定硫酸亚铁铵的实际含量。
例如,使用氧化还原反应中的助溶剂氯化铁,把硫酸亚铁铵还原为 Fe2+,然后通过催化剂促进 Cu2+ 和 Fe2+ 的氧化,得出硫酸亚铁铵的含量。
总之,合理的硫酸亚铁铵制备和纯度检验,可以确保所用的实验试剂质量稳定,结果
准确可靠。
高中化学7.1硫酸亚铁铵的制备教案1苏教版选修6

硫酸亚铁铵的制备硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2·6H2O,商品名为摩尔盐。
硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后即比较稳定。
已知三种盐的溶解度(单位为g/100g水)如下表:某化学兴趣小组利用铁屑、稀硫酸和硫酸铵制备硫酸亚铁铵,具体实验步骤如下:1.Fe屑的处理和称量【操作】称取约5g铁屑,放入锥形瓶,加入15 mL10%Na2CO3溶液,小火加热10 min以除去Fe屑表面的油污,将剩余的碱液倒出,置于回收瓶中,用蒸馏水把Fe冲洗干净,干燥后称其质量,记为m1(Fe),备用。
【问题】Na2CO3溶液用以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是。
2.FeSO4的制备【操作】将称量好的Fe屑放入锥形瓶中,加入25 mL 3mol/L H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3mol/L H2SO4,趁热过滤,将滤液转移至蒸发皿中。
【问题】①反应的化学方程式为,②水浴加热过程中要注意往锥形瓶中补充适量水分,理由是。
③制备FeSO4溶液时,用右图装置趁热过滤是。
该操作中所需的主要玻璃仪器有。
④趁热过滤的目的是。
⑤反应结束时再加入1 mL 3mol/L H2SO4的作用是;⑥在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是。
3.(NH4)2SO4·FeSO4·6HO的制备【操作】称取一定量的(NH4)2SO4并将其加入上面实验的蒸发皿中,缓缓加热,浓缩。
放置冷却,得到硫酸亚铁铵的晶体。
抽滤后,用无水乙醇洗涤晶体,除去其表面的水分,观察生成的硫酸亚铁铵的颜色和状态。
称量为m2g。
【问题】①称取的(NH4)2SO4质量为。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是。
③加热、浓缩溶液时,不浓缩至干的理由是。
④实验时,使摩尔盐结晶可以采取的方法是。
高中化学 专题7 物质的制备与合成 7.1 硫酸亚铁铵的制备课件 苏教版选修6

课题1 硫酸亚铁铵的制备
(NH4)2SO4·FeSO4·6H2O
一硫酸亚铁铵的性质
物理性质:浅绿色晶体,易溶于水,不溶于乙醇,溶 解度比FeSO4 (NH4)2SO4均小。商品名为:摩尔盐
二硫酸亚铁铵的制备
1.实验原理 Fe + H2SO4 = FeSO4 + H2↑ FeSO4 + (NH4)2SO4 + 6H2O=FeSO4·(NH4)2SO4·6H2O↓
蒸干时溶液中的杂质离子会被带入晶体中 蒸干时晶体会受热分解或氧化
思考6:得到的(NH4)2SO4·FeSO4·6H2O晶体,用无 水酒精洗涤2~3次,用酒精除去什么杂质?用酒精 洗的好处是什么?能用蒸馏水或母液洗晶体吗?
利用乙醇除去Fe3+离子,于水,用蒸馏水洗会损耗部分 产品,这种操作会导致计算实际产率时出现偏差。
4.产率计算
铁屑的质量/g 硫酸亚铁铵的质量/g 理论产量 实际产量
4.2022g 28.2022g
产率%
思考7:七嘴八舌讨论,为什么实际产率比理论产率 低这么多?
当溶液中不再有气体产生时,反应基本结束,为防 止Fe2+水解及被氧化,加l mL H2SO4溶液;为防止 因冷却使FeSO4晶体析出而造成损失,采用趁热过 滤。
3.实验流程
思考4:配置硫酸铵饱和溶液时往往需要将溶液煮 沸,这是为什么?
除去溶解在水中的氧气,防止和硫酸亚铁溶液混合 时氧化亚铁离子
思考5:该实验中,要得到摩尔盐晶体,应加热到 溶液表面出现晶膜时,停止加热。为什么不能将溶 液蒸干?
1mol/L碳酸钠溶液浸泡→倾析法分离 (煮沸)
→洗涤→晾干
倾析法对沉淀的要求:
精选2019-2020年高中选修6 实验化学化学课题1 硫酸亚铁铵的制备苏教版习题精选五十八
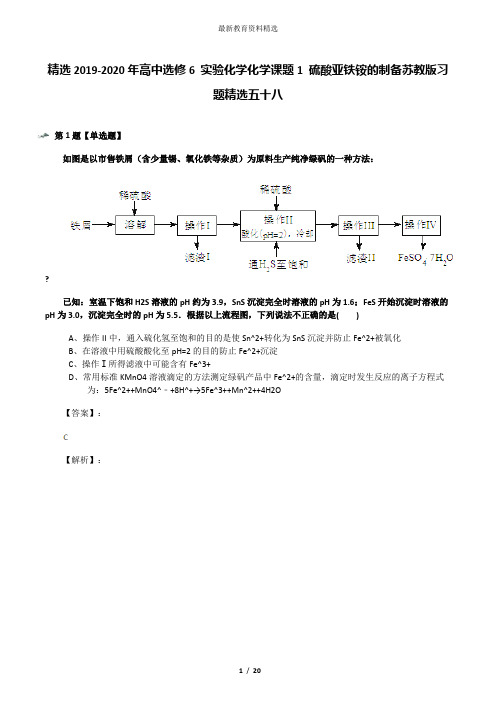
精选2019-2020年高中选修6 实验化学化学课题1 硫酸亚铁铵的制备苏教版习题精选五十八第1题【单选题】如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:?已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )A、操作II中,通入硫化氢至饱和的目的是使Sn^2+转化为SnS沉淀并防止Fe^2+被氧化B、在溶液中用硫酸酸化至pH=2的目的防止Fe^2+沉淀C、操作Ⅰ所得滤液中可能含有Fe^3+D、常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe^2+的含量,滴定时发生反应的离子方程式为:5Fe^2++MnO4^﹣+8H^+→5Fe^3++Mn^2++4H2O【答案】:【解析】:第2题【单选题】下列实验装置能达到实验目的是( )A、海水蒸馏B、钾在空气中的燃烧C、测定中和热D、牺牲阳极的阴极保护法【答案】:【解析】:第3题【单选题】用下列实验装置室温下进行相应实验,能达到实验目的是( )A、验证浓硫酸具有强氧化性B、制取干燥的NH3C、干燥、收集并吸收多余SO2D、验证乙炔的还原性【答案】:【解析】:第4题【单选题】下列实验操作、实验现象和实验结论均正确的是( )A、AB、BC、CD、D【答案】:【解析】:第5题【单选题】A、AB、BC、CD、D【答案】:【解析】:第6题【单选题】利用下列实验装置能完成相应实验的是( )A、装置①测定化学反应速率B、装置②制取并吸收HClC、装置③量取8.5mL的稀硫酸D、装置④模拟铁的腐蚀【答案】:【解析】:第7题【单选题】学习化学过程中需要经常做实验,下列实验操作正确的是( )A、闻气味B、倾倒液体C、取粉末D、过滤【答案】:【解析】:第8题【单选题】下列实验操作能够达到实验目的是( )A、实验室采用图①所示装置收集SO2B、用图②所示装置,分离CCl4萃取I2水后的有机层和水层C、除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤D、称取0.40gNaOH,放入100mL容量瓶中,配制0.10mol?L^﹣^1的NaOH溶液【答案】:【解析】:第9题【单选题】A、AB、BC、CD、D【答案】:【解析】:第10题【多选题】A、AB、BC、CD、D【答案】:【解析】:第11题【实验探究题】铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水.I、还原沉淀法是处理含Cr2O4^2^﹣和CrO7^2^﹣工业废水的一种常用方法,其工艺流程如下:其中第①步存在平衡:2CrO4^2^﹣(黄色)+2H^+?Cr2O7^2^﹣(橙色)+H2O若平衡体系中,pH=0时溶液显______.以石墨为电极,电解Na2CrO4制备Na2Cr2O7的装置如图1所示.a极的名称是______;b极直接相连一极的反应式为______.第②步反应的离子方程式:______.第②步反应后的溶液加入一定量烧碱,若溶液中c(Fe^3^+)=2.0×10^﹣^12mol?L^﹣^1 ,则溶液中c(Cr^3^+)=______mol?L^﹣^1 .(已知Ksp[Fe(OH)3]=4.0×10^﹣^38 mol?L^﹣^1 ,Ksp[Cr (OH)3]=6.0×10^﹣^31 mol?L^﹣^1).II、探究CrO3的强氧化性和热稳定性CrO3遇有机物(如酒精)时猛烈反应以至着火.若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3 .补充并配平下列反应式:aCrO3+bC2H5OH+cH2SO4=dCr2(SO4)3+eCH3COOH+fRb:c:f=______.CrO3的热稳定性差,加热时逐步分解,其固定残留率随温度的变化如图2所示.B点时生成固体的化学式为______.(固体残留率=有误×100%)【答案】:无【解析】:第12题【实验探究题】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。
高中化学 7.1 硫酸亚铁铵的制备教案1 苏教版选修6

硫酸亚铁铵的制备硫酸亚铁铵的化学式为(NH 4)2Fe(SO 4)2·6H 2O ,商品名为摩尔盐。
硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后即比较稳定。
已知三种盐的溶解度(单位为g/100g 水)如下表:某化学兴趣小组利用铁屑、稀硫酸和硫酸铵制备硫酸亚铁铵,具体实验步骤如下:1.Fe 屑的处理和称量【操作】称取约5g 铁屑,放入锥形瓶,加入15 mL10%Na 2CO 3溶液,小火加热10 min 以除去Fe 屑表面的油污,将剩余的碱液倒出,置于回收瓶中,用蒸馏水把Fe 冲洗干净,干燥后称其质量,记为m 1(Fe),备用。
【问题】Na 2CO 3溶液用以除油污的原因是 ,加热更有利于提高去污能力的原因是 ,将剩余的碱液倒掉的方法是 。
2.FeSO 4的制备【操作】将称量好的Fe 屑放入锥形瓶中,加入25 mL 3mol /L H 2SO 4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3mol /L H 2SO 4,趁热过滤,将滤液转移至蒸发皿中。
【问题】①反应的化学方程式为 , ②水浴加热过程中要注意往锥形瓶中补充适量水分,理由是。
③制备FeSO 4溶液时,用右图装置趁热过滤是 。
该操作中所需的主要玻璃仪器有 。
④趁热过滤的目的是 。
⑤反应结束时再加入1 mL 3mol /L H 2SO 4的作用是 ; ⑥在制备FeSO 4过程中常会出现黄色现象,避免这种现象的有效方法是 。
3.(NH 4)2SO 4·FeSO 4·6HO 的制备【操作】称取一定量的(NH 4)2SO 4并将其加入上面实验的蒸发皿中,缓缓加热,浓缩。
放置冷却,得到硫酸亚铁铵的晶体。
抽滤后,用无水乙醇洗涤晶体,除去其表面的水分,观察生成的硫酸亚铁铵的颜色和状态。
称量为m 2g 。
【问题】①称取的(NH 4)2SO 4质量为 。
抽气②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是。
硫酸亚铁铵的制备及组成测定

硫酸亚铁铵的制备及组成测定硫酸亚铁铵的制备及组成测定一、实验目的1.学习制备复盐(NH4)2SO4·FeSO4·6H2O的制备方法和实验条件。
2.熟练掌握水浴加热、过滤、蒸发、结晶等基本无机制备操作。
3.学习制备无机化合物有关投料、产率、产品限量分析等的计算方法。
4.掌握测定硫酸亚铁铵中各组分的的原理与方法。
二、实验原理1.硫酸亚铁铵的制备硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O)商品名为莫尔盐,为浅蓝绿色单斜晶体。
一般亚铁盐在空气中易被氧化,而硫酸亚铁铵在空气中比一般亚铁盐要稳定,不易被氧化,并且价格低,制造工艺简单,容易得到较纯净的晶体,因此应用广泛。
在定量分析中常用来配制亚铁离子的标准溶液。
和其他复盐一样,(NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分FeSO4或(NH4)2SO4的溶解度都要小。
利用这一特点,可通过蒸发浓缩FeSO4与(NH4)2SO4溶于水所制得的浓混合溶液制取硫酸亚铁铵晶体。
三种盐的溶解度数据列于表1。
表1 三种盐的溶解度(单位为g /100g H 2O)本实验先将铁屑溶于稀硫酸生成硫酸亚铁溶液:Fe+H 2SO 4 FeSO 4+H 2↑将溶液浓缩后冷却至室温,可得晶体FeSO 4·7H 2O (俗称绿矾)。
再将等摩尔的硫酸亚铁和硫酸铵溶液混合,并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵晶体,它的氧化还原稳定性比一般的亚铁盐高,常作为亚铁试剂使用。
FeSO 4+(NH 4)2SO 4+6H 2O(NH 4)2SO 4·FeSO 4·6H 2O用目视比色法可估计产品中所含杂质Fe 3+的量。
Fe 3+与SCN -能生成红色物质[Fe (SCN )]2+,温度/℃FeSO 4 (NH 4)2SO 4 (NH 4)2SO 4·FeSO 4·6H 2O1020.0 73 17.2 2026.5 75.4 21.6 30 32.9 78 28.1红色深浅与Fe3+相关。
【测控设计】2021-2022学年高二化学苏教版选修6优化作业:7.1 硫酸亚铁铵的制备
专题7物质的制备与合成课题1硫酸亚铁铵的制备一、非标准1.用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常消灭漏斗颈下端管口堵塞的现象,可实行的措施是()A.将一般漏斗改为分液漏斗B.将漏斗预热,进行热过滤C.增加滤纸层数D.向溶液中加一些稀硫酸解析:反应后的溶液是几乎饱和的硫酸亚铁溶液,进行过滤时常消灭漏斗颈下端管口堵塞的现象,是由于滤液在漏斗颈下端遇冷析出晶体造成的,可实行的措施是将漏斗预热,进行热过滤。
答案:B2.下列溶液有时呈黄色,其中由于久置时被空气中氧气氧化而变色的是()A.浓硝酸B.硫酸亚铁C.高锰酸钾D.工业盐酸解析:有的化学试剂久置在空气中会发生颜色的变化,其变色的缘由是多方面的。
如久置的浓硝酸显黄色,是由于发生分解反应:4HNO34NO2↑+O2↑+2H2O,浓硝酸里溶解了红棕色的NO2而呈黄色。
久置的KMnO4溶液也不格外稳定,在酸性溶液中缓慢地分解,使溶液显黄色:4Mn O4-+4H+4MnO2+3O2↑+2H2O。
工业盐酸呈黄色,是由于含有Fe3+杂质。
硫酸亚铁在空气里,Fe2+被氧气氧化为Fe3+,而使溶液显黄色:4Fe2++4H++O24Fe3++2H2O。
答案:B3.将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,再冷却结晶,最先析出的晶体是()A.硫酸亚铁B.硫酸铵C.硫酸亚铁铵D.硫酸亚铁和硫酸铵的混合晶体解析:由于复盐在水中的溶解度比组成它的每一种盐都要小,因此,将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,冷却结晶,最先析出的晶体是硫酸亚铁铵。
答案:C4.用倾析法进行分别适用于()A.沉淀的结晶颗粒较小B.沉淀的结晶颗粒较大C.沉淀不简洁沉降D.沉淀的质量较小解析:当沉淀的结晶颗粒较大,静置后简洁沉降至容器底部时,常用倾析法(也称倾注法)进行分别或洗涤。
答案:B5.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常实行的措施是()A.硫酸过量B.铁屑过量C.硫酸和铁的物质的量之比为1∶1D.需要用浓硫酸解析:铁屑过量可以还原氧化生成的Fe3+,Fe + 2Fe3+3Fe2+,保证Fe2+稳定、纯洁地存在,削减产物中的Fe3+杂质。
高二化学硫酸亚铁铵的制备同步检测试题及答案
高二化学硫酸亚铁铵的制备同步检测试题及答案1.(2011年宿迁高二检测)用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常出现漏斗颈下端管口堵塞的现象,可采取的措施是( ) A.将普通漏斗改为分液漏斗 B.将漏斗预热,进行热过滤 C.增加滤纸层数 D.向溶液中加一些稀硫酸解析:选B。
反应后的溶液是几乎饱和的硫酸亚铁溶液,进行过滤时常出现漏斗颈下端管口堵塞的现象,是由于滤液在漏斗颈下端遇冷析出晶体造成的,可采取的措施是将漏斗预热,进行热过滤。
2.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( ) A.硫酸过量 B.铁屑过量 C.硫酸和铁的物质的量之比为1∶1 D.需要用浓硫酸解析:选B。
铁屑过量可以还原氧化生成的Fe3+,Fe+2Fe3+===3Fe2+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质。
3.用倾析法进行分离适用于( ) A.沉淀的结晶颗粒较小 B.沉淀的结晶颗粒较大 C.沉淀不容易沉降 D.沉淀的质量较小解析:选B。
当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)进行分离或洗涤。
4.(2011年徐州高二检测)在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( ) A.C�D�D�D�D�D�D→在空气中点燃CO�D�D→CuO△CO2�D�D�D�D�D�D→NaOH溶液Na2CO3B.Cu�D�D�D�D→AgNO3Cu(NO3)2溶液�D�D�D�D→NaOH溶液Cu(OH)2 C.Fe�D�D�D→点燃Fe2O3�D�D�D�D�D�D→H2SO4溶液Fe2(SO4)3溶液 D.CaO�D�D�D�D→H2OCa(OH)2溶液�D�D�D�D�D�D�D→Na2CO3溶液NaOH溶液解析:选D。
A在操作上不可行,经济上也不合理;B在经济上不合理;C中Fe在氧气中燃烧的产物是Fe3O4,而不是Fe2O3,理论上不正确。
2019-2020年高中选修6 实验化学化学专题七 物质的制备与合成课题1 硫酸亚铁铵的制备苏教版拔高训练六十五
B、X是SO2,Y是KOH浓溶液
C、X是CO2,Y是稀盐酸
D、X是HCl,Y是NaCl稀溶液
【答案】:
【解析】:
下列实验操作正确且能达到相应实验目的的是( )
A、 称量NaOH固体
B、 配制100mL0.1mol/L的H2SO4溶液
C、 家里的食用胡麻油不小心混入了大量的水采取的分离方法
B、检验溶液中是否含有SO4^2^﹣,依次滴入Ba(NO3)2溶液和稀盐酸
C、配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
D、配制AlCl3溶液时,将AlCl3溶解在较浓的盐酸中,再用水稀释到所需浓度
【答案】:
【解析】:
A、A
B、B
C、C
D、D
【答案】:
【解析】:
实验室制备乙酸丁酯的叙述正确的是( )
【答案】:
【解析】:
关于下列各装置图的叙述中,正确的是( )
A、实验室用装置①探究NH4Cl的热稳定性
B、装置②用于证明氨气极易溶于水
C、装置③用于石油的分馏
D、装置④用于乙酸乙酯的制备
【答案】:
【解析】:
A、A
B、B
C、C
D、D
【答案】:
【解析】:
下列与实验相关的叙述正确的是( )
A、用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出
D、 提纯Fe(OH)3胶体
【答案】:
【解析】:
下列离子检验的推理正确的是( )
A、向某溶液中加盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中有CO3^2^﹣
B、向某溶液中加石蕊试液,溶液变蓝,则原溶液中溶质是碱
C、向某溶液中加氢氧化钠溶液,生成蓝色沉淀,则原溶液中有Cu^2+
2020高考苏教版化学复习:硫酸亚铁铵的制备(练习附答案解析)
课题1硫酸亚铁铵的制备1.硫酸亚铁铵,商品名称为摩尔盐,其化学式为,色晶体。
是一种盐。
溶于水,溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原因是。
写出反应式根据硫酸亚铁铵的制备知识要点完成下列空格⑴Na2CO3溶液可以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是。
⑵将称量好的Fe屑放入锥形瓶中,加入25 mL 3 mol·L-1 H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3 mol·L-1 H2SO4,趁热过滤,将滤液转移至中。
趁热过滤的目的是。
反应结束时再加入1 mL 3 mol·L-1 H2SO4的作用是。
在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是。
⑶(NH4)2SO4与FeSO4混合后,缓缓加热,浓缩至。
浓缩时能否蒸发至干,为什么?不能。
①蒸干时溶液中的杂质离子会被带入晶体中,②。
制得的晶体过滤后用洗涤而不用蒸馏水的原因是①减少晶体在洗涤时的溶解,②。
⑷加热浓缩硫酸亚铁铵溶液的过程中,可能形成Fe3+,为什么?常见问题:①制备FeSO4时,硫酸为什么要过量___________________________________________________。
②制备(NH4)2SO4·FeSO4·6H2O 时,为什么要采用水浴加热浓缩______________________________。
③如何计算(NH4)2SO4的质量和硫酸亚铁铵的理论产量及产率_______________________________。
④如何制备不含氧的蒸馏水?为什么配制硫酸亚铁铵试液时要用不含氧的蒸馏水________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精 品 试 卷 推荐下载 高中化学学习材料 (灿若寒星**整理制作) 7.1《硫酸亚铁铵的制备》同步检测 1.(2011年宿迁高二检测)用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常出现漏斗颈下端管口堵塞的现象,可采取的措施是( ) A.将普通漏斗改为分液漏斗 B.将漏斗预热,进行热过滤 C.增加滤纸层数 D.向溶液中加一些稀硫酸 解析:选B。反应后的溶液是几乎饱和的硫酸亚铁溶液,进行过滤时常出现漏斗颈下端管口堵塞的现象,是由于滤液在漏斗颈下端遇冷析出晶体造成的,可采取的措施是将漏斗预热,进行热过滤。 2.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( ) A.硫酸过量 B.铁屑过量 C.硫酸和铁的物质的量之比为1∶1 D.需要用浓硫酸 解析:选B。铁屑过量可以还原氧化生成的Fe3+,Fe+2Fe3+===3Fe2+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质。 3.用倾析法进行分离适用于( ) A.沉淀的结晶颗粒较小 B.沉淀的结晶颗粒较大 C.沉淀不容易沉降 D.沉淀的质量较小 解析:选B。当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)进行分离或洗涤。 4.(2011年徐州高二检测)在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.CCO――→CuO△CO2Na2CO3 B.CuCu(NO3)2溶液Cu(OH)2 C.FeFe2O3Fe2(SO4)3溶液 D.CaOCa(OH)2溶液NaOH溶液 精 品 试 卷 推荐下载 解析:选D。A在操作上不可行,经济上也不合理;B在经济上不合理;C中Fe在氧气中燃烧的产物是Fe3O4,而不
是Fe2O3,理论上不正确。 5.硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,商品名为摩尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了。三种盐的溶解度(单位为g/100 g水)如下表: 温度/℃ 10 20 30 40 50 70 (NH4)2SO4 73.0 75.4 78.0 81.0 84.5 91.9 FeSO4·7H2O 40.0 48.0 60.0 73.3 - - (NH4)2SO4·FeSO4·6H2
O 18.1 21.2 24.5 27.9 - -
Ⅰ.实验室制取少量摩尔盐的流程如下:
试回答下列问题: (1)步骤3中进行“趁热快速过滤”,可采取的措施是 ________________________________________________________________________ _______________________________________________________________(写出1种), 趁热过滤的目的是 ________________________________________________________________________ ________________________________________________________________________; (2)步骤4中加热浓缩至 ________________________________________________________________________时为止; (3)步骤4中析出的晶体不含(NH4)2SO4、FeSO4的原因是 ________________________________________________________________________, 理论上制得的摩尔盐的质量为________。 Ⅱ.称取两份质量均为1.96 g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。 (1)滴定时,将KMnO4酸性溶液装在________(填“酸式”或“碱式”)滴定管。已知MnO-4被还原为Mn2+,试写出该滴定过程中的离子方程式: ________________________________________________________________________; (2)判断该反应到达滴定终点的现象为 ________________________________________________________________________ ________________________________________________________________________; 精 品 试 卷 推荐下载 (3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为________mol·L-1。
解析:以物质的制备为背景材料的实验题对实验能力的要求是很弹性的,可以问最简单的实验仪器使用、基本操作,也可以提高到实验步骤的分析能力,还可以灵活考查实验方法的灵活运用能力,甚至可以渗透实验方案设计。由于试题情景的绝对真实性,所涉及的反应原理、实验操作方法一般都是常用的、实用的,仪器也是比较常见的。所以应该把精力放在理解透基本的实验方法、实验原理上。如本题因为FeSO4在低温时溶解度较小,应采用趁热过滤,如果不趁热过滤就会有FeSO4·7H2O晶体析出,过滤时会出现漏斗堵塞现象。 答案:Ⅰ.(1)将漏斗置于沸水中预热后进行快速热过滤 防止FeSO4·7H2O晶体析出 (2)液体表面出现晶膜 (3)在相同温度下,(NH4)2SO4·FeSO4·6H2O的溶解度比(NH4)2SO4、FeSO4都要小 7(m1-m2) g Ⅱ.(1)酸式 5Fe2++MnO-4+8H+===5Fe3++Mn2++4H2O (2)当最后一滴KMnO4酸性溶液滴下时,溶液变成紫色,30 s内不褪色,说明达到滴定终点 (3)1/V
1.(2011年漳州高二检测)下列溶液有时呈黄色,其中由于久置时被空气中氧气氧化而变色的是( ) A.浓硝酸 B.硫酸亚铁 C.高锰酸钾 D.工业盐酸 解析:选B。有的化学试剂久置在空气中会发生颜色的变化,其变色的原因是多方面的。如久置的浓硝酸显黄色,是因为发生分解反应:4HNO3===4NO2↑+O2↑+2H2O,浓硝酸里溶解了红棕色的NO2而呈黄色。久置的KMnO4溶液也不十分稳定,在酸性溶液中缓慢地分解,使溶液显黄色:4MnO-4+4H+===4MnO2+3O2↑+2H2O。工业盐酸呈黄色,是因为含有Fe3+杂质。硫酸亚铁在空气里,Fe2+被氧气氧化为Fe3+,而使溶液显黄色:4Fe2++4H++O2===4Fe3++2H2O。 2.工业上常用过量废铁屑与硫酸反应产生硫酸亚铁,铁屑中常含有下列杂质,其中对生成及产品纯度影响不大的是( ) A.油污 B.铁锈 C.锌 D.硫化物 解析:选B。铁屑中含有油污会阻碍硫酸与铁的接触而影响反应速率;铁屑中含有铁锈,铁锈溶于硫酸生成硫酸铁后,Fe+2Fe3+===3Fe2+,因此,铁屑中含有铁锈对生成及产品纯度影响不大,铁屑中含有锌,锌与硫酸反应生成硫酸锌影响产品纯度;铁屑中含有硫化物(FeS),与硫酸反应生成有毒的硫化氢气体。 3.设计实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散)。下列气体的制取宜使用该装置的是( ) A.用二氧化锰(粉末)与双氧水制氧气 B.用锌粒与稀硫酸制氢气 C.用硫化亚铁(块状)与盐酸制硫化氢 D. 用碳酸钙(块状)与稀硫酸制二氧化碳 解析:选B。选项A中二氧化锰为粉末状物质,关闭K时,反应不能停止;选项B中Zn为颗粒状物质,关闭K可以精 品 试 卷 推荐下载 使试管内的气体压强增大,能达到反应停止;选项C中与选项B相似,但H2S有毒,对空气造成污染;选项D中CaCO3
与H2SO4反应生成CaSO4,由于CaSO4微溶于水,附在CaCO3表面,使反应停止,达不到制取CO2的目的。 4.(2011年无锡高二检测)下列实验中,仪器的下端必须插入液面以下的是( ) ①制备氢气的简易装置中用来加稀硫酸的长颈漏斗 ②实验室用MnO2和浓盐酸制备氯气装置中的分液漏斗 ③用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2操作中的胶头滴管 ④将氯气溶于水制取氯水时的导气管 ⑤蒸馏石油时的温度计 A.③⑤ B.①③④ C.②④⑤ D.全部 解析:选B。制H2时,长颈漏斗必须插入液面以下,以避免H2逸出,①正确;因为分液漏斗上有塞子,所以分液漏斗不必插入液面以下,②不正确;为了避免滴加液体时带入O2,制取Fe(OH)2时,胶头滴管应插入液面以下,③正确;Cl2在水中的溶解度不大,不会引起倒吸,且Cl2有毒,不能排放到空气中,④正确;蒸馏时,温度计的水银球应位于蒸馏烧瓶支管口处,⑤不正确。 5.用下列装置制取并收集 NO2气体,其中最合理的是( )
解析:选C。铜和浓硝酸反应的产物是二氧化氮,其密度比空气大,因此利用排空气法用封闭装置收集二氧化氮气体时,导气管应该长进短出,这样有利于把试管中的空气排尽。 6.(2011年泉州高二检测)将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,再冷却结晶,最先析出的晶体是( ) A.硫酸亚铁 B.硫酸铵 C.硫酸亚铁铵 D.硫酸亚铁和硫酸铵的混合晶体 解析:选C。由于复盐在水中的溶解度比组成它的每一种盐都要小,因此,将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,冷却结晶,最先析出的晶体是硫酸亚铁铵。 7.如图装置可用于( )
