2016广东省高考化学二轮复习专题学案:专题11 条件控制(温度、压强、浓度、调pH值)
广东省高考化学二轮复习 专题15 实验方案设计的变量控制课件

加入氯化铜稀溶液
且铝表面析出一些红色固体
4 取加一 入小硫片酸铝铜片稀于溶试液管中,一直没有明显的变化
你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1 、0.5 mol·L-1的原因 保持两溶液中氢离子浓度相同, 是探究氯离子和硫酸根离子对反应的影. 响。
【自我检测】1
(2014年广州市调研测试题33节选)某研究小组为了 研究不同条件下金属铝粉在过量稀硫酸中的溶解性能, 设计如下实验。已知:c(H2SO4)=4.5 mol·L-1,反应均 需要搅拌60min。
实验 编号
实验过程
实验现象
取一小片铝片于试管中,30秒时开始有少量气泡,然后产
1 加入1.0 mol·L-1的盐酸 生气泡的速率加快,最后铝片消
2 mL
失
取一小片铝片于试管中,55秒时开始有少量气泡,然后产
2 加入0.5 mol·L-1的硫酸 生气泡的速率加快,最后铝片消
2 mL
失
3
取一小片铝片于试管中,3分钟左右表面产生少量气泡,
(1)实验①和②的目的是其它条件不变,温度对稀
。
硫酸溶解铝粉量的影响。
为了获得铝粉溶解量,反应60min后剩余铝粉的质量
(2)实验①和③是为了研究硫酸的浓度对该反应的
影响,则t12=0 ℃,V1=20 mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反
应的影响,则t2=20 ℃,V2=15
mL。
⑵为探讨反应物浓度对化学反应速率的影响,设计的实
验方案如下表:
表中Vχ= mL,理由是
。
课堂反馈练习3
⑵为探讨反应物浓度对化学反应速率的影响,设计的实
验方案如下表:
表中Vχ= 2.0 mL,
优化方案(全国通用)2016版高考化学二轮复习 上篇 专题突破方略 专题一 基本概念 第二讲 化学常用计量学案
第二讲 化学常用计量2016高考导航——适用于全国卷Ⅰ考点一 阿伏加德罗常数的应用[学生用书P5]关于阿伏加德罗常数试题常设的“陷阱”1.气体摩尔体积的运用条件:考查气体时经常给定非标准状况下(如25 ℃、1.01×105Pa)气体体积,考生易用22.4 L·mol -1进行换算,误入陷阱。
2.忽视物质的聚集状态:22.4 L·mol -1适用对象是气体(包括混合气体)。
命题者常用在标准状况下非气态的物质来迷惑考生,如H 2O 、CCl 4、辛烷、汽油、SO 3、C 6H 6等。
3.忽视单质的组成:气体单质的组成除常见的双原子分子外,还有单原子分子(如He 、Ne 等)、三原子分子(如O 3)等。
4.混淆某些氧化还原反应中电子转移的数目:命题者常用一些反应中转移电子的数目来迷惑考生,如Na 2O 2与H 2O 反应、Cl 2与NaOH 溶液反应、Fe 与盐酸反应、1 mol 氯气与过量铁反应、电解硫酸铜溶液等。
5.不理解物质的组成结构:如Na 2O 2是由Na +和O 2-2构成,而不是Na +和O 2-;NaCl 为离子化合物,只有离子没有分子;苯中不含碳碳单键和碳碳双键。
6.忽视电离、水解对溶液中离子数目的影响:考查电解质溶液中离子数目或浓度时常设置弱电解质的电离、盐类水解方面的陷阱。
7.忽视可逆反应不能进行到底:如2NO2 N 2O 4、2SO 2+O 2催化剂△2SO 3、合成氨反应等。
有关阿伏加德罗常数的正误判断1.(概念应用类)(2015·高考全国卷Ⅰ,T8,6分)N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .18 g D 2O 和18 g H 2O 中含有的质子数均为10N AB .2 L 0.5 mol·L -1亚硫酸溶液中含有的H +离子数为2N AC .过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2N AD .密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A[破题关键] D 2O 和H 2O 为10电子分子,但摩尔质量不同;亚硫酸为弱酸,不能完全电离;Na2O 2中O 元素为-1价,产生1 mol 氧气转移2N A 个电子;由于2NO 2 N 2O 4的存在,故NO 2分子数会减少。
2016届高三化学二轮复习课件 1.2.2化学反应速率和化学平衡

4.化学平衡常数的4大“应用”: (1)判断反应进行的程度。 (2)判断反应进行的方向。 < K,反应向正反应方向进行。 ①Qc__ = K,反应处于平衡状态。 ②Qc__ > K,反应向逆反应方向进行。 ③Qc__
(2)由总压强p和起始压强p0计算反应物A的转化率α (A)的表达式为 ____________________。平衡时A的转化率为_________,列式并计 算反应的平衡常数K__。 (3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应 物A的物质的量n(A),n总=_________mol,n(A)=________mol。
2.主观题: (1)考查“常数”:以化学平衡常数为中心,考查化学反应速率、化 学平衡的基本问题及有关计算。 (2)考查“综合”:结合化学反应中的能量变化、电化学等知识点进 行综合考查。 (3)考查“应用”:以生活、工业生产或者化学实验为背景,注重用 所学知识解决实际问题。
1.有关化学反应速率的5个易错点:
根据阿伏加德罗定律可得:0.10/(0.10-x+x+x)=p0/p,求得A的转化 率表达式为α(A)=x/0.10×100%=(p/p0-1)×100%,将题目中数据 p0=4.91×100 kPa,p=9.53×100 kPa代入表达式求得平衡时A的转化 率约为94.1%。将x=0.094 1代入上面的三段式中可以求得该反应的 平衡常数为K=c(B)·c(C)/c(A)=0.094 1×0.094 1/(0.10-0.094 1) ≈1.5。
(3)①由以上三段式知平衡时n(总)=(0.10+x)mol,n(A)=(0.10-x)mol, 将(2)问中的x代入即可得到n(总)=0.10×p/p0mol,n(A)=0.10× (2-p/p0)mol; ②因n(A)=0.10×(2-p/p0)mol,所以a=0.10×(2- 7.31 100 kPa )
广东省高考化学第二轮复习 备考心得交流课件

以考定“题”—广东理综化学试题分析
问题设计一般没有递进性 强化识图能力考察
以考定“题”—广东理综化学试题分析
离子方程式、化学方书写-与2013同
元素化合物知识!C、Cl、N、Si、Al、Fe、Mg
作图
以考定“题”—广东理综化学试题分析
强化实验设计能力和实验作图能力
得益于高一到高三都是实施导学案教学,学 生在课堂上的学习一直都是高效益。
重视高考意识的前移,导学案的情境性、建 构性、系统性、探究性的四性特色起到了帮 助作用。
重视对教材知识内容的挖掘,比如高考最后一 个压轴题就是我们在高一深层次处理过的问题。
在高一、高二重视对图像问题的处理能力培养。 重视在起始年级对方程式书写,坚决杜绝背方
第二轮复习怎么 选题?
•忌全盘皆收
• 精挑 • 重组 • 改造
分工、合作,各负其责
个人的失败教训
• 在多次的考试中成绩不如刚出道的年轻人——与 学生缺乏有效交流时间与渠道;
• 过分相信学生的记忆力——因我班学生化学方程 式书写在区模拟考及深一模考试中屡屡丢分,而 导致与其他班成绩有差距。其实还是要不断地与 遗忘作斗争。改变策略:后期坚持每天书写10来 个方程式。
程式的现象 敢于打破辅导资料的限制,进行重组; 组内几个老师不搞单打独斗,和谐相处,资料
共用
以考定“题”——微专题
• 单双液电池与电解池的设计和作图、金属的电化 学防护
• 常规化学方程式或离子方程式听写与说写 • 原理迁移型陌生化学或离子方程式书写(工艺流程) • 常规气体的实验室制备 • 开放性实验综合设计(回归教材) • 探究实验中的实验基本操作 • 工艺流程中的物质分离提纯(真实问题情景)
2023届高中化学人教版二轮专题复习第55讲-如何调控pH(练习)

第55讲-如何调控pH1. (2022广东卷18题)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。
我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:已知:月桂酸(C11H23COOH)熔点为44℃;月桂酸和(C11H23COO)3RE均难溶于水。
该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的K sp=1.8×10-8,Al(OH)3开始溶解时的pH为;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是_______。
(2)“过滤1”前,用NaOH溶液调pH至_______的范围内,该过程中Al3+发生反应的离子方程式为_______。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7g·L-1。
为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO―)低于_______mol·L-1(保留两位有效数字)。
(4)℃“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是_______。
℃“操作X”的过程为:先_______,再固液分离。
(5)该工艺中,可再生循环利用的物质有_______(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。
℃还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1mol Pt3Y转移_______mol电子。
℃Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为_______。
2. (2022辽宁卷16题)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:已知:℃焙烧时过量的MnO 2分解为Mn 2O 3,FeS 2转变为Fe 2O 3;℃金属活动性:Fe>(H)>Bi>Cu ;℃相关金属离子形成氢氧化物的pH 范围如下:回答下列问题:(1)为提高培烧效率,可采取的措施为___________。
广东省2016高考化学二轮复习专题限时训练(十八)以物质制备和性质探究为载体的实验综合考查题型
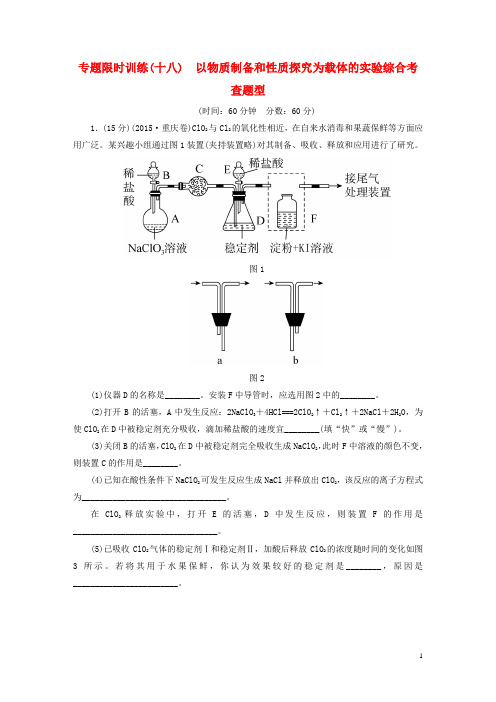
专题限时训练(十八) 以物质制备和性质探究为载体的实验综合考查题型(时间:60分钟分数:60分)1.(15分)(2015·重庆卷)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。
某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
图1图2(1)仪器D的名称是________。
安装F中导管时,应选用图2中的________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________________。
在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。
若将其用于水果保鲜,你认为效果较好的稳定剂是________,原因是________________________。
图3答案:(1)锥形瓶 b(2)慢(3)吸收Cl2(4)4H++5ClO-2===Cl-+4ClO2↑+2H2O 验证是否有ClO2生成(5)稳定剂Ⅱ稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度解析:(1)仪器D是锥形瓶;安装F中导管时,应遵循“长进短出”的原则,所以应选择装置b。
(2)为使ClO2被充分吸收,必须控制ClO2的生成速率,因此滴加盐酸的速率宜慢不宜快。
(3)F溶液中的颜色不变说明没有氯气通入,即氯气被装置C所吸收。
广东省2016高考化学二轮复习 第一部分 专题突破篇 专题一 化学基本概念 第1讲 物质的组成、性质和分类课件
高频考点二
物质及反应类型的分类 [领略真题]
1.(2014· 四川卷)下列关于物质分类的说法正确的是( A.金刚石、白磷都属于单质 B.漂白粉、石英都属于纯净物 C.氯化铵、次氯酸都属于强电解质 D.葡萄糖、蛋白质都属于高分子化合物
)
答案:A 解析:金刚石是碳元素形成的单质,白磷是磷元 素形成的单质,A 项正确;漂白粉是 CaCl2 和 Ca(ClO)2 的混合 物,石英的主要成分是二氧化硅,常含有 Al2O3、 CaO、MgO 等杂质,为混合物,B 项错误;氯化铵为强电解质,次氯酸为弱 酸,是弱电解质,C 项错误;葡萄糖是小分子化合物,蛋白质 是高分子化合物,D 项错误。
[突破演习] 题组一 考查物理变化的判断 )
1. (2015· 江苏常州模拟)下列变化不属于化学变化的是( A.SO2 使品红溶液褪色 B.氯水使有色布条褪色 C.活性炭使红墨水褪色 D.H2O2 水溶液使染料褪色
答案:C 解析:因为活性炭疏松多孔,表面积大,活性炭 使红墨水褪色,利用的是它的吸附作用,属于物理变化;A 项, SO2 使品红溶液褪色, 利用了化合反应, 但褪色后的无色物质加 热或者光照很快就会恢复原来的颜色;B 项的氯水使有色布条 褪色和 D 项的 H2O2 水溶液使染料褪色, 都是利用它们的强氧化 性。
(3)酸性氧化物不一定是非金属氧化物(如 Mn2O7); 非金属氧 化物也不一定是酸性氧化物(如 CO、NO)。 (4)胶体区别于其他分散系的本质特征是分散质粒子直径在 1~100 nm 之间,而不是丁达尔现象。
题组二
考查反应类型的分类
3.(2015· 山东威海一模 )下图是某反应在密闭容器中反应前 后的分子状况示意图,“●”和“ ”分别表示不同的原子。下 列对该过程的相关描述正确的是( )
高三化学二轮复习 归因分析课件
不同压强时,CO2的平衡转化率如图2所示:
②图2中,相同温度下,压强越大,CO2的平衡转化率越
大,其原因是
。
增大压强,反应Ⅱ不移动,反应Ⅰ向正反应方向移动
③图中800℃时,四条线几乎交于一点,且随着温度升高,
CO2的平衡转化率越大,其原因是
。
说明压强对平衡转化率影响不大,且温度高于800℃之后, 反应II起主导作用,CO2的平衡转化率主要由反应II决定
pH=2时,Fe2+转化为Fe(OH)2沉淀需要的Fe2+浓度为4.9×107 mol·L-1 ; Fe3+转化为Fe(OH)3沉淀需要的Fe3+浓度为2.6×10﹣3 mol·L-1,
加铁粉将Fe3+还原为Fe2+,防止Fe3+优先发生水解生成氢氧化铁沉淀,阻碍Ti4+的水解 反应,导致钛水解率下降。
性质:溶解度、 反应:化学平衡
MgO + 2NH4+ + H2O ⇌ Mg2+ + 2NH3·H2O
随大量NH3逸出, 平衡正移
吸收塔中的温度不宜过高,可能的原因是________
吸收SO2
温度
SO2 Na2CO3溶液
性质:溶解度、 防止SO2的溶解度下
热稳定性、
降;防止HSO3−受热
H2O + 2SO2 + Na2CO3 = 2NaHSO3 + CO2氧 反化 应还 :原反性应速率
率α(NO)随温度的变化关系如图所示:
由图可知,温度低于1050K时,NO的转化率随温度升高而增大,原因是
。
温度低于1 050 K时,反应未达到平衡状态,随温度升高,反应速率加快,NO转化率增大
由图可知,温度高于1050K时,NO的转化率随温度升高而减少,原因是
2016版优化方案高考化学二轮复习课件 化学实验基础
化学实验基础
2016高考导航 最新考纲 1.了解化学实验是科学探究过程中的一种重要方法。了解实验 探究的一般过程。 2.了解化学实验的绿色化和安全性要求。能识别化学品安全使 用标识。了解实验室一般事故的预防和处理方法。 3.了解中学化学实验室常用仪器的主要用途和使用方法。能识 别和绘制简单的实验仪器装置图。 4.初步掌握测定溶液pH的方法。初步了解中和滴定的原理和 方法。 5.能根据物质的特性,运用过滤、蒸发、蒸馏、结晶、萃取等 方法分离和提纯常见的物质。 6.能对常见物质进行检验和分析,并初步掌握其操作技能。初 步了解常见物质的组成和结构的检测方法。 7.了解对物质进行定性研究和定量分析的基本方法。
(2)对量筒和滴定管,读数时同样是仰视,引起的读数误差相
同吗? 不同,滴定管的读数偏大,量筒的读数偏小。
(3)下列仪器中,在灼烧固体物质时必须用到的仪器是 坩埚、泥三角 ________________( 填名称)。
栏目 导引
专题四
化学实验基础
(2015· 高考重庆卷)下列实验中,所使用的装置 (夹 持装置略 )、试剂和操作方法都正确的是( A )
栏目 导引
专题四
化学实验基础
解析: A.Fe(OH)2 易被氧化,为防止空气中的氧气溶解在溶液 中而氧化 Fe(OH)2,制取时常采取在试管中的 FeSO4 溶液表面 加一层植物油,在加入 NaOH 溶液时用长胶头滴管,且插入 FeSO4 溶液液面下,故正确。 B.配制一定物质的量浓度的溶液 时,固体应在烧杯中溶解,容量瓶不能用来溶解固体,故不正 确。 C. 氨气极易溶于水,不能用排水法收集,故不正确。 D. 乙醇在浓硫酸作用下加热到 170 ℃,发生消去反应生成乙烯, 温度计测量的是混合液的温度, 温度计的水银球应位于液面以 下,高锰酸钾酸性溶液有强氧化性,不仅能氧化乙烯,也能氧 化乙醇及反应副产物 SO2 等,在检验乙烯之前应先除去乙醇、 SO2 等杂质,故不正确。
广东省2016高考化学二轮复习 专题限时训练(二)化学常用计量
专题限时训练(二) 化学常用计量(时间:60分钟分数:100分)一、选择题(每小题5分,共60分)1.(2015·河北邯郸模拟)冬季的降雪给机场和马路带来诸多不便,其中醋酸钾(CH3COOK)是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是( )A.1 mol CH3COOK的质量为98 g·mol-1B.CH3COOK的摩尔质量等于它的相对分子质量C.一个CH3COOK微粒的质量约为986.02×1023gD.含有6.02×1023个碳原子的CH3COOK的物质的量为1 mol答案:C 解析:A项,1 mol CH3COOK的质量为98 g,错误;B项,摩尔质量的单位是g/mol,相对分子质量的单位是“1”,错误;C项,一个CH3COOK微粒的质量=98 g÷6.02×1023=986.02×1023g,正确;D项,醋酸钾的物质的量是碳原子物质的量的一半,为0.5 mol,错误。
2.(2014·广东卷)设n A为阿伏加德罗常数的数值。
下列说法正确的是( )A.1 mol甲苯含有6n A个C—H键B.18 g H2O含有10n A个质子C.标准状况下,22.4 L氨水含有n A个NH3分子D.56 g铁片投入足量浓H2SO4中生成n A个SO2分子答案:B 解析:解有关阿伏加德罗常数的题一般分为三步,第一步为宏观量之间的转换,即将质量和体积转化为物质的量;第二步为微观量之间的转换,即判断1分子该物质所含的微粒数;第三步为宏观量和微观量的对应,即一定物质的量的该物质含有的微粒数。
A项,第一步,题目中直接给出物质的量,所以不用转换;第二步,甲苯的分子式为C7H8,因此1分子甲苯中含有8个C—H键;第三步,1 mol甲苯中含有8n A个C—H键,A错误。
B项,第一步,18 g水的物质的量为1 mol;第二步,1个水分子中含有10个质子;第三步,1 mol 水分子中含有10n A个质子,B正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
条件控制专题(温度、压强、浓度、调pH值)
在工艺流程图题目中,我们发现不同生产工艺,物质间反应对于温度、压强、浓度、催
化剂等有不同要求,它们所起的作用也不一样,但都是达到目的的关键所在。反应条件的控
制成为命题常考点。考查的方式大体有两种情况:其一是要求学生能根据已学知识,结合节
能减排、提高生产效益等生产实际,为核心反应选取适宜的反应条件;二是根据图表信息,
总结变化规律,或说明工艺流程中某反应条件的选择理由。
例题:2014年广州一模第32题节选
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,
一种综合利用工艺设计如下:
(2)“酸浸”时铝浸出率的影响因素可能有 、 。(写出两个)
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH
分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一
种试剂,后续操作过程是 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向
AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释
析出晶体的原因: 。
【解题思路】
(2)将“酸浸时铝浸出率的影响因素”转化为考点“固、液反应物充分反应的因素”。
(3)利用控制CaCO3用量调节溶液的pH值分级沉淀,先调节pH到3.2,沉淀Fe3+,过滤除
杂后,再先调节pH到5.4,沉淀Al3+过滤得到产品Al(OH) 3 。
(4)浓度对化学平衡(沉淀溶解平衡)的影响的具体应用。关键找准平衡。
2
【参考答案】
(2)盐酸的浓度、反应温度、煤矸石颗粒大小、是否充分搅拌、反应时间(任写两个)(4
分,每个2分)
(4)加入CaCO3调节pH到3.2,过滤除去Fe(OH) 3后,再加入CaCO3调节pH到5.4,过
滤得到Al(OH) 3 (2分)
(5)AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s)Al3+(aq) +3Cl—(aq) +6H2O(l),通
入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。(2分)
【方法归纳】
一、夯实基础,以不变应万变
核心理论:化学反应速率、化学平衡的影响因素(浓度、温度、压强、催化剂);绿色
化学;节能减排这里补充说明接触面积和催化剂两因素影响。
接触面积的问题:增大反应物间的接触, 固体可以用粉碎的方法 ,液体可以用喷洒的
方法 ,气体可以用多孔分散器(多孔球泡等),搅拌、混溶、逆流投料(沸腾炉)等措施。
催化剂:催化剂同等程度改变正、逆反应的速率;催化剂的催化效率与温度有关。如合
成氨反应或SO2催化氧化反应,两反应均为放热反应,高温不利于平衡正向移动,工业生产
选择温度为500℃左右,原因之一是使催化剂的活性达到最高,反应速率更快。
二、引导学生学会将“问题” 转化为“考点”,再调用所学理论知识加以解决。
仔细审题,分析清楚问题考查的是反应速率问题,还是平衡移动问题;是加快还是减缓
反应速率;对于多个化学平衡共存的反应体系,找准考查的平衡,是促进还是抑制平衡;结
合温度、浓度、压强、催化剂等影响因素综合分析,逐一遴选。
解析与平衡移动有关的问题遵循以下步骤:阐明体系中存在的核心平衡→所采取的措
施、改变的条件→导致平衡如何移动移动、产生什么结果。
巩固练习:
32—1(2012年广东卷)
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2+ + 2K+ + Mg2+ + 4SO42— + 2H2O
为能充分利用钾资源,用饱和Ca(OH) 2溶液浸杂卤石制备硫酸钾,工艺流程如下:
Ca(OH)2溶液 滤渣
母液
杂卤石 过滤
(2)用化学平衡移动原理解释Ca(OH) 2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,
过滤,再加入 溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见图14,
由图可得,随着温度升高,①
溶浸 过滤 除杂 蒸发浓缩、冷却结晶 过滤 硫酸钾
3
② 。
【答案】
(2)加入Ca(OH)2溶液,OH—与Mg2+结合成Mg(OH)2、Ca2+与SO42—结合成CaSO4而析出,使平
衡向右移动,杂卤石溶解浸出K+(留在滤液中)。
(3)K2CO3 稀H2SO4
(4)①在同一时间内,K+的浸出浓度增大。②K+的溶浸速率加快,达到溶浸平衡的时间短。
32—2(2012年广州一模)绿矾(FeSO4·7H2O)的一种综合利用工艺如下:
(3)“除杂”步骤为:向母液中通入含臭氧的空气、调节pH、过滤,除去的杂质离子是
____________。
(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、
____________。浓缩时若温度过高,产品中将混有NH4HSO4,运用化学平衡移动原理解释其
原因 。
【答案】:
(3)Fe2+(3分)
(4)过滤(2分) NH4++H2O NH3·H2O+H+,温度过高NH3挥发使平衡向右移动,
溶液酸性增强生成NH4HSO4。(3分)
32—3(2010年广东卷)碳酸锂广泛应用于陶瓷和医药等领域。以-锂辉石(主要成分为
Li2OAl2O34SiO2)为原材料制备Li2CO3的工艺流程如下:
-锂辉石
β
浸取锂硫酸浸出液浸出渣除杂滤液滤渣蒸发浓缩沉淀
饱和碳酸钠溶液
碳酸锂
母液
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7
和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、
Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节
溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
【答案】
(1)增大固液接触面积,加快浸出反应速率,提高浸出率
(2)石灰石
32—4(2014年广州二模)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。
工业上可从电解精炼铜的阳极泥中提取碲。
绿矾
NH4HCO3
FeCO3固体 母液 焙烧 煤粉 还原铁粉
(NH4)2SO4粗产品 除杂
转化分离
„„
4
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工
艺流程如下:
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,
将导致碲的沉淀不完全,原因是___________________________;防止局部酸度过大的操作
方法是___________________________。
【答案】:
②TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失。(3分)缓慢加入
H2SO4,并不断搅拌 (3分)
32—5(2013年广州一模)
32.(16分)某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取Al2O3、K2CO3等物
质,工艺流程如下:
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O Al(OH)3 + OH—
“浸取”时应保持溶液呈 性(填“酸”或“碱”。 “浸取”时不断搅拌的
目的是 。
【答案】:
(2)碱 (1分); 提高浸取速率(2分)
32—6(2013年广东卷)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产
品的工艺如下的:
(2)固体混合物B的组成为 ;在生成固体B的过程中,需要控制NaOH的加入量,若
NaOH过量,则因过量引起的反应的离子方程式为 。
【答案】:,
