有源与无源医疗器械
医疗器械分类规则

医疗器械分类规则 Revised by Liu Jing on January 12, 2021医疗器械分类规则第一条为规范医疗器械分类,根据《医疗器械监督管理条例》,制定本规则。
第二条医疗器械是指:单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需的软件。
其使用目的是:(一)疾病的预防、诊断、治疗、监护或者缓解。
(二)损伤或残疾的诊断、治疗、监护、缓解或者补偿。
(三)解剖或生理过程的研究、替代或者调节。
(四)妊娠控制。
其用于人体体表及体内的作用不是用药理学、免疫学或代谢的手段获得,但可能有这些手段参与并起一定辅助作用。
第三条本规则用于指导《医疗器械分类目录》的制定和确定新的产品注册类别。
第四条确定医疗器械分类,应依据医疗器械的结构特征、医疗器械使用形式和医疗器械使用状况三方面的情况进行综合判定。
医疗器械分类的具体判定可以依据《医疗器械分类判定表》(见附件)进行。
第五条医疗器械分类判定的依据(一)医疗器械结构特征医疗器械的结构特征分为:有源医疗器械和无源医疗器械。
(二)医疗器械使用形式根据不同的预期目的,将医疗器械归入一定的使用形式。
其中:1.无源器械的使用形式有:药液输送保存器械;改变血液、体液器械;医用敷料;外科器械;重复使用外科器械;一次性无菌器械;植入器械;避孕和计划生育器械;消毒清洁器械;护理器械、体外诊断试剂、其他无源接触或无源辅助器械等。
2.有源器械的使用形式有:能量治疗器械;诊断监护器械;输送体液器械;电离辐射器械;实验室仪器设备、医疗消毒设备;其他有源器械或有源辅助设备等。
(三)医疗器械使用状态根据使用中对人体产生损伤的可能性、对医疗效果的影响,医疗器械使用状况可分为接触或进入人体器械和非接触人体器械,具体可分为:1.接触或进入人体器械(1)使用时限分为:暂时使用;短期使用;长期使用。
(2)接触人体的部位分为:皮肤或腔道;创伤或体内组织;血液循环系统或中枢神经系统。
医疗器械产品技术要求编写指导原则

27
第十五条申请人或者备案人应当编制拟注册或者备案医疗器械的产品技术要求。 第一类医疗器械的产品技术要求由备案人办理备案时提交食品药品监督管理部门。 第二类、第三类医疗器械的产品技术要求由食品药品监督管理部门在批准注册时 予以核准。产品技术要求主要包括医疗器械成品的性能指标和检验方法,其中性 能指标是指可进行客观判定的成品的功能性、安全性指标以及与质量控制相关的 其他指标。在中国上市的医疗器械应当符合经注册核准或者备案的产品技术要求。 第十六条申请第二类、第三类医疗器械注册,应当进行注册检验。医疗器械检验 机构应当依据产品技术要求对相关产品进行注册检验。注册检验样品的生产应当 符合医疗器械质量管理体系的相关要求,注册检验合格的方可进行临床试验或者 申请注册。办理第一类医疗器械备案的,备案人可以提交产品自检报告。
11
性能指标举例:
(1)功能性指标 导管 强度(断裂拉伸性能)、连接分离力、抗弯曲性、泄漏、顺应性、 气阻、流量、球囊强度(最大爆破压力、爆破体积) 敷料 阻水性、阻菌性、水蒸气透过率、舒适性、粘性、弹性 其他 有效物质含量、抑菌/杀菌效果、使用性能。
12
(2)安全性指标 环氧乙烷残留、重金属、酸碱度、易氧化物、表面活性物质、荧光物质、 杂蛋白、微粒物质、 无菌/微生物限度、细菌内毒素/热源 (3)质量控制相关指标 外观结构、尺寸(长度、厚度、孔径、位置)、单位面积重量、数量 耐腐蚀性、表面粗糙度 形状 材料、化学成分 机械性能、硬度
10
6、出厂检验规则/项目不再在注册过程中确认,由生产许可部门根据企业的质量 管理水平核准; 7、包类产品以及带附件类产品,所含组分部分性能指标均应写入技术要求。 (各个部件信息建议以附录的形式写入技术要求);配方类产品应明确配方 及其含量。 8、产品技术要求中的性能指标应明确具体要求,不应以“见随附资料”、“按供货 合同”、“范围”等形式提供。 9、强调检验方法具有可重现性和可操作性。(EO、pH检测应明确具体方法)。 10、推荐制定附录: (1)型号及各规格之间的所有区别、结构组成(图示); (2)原材料信息、各组分含量、供应商信息; (3)样品的制备方法; (4)其他较复杂的试验方法。
01 有源手术器械说明
01 有源手术器械说明
一、范围
本子目录包括以手术治疗为目的与有源相关的医疗器械,包括超声、激光、高频/射频、微波、冷冻、冲击波、手术导航及控制系统、手术照明设备、内窥镜手术用有源设备等医疗器械。
二、框架结构
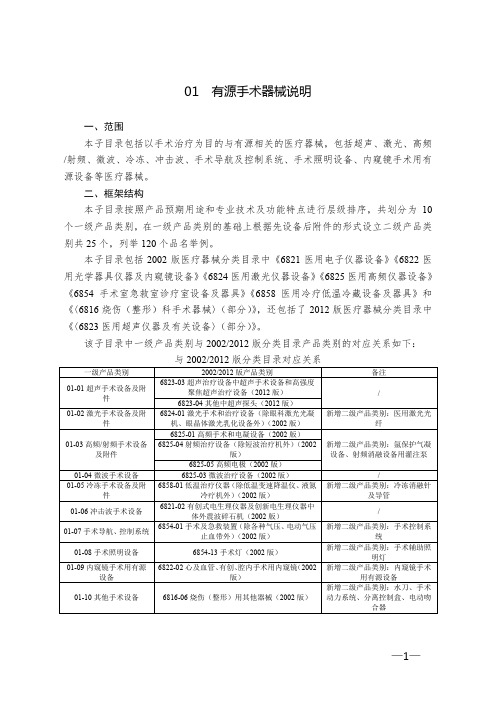
本子目录按照产品预期用途和专业技术及功能特点进行层级排序,共划分为10个一级产品类别,在一级产品类别的基础上根据先设备后附件的形式设立二级产品类别共25个,列举120个品名举例。
本子目录包括2002版医疗器械分类目录中《6821医用电子仪器设备》《6822医用光学器具仪器及内窥镜设备》《6824医用激光仪器设备》《6825医用高频仪器设备》《6854手术室急救室诊疗室设备及器具》《6858医用冷疗低温冷藏设备及器具》和《〈6816烧伤(整形)科手术器械〉(部分)》,还包括了2012版医疗器械分类目录中《〈6823医用超声仪器及有关设备〉(部分)》。
该子目录中一级产品类别与2002/2012版分类目录产品类别的对应关系如下:
三、其他说明
(一)医用激光光纤与激光治疗仪配套应用,传输激光器产生的能量,用于激光手术治疗。
依据《关于一次性前列腺治疗套件等产品分类界定的通知》(国食药监械〔2008〕587号)和《国家食品药品监督管理局关于超声肿瘤治疗系统等17个产品分类界定的通知》(国食药监械〔2012〕36号)分类界定文件规定管理类别为二类,分类编码6824。
因此将医用激光光纤纳入《01有源手术器械》目录中。
(二)射频消融设备用灌注泵,管理类别由第三类降为第二类。
(三)发光二极管(LED)手术照明灯,管理类别由第二类降为第一类。
01 有源手术器械
—3—
—4—
—5—
—6—
—7—。
有源二类医疗器械的技术原理与工作机制

有源二类医疗器械的技术原理与工作机制有源二类医疗器械是指通过能源转换、控制和调节等功能来实现医疗和医学监测等目的的器械。
它们利用电、磁、光、声等能源,并由内部的电子元件和电路控制系统来完成各项功能。
一、技术原理1. 电子技术原理有源二类医疗器械中广泛应用的一种技术原理是电子技术。
电子技术是通过电流和电子元器件的组合来进行信号的传输、处理和控制的一门学科。
有源二类医疗器械利用电子技术来驱动各种功能模块,例如传感器的信号采集、电动机的驱动、显示器的显示等。
通过电子技术,能够实现医疗器械的高精度和快速响应。
2. 传感器技术原理传感器是有源二类医疗器械中常见的组件之一。
它能够将感知的物理量或化学量转换为电信号,以实现对环境的监测和控制。
传感器技术原理包括各种物理量转电信号的原理,例如光电效应、电感效应、压力敏感效应等。
通过传感器技术,可以实现对患者的心率、血氧、体温等生理指标的测量。
3. 控制技术原理有源二类医疗器械的控制系统通常采用微处理器和嵌入式系统来实现对器械的控制和监测。
控制技术原理主要包括计算机编程、控制算法和信号处理等方面的知识。
通过控制技术,能够实现对器械的自动化控制、数据处理和结果分析。
二、工作机制1. 电源供电有源二类医疗器械通常会采用内置电池或外部电源供电。
内置电池可以提供便携性和灵活性,适用于患者佩戴的个人监测设备。
外部电源则常用于医院、诊所等场所的专业医疗器械,提供更稳定的供电能力。
2. 信号采集与处理有源二类医疗器械中的传感器会采集患者的生理参数或环境数据,并将其转换为电信号。
这些信号经过放大、滤波、模数转换等处理后,会被发送到控制系统中进行进一步的分析和处理。
3. 控制与调节通过控制系统中的算法和参数设置,有源二类医疗器械可以根据实际需求对输出信号或操作进行控制和调节。
例如,根据患者的心率变化,心脏起搏器可以自动调节输出的脉冲信号以维持心脏的正常工作。
4. 输出显示与反馈有源二类医疗器械通常会将采集到的数据和结果通过显示器、声音或震动等方式输出给用户或医护人员。
GB9706医用电气设备的分类

仪器外壳与火线短路引起电击
2020/10/3
2.电容耦合
漏电电容存在于任何导体与地之间、用绝缘分开的两个 导体之间,等效为电容器构成的交流通路。 漏电范围 几十~几百uA,最大不超过500uA。
图3-3 电容耦合引起的漏电
2020/10/3
3.外壳未接地或接地不良
4.非等电位接地
如果有几台仪器(包括病床)同时与病人相连,那么每台仪器 的外壳电位必须相等,否则也会发生电击事故。 漏电流的大小与A、B两点间接地电阻的大小和外壳漏电仪 器的漏电程度有关。
第三版标准扩大了安全的范围和概念,引入了 风险管理的流程,同时赋予了企业一定的自由度选 择产品的实现方式。
设计有较大的灵活性,有些要求无法满足标准 要求,如果通过风险管理文件能够证明不会因此而 产生不可接受的风险,则可以接受。
风险管理不是为不能达到安全要求产品提供的 方便之门。提供风险管理文件,对于很多仿制成熟 产品的企业,对于风险管理十分陌生,满足这个要 求很困难。
级别
I
II
III
内部电 源设备
保护 措施
附加保护措施
备注
保护接地
接地型Hale Waihona Puke P插座,3P插座 ,需要保护接地装置
辅助绝缘
对使用的设备没有限制
基础 绝缘 医用安全超低压电源 要求特殊的电源设备,
不能认为是III级CF型
内藏电源
不能连接外部电源 对使用的设备没有限制
2020/10/3
第四节 防电击程度分类
60601-2-50
婴儿光疗设备
1988年9月5日颁布GB9706.1-1988 1989年3月1日实施
1995年12月21日颁布GB9706.1-1995 1996年12月1日实施 (IDT IEC 60601:1988+A1)
有源医疗器械工艺验证方案

有源医疗器械工艺验证方案引言:有源医疗器械是指需要电源供应的医疗设备,如手术刀、电子监护仪等。
由于其直接涉及人体健康和安全,因此在生产过程中需要进行严格的工艺验证。
本文将介绍有源医疗器械工艺验证的方案。
一、工艺验证概述工艺验证是指通过实验和测试验证工艺是否能够满足产品的设计和规格要求。
对于有源医疗器械而言,工艺验证主要包括以下内容:1. 设计验证:验证产品的设计是否满足功能和性能要求。
这可以通过模拟实际使用情况、进行功能测试和性能评估等方式进行。
2. 材料验证:验证所使用的材料是否符合相关法规和标准要求。
这可以通过材料检测和分析等方式进行。
3. 生产工艺验证:验证生产工艺是否能够稳定地生产出符合产品要求的产品。
这可以通过生产小批量产品进行测试和评估。
4. 设备验证:验证所使用的生产设备是否能够满足生产工艺的要求。
这可以通过设备测试和评估等方式进行。
二、工艺验证方案1. 确定验证目标和指标:根据产品的设计要求,确定验证的目标和指标。
例如,确定产品的功能要求、性能要求、材料要求等。
2. 制定验证计划:根据验证目标和指标,制定详细的验证计划。
包括验证的内容、方法、样品数量、测试设备和测试环境等。
3. 进行设计验证:根据验证计划,进行产品的设计验证。
这可以通过模拟实际使用情况、进行功能测试和性能评估等方式进行。
4. 进行材料验证:根据验证计划,进行材料的验证。
这可以通过材料检测和分析等方式进行。
5. 进行生产工艺验证:根据验证计划,进行生产工艺的验证。
这可以通过生产小批量产品进行测试和评估。
6. 进行设备验证:根据验证计划,进行生产设备的验证。
这可以通过设备测试和评估等方式进行。
7. 分析和评估验证结果:根据验证的数据和结果,进行分析和评估。
如果验证结果符合要求,则可以进入下一阶段。
如果验证结果不符合要求,则需要调整工艺或设计,重新进行验证。
8. 编写验证报告:根据验证的结果,编写验证报告。
报告应包括验证的目标、方法、结果、分析和评估等内容。
有源医疗器械分类界定判定基本原则及实例分析
(一)如果同一医疗器械适用两个或者两个以上的分类,应当采取其中风险程度最高的分类。
Ø多种工作原理、多个应用部分组合的产品,其类别应遵循此原则Ø同一医疗器械预期用于多种目的,其类别应遵循此原则Ø激光高频治疗仪(包含高频模式和激光模式)l高频模式用于口腔软组织切割和凝血(III类)l激光模式用于口腔减少细菌、弱激光治疗(包括疱疹治疗和口腔溃疡治疗)及种植手术暴露(II类)实例分析III类Ø糖尿病管理应用程序(包含多项预期目的)(食药监办械管〔2015〕104号)l软件产品。
通过蓝牙连接特定的血糖仪,将血糖值从血糖仪传输到移动设备(II类)l同时,具有药物计算(用药剂量指导)功能(III类)III类Ø数字化X射线透视摄影系统(包含多项预期目的)(食药监办械管〔2014〕198号)l用于对患者的头部、躯干、四肢进行数字X射线摄影、透视和胃肠诊断、泌尿摄影(II类)、l体层摄影、数字减影血管造影(III类)III类(二)可作为附件的医疗器械,其分类应当综合考虑该附件对配套主体医疗器械安全性、有效性的影响;如果附件对配套主体医疗器械有重要影响,附件的分类应不低于配套主体医疗器械的分类。
Ø理疗电极片:由导电硅胶层和其他辅助层组成,不含药物成分。
与中低频理疗仪配套使用,用于传导仪器发出的电脉冲信号。
(食药监办械管〔2015〕49号)Ø一次性集成电极:主要由银电极传感器、柔性线路、标签、医用导电胶、基衬材料组成,一次性使用。
配套心电图机、心电监护仪、心电监测仪(系统)等设备,观察、记录人体相关部位的生物电变化,传输人体生物电信号,用于心脏监测。
(食药监办械管〔2015〕49号)实例分析I 类II 类Ø髓内钉延长系统:由磁手柄、控制面板及电源适配器组成。
与特定的可延长髓内钉(III类)配合使用,用于控制髓内钉在髓腔里的缩回或伸长。
(食药监办械管〔2014〕198号) Ø胶囊式内窥镜控制系统:由电动检查床、体外磁控装置、图像工作站和紧急控制装置组成,与胶囊式内窥镜( III类)配套使用,用于在人体胃和十二指肠检查中,控制患者吞服的胶囊式内窥镜的姿态、方向和运动。
骨科植入性医疗器械的技术监管要点
4、生物医用ቤተ መጻሕፍቲ ባይዱ合材料
生物医用复合材料是由两种或两种以上材料复合 而成。不同材料复合后,可能出现新的,独特的不同 于其组成材料的性质,这种性质可能是有利的,也可 能于人体不利。因此对于生物医用复合材料不仅要求 各组成部分材料要满足生物学性能要求,更要求复合 后的复合材料必须满足生物学性能要求。医用高分子 材料、医用金属和合金材料以及生物陶瓷均既可作为 复合材料的基材,又可作为其增强体或填料,它们相 互配合形成性质各异的生物医用复合材料。其分类按 基材分为高分子基、陶瓷基、金属基等;按增强体形 态和性质分为纤维增强、颗粒增强、生物活性物质充 填等;按材料与组织发生的反应分为生物惰性、生物 活性和可吸收生物医用复合材料。如广泛应用的骨水 泥,涂层材料,及近年来发展的纳米磷灰石——医用 高分子复合材料等。
2、生物医用高分子材料
高分子材料在生物医用材料领域中应用最为广泛, 其优良的易于通过设计调整或控制的理化性能,使其 应用到医学的各个领域。按来源可分为天然高分子材 料和合成高分子材料。天然的如多糖类、蛋白类,合 成的如超高分子量聚乙烯、聚醚醚酮(PEEK)、聚 乳酸、聚甲基丙烯酸系列等,广泛地用于人工器官、 软硬组织修复、人工关节、等;按性质,生物医用高 分子材料可分为非降解和可生物降解两大类。非降解 高分子材料如超高分子量聚乙烯、聚醚醚酮 (PEEK)、聚丙烯酸酯等可在体内保持稳定;可降 解高分子材料如胶原、脂肪族聚酯、甲壳素、纤维素、 聚乳酸等,可在体内逐步降解并可为人体吸收或通过 新陈代谢排除。按使用目的可分为心血管材料、软组 织和硬组织修复材料等。
5、生物衍生材料
这类材料又称生物衍生材料,是由天然生物组织
经过特殊处理而形成的。生物组织可取自同种或异种 生物体,特殊处理包括维持组织原有构型而进行的固 定、灭菌和消除抗原性的较轻微的处理,以及拆散原 有构性,重建新的物理形态的强烈处理。前者如猪心 瓣膜、牛心包、人脐动脉、速冻的骨片等;后者如再 生的胶原,弹性蛋白,透明质酸、壳聚糖等。由于经 过处理的生物组织已失去生命力,生物衍生材料是无 生命活力的生物组织材料。由于它有类似于自然组织 的构型和功能,或其组成类似于自然组织,因此,它 在维持人体动态过程的修复和替换中具有重要作用。 主要用于人工心瓣膜、血管修复体、人工皮肤、纤维 蛋白制品、骨修复体等。
医疗器械分类规则讲解
目录目录 (1)医疗器械分类规则 (2)医疗器械产品分类目录编制说明 (6)关于制定《医疗器械分类目录》的说明 (7)医疗器械分类目录 (8)其他产品的类别划分目录 (40)说明《中国医疗器械分类目录》收集了国家食品药品监督管理局关于医疗器械分类的各项规定,包括医疗器械分类规则、包括医疗器械分类规则、中国医疗器械分类目录编制说明,及医疗器械分类目录。
同时捷通咨询对国家食品药品监督管理局关于医疗器械分类的补充文件(2001-2008)进行了汇总及归纳,作为其他产品的类别划分排在《医疗器械分类目录》之后。
《中国医疗器械分类目录》仅供公司参考之用,不对外销售,所有客户均可免费索取。
医疗器械分类规则(局令第15号)第一条为规范医疗器械分类,根据《医疗器械监督管理条例》,制定本规则。
第二条医疗器械是指:单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需的软件。
其使用目的是:(一)疾病的预防、诊断、治疗、监护或者缓解。
(二)损伤或残疾的诊断、治疗、监护、缓解或者补偿。
(三)解剖或生理过程的研究、替代或者调节。
(四)妊娠控制。
其用于人体体表及体内的作用不是用药理学、免疫学或代谢的手段获得,但可能有这些手段参与并起一定辅助作用。
第三条本规则用于指导《医疗器械分类目录》的制定和确定新的产品注册类别。
第四条确定医疗器械分类,应依据医疗器械的结构特征、医疗器械使用形式和医疗器械使用状况三方面的情况进行综合判定。
医疗器械分类的具体判定可以依据《医疗器械分类判定表》(见附件)进行。
第五条医疗器械分类判定的依据(一)医疗器械结构特征医疗器械的结构特征分为:有源医疗器械和无源医疗器械。
(二)医疗器械使用形式根据不同的预期目的,将医疗器械归入一定的使用形式。
其中:1.无源器械的使用形式有:药液输送保存器械;改变血液、体液器械;医用敷料;外科器械;重复使用外科器械;一次性无菌器械;植入器械;避孕和计划生育器械;消毒清洁器械;护理器械、体外诊断试剂、其他无源接触或无源辅助器械等。
医疗器械分类规则
目录目录 (1)医疗器械分类规则 (2)医疗器械产品分类目录编制说明 (6)关于制定《医疗器械分类目录》的说明 (7)医疗器械分类目录 (8)其他产品的类别划分目录 (40)说明《中国医疗器械分类目录》收集了国家食品药品监督管理局关于医疗器械分类的各项规定,包括医疗器械分类规则、包括医疗器械分类规则、中国医疗器械分类目录编制说明,及医疗器械分类目录。
同时捷通咨询对国家食品药品监督管理局关于医疗器械分类的补充文件(2001-2008)进行了汇总及归纳,作为其他产品的类别划分排在《医疗器械分类目录》之后。
《中国医疗器械分类目录》仅供公司参考之用,不对外销售,所有客户均可免费索取。
医疗器械分类规则(局令第15号)第一条为规范医疗器械分类,根据《医疗器械监督管理条例》,制定本规则。
第二条医疗器械是指:单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需的软件。
其使用目的是:(一)疾病的预防、诊断、治疗、监护或者缓解。
(二)损伤或残疾的诊断、治疗、监护、缓解或者补偿。
(三)解剖或生理过程的研究、替代或者调节。
(四)妊娠控制。
其用于人体体表及体内的作用不是用药理学、免疫学或代谢的手段获得,但可能有这些手段参与并起一定辅助作用。
第三条本规则用于指导《医疗器械分类目录》的制定和确定新的产品注册类别。
第四条确定医疗器械分类,应依据医疗器械的结构特征、医疗器械使用形式和医疗器械使用状况三方面的情况进行综合判定。
医疗器械分类的具体判定可以依据《医疗器械分类判定表》(见附件)进行。
第五条医疗器械分类判定的依据(一)医疗器械结构特征医疗器械的结构特征分为:有源医疗器械和无源医疗器械。
(二)医疗器械使用形式根据不同的预期目的,将医疗器械归入一定的使用形式。
其中:1.无源器械的使用形式有:药液输送保存器械;改变血液、体液器械;医用敷料;外科器械;重复使用外科器械;一次性无菌器械;植入器械;避孕和计划生育器械;消毒清洁器械;护理器械、体外诊断试剂、其他无源接触或无源辅助器械等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
精品
无源医疗器械
指不依靠任何电能或其它能源, 而是直接由人体或重力产生的能源来发挥其功
能的医疗器械。主要包括:医用输液、输血、注射器具的检测,血压计、血压表
的检测,医疗器械中不溶微粒的检测,环氧乙烷残留量的检测,人工心脏瓣膜的
检测,外科植入器械的检测,血管支架的检测,空心纤维透析器的检测,人工晶
体的检测。
有源医疗器械
有源医疗器械是相对于无源医疗器械而言的,需要使用电、气等驱动的器械可称之为有源器
械,比如各类医用电气类器械-X光机、心电监护、呼吸机、麻醉机、植入式心脏起搏器、
心脏除颤器、心电图机、医用监护仪、超声诊断仪、血液透析装置、高频手术设备等。
如有侵权请联系告知删除,感谢你们的配合!
如有侵权请联系告知删除,感谢你们的配合!
