分子之间的相互作用力
《分子间的相互作用力》范德华力简析

《分子间的相互作用力》范德华力简析《分子间的相互作用力——范德华力简析》在我们日常生活的世界中,物质以各种各样的形态存在,无论是固体、液体还是气体,其性质和状态的变化都与分子间的相互作用力密切相关。
而在众多分子间相互作用力中,范德华力是一种不可忽视的重要力量。
那么,什么是范德华力呢?简单来说,范德华力是存在于分子之间的一种较弱的相互作用力。
它不像化学键那样强烈和定向,但却在很多物质的性质和行为中发挥着关键作用。
范德华力主要包括三种类型:取向力、诱导力和色散力。
取向力发生在极性分子之间。
极性分子就像是有明确“方向感”的个体,它们的正负电荷中心不重合,存在着一定的偶极矩。
当两个极性分子相互靠近时,它们会像两个小磁针一样,由于异性相吸,分子会发生相对的定向排列,从而产生取向力。
这种力的大小与分子的偶极矩以及温度有关。
一般来说,分子的偶极矩越大,取向力也就越大;而温度升高时,分子的热运动加剧,取向变得更加混乱,取向力会相应减小。
诱导力则是极性分子和非极性分子之间产生的一种作用力。
当极性分子接近非极性分子时,极性分子会对非极性分子产生影响,使其正负电荷中心发生位移,从而产生诱导偶极。
这样一来,极性分子和被诱导出偶极的非极性分子之间就会产生相互吸引的诱导力。
色散力是范德华力中最为普遍存在的一种。
即使是像氢气、氮气这样的非极性分子,它们之间也存在着相互作用力,这就是色散力。
从微观角度来看,由于分子中的电子在不断运动,某一瞬间,分子的正负电荷中心可能会不重合,从而产生瞬间偶极。
这些瞬间偶极之间的相互作用就形成了色散力。
色散力的大小与分子的变形性有关,分子越大、越容易变形,色散力也就越强。
范德华力虽然相对较弱,但它对物质的性质却有着重要的影响。
在物质的状态方面,范德华力的大小决定了物质是呈现固态、液态还是气态。
例如,在常温常压下,氧气是气态,而水是液态。
这是因为水分子之间的范德华力相对较强,使得水分子能够较为紧密地聚集在一起,形成液态;而氧气分子之间的范德华力较弱,分子能够自由地扩散,从而形成气态。
分子间的相互作用力

2 分子间的引力和斥力随分子间距离 r 的变化关系:
分子力 F 随分 分子间
子间距离 r 的变 距离
化关系图象
Hale Waihona Puke 分子力分子力弹簧模型
r=r0
零
象征分子力合力为零
分子力 F 随分 分子间 子间距离 r 的 距离 变化关系图象
分子力
分子力弹簧模型
表现为斥力,且
r<r0
分子力随分子间 象征分子力的合力为
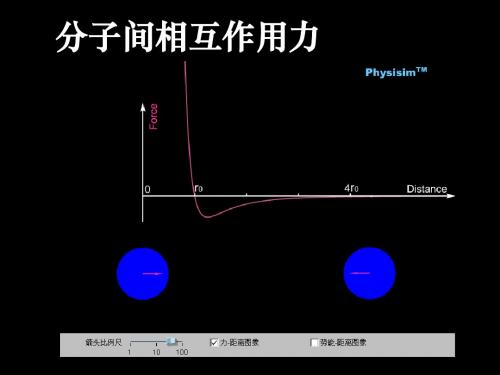
当 r<r0 时,分子力随分子间距离增大而减小; 当 r>r0 时,分子间距由 r0 增大到 10r0 的过程中, 分子力先增大后减小.
(多选)对下列现象的解释正确的是(ABC) A.两块铁经过高温加压将连成一整块,这说明铁分子间有吸引 力 B.一定质量的气体能充满整个容器,这说明在一般情况下,气 体分子间的引力很微弱 C.电焊能把两块金属连接成一整块是分子间的引力起作用 D.破碎的玻璃不能把它们拼接在一起是因为其分子间斥力作用 的结果
§3.分子间的相互作用力
演示:
1.将50ml水和50ml无水酒精倒入细长玻璃管中, 记住液面到达的高度,振荡混合均匀后,再看 液面到达的高度。
现象:混合后总体积减小 说明:液体分子之间存在着空隙
2、碳原子结构图: 3、空气容易被压缩
石墨表面原子结构图
固体分子间有间隙!
气体分子间有间隙!
思考1:分子间存在空隙,大量分子却 能聚集在一起形成固体或液体,这是 为什么呢? 分子之间存在着引力
1)当r=r0=10-10m时,F引=F斥, 分子力F分=0,处于平衡状态
2).当 r< r0 时, F引< F斥,
对外表现的分子力F为斥力.
3).当r>r0时, F引 >F斥,对外表现的分子力F为引力
分子间作用力物理

分子间作用力物理
分子间作用力是指分子之间相互作用的力量。
这些力量起着决定物质性质和相态的重要作用。
以下是几种主要的分子间作用力物理:
1.静电作用力(电荷-电荷相互作用):当分子中带电荷的部分与其他分子中的电荷部分靠近时,它们之间会发生相互作用。
正电荷与负电荷之间的相互吸引力称为静电作用力。
2.范德华力(分子间引力):范德华力是非极性分子之间的吸引力,它是由于分子中电子的运动引起的。
当非极性分子靠近时,它们的电子云会发生瞬时涨落,形成一个暂时的电偶极矩,从而产生吸引力。
3.氢键:氢键是一种较强的分子间相互作用力,通常发生在含有氢原子和较电负的原子(如氮、氧和氟)之间。
氢键是靠氢原子与较电负原子之间的强电负性相互作用形成的。
4.离子作用力:当存在正离子和负离子时,它们之间会产生相互吸引的作用力。
正离子与负离子之间的吸引力被称为离子作用力。
这些分子间作用力决定了物质的许多性质,如沸点、熔点、溶解性、表面张力等。
不同类型的分子间作用力对于不同的物质起着不同的作用。
分子间的作用力的概念和内容

分子间的作用力的概念和内容一、分子间的作用力的概念和内容1、概念:分子间的作用力包括引力和斥力。
2、内容:分子间的引力和斥力是同时存在、同时消失的,是不会相互抵消的。
(1)当分子间的距离$r=10^{-10}$m时,引力等于斥力,分子之间作用力为零。
(2)当分子间的距离$r<10^{-10}$m时,分子之间的斥力大于引力,分子之间作用力表现为斥力。
(3)当分子间的距离$r>10^{-10}$m时,分子之间的引力大于斥力,分子之间作用力表现为引力。
(4)当分子间的距离大于$10^{-10}$m的10倍时,分子之间作用力变得十分微弱,可以忽略;“破镜难圆”就是由于断裂处的距离已经超出分子间引力作用的最大距离。
3、从分子间作用力的角度理解固体、液体、气体的特征:(1)固体中分子之间的距离小,相互作用力很大,分子只能在一定的位置附近振动,所以既有一定的体积,又有一定的形状。
(2)液体中分子之间的距离较小,相互作用力较大,以分子群的形态存在,分子可在某个位置附近振动,分子群却可以相互滑过,所以液体有一定的体积,但有流动性,形状随容器而变化。
(3)气体中分子之间的距离很大,相互作用力很小,每一个分子几乎都可以自由运动,所以气体既没有固定的体积,也没有固定的形状,可以充满能够达到的整个空间。
(4)固体很难被拉伸,是因为分子间存在着引力。
固体和液体很难被压缩,是因为分子间存在着斥力。
固体和液体能保持一定的体积是因为分子间存在着引力。
二、分子间的作用力的相关例题下面说法正确的是___A.当水凝固成冰后,水分子的热运动也就停止了B.气体分子间作用力要比固体分子间作用力大C.快速压缩气体,可使气体内能增大,温度升高D.热量总是从内能大的物体向内能小的物体传递答案:C解析:A.当水凝固成冰后,由于分子都在不停地做无规则运动,水分子的热运动不会停止,故A错误;B.与固体相比,空气很容易被压缩,这是因为气体分子间距离较大,分子间作用力较小,故B错误;C.快速压缩气体,对气体做功,可使气体内能增大,温度升高,故C正确;D.发生热传递的条件是两物体有温度差,高温物体的内能转移到低温物体,直到两者温度相同,热传递才停止,所以热量总是从温度高的物体传递到温度低的物体,故D错误。
分子间的相互作用力教案

分子间的相互作用力教案第一章:引言1.1 教学目标:让学生了解分子间相互作用力的概念。
激发学生对分子间相互作用力的兴趣。
1.2 教学内容:介绍分子间相互作用力的定义。
通过日常生活中的例子,让学生感受分子间相互作用力的存在。
1.3 教学方法:讲授法:讲解分子间相互作用力的定义和概念。
举例法:通过生活中的实例,让学生理解和感受分子间相互作用力。
1.4 教学评价:学生能够准确地描述分子间相互作用力的概念。
学生能够通过实例来说明分子间相互作用力的存在。
第二章:分子间的引力和斥力2.1 教学目标:让学生了解分子间存在的引力和斥力。
让学生知道这些力的作用和影响。
2.2 教学内容:讲解分子间的引力,包括范德华力和氢键。
讲解分子间的斥力,包括电子云重叠和离子间的电荷排斥。
2.3 教学方法:讲授法:讲解分子间的引力和斥力的概念和作用。
实验法:进行一些简单的实验,让学生观察和体验分子间的力。
2.4 教学评价:学生能够描述分子间的引力和斥力的概念。
学生能够解释这些力在日常生活中的作用和影响。
第三章:分子间的相互作用与物质的性质3.1 教学目标:让学生了解分子间的相互作用与物质的性质之间的关系。
让学生知道分子间相互作用力对物质的影响。
3.2 教学内容:讲解分子间的相互作用力与物质的熔点、沸点、溶解度和硬度等性质的关系。
分析不同分子间相互作用力对物质性质的影响。
3.3 教学方法:讲授法:讲解分子间的相互作用力与物质性质之间的关系。
案例分析法:分析一些具体的物质,让学生了解分子间相互作用力对物质性质的影响。
3.4 教学评价:学生能够描述分子间的相互作用力与物质性质之间的关系。
学生能够分析不同分子间相互作用力对物质性质的影响。
第四章:分子间的相互作用力与化学反应4.1 教学目标:让学生了解分子间的相互作用力对化学反应的影响。
让学生知道如何利用分子间的相互作用力来设计和控制化学反应。
4.2 教学内容:讲解分子间的相互作用力对化学反应的速率和选择性的影响。
分子间相互作用力
2.斥力随距离变化比较快 3.r=r0时引力等于斥力,分子力为零 4. r<r0 为斥力 5. r>r0
r0 F斥 为引力
0
r
F引 6.当r>10r0时,分子力等于0.
F分表示合力,即分子力.
二.分子之间的相互作用力
(1)分子之间的相互作用包括 斥力和引力,斥力和引力同时 存在,实际表现出来的分子力 是分子间斥力和引力的合力。
(2)斥力和引力都随分子间的距离增大 而减小,但斥力的变化比引力的变化快。 r0表示斥力和引力相等的分子间的距
离. 当分子间的距离r<r0时,斥力大于引 力,分子力表现为斥力. 当分子间的距离r>r0时,斥力小于引
力,分子力表现为引力.
r>r0
f斥 f引 f引 f斥
④当分子间距离超过它们的直径的10倍 时,相互作用 十分微弱,可认为分子力 为零。
三、分子力及引力和斥力的大小跟分子间距离 的关系。
1.分子力随分子间距的变化图 F 纵轴表示分子间的作用力 正值表示F斥
横轴表示分子间的距离
0
r 负值表示F引都随距离的增大而减小
分子间相互作用力
一、分子力随分子间距离变化的关系 ①r=r0(10-10m)时,分子引力和斥力 相等,分子力为零,分子处于平衡位 r=r0 置.
f斥
f引
f引
f斥
② r <r0时分子引力小于分子斥力,分子 力为斥力
r<r0
f引 f斥 f引 f斥
③ r >r0时,分子引力大于分子斥力, 分子力为引力;
分子间的相互作用力
3.分子间的相互作用力 (1)分子间同时存在着相互作用的 引力 和 斥力 .大量分子能聚 集在一起形成固体或液体,说明分子间存在着 引力 ;用力压缩 物体,物体内会产生反抗压缩的力,说明分子间存在着 斥力 . (2)当两个分子间的距离为 r0 时, 分子所受的引力与斥力大小相等, 此时分子所受的合力 为零 .当分子间的距离小于 r0 时,作用力的 合力表现为 斥力 ;当分子间的距离大于 r0 时,作用力的合力表 现为 引力 . 4.分子力的实质 (1)分子间的作用力本质上是一种 电磁力 . (2)分子间的作用力是由原子内部的带电粒子的 相互作用 引 起的.
解析 挤压后的铅分子之间的距离可以达到分子之间存在相 互作用力的距离范围,故不脱落的主要原因是分子之间存在 引力,故 D 正确,A、B、C 错误.
图3
例2
(单选)分子间的相互作用力由引力 F 引和斥力 F 斥两部分 ( A )
组成,则 A.F 斥和 F 引是同时存在的 B.F 引总是大于 F 斥,其合力总是表现为引力 C.分子之间的距离越小,F 引越小,F 斥越大
图2
三、阅读课本 [要点提炼]
理解分子间作用力的本质
分子间的作用力本质上是一种电磁力. 分子是由原子组成的, 原子内部有带正电的原子核和带负电 的电子, 分子间的作用力就是由这些带电粒子的相互作用引 起的.
例1
(单选)如图 3 所示,两个接触面平滑的 ( D )
铅柱压紧后悬挂起来,下面的铅柱不脱 落,主要原因是 A.铅分子做无规则热运动 B.铅柱受到大气压力作用 C.铅柱间存在万有引力作用 D.铅柱间存在分子引力作用
分子间存在空隙
分 子 间 的 相 互 作 用 力
①分子间存在相互作用的引力 F 引和 斥力 F 斥,它们的合力就是分子力 F ②分子间的引力 F 引和斥力 F 斥同时存在
分子间相互作用力的类型
分子间相互作用力的类型
分子间相互作用是化学中的一个基本概念,其类别主要有三种:范德华力、氢键和离子-离子相互作用力。
首先,范德华力是由于分子中极性不均匀而产生的分子间吸引力,也称为范德华相互作用。
这种相互作用力的强度很小,通常只有几
kJ/mol,但是由于其范围很大,可以达到一定的相互作用距离。
范德华力是所有分子间相互作用中最常见的一种,对于分子间的各种物理和化学现象的研究具有非常重要的意义。
其次,氢键是比范德华力强得多的一种相互作用力。
它是由于带有强电负性原子的分子与带有弱电正性氢原子的分子之间的作用力而产生的。
氢键最常见的例子是水分子中的氢键,它不仅仅是使水分子形成网络结构的机制,同时也是DNA分子中的碱基配对中的基本机制。
最后,离子-离子相互作用可以看作是氢键的一种特例。
当分子中带有正电荷或负电荷的离子遇到带有相反电荷的离子时,它们之间的相互作用就产生了离子-离子相互作用。
这种相互作用力的强度也非常大,通常在数十kJ/mol的范围内,能够影响物质的聚集和溶解性质。
总之,这三种分子间相互作用力在化学和生物学领域中都有广泛的应
用。
人们可以利用它们来理解物理和化学现象的基本机制,为材料和生命科学的发展提供重要的支持。
分子间相互作用力与距离的关系
分子间相互作用力与距离的关系
分子间相互作用力与距离之间存在一定关系。
一般来说,分子间相互作用力在两个分子之间随着距离的增加而减弱。
1. 范德华力:范德华力是一种吸引力,它是由于瞬时诱导极化引起的。
这种力与分子之间的瞬时诱导极化和电子云的重叠有关。
范德华力的大小与距离的第六次方成反比。
当两个分子之间的距离增加时,范德华力逐渐减弱。
2. 静电力:静电力是由于带电分子或离子之间的电荷相互作用引起的。
这种力的大小与距离的平方成反比。
当两个带电分子或离子之间的距离增加时,静电力减弱。
3. 氢键:氢键是一种弱的化学键。
它通常涉及到一个带有部分正电荷的氢原子与一个带有部分负电荷的电子云丰富的原子之间的相互作用。
氢键的强度和稳定性随着距离的增加而减弱。
需要注意的是,这些相互作用力是非共价的作用力,相对较弱。
在分子中,还存在着共价键,其强度不会随着距离的变化而明显改变。
总的来说,随着分子间的距离增加,各种分子间相互作用力会减弱,直到达到相互作用可忽略的程度。
这种距离与分子间相互作用力之间的关系对于理解分子的物理化学性质和分子间相互作用的影响至关重要。
分子间作用力的四种形成方式
分子间作用力的四种形成方式分子间作用力是分子之间相互作用的力量,它是物质存在和物质性质产生的基础。
分子间作用力的形成方式有四种,分别是范德华力、氢键、离子键和共价键。
一、范德华力范德华力是分子间最常见的一种作用力,它是由于分子内部电子的运动导致的。
分子中的电子在空间中的运动会引起电荷分布的不均匀,从而形成一种瞬时的偶极矩。
这种偶极矩会与附近的分子偶极矩相互作用,产生吸引力,即范德华力。
范德华力的大小与分子的极性有关,极性越大,范德华力越强。
二、氢键氢键是指分子中氢原子与氧、氮、氟等高电负性原子之间的相互作用。
氢键的形成需要具备三个条件:①氢原子与较电负的原子之间的键能较强,如氢原子与氮原子之间的键能;②氢原子与较电负的原子之间的距离适当,一般在1.5-2.5埃之间;③氢键的形成需要在分子中存在较为稳定的空间构型。
氢键的强度介于共价键和离子键之间,它对物质的性质起到重要的影响。
三、离子键离子键是指由正离子和负离子之间的静电作用力形成的化学键。
在离子键中,正离子和负离子之间相互吸引,形成离子晶体的结构。
离子键的强度较大,使离子晶体具有高熔点、高硬度和良好的导电性等性质。
离子键的形成需要具备两个条件:①正离子和负离子之间的电荷差异较大;②正离子和负离子之间的距离较近。
四、共价键共价键是指由两个非金属原子共享电子而形成的化学键。
在共价键中,原子之间通过电子的共享而相互吸引。
共价键的强度较大,使得共价化合物具有较高的熔点和沸点。
共价键的形成需要满足两个条件:①原子之间的电负性差异较小;②原子之间的距离适当。
共价键的形成可以是单一共价键、双键或者三键,共价键的类型决定了化合物的性质。
分子间作用力的四种形成方式分别是范德华力、氢键、离子键和共价键。
这些作用力对物质的结构和性质具有重要的影响,深入了解分子间作用力的形成方式有助于我们更好地理解物质的性质和相互作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子之间的相互作用力
1、共价键
共价键具有一定的大小和方向,是有机分子之间最强的作用力,化学物质(药物、毒物等)可以与生物大分子(受体蛋白或核酸)构成共价键,共价键除非被体内的特异性酶催化断裂以外,很难恢复原形,是不可逆过程,对酶来讲就是不可逆抑制作用。
这种作用常常形成长期的药理作用及毒理效应,如抗癌药、抗寄生虫药、化疗药、抗生素、杀虫剂等。
化学物质(药物等)的主要共价结合方式有烷基化作用、酰基化作用和磷酰化作用。
药物的主要共价结合方式
方式作用基团药物示例
烷基化N-氯乙基氮芥药物、环磷酰胺
正碳离子甲磺酸乙酯
氮丙啶基氮丙啶苯醌
双氧乙基T-2毒素
酰基化β-内酰胺基青霉素、头孢菌素
氨甲酰基毒扁豆碱
邻二甲酸酐基斑螯素
磷酰化磷酰基丙氟磷
二异丙基氟磷酸酯
药物的共价基团的选择性
药物的共价基团往往具有较高的化学活性而缺乏特异选择性。
有些药物或毒物本身结构并没有反应基团,而是在人体内转化生成活性基团。
如自力霉素和致癌物苯并蒽就是先在体内转化,再通过生成正碳离子而发生烷基化作用。
药物与生物大分子的化学反应与生物分子表面的基团和性质有关。
2、非共价键
生物体系中分子识别的过程不仅涉及到化学键的形成,而且具有选择性的识别。
共价键存在于一个分子或多个分子的原子之间,决定分子的基本结构,是分子识别的一种方式。
而非共价键(又称为次级键或分子间力)决定生物大分子和分子复合物的高级结构,在分子识别中起着关键的作用。
1)、静电作用
静电作用是指荷电基团、偶极以及诱导偶极之间的各种静电吸引力。
酶、核酸、生物膜、蛋白质等生物大分子的表面都具有可电离的基团和偶极基团存在,很容易与含有极性基团的底物或抑制剂等生成离子键和其它静电作用。
(1).离子键
生物大分子表面的带电基团可以与药物或底物分子的带电基团形成离子键。
这种键可以解离。
(2).离子-偶极作用
药物分子和受体分子中O、S、N和C原子的电负性均不相等,这些原子形成的键由于电负性差值可以产生偶极现象。
这种偶极部分与永久电荷可以形成静电作用。
离子-偶极相互作用一般比离子键小得多,键能与距离的平方差成反比,由于偶极矩是个向量,电荷与偶极的取向会影响药物-受体的作用强度。
如普鲁卡因及其衍生物的局部麻醉作用与酯羰基的偶极性质有关。
(3).偶极-偶极相互作用
两个原子的电负性不同,产生价键电子的极化作用,成为持久的偶极两个偶极间的作用。
偶极—偶极相互作用的大小,取决于偶极的大小、它们之间的距离和相互位置。
这种相互作用在水溶液中普遍存在。
它的作用强度比离子—偶极作用小,但比偶极—诱导偶极作用大。
这种作用对药物—受体相互作用的特异性和立体选择性非常重要。
2)、氢键
氢键的形成氢键是由两个负电性原子对氢原子的静电引力所形成,是一种特殊形式的偶极—偶极键。
它是质子给予体X-H和质子接受体Y之间的一种特殊类型的相互作用。
氢键的大小和方向氢键的键能比共价键弱,比范德华力强,在生物体系中为8.4~
33.4kj/mol(2-8kcal/mol)。
键长为0.25~0.31nm,比共价键短。
氢键的方向用键角表示,是指X—H与H…Y 之间的夹角,一般为180度~250度。
(1).氢键的分类
氢键可分为分子内和分子间氢键。
目前人们根据谱学和晶体结构数据按氢键强弱进行分类。
弱氢键uOH(cm-1)>3200, R(O…O)(nm)>0.270
中强氢键uOH(cm-1)>2800-3100, R(O…O)(nm)>0.26-0.270
强氢键uOH(cm-1)>700-2700, R(O…O)(nm)>0.240-0.260
近年来,人们又提出了一种芳香氢键(α—平面氢键),即芳环的电子云作为质子受体与一个氢键的质
子给体所形成的氢键。
已经证明这种氢键在蛋白质—DNA相互作用中能代替普通氢键的功能,用于蛋白质和DNA结合的能量约为2.09-4.18kj/mol,用于特异性识别过程的能量约为4.18-8.36kj/mol。
(2).氢键与质子传递
在生物体内氢键和质子的传递过程与某些重要的生命现象有着密切的联系,如酶的催化机制以及DNA 重组中的快速氢交换现象。
质子沿氢键的传递过程可以表示为:X—H…Y=[XHY]=X-…H +—Y 随着质子从给体X转移到受体Y上,氢键的势能曲线夜相应发生变化。
某些酶作用的第一步就是质子的定向传递,因此能有效调节质子的传递势垒。
质子传递发生后,导致给体和受体的电荷和构型的变化。
如果质子传递沿氢键链进行或与相邻氢键发生偶合,则会引起体系极性的改变,产生电荷的定向传导和分子结构的重排。
在单一氢键中,质子从给体原子转移到受体原子,有两种可能途径。
一种是质子隧道效应(proton tunneling),即质子隧穿势垒到达对面的势阱。
通常在低温下固体中的质子以隧道效应为主。
另一种途径是质子跃迁(proton flopping),即质子通过热活化翻跃势垒进入对面的势阱。
某些酶的活化过程与该机理有关。
3). 范德华力
这是一种普遍存在的作用力,是一个原子的原子核吸引另一个原子外围电子所产生的作用力。
它是一种比较弱的、非特异性的作用力。
这种作用力非常依赖原子间的距离,当相互靠近到大约0.4~0.6nm(4~6A?)时,这种力就表现出较大的集合性质。
范德华力包括引力和排斥力,其中作用势能与1/R6成正比的三种作用力(静电力、诱导力和色散力)通称为范德华引力。
(1).静电力
静电力是极性分子的永久偶极之间的静电吸引作用。
(2).诱导力
永久偶极矩诱导邻近分子,并使其发生电荷转移,出现诱导偶极矩。
永久偶极矩和诱导偶极矩之间存在吸引作用,此相互作用的能量称为诱导能。
诱导力通常是较弱的,并随温度升高而降低, 其大小随偶极矩指向的不同而不同,具有方向性。
(3).色散力
非极性分子有瞬间偶极矩。
瞬间偶极矩将在邻近分子中诱导出新的偶极矩。
瞬间偶极矩与诱导偶极矩间的相互作用力就叫做色散力。
在非极性分子之间只有色散力;在极性分子和非极性分子之间有诱导力也有色散力;在极性分子之间,静电力、诱导力和色散力都存在。
(4).排斥力
当分子间相距较远时,表现为范德华引力,当分子靠得很近时,则会出现排斥力。
和吸引力相比,排斥力是短程力。
总之范德华力是瞬息间作用力,时间大约为10-8s。
是非特异性的作用力,分子越复杂,原子或基团间接触点越多,其引力总和就越大。
多环芳烃致癌物与生物受体的作用及啶垒抗疟药与DNA 的结合主要为范德华力;而甾类化合物与受体的结合能主要表现为疏水作用和范德华力。
4)、疏水作用
疏水作用是指极性基团间的静电力和氢键使极性基团倾向于聚集在一起,因而排斥疏水基团,使疏水基团相互聚集所产生的能量效应和熵效应。
就化学分子来说,它们的非极性部分在生物体内的环境中均为水合状态,即被水分子所包围,当它们与受体接近到某种程度时,非极性部分周围的水分子便被挤出去,两个非极性区域的接触稳定化,从而缔合在一起。
蛋白质和酶的表面通常具有极性链或区域,这是由构成它们的氨基酸侧链上的烷基链或苯环在空间上相互接近时形成的。
高分子的蛋白质可形成分子内疏水链、疏水腔或疏水缝隙,可以稳定生物大分子的高级结构。
5)、电荷转移作用
在生物系统中,生物分子可以通过电子给予分子与电子接受分子的相互作用形成电荷转移复合物。
电荷转移是生物体系的重要作用方式和传能方式之一。
