第1章 化学中常用的物理量——物质的量 本章易错题重练
【化学】化学物质的量的专项培优 易错 难题练习题(含答案)附答案解析

【化学】化学物质的量的专项培优 易错 难题练习题(含答案)附答案解析一、高中化学物质的量1.物质的量是高中化学中常用的物理量,请回答下列问题:(1)某硫酸钠溶液中含有3.01×1023个Na +,则溶液中SO 42-的物质的量是_____mol 。
(2)在标准状况下,4.48 L HCl 气体溶于水配成500 mL 溶液,其物质的量浓度为_____________。
(3)在标准状况下,1.7 g 氨气所占的体积约为_________L ,与_____mol H 2S 含有相同的氢原子数。
(4)7.8 g Na 2X 中含Na + 0.2 mol ,则X 的摩尔质量是_____________________。
(5)实验室需要0.3 mol•L -1硫酸溶液480 mL 。
①配制过程用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管、试剂瓶外,还需要______________。
②需量取质量分数为98%、密度为1.84 g•cm -3的浓硫酸的体积为______mL 。
③配制过程中需先在烧杯中将浓硫酸进行稀释,操作方法是:_______________。
【答案】0.25 0.4 mo•L -1 2.24 0.15 32 g•mol -1 500mL 容量瓶 8.2 将浓硫酸沿烧杯内壁缓缓注入盛有水的烧杯中并用玻璃棒不断搅拌【解析】【分析】(1)硫酸钠为强电解质,完全电离,1molNa 2SO 4电离产生2molNa +和1molSO 42-; (2)依据m V n V =计算氯化氢的物质的量,依据n c V =计算溶液中氯化氢的物质的量浓度;(3)依据m V m n==V M结合氨气与硫化氢分子构成计算解答; (4)由钠离子物质的量计算Na 2X 的物质的量,根据mM=n 计算Na 2X 的摩尔质量,进而计算X 的相对原子质量;(5)①依据配制溶液的体积,选择需要的容量瓶;②依据1000c Mw ρ=计算硫酸的物质的量浓度,依据稀释过程中溶质的物质的量不变计算需要浓硫酸的体积; ③依据浓硫酸稀释的正确操作解答,注意浓硫酸的密度大于水,稀释产生大量的热。
2020-2021历年备战高考化学易错题汇编-物质的量练习题附答案

2020-2021历年备战高考化学易错题汇编-物质的量练习题附答案 一、高中化学物质的量 1.填写下列表格
序号 物质 分子数(用NA表示) 质量/g 物质的量/mol 摩尔质量/g·mol-1 体积/标况 (1) 氮气 ___ 14 ___ ___ ___ (2) H2SO4 3.01×1022 ___ ___ ___ 空 (3) H2O ___ ___ 0.5 ___ 空 (4) Cl2 ___ ___ ___ ___ 2.24L
【答案】0.5NA 0.5 28 11.2 4.9 0.05 98 0.5NA 9 18 0.1NA 7.1 0.1 7.1 【解析】 【分析】
摩尔质量在以为g·mol-1单位时,数值上等于相对分子质量,以n=ANN、n=mM、n=m
V
V
这几个公式为基础,按试题中的要求,进行计算。 【详解】 (1)N2的摩尔质量在以为g·mol-1单位时,数值上等于相对分子质量,所以N2的摩尔质
量是28 g·mol-1,当N2的质量为14g时,n(N2)= 11428.ggmol=0.5mol,N2的分子数N(N2)= 0.5 NA,标况下N2的体积为:0.5mol22.4L·mol-1=11.2L;
(2)H2SO4的分子数是3.01×1022,H2SO4的物质的量:n(H2SO4)= 22233.01106.0210=0.05 mol,H2SO4的摩尔质量是98 g·mol-1,质量:m(H2SO4)= 0.05 mol×98 g·mol-1=4.9g;
(3)H2O的物质的量是0.5 mol,水的摩尔质量:M(H2O)=18 g·mol-1,水分子的个数N(H2O)= 0.5 NA,水分子的质量是:m(H2O)= 0.5 mol×18 g·mol
-1
=9g;
(4)Cl2标况下的体积试剂2.24L,Cl2的物质的量:n(Cl2)= 12.2422.4LLmolg=0.1mol,Cl2的分子数是:N(N2)=0.1 NA,Cl2的摩尔质量是71 g·mol-1,Cl2的质量:m(Cl2)= 0.1mol71 g·mol-1=7.1g;
精选高考化学易错题专题复习物质的量附答案解析

精选高考化学易错题专题复习物质的量附答案解析一、高中化学物质的量1.现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
(1)沉淀A的主要成分是_____________、______________(填化学式)。
(2)①②③中均进行的分离操作是_______________。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(4)实验探究小组在实验中需要用到456 mL1 mol•L-1的HNO3溶液,但是在实验室中只发现一瓶8 mol•L-1的HNO3溶液,该小组用8mol•L-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括________、_____mL量筒、烧杯、________、胶头滴管等。
②该实验中需要量取8mol•L-1的HNO3溶液________mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________。
A.取用8mol•L-1的HNO3溶液溶液时仰视量筒刻度线B.量取用的量筒水洗后未进行任何操作C.8mol•L-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯D.定容时仰视刻度线E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作【答案】BaSO4 BaCO3过滤 Na2CO3 HNO3 500mL 容量瓶 100 玻璃棒 62.5 AC 【解析】【分析】由实验流程可知,加入过量的Ba(NO3)2,生成BaSO4、BaCO3沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3。
2020-2021高考化学复习物质的量专项易错题及答案

2020-2021高考化学复习物质的量专项易错题及答案一、高中化学物质的量1.物质的量是高中化学中常用的物理量,请回答下列问题:(1)某硫酸钠溶液中含有3.01×1023个Na +,则溶液中SO 42-的物质的量是_____mol 。
(2)在标准状况下,4.48 L HCl 气体溶于水配成500 mL 溶液,其物质的量浓度为_____________。
(3)在标准状况下,1.7 g 氨气所占的体积约为_________L ,与_____mol H 2S 含有相同的氢原子数。
(4)7.8 g Na 2X 中含Na + 0.2 mol ,则X 的摩尔质量是_____________________。
(5)实验室需要0.3 mol•L -1硫酸溶液480 mL 。
①配制过程用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管、试剂瓶外,还需要______________。
②需量取质量分数为98%、密度为1.84 g•cm -3的浓硫酸的体积为______mL 。
③配制过程中需先在烧杯中将浓硫酸进行稀释,操作方法是:_______________。
【答案】0.25 0.4 mo•L -1 2.24 0.15 32 g•mol -1 500mL 容量瓶 8.2 将浓硫酸沿烧杯内壁缓缓注入盛有水的烧杯中并用玻璃棒不断搅拌【解析】【分析】(1)硫酸钠为强电解质,完全电离,1molNa 2SO 4电离产生2molNa +和1molSO 42-; (2)依据m V n V =计算氯化氢的物质的量,依据n c V =计算溶液中氯化氢的物质的量浓度;(3)依据m V m n==V M结合氨气与硫化氢分子构成计算解答; (4)由钠离子物质的量计算Na 2X 的物质的量,根据mM=n 计算Na 2X 的摩尔质量,进而计算X 的相对原子质量;(5)①依据配制溶液的体积,选择需要的容量瓶;②依据1000c Mw ρ=计算硫酸的物质的量浓度,依据稀释过程中溶质的物质的量不变计算需要浓硫酸的体积; ③依据浓硫酸稀释的正确操作解答,注意浓硫酸的密度大于水,稀释产生大量的热。
【化学】化学物质的量的专项培优 易错 难题练习题(含答案)及答案解析

【化学】化学物质的量的专项培优 易错 难题练习题(含答案)及答案解析一、高中化学物质的量1.物质的量是高中化学中常用的物理量,请回答下列问题:(1)某硫酸钠溶液中含有3.01×1023个Na +,则溶液中SO 42-的物质的量是_____mol 。
(2)在标准状况下,4.48 L HCl 气体溶于水配成500 mL 溶液,其物质的量浓度为_____________。
(3)在标准状况下,1.7 g 氨气所占的体积约为_________L ,与_____mol H 2S 含有相同的氢原子数。
(4)7.8 g Na 2X 中含Na + 0.2 mol ,则X 的摩尔质量是_____________________。
(5)实验室需要0.3 mol•L -1硫酸溶液480 mL 。
①配制过程用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管、试剂瓶外,还需要______________。
②需量取质量分数为98%、密度为1.84 g•cm -3的浓硫酸的体积为______mL 。
③配制过程中需先在烧杯中将浓硫酸进行稀释,操作方法是:_______________。
【答案】0.25 0.4 mo•L -1 2.24 0.15 32 g•mol -1 500mL 容量瓶 8.2 将浓硫酸沿烧杯内壁缓缓注入盛有水的烧杯中并用玻璃棒不断搅拌【解析】【分析】(1)硫酸钠为强电解质,完全电离,1molNa 2SO 4电离产生2molNa +和1molSO 42-; (2)依据m V n V =计算氯化氢的物质的量,依据n c V =计算溶液中氯化氢的物质的量浓度;(3)依据m V m n==V M结合氨气与硫化氢分子构成计算解答; (4)由钠离子物质的量计算Na 2X 的物质的量,根据mM=n 计算Na 2X 的摩尔质量,进而计算X 的相对原子质量;(5)①依据配制溶液的体积,选择需要的容量瓶;②依据1000c Mw ρ=计算硫酸的物质的量浓度,依据稀释过程中溶质的物质的量不变计算需要浓硫酸的体积; ③依据浓硫酸稀释的正确操作解答,注意浓硫酸的密度大于水,稀释产生大量的热。
鲁教版化学必修1第一章第3节-化学中常用的物理量——物质的量知识点复习总结
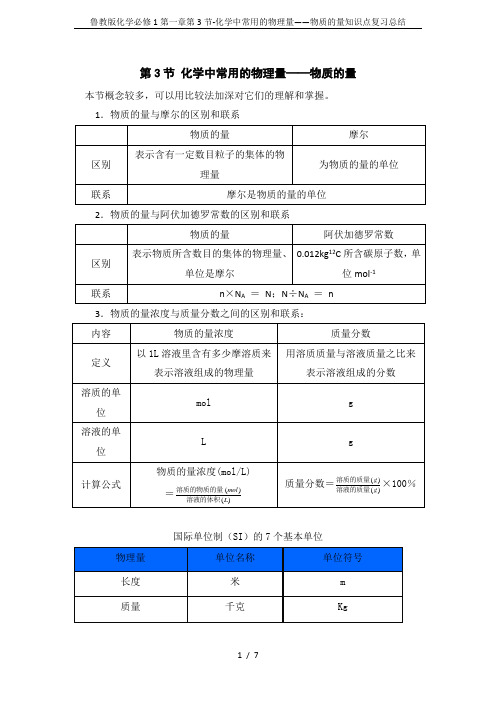
第3节化学中常用的物理量——物质的量本节概念较多,可以用比较法加深对它们的理解和掌握。
1.物质的量与摩尔的区别和联系2.物质的量与阿伏加德罗常数的区别和联系3.物质的量浓度与质量分数之间的区别和联系:国际单位制(SI)的7个基本单位已知:一个碳原子的质量为 1.993 × 10-23kg求: 0.012kg 碳-12 中所含的碳原数?物质的量知识点小结有关概念:1、物质的量(n)①物质的量是国际单位制中七个基本物理量之一。
②用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,它的单位是摩尔,即一个微观粒子群为1摩尔。
③摩尔是物质的量的单位。
摩尔是国际单位制中七个基本单位之一,它的符号是mol。
④“物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。
⑤摩尔的量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。
如1molCaCl2可以说含1molCa2+,2molCl-或3mol 阴阳离子,或含54mol质子,54mol电子。
摩尔不能量度宏观物质,如果说“1mol 氢”就违反了使用准则,因为氢是元素名称,不是微粒名称,也不是微粒的符号或化学式。
⑥使用摩尔时必须指明物质微粒的名称或符号或化学式或符号的特定组合。
2.阿伏加德罗常数(NA):①定义值(标准):以0.012kg(即12克)碳-12原子的数目为标准;1摩任何物质的指定微粒所含的指定微粒数目都是阿伏加德罗常数个。
②近似值(测定值):经过科学测定,阿伏加德罗常数的近似值一般取6.02×1023,单位是mol-1,用符号NA表示。
3.摩尔质量(M):①定义:1mol某微粒的质量②定义公式:,③摩尔质量的单位:克/摩。
④数值:某物质的摩尔质量在数值上等于该物质的原子量、分子量或化学式式量。
⑤注意:摩尔质量有单位,是克/摩,而原子量、分子量或化学式的式量无单位。
4.气体摩尔体积(Vm)①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。
【化学】化学物质的量的专项培优 易错 难题练习题(含答案)含详细答案
【化学】化学物质的量的专项培优 易错 难题练习题(含答案)含详细答案一、高中化学物质的量1.物质的量是高中化学中常用的物理量,请回答下列问题:(1)某硫酸钠溶液中含有3.01×1023个Na +,则溶液中SO 42-的物质的量是_____mol 。
(2)在标准状况下,4.48 L HCl 气体溶于水配成500 mL 溶液,其物质的量浓度为_____________。
(3)在标准状况下,1.7 g 氨气所占的体积约为_________L ,与_____mol H 2S 含有相同的氢原子数。
(4)7.8 g Na 2X 中含Na + 0.2 mol ,则X 的摩尔质量是_____________________。
(5)实验室需要0.3 mol•L -1硫酸溶液480 mL 。
①配制过程用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管、试剂瓶外,还需要______________。
②需量取质量分数为98%、密度为1.84 g•cm -3的浓硫酸的体积为______mL 。
③配制过程中需先在烧杯中将浓硫酸进行稀释,操作方法是:_______________。
【答案】0.25 0.4 mo•L -1 2.24 0.15 32 g•mol -1 500mL 容量瓶 8.2 将浓硫酸沿烧杯内壁缓缓注入盛有水的烧杯中并用玻璃棒不断搅拌【解析】【分析】(1)硫酸钠为强电解质,完全电离,1molNa 2SO 4电离产生2molNa +和1molSO 42-; (2)依据m V n V =计算氯化氢的物质的量,依据n c V =计算溶液中氯化氢的物质的量浓度;(3)依据m V m n==V M结合氨气与硫化氢分子构成计算解答; (4)由钠离子物质的量计算Na 2X 的物质的量,根据mM=n 计算Na 2X 的摩尔质量,进而计算X 的相对原子质量;(5)①依据配制溶液的体积,选择需要的容量瓶;②依据1000c Mw ρ=计算硫酸的物质的量浓度,依据稀释过程中溶质的物质的量不变计算需要浓硫酸的体积; ③依据浓硫酸稀释的正确操作解答,注意浓硫酸的密度大于水,稀释产生大量的热。
高考化学复习物质的量专项易错题含详细答案
高考化学复习物质的量专项易错题含详细答案一、高中化学物质的量练习题(含详细答案解析)1.按要求填空,已知N A为阿伏伽德罗常数的数值。
(1)标准状况下,2.24L Cl2的质量为____;有__个氯原子。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是____。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32﹣质量之比为51:300,则这两种离子的物质的量之比为____。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____。
(5)标准状况下,3.4g NH3的体积为___;它与标准状况下____L H2S含有相同数目的氢原子。
(6)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为___;R元素名称是___。
(7)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___,混和溶液中Cl-的物质的量___(忽略混合前后溶液体积的变化)。
(8)a个X原子的总质量为b g,则X的相对原子质量可以表示为____(9)已知CO、CO2混合气体的质量共11.6g,在标准状况下的体积为6.72L,则混合气体中CO的质量为___;CO2在相同状况下的体积为___。
(10)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。
则该混合气体中CH4和O2的体积比为___。
【答案】7.1g 0.2N A或1.204×1023 0.6mol 3:5 SO2 4.48L 6.72 14 氮 1mol/L0.02mol baN A或6.02×1023ba2.8g 4.48L 3:13【解析】【分析】(1)先计算标准状况下,2.24L Cl2的物质的量,再计算氯气的质量和氯原子个数;(2)由化学式计算硫酸根的物质的量;(3)由两种离子的质量比结合摩尔质量计算两种离子的物质的量之比;(4)由n=mM可知,质量相同的不同气体,气体的摩尔质量越大,物质的量越小,分子数越小;(5)先计算标准状况下,3.4g NH3的物质的量,再计算气体体积和所含氢原子的物质的量,最后依据氢原子的物质的量计算硫化氢的体积;(6)由R2O5的质量和所含氧原子个数建立关系式计算R的相对原子质量;(7)将10mL 1.00 mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和发生反应,生成碳酸钙沉淀和氯化钠,反应过程中Na+和Cl-的物质的量不变;(8)先计算a个X原子的物质的量,再依据质量计算X的摩尔质量;(9)依据混合气体的质量和体积建立求解关系式求得一氧化碳和二氧化碳的物质的量,在分别计算一氧化碳质量和二氧化碳体积;(10)先计算混合气体的平均相对分子质量,再依据公式计算甲烷和氧气的体积比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、常考易错选择题选项再排查
正误判断,正确的打“√”,错误的打“×”
1.(1)考查气体摩尔体积适用条件及物质的聚集状态
①常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA( )
②常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA( )
③标准状况下,22.4 L二氯甲烷的分子数约为4NA个( )
答案 ①√ ②× ③×
(2)考查物质的组成和结构
①78 g苯含有C==C双键的数目为3NA( )
②28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA( )
③1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023( )
④1.7 g H2O2中含有电子数为0.9NA( )
⑤10.00 mol NaCl中含有6.02×1023个NaCl分子( )
答案 ①× ②√ ③√ ④√ ⑤×
(3)考查氧化还原反应电子转移数目
①标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( )
②1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子( )
③常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA( )
④1 mol Cl2与足量Fe反应,转移的电子数为3NA( )
答案 ①× ②√ ③√ ④×
(4)考查电解质溶液中粒子的数目
①1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA( )
②1 L 0.1 mol·L-1氨水含有0.1NA个OH-( )
③10 L pH=1的硫酸溶液中含有的H+离子数为2NA( )
④10 L pH=13的NaOH溶液中含有的OH-离子数为NA( )
答案 ①× ②× ③× ④√
(5)考查一些特殊反应
①50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA( )
②某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为
0.6NA( )
③1 mol Cu和足量稀硝酸反应产生NA个NO分子( )
答案 ①× ②× ③×
2.(1)1.0 L 1.0 mol·L-1的Na[Al(OH)4]水溶液中含有的氧原子数为2NA( )
(2)2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA( )
(3)欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl 溶于1.00 L水中( )
(4)1 mol·L-1NaCl溶液含有NA个Na+( )
(5)常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2NA( )
(6)含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L-1( )
答案 (1)× (2)× (3)× (4)× (5)√ (6)×
3.(1)配制0.100 0 mol·L-1氯化钠溶液时,玻璃棒在整个实验中的作用是引流( )
(2)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小( )
(3)用pH=1的盐酸配制100 mL pH=2的盐酸需要100 mL容量瓶、烧杯、玻璃棒、胶头滴
管( )
答案 (1)× (2)× (3)×
二、常考笔答题答题语言再规范
1.实验室需要0.5 mol·L-1的NaOH溶液470 mL,配制时应称量________g NaOH,称量时需
要____________、__________、__________(填仪器名称)。
答案 10.0 托盘天平 小烧杯 药匙
2.检查容量瓶是否漏水的方法:___________________________________________。
答案 向容量瓶中加入适量水,盖好瓶塞,右手食指顶住瓶塞,左手托住瓶底,将容量瓶倒
转过来看瓶口处是否有水渗出,若没有,将容量瓶倒立,将瓶塞旋转180度,重复上述操作,
如果瓶口仍无水渗出,则此容量瓶不漏水
3.配制一定物质的量浓度溶液定容时的操作是________________________________。
答案 往容量瓶中缓慢加蒸馏水,等液面离容量瓶瓶颈刻度线1~2 cm时,改用胶头滴管滴
加蒸馏水至液面与刻度线相切
4.为测定镁铝合金中铝的含量,设计如下图所示的实验:
(1)锥形瓶中反应的化学方程式___________________________________________。
(2)装置中导管a的作用是_______________________________________________。
(3)读数前调平B、C装置液面的方法是___________________________________,
其目的是_____________________________________________________________。
(4)若拆去实验中导管a,使测得气体体积________(填“偏大”、“偏小”或“无影响”)。
答案 (1)2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(2)平衡分液漏斗与锥形瓶内的气压,使液体顺利流下
(3)上下缓慢移动量气管C 使B内的气压等于外界大气压
(4)偏大
5.SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
实验室中“漂洗”沉淀的实验操作方法是___________________________________。
答案 (沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操
作2~3次
解析 “漂洗”沉淀就是洗涤沉淀,需要直接在过滤器中进行,(沿玻璃棒)向漏斗(或过滤器)
中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次。
6.氯化亚铜在氯的衍生物产品中占有较突出的位置,在有机合成工业中可作催化剂。以下是
从Cu、Fe的电镀废水制备氯化亚铜的工艺流程图。
结晶后采用无水乙醇洗涤的原因是_________________________________________。
答案 降低CuCl在洗涤时的损失,乙醇容易挥发
解析 CuCl晶体不溶于乙醇,可以用乙醇洗去晶体表面杂质,且乙醇容易挥发,比较容易干
燥。
