电化学原理习题课. 共56页
电化学知识点总结+习题练习解析版

专题六电化学[ 考纲要求] 1.理解原电池和电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。
2.了解常见化学电源的种类及其工作原理。
3.了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。
考点一原电池的工作原理及其应用图解原电池工作原理.原电池装置图的升级考查说明(1)无论是装置① 还是装置②,电子均不能通过电解质溶液。
(2)在装置①中,由于不可避免会直接发生Zn +Cu2 +===Cu +Zn2+而使化学能转化为热能,所以装置②的能量转化率高。
(3)盐桥的作用:原电池装置由装置① 到装置② 的变化是由盐桥连接两个“半电池装置” ,其中盐桥的作用有三种:① 隔绝正负极反应物,避免直接接触,导致电流不稳定;②通过离子的定向移动,构成闭合回路;③ 平衡电极区的电荷。
(4) 离子交换膜作用:由装置②到装置③的变化是“盐桥”变成“质子交换膜”。
离子交换膜是一种选择性透过膜,允许相应离子通过,离子迁移方向遵循电池中离子迁移方向。
题组一原电池电极反应式书写集训(一) 辨析“介质”书写电极反应式1.按要求书写不同“介质”下甲醇燃料电池的电极反应式。
(1) 酸性介质,如H2SO4 溶液:负极:CH3OH-6e-+H2O===CO2+6H+。
正极:3O2 +6e-+6H+===3H 2O 。
2(2) 碱性介质,如KOH 溶液:负极:CH3OH-6e-+8OH-===CO23-+6H2O。
正极:3O2+6e +3H 2O ===6OH 。
2(3) 熔融盐介质,如K2CO3:负极:CH OH-6e-+3CO2 ===4CO +2H O。
3 3 2 2正极:3O2+6e-+3CO 2= ==3CO23-。
2(4) 掺杂Y2O3的ZrO3 固体作电解质,在高温下能传导O2-:负极:CH3OH-6e-+3O2-===CO2+2H2O。
3 --正极:O2+6e ===3O2。
2(二) 明确“充、放电”书写电极反应式2.镍镉(Ni -Cd)可充电电池在现代生活中有广泛应用。
习题课---电化学_动力学部分

《物理化学》习题课 (电化学、动力学部分)(中科院2009硕士入学考试)1. 某药物分解反应为一级反应,298K 时,反应速率常数k 为0.46h -1,若服用该药物0.16g ,则体内停留多长时间分解90%?A) 3h B) 5h C) 4.6h D) 6h2. 升高温度可以增加反应速率,主要原因是A) 增加分子总 B) 增加活化分子总数C) 降低反应的活化能 D) 使反应向吸热方向进行3. 浓度为0.001 mol/L 的硫酸钠溶液的电导率为0.026 S.cm 2,当该溶液饱和了硫酸钙以后,电导率上升为0.070 S.cm 2,求硫酸钙的活度积(已知Na +与1/2Ca 2+的摩尔电导率分别为5.0×10-3和6.0×10-3 S.m 2.mol -1)4. 某气相反应12()()()k k A g B g C g −−→+←−−,在298K 时,K 1=0.2s -1,K 2=5×10-6 pa ∙s -1,当温度升高到310K 时,K 1和K 2均增加1倍,求:(1)298K 的平衡常数; (2)正逆反应的表观活化能; (3)反应的r m H ∆; (4)在298K 时,A 的起始压力为101.325kpa ,总压力到151.99kpa 时,需时间多少?(中科院2007硕士入学考试)5. 某反应的速率常数与各基元反应的速率常数的关系为124()2k k k k =,则该反应的表观活化能E a 与各基元反应活化能的关系为: (A) 21412a E E E E =+- (B) 2141()2a E E E E =+- (C) 1/2214(2)a E E E E =+- (D) 214a E E E E =+-6. 在化学反应动力学中,反应级数是个宏观的概念,其值 。
(A )只能是正整数; (B )可正、可负、可为零,可以是整数,也可以是分数;(C )只能是0,1,2,3,· ; (D )无法确定。
高考化学 专题十二 电化学练习
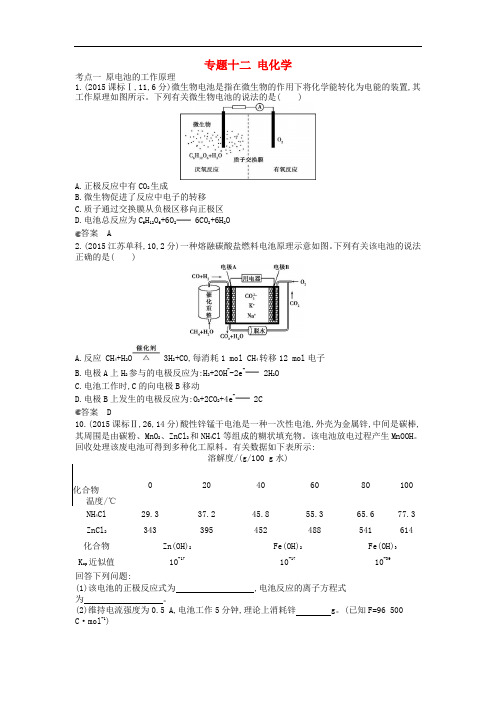
专题十二电化学考点一原电池的工作原理1.(2015课标Ⅰ,11,6分)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法的是( )A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O2 6CO2+6H2O答案 A2.(2015江苏单科,10,2分)一种熔融碳酸盐燃料电池原理示意如图。
下列有关该电池的说法正确的是( )A.反应 CH4+H2O 3H2+CO,每消耗1 mol CH4转移12 mol电子B.电极A上H2参与的电极反应为:H2+2OH--2e- 2H2OC.电池工作时,C的向电极B移动D.电极B上发生的电极反应为:O2+2CO2+4e- 2C答案 D10.(2015课标Ⅱ,26,14分)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。
该电池放电过程产生MnOOH。
回收处理该废电池可得到多种化工原料。
有关数据如下表所示:溶解度/(g/100 g水)0 20 40 60 80 100 化合物温度/℃NH4Cl 29.3 37.2 45.8 55.3 65.6 77.3 ZnCl2343 395 452 488 541 614 化合物Zn(OH)2Fe(OH)2Fe(OH)3K sp近似值10-1710-1710-39回答下列问题:(1)该电池的正极反应式为,电池反应的离子方程式为。
(2)维持电流强度为0.5 A,电池工作5分钟,理论上消耗锌g。
(已知F=96 500 C·mol-1)(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过分离回收;滤渣的主要成分是MnO2、和,欲从中得到较纯的MnO2,最简便的方法为,其原理是。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀H2SO4和H2O2溶解,铁变为,加碱调节至pH为时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。
2018届二轮复习 电化学原理 课件(76张)(全国通用)

2.正误判断,正确的划“√”,错误的划“✕”。 (1)铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 ( (2)原电池的负极材料一定比正极材料活泼 ( ) ) )
(3)原电池的负极发生氧化反应,正极发生还原反应 ( (4)原电池工作时负极材料一定发生损耗 ( (5)实现Zn+2H+ ) Zn2++H2↑的反应装置只能是原电池 (
正极:得电子,发生还原反应。
外电路中,电子从负极流出经 子移向 ,阴离子移向
流入正极。电解质溶液中,阳离 。
(4)原电池原理的应用 ①比较金属的活动性强弱;②加快化学反应速率;③用于金属的防护;④ 设计制作原电池。
答案 (2)①活泼性不同的 ②电解质溶液或熔融电解质
闭合回路 ③氧化还原 (3)导线 正极 负极
2 C.22.4<V≤44.8时,负极的电极反应为:CH4-8e-+9C O 3 +3H2O
O2 Pb+S 4 ,错误;C项,左侧电极上Zn失
去电子生成Zn2+,S O 2 通过阴离子交换膜向左迁移 ,故左边c(ZnSO4)增大, 4
右边PbSO4得电子产生的S O 2 全部移向左边 ,故右边c(ZnSO4)不变,正确; 4 2 D项,据Zn~PbSO4~S O 2 可知 , 若溶解 6.5 g Zn, 则正极有 0.1 mol S 生成 , O 4 4
答案 B A项,O2-向负极(NiO电极)移动,故错;B项,负极反应式为NO+ O2--2eNO2,正确;C项,O2的电极反应产物为O2-,故错;D项,根据得失
电子守恒可知反应消耗的NO与O2的物质的量之比为2∶1,故错。
3.(2017福建厦门一模,13)铁碳微电解技术是利用原电池原理处理酸性 污水的一种工艺,装置如图所示。若上端开口关闭,可得到强还原性的 H· (氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的· OH(羟基 自由基)。下列说法错误的是 ( )
高中化学必修课----《电化学》单元复习知识讲解及巩固练习题(含答案解析)

电镀池 应用电解原理在某些金属表面镀 上一层其他金属(或合金)的装 置
装置 举例
①活泼性不同的两电极(连 ①两电极接直流电源
①镀层金属接电源正极。镀件(待
接)
②两电极插入电解质溶液
形成
②电解质溶液(电极插入其 ③形成闭合回路
条件
中并与电极自发反应)
镀金属)接电源负极 ②电镀液必须含有镀层金属离子 (电镀过程浓度不变)
相对原子质量小。
附:用惰性电极电解下列电解质溶液变化情况简析
类型
电极反应特点
实例 电解物质 电解质 pH
电解质
溶液浓度
溶液复原
电解水型 阴极:2H++2e-=H2↑ 阳极:4OH--4e-=2H2O+O2↑
电解 电解质电离出的阴、阳离子分别
NaOH H2SO4 Na2SO4 HCl
水 水 水 电解质
③形成闭合回路
负极:较活泼金属(电子流 阳极:与电源正极相连的极 名称同电解池,但有限制条件
电极 出的极)
阴极:与电源负极相连的极 阳极:必须是镀层金属
名称 正极:较不活泼金属或能导
阴极:镀件
电的非金属(电子流入的极)
负极:发生氧化反应,失电 阳极:发生氧化反应,溶液 阳极:镀层金属电极失电子(溶
子
量不变,则此电极上一定有气体产生,且该气体一定是 H2。 4、溶液中,若阳离子的放电能力强于 H+,而阴离子的放电能力强于 OH-时,电解的实质是:电解电解
质本身。
5、溶液中,若阳离子的放电能力强于 H+,而阴离子的放电能力弱于 OH-时,电解的实质是:电解质的
阳离子和水电离出的 OH-放电,溶液的 pH 一定变小。如电解 CuSO4 溶液。 6、溶液中,若阳离子的放电能力弱于 H+,而阴离子的放电能力强于 OH-时,电解的实质是:电解质的
关于物理化学习题七章电化学

第七章电化学一•基本要求1. 理解电化学中的一些基本概念,如原电池和电解池的异同点,电极的阴、阳、正、负的定义,离子导体的特点和Faraday定律等。
2. 掌握电导率、摩尔电导率的定义、计算、与浓度的关系及其主要应用等。
了解强电解质稀溶液中,离子平均活度因子、离子平均活度和平均质量摩尔浓度的定义,掌握离子强度的概念和离子平均活度因子的理论计算。
3. 了解可逆电极的类型和正确书写电池的书面表达式,会熟练地写岀电极反应、电池反应,会计算电极电势和电池的电动势。
4. 掌握电动势测定的一些重要应用,女口:计算热力学函数的变化值,计算电池反应的标准平衡常数,求难溶盐的活度积和水解离平衡常数,求电解质的离子平均活度因子和测定溶液的pH等。
5 .了解电解过程中的极化作用和电极上发生反应的先后次序,具备一些金属腐蚀和防腐的基本知识,了解化学电源的基本类型和发展趋势。
二•把握学习要点的建议在学习电化学时,既要用到热力学原理,又要用到动力学原理,这里偏重热力学原理在电化学中的应用,而动力学原理的应用讲得较少,仅在电极的极化和超电势方面用到一点。
电解质溶液与非电解质溶液不同,电解质溶液中有离子存在,而正、负离子总是同时存在,使溶液保持电中性,所以要引入离子的平均活度、平均活度因子和平均质量摩尔浓度等概念。
影响离子平均活度因子的因素有浓度和离子电荷等因素,而且离子电荷的影响更大,所以要引进离子强度的概念和Debye-Hu ckel极限定律。
电解质离子在传递性质中最基本的是离子的电迁移率,它决定了离子的迁移数和离子的摩尔电导率等。
在理解电解质离子的迁移速率、电迁移率、迁移数、电导率、摩尔电导率等概念的基础上,需要了解电导测定的应用,要充分掌握电化学实用性的一面。
电化学在先行课中有的部分已学过,但要在电池的书面表示法、电极反应和电池反应的写法、电极电势的符号和电动势的计算方面进行规范,要全面采用国标所规定的符号,以便统一。
电化学原理教学课件
电化学原理
电 化 学 原 理
考纲要求考 点来自分 值得 分(1)原电池装置原理判断,原电池电极反应 和电池反应方程式的书写 (2)常见化学电源的种类,碱性锌锰干电池、 铅蓄电池、燃料电池的工作原理及其应用 价值 (3)电解池装置原理判断,电解池电极判断 与电极反应和电池反应方程式的书写 (4)一些电解过程(如电解熔融氯化钠、饱 和食盐水)实例工作原理分析及电极反应 式书写与判断 (5)了解电解原理在氯碱生产、金属精炼和 电镀中的应用
电化学原理 例 1、[2007高考∙海南卷∙14]依据氧化还原反应: 2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电 池如图所示: ⑴电极X的材料是 Cu ; AgNO3 电解质溶液Y是 ; ⑵银电极为电池的 正 极,发生的电极反应 + + e- = Ag Ag 为 ; 题目解析: X考点:原电池装置判断 电极上发生的电极 - = Cu2+ Cu 2e 反应为 ; 分值:1+1+1 得分: ⑶外电路中的电子 是从 Cu 电极 流向 Ag 电极。
使电流通过电解质溶液而在阴、阳两 极引起氧化还原反应的过程叫做电解。 这种把电能转变为化学能的装置叫做 电解池。 ①电源 ②电极(惰性或非惰性) ③电解质(水溶液或熔化态) 非自发的氧化还原反应 由外电源决定: 阳极:连电源的正极; 阴极:连电源的负极;
电极名称
电极反应 电子流向
负极:Zn-2e-=Zn 2+ (氧化反应) 阴极:Cu2+ +2e- = Cu (还原反应) 阳极:2Cl--2e-=Cl2↑ (氧化反应) 正极:2H++2e-=H2↑(还原反应) 负极→正极 电源负极→阴极;阳极→电源正极
电化学专题(共64张ppt)
课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT 课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT
课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优Байду номын сангаас课 课件免 费课件 PPT 课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT
课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT 课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT
课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT 课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT
3、科学家
4.支撑海港码头基础的钢管桩,常用外加电流的阴 极保护法进行防腐,工作原理如图所示,其中高硅铸 铁为惰性辅助阳极。下列有关表述不正确的是 ()
5.用电解氧化法可以在铝制品表面形成致密、耐腐蚀 的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。 下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为Al3++3e -=A1 D.硫酸根离子在电解过程中向阳极移动
课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT 课件PPT部编版课件统编版部编版电 化学专 题(共6 4张ppt )课件 优质课 课件免 费课件 PPT
电化学辅导习题练习Word版
高中化学选修四第四章《电化学基础》习题课学案设计宁夏固原二中黄占军 2014.10如图所示,若电解5min时,铜电极质量增加2.16g。
试回答:(1)电源电极X名称为_________(填“正极”或“负极”)(2)电解池中溶液的pH变化:B______C______(填“增大”“减小”或“不变”)(3)A中发生反应的化学方程式为__________________________________若要使A中NaCl溶液恢复原浓度、原体积,应加入适量的下列物质中的_____O D.HCl (填序号) A.盐酸 B.NaCl C.H2若A中NaCl溶液的体积也是200mL,电解5min时溶液的pH为____。
(4)B中阳极的电极反应式为____________;若通电5min时,B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量的浓度约为_____________。
(5)若将C装置单独取出,用导线直接连接铜、银后,请写出负极的电极反应式__________________________________ 。
(6)若通电不是5min而是较长一段时间后,A池中收集到氢气2.24L(标况),此时测得甲池中溶液质量实际减少4.23克,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量为_____mol。
课后练习:1、如图装置闭合电键K 时,电流计A 的指针将发生偏转,试回答:(1)丙池是______________________ (填“原电池”或“电解池”), 甲中a 极电极名称是____________; 丙中c 极电极名称是____________; (2)乙中Cu 极的电极反应式是_______________________________;若电路中有0.02mol 电子通过,则甲中a 电极溶解的质量为____________g ;(3)闭合电键K 一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的化学方程式是________________________________________________; (4)如果要给丙中铁片上镀上一层Cu ,则丙池应作何改进?2:由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐与烧碱反应制得白色纯净的Fe(OH)2沉淀。
