高中化学1.3.1原电池的工作原理当堂过关(含解析)鲁科版选修4
高中化学第1章化学反应与能量转化第2节化学能转化为电能电池第1课时原电池的工作原理课件鲁科版选修4

知识铺垫
必备知识
正误判断
简单的锌铜原电池装置:
1.原电池装置中有 电流 产生,在两个电极上分别发生_氧__化__ 反应和 还原 反应。
2.电子不能通过电解质溶液,溶液中依靠 离子的移动 来导电。
知识铺垫
必备知识
正误判断
一、铜锌原电池 1.装置
知识铺垫
必备知识
正误判断
2.实验现象及分析
Zn 极
① 检流计指针 发生偏转 实验现象 ② 锌片质量 减小
探究一
探究二
素养脉络
随堂检测
探究一
探究二
素养脉络
随堂检测
1.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有 KNO3-琼脂的U形管)构成一个原电池。以下有关该原电池的叙述 正确的是( )
①在外电路中,电流由铜电极流向银电极 ②正极反应为Ag++e-
=== Ag ③实验过程中取出盐桥,原电池仍继续工作 ④将铜片浸
反应
电极 闭合 回路
能 自发进行 的氧化还原反应(一般是活泼性强的 金属与电解质溶液反应) 一般是 活泼性 不同的两个电极(金属或石墨) ①电解质溶液 ②两电极直接或间接 接触 ③两电极插入电解质溶液中
知识铺垫
必备知识
正误判断
3.原电池的工作原理 (1)电极。 ①负极: 失去 电子,发生 氧化 反应; ②正极: 得到 电子,发生 还原 反应。 (2)电子定向移动方向和电流方向。 ①电子从 负极 流出经外电路流入正极 ; ②电流从 正极 流出经外电路流入 负极 ;故电子定向移动 方向与电流方向正好相反。
探究一
探究二
素养脉络
随堂检测
原电池原理的应用
问题探究
鲁科版高中化学选修4-1.3《原电池的工作原理》名师课件1

Zn
双液原电池工作原理 检流计 能否实现?
G
Cl- K+
Cu
盐桥
Zn2+
作用?
Cu2+
?ZnSO4
溶液
Zn-2e-= Zn2+
?CuSO4
溶液
Cu2+ + 2e-=Cu
表示式:Z(n -+ )CuZ2n+ =Z=nSZOn24+ +CCuuCuSO4 (+)
双液原电池工作原理
鲁科版·高中化学·选修《化学反应原理》
第1章 第3节 化学能转化为电能——电池
第1课时:原电池的工作原理
能量的转化形式 能量的转化形式多种多样,举例说明化学能的转 化形式有哪些? 从能量转化形式角度分析:电解池和原电池的工 作原理有何异同?
电化学反应
借助电流而发生的反应 ——电解池 (由外界能量推动)
【发现问题】
1、为什么Zn与Cu2+未接触,反应仍能发生? 2、金属为什么能导电?
金属内部存在金属阳离子和自由电子 3、 ZnSO4溶液中,锌片上的Zn2+是如何进入溶液 中的?
电流的产生与电势差
- Zn
e- Zn2+
G
盐桥
Cu2+
Cu e-
锌片上:Zn-2e-= Zn2+ 溶液中:Zn2++2e-= Zn
检测:选出原电池( ABC ),指出其正负极,写出
电池反应的化学方程式。
Zn A Cu Zn A Cu Mg A Al Zn A Cu
稀H2SO4
A
Zn A Zn
CuSO4 溶液
2019年高中化学第1章第3节第1课时原电池的工作原理课件鲁科版选修4

解析:(1)若 X 是 AlCl3 溶液,Y 是稀硫酸,实质上 是由 Al—稀硫酸—Cu 组成的原电池,由于 Al 比 Cu 活 泼,所以 Al 做负极,Al 失电子被氧化为 Al3+,Cu 做正 极,溶液中的 H+得电子被还原为 H2。(2)若 X 是浓硝酸, Y 是 NaCl 溶液,实质上是由 Al—浓硝酸—Cu 组成的原 电池,常温下由于 Al 遇浓硝酸发生钝化,Al 做正极,Cu 做负极,Cu 失电子被氧化为 Cu2+。
答案:B
解析:该装置为原电池,a 极发生还原反应,b 极发 生氧化反应,电子由负极(b)流出经导线流向正极(a),该 过程中能量由化学能转换为电能、热能,甚至是光能。
答案:D
4.下列反应不可用于设计原电池的是( ) A.NaOH+HCl===NaCl+H2O B.2CH3OH+3O2―→2CO2+4H2O C.Zn+2HCl===ZnCl2+H2↑ D.4Al+3O2+6H2O===4Al(OH)3 解析:只有氧化还原反应才能设计成原电池。NaOH 与 HCl 的反应为非氧化还原反应。 答案:A
定电极反应
2e-===2Fe2+
以两极反应为原理, 确定电极材料及电解 质溶液
负极材料:Cu;正极材料: 石墨或铂; 电解质溶液:FeCl3(aq)
画出示意图
[例 2] 依据反应 Zn+2Fe3+===Zn2++2Fe2+,设计 原电池。
(1)在方框中画出能形成稳定电流的半电池形式的装 置图(标出电极材料、电解质溶液)。
解析:酒精为非电解质,A 错误;选项 B 中未使用 盐桥,没有形成闭合回路;C 项中两个电极材料相同,不 能形成原电池;依据原电池的构成条件可知 D 正确。
答案:D
3.右图中,两电极上发生的电极反应为:a 极: Cu2++2e-===Cu b 极:Fe-2e-===Fe2+
鲁科版高中化学选修四1-3-1原电池工作原理(课时练)(教师版).docx

高中化学学习材料唐玲出品1-3-1 原电池工作原理1.关于右图装置的叙述,正确的是( )A.铜是负极,铜片上有气泡产生B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.氢离子在铜片表面被还原后生成H2【答案】D【解析】本题主要考查有关原电池的知识,由所给图示可知Zn为原电池负极,失去电子被氧化,电子经导线流向正极(Cu极),溶液中的氢离子在正极得到电子而被还原为H2,Cu为原电池的正极,电流流向与电子流向相反。
2.如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是( )A.外电路的电流方向为X→外电路→YB.若两电极分别为Fe和碳棒,则X为碳棒,Y为FeC.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性顺序为X>Y【答案】D【解析】由图示电子流向知X为负极,Y为正极,则电流方向为Y→外电路→X,故A错;若两电极分别为Fe和碳棒,则X为铁,Y为碳棒,B错;负极上失去电子发生氧化反应,正极上得到电子发生还原反应,C错;若两电极均为金属,活泼金属作负极,故有活动性X>Y。
3.如图所示装置中,可观察到检流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )选项M N PA 锌铜稀硫酸溶液B 铜锌稀盐酸C 银锌硝酸银溶液D 锌铁硝酸铁溶液【答案】C【解析】本题通过电极变化来确定电极,N棒变细,即N极上发生氧化反应,N棒金属较活泼,排除A、D 项,由M棒变粗,可知B项不正确。
4.按下图装置实验,若x轴表示流出负极的电子的物质的量,则y轴应表示( )①[Ag+] ②[NO-3] ③a棒的质量④b棒的质量⑤溶液的质量A.①③ B.③④ C.①②④ D.②【答案】D【解析】在这个原电池中,负极:Fe-2e-===Fe2+,正极:Ag++e-===Ag,使b棒增重,溶液中[NO-3]不变。
鲁科版高中化学精品系列 选修四1.3 化学能转化为电能—电池 课件

1. 锌锰干电池
(1)酸性锌锰干电池 电极反应方程式: 负极:Zn – 2e- = Zn2+ 正极:2MnO2+2NH4++2e= Mn2O3+2NH3↑+H2O 反应总的方程式 2MnO2+2NH4++ Zn= Mn2O3+2NH3↑+H2O+Zn2+
1. 锌锰干电池
(2)碱性锌锰干电池 电极反应方程式: 负极:Zn+2OH-–2e-= ZnO+H2O 正极:MnO2+2H2O +2e= Mn(OH)2+2OH反应总的方程式 Zn + MnO2+ H2O= ZnO + Mn(OH)2
阅读:课本P22第一段
1.电池反应:原电池的两个电极反应组成电池的总 反应,这个总反应叫做电池反应 2.原电池的表示式(课本P22资料在线)
要点强调(《导学》P16-17)
要点强调(《导学》P16-17)
要点强调(《导学》P16-17)
要点强调(《导学》P16-17)
要点强调(《导学》P16-17)
Zn-2e- == Zn2+
正极(Cu): (还原反应)
Cu2+ + 2e- == Cu
电池反应: Zn+CuSO4=ZnSO4+Cu
返回
原电池的工作原理
原理分析:课本P20 电极反应 负极: Zn-2e- == Zn2+ 氧化反应 正极:Cu2++2e- == Cu 还原反应 总反应:Zn+Cu2+=Zn2++Cu
阴离子 电解质 溶液
内电路
总反应: Zn+CuSO4=ZnSO4+Cu
高中化学第1章化学反应与能量转化1.3.1原电池的工作原理导学案鲁科版选修4
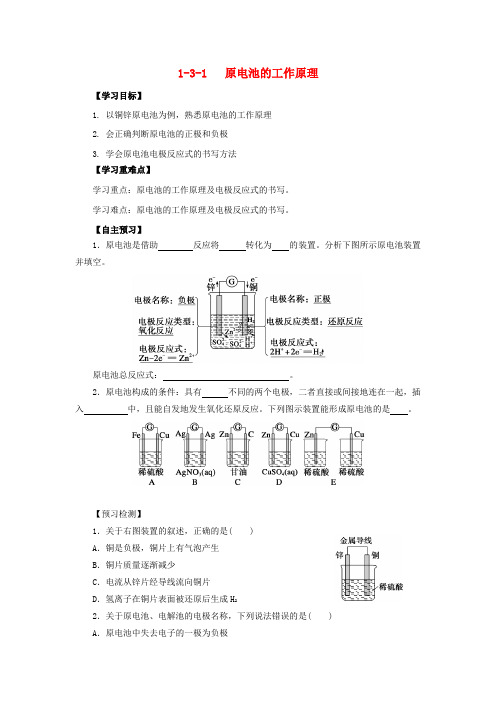
1-3-1 原电池的工作原理【学习目标】1. 以铜锌原电池为例,熟悉原电池的工作原理2. 会正确判断原电池的正极和负极3. 学会原电池电极反应式的书写方法【学习重难点】学习重点:原电池的工作原理及电极反应式的书写。
学习难点:原电池的工作原理及电极反应式的书写。
【自主预习】1.原电池是借助反应将转化为的装置。
分析下图所示原电池装置并填空。
原电池总反应式:。
2.原电池构成的条件:具有不同的两个电极,二者直接或间接地连在一起,插入中,且能自发地发生氧化还原反应。
下列图示装置能形成原电池的是。
【预习检测】1.关于右图装置的叙述,正确的是( )A.铜是负极,铜片上有气泡产生B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.氢离子在铜片表面被还原后生成H22.关于原电池、电解池的电极名称,下列说法错误的是( )A.原电池中失去电子的一极为负极B.电解池中与直流电源负极相连的一极为阴极C.原电池中相对活泼的一极为正极D.电解池中发生氧化反应的一极为阳极合作探究探究活动一:原电池的工作原理1.按右图所示装置,完成实验并回答下列问题:(1)有关的实验现象是①锌片,铜片,CuSO4溶液颜色。
②检流计的指针,该装置中的能量变化是。
(2)电子流动方向和电流方向①外电路:电子由电极经过导线流向铜电极,电流由铜电极流向电极。
②内电路:电流由电极流向电极。
(3)电极反应:负极反应式是;正极反应式是;总反应式是。
(4)用温度计测量溶液的温度,其变化是,原因是还有。
2.按下图所示装置,完成实验,并回答下列问题:(1)实验过程中,你能观察到的实验现象是。
(2)用温度计测量溶液的温度,其结果是,由此可说明。
(3)离子移动方向①硫酸锌溶液中:向盐桥移动;②硫酸铜溶液中:向铜极移动;③盐桥中:K+移向区(CuSO4溶液),Cl-移向区(ZnSO4溶液)。
(4)若取出装置中的盐桥,检流计的指针是否还会发生偏转?为什么?3.实验结论:与问题1中的原电池装置相比较,问题2中双液原电池具有的特点是(1)具有盐桥。
2018版高中化学鲁科版化学反应原理学案:1.3.1 原电池的工作原理 Word版含答案
第3节化学能转化为电能——电池第1课时原电池的工作原理[学习目标定位] 1.以铜锌原电池为例,熟悉原电池的工作原理。
2.会正确判断原电池的正极和负极。
3.学会原电池电极反应式的书写方法。
一原电池的工作原理1.按右图所示装置,完成实验并回答下列问题:(1)有关的实验现象是①锌片________,铜片________________,CuSO4溶液颜色________。
②检流计的指针________________,该装置中的能量变化是________能转化为____能。
(2)电子流动方向和电流方向①外电路:电子由________电极经过导线流向______电极,电流由________电极流向________电极。
②内电路:电流由____电极流向____电极。
(3)电极反应:负极反应式是________________________________;正极反应式是________________________________;总反应式是___________________________。
(4)用温度计测量溶液的温度,其变化是________________________________,原因是________________________________________________________________________________________________________________________________________________。
2.按下图所示装置,完成实验,并回答下列问题:(1)实验过程中,你能观察到的实验现象是_________________________________________________________________。
(2)用温度计测量溶液的温度,其结果是________________________________,由此可说明____________________________________________________________________。
高中化学第1章化学反应与能量转化1.3.1原电池的工作原理导学案鲁科版选修4
1-3-1 原电池的工作原理【学习目标】1. 以铜锌原电池为例,熟悉原电池的工作原理2. 会正确判断原电池的正极和负极3. 学会原电池电极反应式的书写方法【学习重难点】学习重点:原电池的工作原理及电极反应式的书写。
学习难点:原电池的工作原理及电极反应式的书写。
【自主预习】1.原电池是借助反应将转化为的装置。
分析下图所示原电池装置并填空。
原电池总反应式:。
2.原电池构成的条件:具有不同的两个电极,二者直接或间接地连在一起,插入中,且能自发地发生氧化还原反应。
下列图示装置能形成原电池的是。
【预习检测】1.关于右图装置的叙述,正确的是( )A.铜是负极,铜片上有气泡产生B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.氢离子在铜片表面被还原后生成H22.关于原电池、电解池的电极名称,下列说法错误的是( )A.原电池中失去电子的一极为负极B.电解池中与直流电源负极相连的一极为阴极C.原电池中相对活泼的一极为正极D.电解池中发生氧化反应的一极为阳极合作探究探究活动一:原电池的工作原理1.按右图所示装置,完成实验并回答下列问题:(1)有关的实验现象是①锌片,铜片,CuSO4溶液颜色。
②检流计的指针,该装置中的能量变化是。
(2)电子流动方向和电流方向①外电路:电子由电极经过导线流向铜电极,电流由铜电极流向电极。
②内电路:电流由电极流向电极。
(3)电极反应:负极反应式是;正极反应式是;总反应式是。
(4)用温度计测量溶液的温度,其变化是,原因是还有。
2.按下图所示装置,完成实验,并回答下列问题:(1)实验过程中,你能观察到的实验现象是。
(2)用温度计测量溶液的温度,其结果是,由此可说明。
(3)离子移动方向①硫酸锌溶液中:向盐桥移动;②硫酸铜溶液中:向铜极移动;③盐桥中:K+移向区(CuSO4溶液),Cl-移向区(ZnSO4溶液)。
(4)若取出装置中的盐桥,检流计的指针是否还会发生偏转?为什么?3.实验结论:与问题1中的原电池装置相比较,问题2中双液原电池具有的特点是(1)具有盐桥。
2019高中化学 第1章第3节电池 第1课时 原电池的工作原理、化学电源作业1 鲁科版选修4
第1课时 原电池的工作原理、化学电源[基础达标]1.根据图示,下列判断中正确的是()A .烧杯a 中的溶液pH 降低B .烧杯b 中发生氧化反应C .烧杯a 中发生的反应为2H ++2e -===H 2D .烧杯b 中发生的反应为2Cl --2e -===Cl 2解析:选B 。
题中给出的物质表明,该电池的总反应是2Zn +O 2+2H 2O===2Zn(OH)2,a 烧杯中电极反应为O 2+2H 2O +4e -===4OH -,b 中为Zn -2e -===Zn 2+。
2.用选项中的电极、溶液和如图所示的装置可组成原电池。
下列现象或结论正确的是()构成了铜锌原电池,铜为正极,锌为负极,锌失电子,电极b 质量减少,而A 溶液中的Cu2+得到电子,使电极a 质量增加,根据得失电子守恒知,负极减少的质量大于正极增加的质量,A 错误。
选项B 中,锌是负极,铜是正极,锌失去电子形成锌离子进入溶液中,而A 溶液中的H +得到电子生成了氢气,根据电荷守恒,盐桥中的阳离子向A 溶液移动,从而保证溶液的电中性,B 错误。
C 选项中,Fe 是负极,C 是正极,故外电路中电子由电极a 流向电极b ,错误。
D 选项通过反应2FeCl 3+2KI===2FeCl 2+I 2+2KCl 组合成原电池,增大FeCl 3溶液的浓度,反应加快且平衡正向移动,故电极b 附近溶液变蓝的速度加快,正确。
3.可用于电动汽车的铝空气燃料电池,通常以NaCl 溶液或NaOH 溶液为电解液,铝合金为负极,空气电极为正极。
下列说法正确的是( )A .以NaCl 溶液或NaOH 溶液为电解液时,正极反应都为O 2+2H 2O +4e -===4OH -B .以NaOH 溶液为电解液时,负极反应为Al +3OH -===Al(OH)3↓+3e -C .以NaOH 溶液为电解液时,电池在工作过程中电解液的pH 保持不变D .电池工作时,电子通过外电路从正极流向负极解析:选A 。
2021年高中化学 1.3.1 原电池的工作原理 化学电源课时提能演练 鲁科版选修4
2021年高中化学 1.3.1 原电池的工作原理化学电源课时提能演练鲁科版选修4一、选择题(本题包括6小题,每小题5分,共30分)1.(双选)下列四组原电池放电后,电解质溶液质量增加,且在正极上有单质生成的是( )A.Cu、Ag、AgNO3溶液 B.Zn、Cu、稀硫酸C.Fe、Zn、CuSO4溶液 D.Fe、C、Fe2(SO4)3溶液2.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是( ) A.加入少量稀氢氧化钠溶液B.加入少量CH3COONa固体C.加入少量NH4HSO4固体D.加入少量CuSO4溶液3.有关如图所示原电池的叙述,正确的是( )(盐桥中装有含琼胶的KCl饱和溶液)A.铜片上有气泡逸出B.取出盐桥后,检流计依然发生偏转C.反应中,盐桥中的K+会移向CuSO4溶液D.反应前后铜片质量不改变4.如图所示,杠杆AB两端分别持有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入较浓的硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑两球的浮力变化)( )A.当杠杆为绝缘体时,A端高、B端低;为导体时,A端低、B端高B.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低C.当杠杆为导体或绝缘体时,均为A端高B端低D.当杠杆为导体或绝缘体时,均为A端低B端高5.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl====Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )A.正极反应:Ag+Cl--e-====AgClB.每生成1 mol Na2Mn5O10转移2 mol电子C.Na+不断向“水”电池的负极移动D.AgCl是还原产物6.美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3节化学能转化为电能——电池
第1课时原电池的工作原理
1.下列装置中,属于原电池的是
( )
答案 D
解析利用组成原电池的条件分析;A项两电极相同;B项酒精为非电解质;C项缺少盐桥;E项有外加电源,只有D项符合。
2.右图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡
片上记录如下:在卡片上,描述合理的是
( ) 实验后的记录:
①Zn为正极,Cu为负极。
②H+向负极移动。
③电子流动方向Zn→Cu。
④Cu极上有H2产生。
⑤若有1 mol电子流过导线,则产生H20.5mol。
⑥正极的电极反应式为Zn-2e-===Zn2+。
A.①②③ B.③④⑤ C .④⑤⑥ D.②③④
答案 B
解析Zn、Cu和稀H2SO4构成原电池。
Zn比Cu活泼,Zn为负极,电极反应式为Zn-2e -===Zn2+,Cu为正极,电极反应式为2H++2e-===H
2↑,每转移1 mol电子,产生H20.5 mol,电子由Zn流出,经导线流向Cu,溶液中H+向正极移动,SO2-4向负极移动,故选B。
3.把A、B、C、D四块金属浸在稀H2SO4中,用导线两两相连可以组成多种原电池。
A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。
则四种金属的活动性顺序由大到小排列为
( ) A.A>B>C>D B.A>C>B>D
C.A>C>D>B D.B>D>C>A
答案 C
解析原电池中相对活泼的金属失去电子作负极,相对不活泼的金属作正极。
负极被氧化,质量减轻,正极发生还原反应,有物质析出,由题意得活动性A>B、A>C、C>D、D>B。
4.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s),设计的原电池如下图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________;
(2)银电极为电池的________极,发生的电极反应为__________________;
X电极上发生的电极反应为__________________________________;
(3)外电路中的电子是从________电极流向________电极(填“Cu”或“Ag”)。
答案 (1)铜AgNO3溶液(2)正Ag++e-===Ag
Cu-2e-===Cu2+(3)Cu Ag
解析Cu失电子发生氧化反应, Cu应作负极,Ag+得电子发生还原反应,应在正极上反应。
AgNO3溶液应为电解质溶液,从而推知:
(1)X的材料为铜,Y是AgNO3溶液。
(2)银为原电池的正极,发生的电极反应式为Ag+
+e-===Ag。
X电极上发生的电极反应式为Cu-2e-===Cu2+。
(3)外电路中的电子从铜(负)电极流向银(正)电极。
