备战高考化学专题《铝及其化合物推断题》综合检测试卷
备战高考化学综合题专练∶铝及其化合物推断题含答案

备战高考化学综合题专练∶铝及其化合物推断题含答案一、铝及其化合物1.为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(1)第①步Cu与混酸反应的离子方程式为________________。
得到滤渣1的主要成分为___________。
(2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是_________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:上述三种方案中,_______方案不可行,原因是________________;从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。
取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。
滴定反应如下:Cu2++ H2Y2-→ CuY2-+ 2H+。
写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。
【答案】Cu + 4H++ 2NO3-=Cu2++ 2NO2↑+ 2H2O或3Cu + 8H++ 2 NO3-=3Cu2++ 2NO↑+ 4H2O Au、Pt 将Fe2+氧化为Fe3+不引入杂质,对环境无污染使Fe3+、Al3+沉淀除去加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体甲所得产品中含有较多Fe2(SO4)3杂质乙3102505c ba-⨯⨯⨯⨯× 100%【解析】【分析】【详解】(1)Cu与混酸反应的实质是与H+、NO3-反应,随反应进行离子浓度逐渐减小,所以离子方程式为Cu + 4H++ 2NO3-=Cu2++ 2NO2↑+ 2H2O,3Cu + 8H++ 2 NO3-=3Cu2++ 2NO↑+ 4H2O,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt;(2)加过氧化氢的目的是把亚铁离子氧化成铁离子,方便除去;而且加入过氧化氢不会引入新的杂质且无污染;调节溶液的pH目的是使Fe3+、Al3+沉淀除去;(3)由滤液2得到CuSO4·5H2O的方法是把滤液蒸发得浓溶液再冷却结晶,过滤得硫酸铜晶体;(4)甲方案不可行,因为滤渣2的主要成分是Fe(OH)3、Al(OH)3沉淀,加入硫酸沉淀全部溶解使制得的产品中含有较多Fe2(SO4)3杂质;从原子利用率角度分析,乙方案更合理,不仅能除去硫酸铁,同时增加了硫酸铝的量,原子利用率较高;(5)由滴定反应方程式得100mL溶液中n(Cu2+)=b×10-3×a×5mol,所以CuSO4·5H2O质量分数= b×10-3×a×5×250/a×100%。
备战高考化学复习铝及其化合物推断题专项综合练含详细答案

备战高考化学复习铝及其化合物推断题专项综合练含详细答案一、铝及其化合物1.Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值(1)步骤①提高酸溶速率的措施__(任填一条即可)。
固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。
该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。
理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
【答案】加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条) SiO2 4.9≤pH<5.5 使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3 + 2Cr3+ +7OH- + H2O =2Cr2O72− + 3Bi(OH)3↓+3Na+蒸发浓缩、冷却结晶、过滤洗涤干燥 Cr2O72− + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O 6.4×10−14 2.78【解析】【分析】铬铁矿中的FeO 、Cr 2O 3和Al 2O 3均能溶于硫酸,SiO 2不溶,过滤,向滤液中加入双氧水,氧化亚铁离子,步骤③的目的是使Fe 3+、Al 3+沉淀,过滤,向滤液中加入NaBiO 3、NaOH ,能将Cr 3+转化为Cr 2O 72−,过滤,将滤液蒸发浓缩、冷却结晶、过滤洗涤干燥得到Na 2Cr 2O 7·2H 2O 。
高考化学专题《铝及其化合物推断题》综合检测试卷及答案(1)

高考化学专题《铝及其化合物推断题》综合检测试卷及答案(1)一、铝及其化合物1.由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。
工艺流程如下:(注:NaCl熔点为801℃;AlCl3在181℃升华)(1)工业上电解法获得金属铝的过程中,须在氧化铝中加入______,其目的是____。
(2)精炼前,需清除坩埚内的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,铝与氧化铁反应的化学方程式为:__________。
(3)将Cl2连续通入粗铝熔体中,杂质随气泡上浮除去。
气泡的成分有____;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中的物质有________。
(4)在用废碱液处理A时,写出主要反应的离子方程式______。
(5)镀铝电解池中,以钢材镀件和铝为电极,熔融盐做电解液。
则金属铝为________极。
电镀选择在170℃下进行的原因是_________。
采用的加热方式最好是_________。
(填字母选项)A 水浴 b 油浴 c 直接强热快速升温至170℃(6)钢材表面镀铝之后,能有效防止钢材腐蚀,其原因是_______。
【答案】冰晶石或Na3AlF6降低氧化铝熔融所需的温度 2Al+Fe2O3高温2Al2O3+2Fe Cl2、HCl和AlCl3 NaCl Cl2+2OH- =Cl-+ClO-+H2O H++OH-=H2O 阳极,防止氯化铝升华损失b 铝在钢材表面形成致密的氧化铝膜,保护了内层金属【解析】【分析】(1)根据氧化铝的熔点高,为降低其熔点,常加入冰晶石;(2)氧化铁和铝在高温的条件下生成氧化铝和铁;(3)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,以及NaCl熔点为801℃;AlCl3在181℃升华,在结合物质之间的反应来分析;(4)酸性气体能和强碱反应,用烧碱来处理尾气;(5)电镀池中镀件金属作阳极,金属发生氧化反应;根据氯化铝在在181℃升华;根据水浴的最高温度为100℃,油浴的温度大于100℃,且受热均匀;(6)根据氧化铝的性质来回答。
备战高考化学铝及其化合物推断题综合题汇编及详细答案

备战高考化学铝及其化合物推断题综合题汇编及详细答案一、铝及其化合物1.Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值(1)步骤①提高酸溶速率的措施__(任填一条即可)。
固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。
该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。
理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
【答案】加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条) SiO2 4.9≤pH<5.5 使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3 + 2Cr3+ +7OH- + H2O =2Cr2O72− + 3Bi(OH)3↓+3Na+蒸发浓缩、冷却结晶、过滤洗涤干燥 Cr2O72− + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O 6.4×10−14 2.78【解析】【分析】铬铁矿中的FeO 、Cr 2O 3和Al 2O 3均能溶于硫酸,SiO 2不溶,过滤,向滤液中加入双氧水,氧化亚铁离子,步骤③的目的是使Fe 3+、Al 3+沉淀,过滤,向滤液中加入NaBiO 3、NaOH ,能将Cr 3+转化为Cr 2O 72−,过滤,将滤液蒸发浓缩、冷却结晶、过滤洗涤干燥得到Na 2Cr 2O 7·2H 2O 。
备战高考化学《铝及其化合物推断题的综合》专项训练
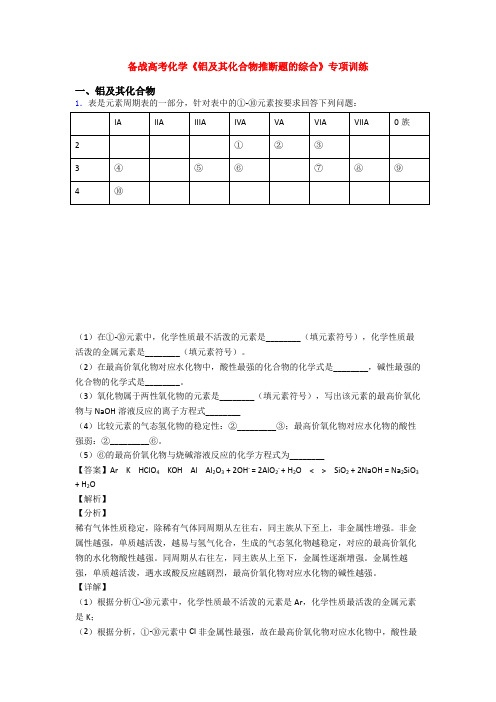
备战高考化学《铝及其化合物推断题的综合》专项训练 一、铝及其化合物 1.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:
IA IIA IIIA IVA VA VIA VIIA 0族
2 ① ② ③ 3 ④ ⑤ ⑥ ⑦ ⑧ ⑨
4 ⑩
(1)在①-⑩元素中,化学性质最不活泼的元素是________(填元素符号),化学性质最活泼的金属元素是________(填元素符号)。 (2)在最高价氧化物对应水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的化学式是________。 (3)氧化物属于两性氧化物的元素是________(填元素符号),写出该元素的最高价氧化物与NaOH溶液反应的离子方程式________ (4)比较元素的气态氢化物的稳定性:②_________③;最高价氧化物对应水化物的酸性强弱:②_________⑥。 (5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为________ 【答案】Ar K HClO4 KOH Al Al2O3 + 2OH- = 2AlO2- + H2O < > SiO2 + 2NaOH = Na2SiO3
+ H2O
【解析】 【分析】 稀有气体性质稳定,除稀有气体同周期从左往右,同主族从下至上,非金属性增强。非金属性越强,单质越活泼,越易与氢气化合,生成的气态氢化物越稳定,对应的最高价氧化物的水化物酸性越强。同周期从右往左,同主族从上至下,金属性逐渐增强。金属性越强,单质越活泼,遇水或酸反应越剧烈,最高价氧化物对应水化物的碱性越强。 【详解】 (1)根据分析①-⑩元素中,化学性质最不活泼的元素是Ar,化学性质最活泼的金属元素是K; (2)根据分析,①-⑩元素中Cl非金属性最强,故在最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,K金属性最强,碱性最强的化合物的化学式是KOH; (3)铝、氧化铝、氢氧化率均属于两性物质,则氧化物属于两性氧化物的元素是Al,该元素的氧化物与NaOH溶液反应的离子方程式Al2O3 + 2OH- = 2AlO2- + H2O; (4)非金属性越强,气态氢化物的稳定性越强,氧的非金属较强,故水比氨气稳定,②<③;非金属性越强,最高价氧化物对应的水化物的酸性越强,N非金属性强于Si,则HNO3酸性强于H2SiO3,故最高价氧化物对应水化物的酸性强弱:②>⑥;
高考化学专题《铝及其化合物推断题》综合检测试卷含答案解析

高考化学专题《铝及其化合物推断题》综合检测试卷含答案解析一、铝及其化合物1.(1)选用方案I时,X应该具有的性质是__________,残留物应该具有的性质是__________;(2)选用方案Ⅱ从某黑色粉末(含有MnO2和CuO)中分离X(MnO2),加入的试剂是_______;王同学参照以上方案I和Ⅱ,设计以下实验方案除去AlCl3固体中的FeCl3。
(3)操作①所需的玻璃仪器为_____________;(4)试剂a为_____________;试剂b为________;(5)请描述操作②的步骤:____________;(6)李同学认为在溶液C中滴加适量的试剂b就能得到溶液E,从而得到AlCl3固体,你______(填“赞同”或“不赞同”)李同学,理由是______。
【答案】有挥发性(或易升华)受热不挥发,且具有较高的热稳定性稀盐酸(或稀硫酸或稀硝酸) 烧杯、、漏斗、玻璃棒过量的NaOH(或KOH)溶液适量的盐酸将溶液加热浓缩,然后冷却浓溶液,过滤即可得到固体氯化铝不赞同会得到含有NaCl杂质的AlCl3【解析】【分析】(1)加热X的混合物进行分离可得X,X应具有挥发性或易升华的性质,则残留物难挥发;(2)从MnO2和CuO中分离MnO2,应加入酸的稀溶液;除去AlCl3固体中的FeCl3,应先水溶解,然后加入过量的NaOH溶液分别生成Fe(OH)3沉淀和NaAlO2溶液,过滤分离后,再向滤液中通入过量的CO2气体生成Al(OH)3沉淀,过滤后将沉淀经洗涤后溶解于盐酸中得AlCl3溶液,在酸性条件下蒸发结晶可到AlCl3,以此解答(3)~(6)小题。
【详解】(1)加热X的混合物进行分离可得X,X应具有挥发性或易升华的性质,残留物具有加热难挥发的性质;(3)根据上述分析可知:操作①为过滤操作,所需的玻璃仪器为烧杯、漏斗、玻璃棒;(4)由以上分析可知试剂a为过量的NaOH(或KOH)溶液,试剂b为适量的盐酸;(5)操作②是从AlCl3溶液中获得AlCl3固体,由于该盐是强酸弱碱盐,容易发生水解反应,水解产生Al(OH)3和 HCl,HCl易挥发,所以为防止盐水解,导致物质变质,应该在HCl气氛中加热蒸发结晶可到AlCl3,操作方法为将溶液加热浓缩,然后冷却浓溶液,过滤即可得到固体氯化铝;(6)若在NaAlO2溶液中滴加盐酸,就会得到AlCl3和NaCl的混合溶液,蒸发结晶不能得到纯净的氯化铝固体,得到的是含有杂质NaCl的AlCl3,所以不赞同李同学的观点。
备战高考化学铝及其化合物推断题综合经典题及答案
备战高考化学铝及其化合物推断题综合经典题及答案一、铝及其化合物1.由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。
工艺流程如下:(注:NaCl熔点为801℃;A1C13在181℃升华)(1)工业上电解法获得金属铝的过程中,须在氧化铝中加入,其目的是(2)精炼前,需清除坩埚内的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,铝与氧化铁反应的化学方程式为:。
(3)将C12连续通入粗铝熔体中,杂质随气泡上浮除去。
气泡的成分有—;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中的物质有。
(4)在用废碱液处理A时,写出主要反应的离子方程式_____ 。
(5)镀铝电解池中,以钢材镀件和铝为电极,熔融盐做电解液。
则金属铝为极。
电镀选择在170℃下进行的原因是。
采用的加热方式最好是。
(填字母选项)A水浴b油浴c直接强热快速升温至170℃(6)钢材表面镀铝之后,能有效防止钢材腐蚀,其原因是。
【答案】冰晶石或Na3A1F6降低氧化铝熔融所需的温度2A1 + Fe2O3高温2A12O3+2Fe C12、HC1 和A1C13 NaC1 C12+ 2OH-=C1-+C1O-+H2O H++OH-=H2O 阳极,防止氯化铝升华损失b铝在钢材表面形成致密的氧化铝膜,保护了内层金属【解析】【分析】(1)根据氧化铝的熔点高,为降低其熔点,常加入冰晶石;⑵氧化铁和铝在高温的条件下生成氧化铝和铁;⑶粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,以及NaCl熔点为801℃;A1C13在181℃升华,在结合物质之间的反应来分析;⑷酸性气体能和强碱反应,用烧碱来处理尾气;⑸电镀池中镀件金属作阳极,金属发生氧化反应;根据氯化铝在在181℃升华;根据水浴的最高温度为100℃,油浴的温度大于100℃,且受热均匀;⑹根据氧化铝的性质来回答。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
备战高考化学专题《铝及其化合物推断题》综合检测试卷 一、铝及其化合物 1.某厂用蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)作原料生产A12O3与Fe(OH)3。 Ⅰ.工艺流程如图(只有固体A和F为纯净物):
Ⅱ.查阅资料:某些阳离子浓度为0.1mol/L时,氢氧化物沉淀时的pH为: 氢氧化物 Fe(OH)3 Mg(OH)2 Al(OH)3
开始沉淀时的pH 2.3 10.4 4.0
完全沉淀时的pH 3.7 12.4 5.2
注:Al(OH)3pH=7.8时开始溶解,10.8时完全溶解。 请回答以下问题: (1)写出下列物质化学式:试剂I__,F__; (2)步骤②B生成C的离子方程式:__; (3)要使固体D杂质尽量少,步聚②调节溶液的pH合理的是__; A.12.4~13 B.10.8 C.3.7~5.2 (4)滤液E中存在较多的阴离子是__,滤液E中加入过量的NaOH溶液,充分沉淀后,检验上层清液中金属阳离子的操作步骤是__; (5)固体D可用来生产合成氨的表面催化剂。如图表示无催化剂时,某合成氨的NH3的百分含量随时间变化曲线,请在图上用虚线画出该反应有催化剂时的曲线___。
【答案】稀盐酸或稀硫酸 Al(OH)3 Al3++4OH-=AlO2-+2H2O B HCO3-、Cl-(或SO42-) 将铂丝用盐酸清洗后,放在酒精灯火焰上灼烧一会儿,蘸取滤液后放在酒精灯火焰上灼烧,火焰
呈黄色,即证明有Na+ 【解析】 【分析】 蛭石矿样加入试剂I可以得到溶液和一种纯净滤渣,根据蛭石主要成份为:MgO、Fe2O3、A12O3、SiO2可知试剂I应为稀盐酸或稀硫酸,得到的固体A为SiO2;滤液中主要金属阳离子有Fe3+、Mg2+、Al3+,加入过量的氢氧化钠,得到氢氧化镁沉淀和氢氧化铁沉淀,和含有偏铝酸钠的滤液C,滤液C中通入过量的二氧化碳得到纯净的氢氧化铝沉淀F。 【详解】 (1)上述分析可知试剂Ⅰ是稀硫酸或稀盐酸;固体F为氢氧化铝,Al(OH)3;
(2)步骤②B生成C的反应是铝离子和过量氢氧根离子反应生成偏铝酸盐,反应的离子方程
式为:Al3++4OH-═AlO2-+2H2O; (3)分析图表数据保证镁离子和铁离子全部沉淀,铝离子全部变化为偏铝酸盐,应调节溶液
pH为10.8,B符合;
(4)试剂I所用酸的阴离子一直存在与溶液中,滤液C通入过量的二氧化碳会生成碳酸氢
根,所用滤液E中存在较多的阴离子是HCO3-、Cl-(或SO42-);检验钠离子常用焰色反应,具体操作为将铂丝用盐酸清洗后,放在酒精灯火焰上灼烧一会儿,蘸取滤液后放在酒精灯火焰上灼烧,火焰呈黄色,即证明有Na+;
(5)催化剂改变反应速率不改变化学平衡,据此画出曲线变化为。
2.铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图:
回答下列问题: (1)“焙烧”时,Cr2O3转化为Na2CrO4的化学方程式为__。 (2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余量的影响如图所示,则最佳反应条件为__。
(3)“滤渣1”中有一种成分为铁铝酸四钙(Ca4Fe2Al2O10),是制造水泥的原料之一,用氧化物的形式表示其化学式__。 (4)“滤渣2”主要成分为Al(OH)3和__(填化学式),“过滤2”后,将溶液pH调至a,a__6.5(填“小于”或“大于”),目的是__(用离子方程式表示)。
(5)已知CH3OH在酸性条件下可被氧化生成CO2,写出Na2Cr2O7与CH3OH反应生成Cr(OH)SO4的化学方程式__。 (6)某厂用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,则产率为__。
【答案】2Cr2O3+ 4Na2CO3+3O2高温 4Na2CrO4 +4CO2 物质的粒度为60目时
4CaO·Fe2O3·Al2O3 H2SiO3 小于 2CrO42-+2H+垐?噲? Cr2O72-+H2O Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2+ Na2SO4+4H2O 2138100%33mm 【解析】 【分析】 以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4,先加入碳酸钠、通入空气进行焙烧,再经过水浸、过滤除去固体杂质Fe2O3,调pH除去杂质氢氧化铝和氢氧化铁,最后通过氧化还原反应生成目标产物Cr(OH)SO4。 【详解】 (1)“焙烧”时,Cr2O3转化为Na2CrO4,Cr元素的化合价升高,反应为氧化还原反应,还需
氧化剂O2,根据电子守恒配平方程式为2Cr2O3+ 4Na2CO3+3O2高温 4Na2CrO4 +4CO2。 (2)根据图示可知,当物质的粒度为60目时,铬的残余量最少,故最佳反应条件为物质的粒度为60目时。 (3)铁铝酸四钙(Ca4Fe2Al2O10),用氧化物的形式表示其化学式为4CaO·Fe2O3·Al2O3。 (4)步骤过滤1后溶液中存在偏铝酸钠和硅酸钠等杂质,调节pH使其转化为沉淀Al(OH)3
和H2SiO3,故滤渣2主要成分为Al(OH)3和H2SiO3 。“过滤2”后,将溶液pH调至a,是为将
2CrO42-转化为Cr2O72-,酸性条件下可以实现转化,故a小于6.5实现2CrO42-+2H+垐?噲? Cr2O72-+H2O的转化。
(5)根据条件CH3OH在酸性条件下可被氧化生成CO2, Na2Cr2O7与CH3OH反应生成Cr(OH)SO4为氧化还原反应,其中碳元素、铬元素的化合价发生改变,根据电子守恒得化学
反应方程式为Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2+ Na2SO4+4H2O。
(6)最终得到产品Cr(OH)SO4m2kg,其中铬元素的含量为252165mkg,原料中铬元素的含
量为1522(40%)522163mkg,则产率为22
11
5238165100%100%5223340%522163mm
mm
。
3.氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回答下列问题: (1)甲的化学式是__________;乙的电子式是__________。 (2)甲与水反应的化学方程式是__________。 (3)气体丙与金属镁反应的产物是__________(用化学式表示)。 (4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已
知Cu2O+2H+=Cu+Cu2++H2O)。
【答案】AlH3 AlH3+3H2O=Al(OH)3↓+3H2↑ Mg3N2 2NH3+3CuO3Cu+N2+3H2O 将固体溶于稀硫酸中,如果溶液变蓝,说明产物中含有Cu2O,
反之则无Cu2O 【解析】 【分析】 将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液,因此白色沉淀是Al(OH)3,则金属单质是铝,因此甲是AlH3。化合物乙在催
化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1,则丙的相对分子质量是1.25×22.4=28,因此丙是氮气,则乙是氨气NH3,据此解答。 【详解】 (1)根据以上分析可知甲的化学式是AlH3。乙是氨气,含有共价键的共价化合物,电子式
为; (2)甲与水反应生成氢气和氢氧化铝,反应的化学方程式是AlH3+3H2O=Al(OH)3↓+3H2↑。
(3)氮气与金属镁反应的产物是Mg3N2。 (4)氨气在加热条件下与CuO反应可生成Cu和氮气,根据原子守恒可知该反应的化学方程式为2NH3+3CuO3Cu+N2+3H2O。铜与稀硫酸不反应,则根据Cu2O+2H+=Cu+Cu2++H2O可知,要检验产物Cu中可能还混有Cu2O可以将固体溶于稀硫酸中,如果溶液变
蓝,说明产物中含有Cu2O,反之则无Cu2O。
4.某无色稀溶液X中,可能含有下表所列离子中的某几种。 阴离子 CO32-、SiO32-、AlO2-、Cl-
阳离子 Al3+、Fe3+、Mg2+、NH4+、Na+
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
