美国自1995到2008年上市的抗癌新药
palbociclib的全部数据

Home·Pfizer’s Potential Mega-Blockbuster Breast Cancer Drug 辉瑞口服乳腺癌药物帕博西尼(palbociclib)Pfizer’s PotentialMega-Blockbuster Breast Cancer Drug 辉瑞口服乳腺癌药物帕博西尼(palbociclib)2015年9月5日辉瑞公司的口服乳腺癌药物帕博西尼(palbociclib, Ibrance, 帕博西林)能否成为重磅炸弹产品?帕博西尼(Palbociclib)是近来备受关注的也是辉瑞最重要试验药物之一,2015年2月3日FDA提前批准辉瑞CDK4/6双抑制剂Palbociclib (商品名Ibrance)作为一线药物治疗ER阳性、HER2阴性乳腺癌,比原定4月13日的PDUFA日期提前两个多月。
分析人士预计,palbociclib每年销售额最高可达到30亿-50亿美元之多。
在一项2期临床研究中,使晚期乳腺癌患者的无进展生存期(PFS)平均增加一倍,但对患者总生存期(OS)未显示有统计学意义上的明显改善。
据研究人员2014年4月在圣地亚哥举行的美国癌症研究协会会议上发布的最新数据显示,雌激素受体阳性转移性乳腺癌患者在合并使用Palbociclib与抗雌激素药物来曲唑时,其PFS平均为20.2个月,相比之下,单独使用来曲唑的患者其PFS平均为10.2个月。
辉瑞公司决定在今年第三季度根据乳腺癌试验药物Palbociclib的2期临床试验结果即向美国食品药监局(FDA)申请上市批准,Palbociclib(又名PD-0332991)最早进入人们视野的是在2012年圣安东尼奥乳腺癌会议上(SABCS),一经发布就引起行业广泛关注。
Palbociclib是一种口服的细胞周期素依赖性激酶4、6的抑制药物,主要通过调节细胞周期发挥作用。
Palbociclib主要通过抑制CDK4/6活性来阻止细胞由G1期到S期进而抑制DNA的合成。
5.泰索帝的产品基础知识

泰索帝®药代动力学
线性药代动力学特征,符合三室模型
浓度 (g/ml)
4 3.75
3.5 3.25
3 2.75
2.5 2.25
2 1.75
1.5 1.25
1 0.75
0.5 0.25
0
0
t 1/2 =4 min t 1/2 = 36 min t 1/2 = 11.1 hour CL= 21 l/h/m2 Vss= 113 l 峰浓度: 3.7mg/ml AUC: 4.6mg/ml.h
标准美国方案:在泰索帝®用药前一天开始使用 地塞米松8mg (口服),每日二次共服5次
每周方案
在泰索帝®用药前12小时给予首剂地塞米松8mg, 然后每隔12小时给予一次,共3次
泰索帝®—安全性和耐受性
激素预处理
中重度液体潴留 发生前泰索帝® 累积剂量 重度液体潴留 III-IV级感染 III-IV级胃炎
微管
20nm
抑制解聚 紫杉类
泰索帝®的临床前数据
细胞水平上作用机制
有丝分裂纺 锤体的极
可溶性微 管二聚体
核膜碎片
紫杉类促进聚 合,抑制解聚
长春碱类阻止 纺锤体形成
泰索帝®的临床前数据
泰索帝®与紫杉醇体外细胞毒作用的比较
细胞株
P388小鼠白血病b SV1Ras4小鼠纤维肉瘤b Calc 18人乳腺癌b HCT116人结肠癌b T24人膀胱癌b KB人表皮样癌b KB人表皮样癌c N417人小细胞肺癌c
泰索帝®的临床前数据
在小鼠肿瘤中的联合治疗应用
泰索帝
+ 去甲长春花碱 + VP16 + 环磷酰胺 + 5-FU + 甲氨蝶呤
抗肿瘤活性
ADC药物进入全面爆发期,全球8款上市,百奥泰、荣昌谁会成为国产第一家?

ADC药物进入全面爆发期,全球8款上市,百奥泰、荣昌谁会成为国产第一家?今日,关于 ADC 药物的好消息不断。
4 月25 日,武田药品有限公司维布妥昔单抗的上市申请(JXSS1900015)在NMPA 的状态变更为「在审批」,这预示这国内第二款抗体偶联药物即将获批。
维布妥昔单抗(Brentuximab vedotin,Adcetris)由靶向 CD30 蛋白的一种单克隆抗体brentuximab 和一种微管破坏剂(单甲基auristatin E,MMAE)通过一种蛋白酶敏感的交联剂偶联而成。
已获FDA 批准的适应症包括经典霍奇金淋巴瘤(cHL)、间变性大细胞淋巴瘤(ALCL)和外周T 细胞淋巴瘤(PTCL)和蕈样肉芽肿(MF)等, 是近 40 年来 FDA 批准的第一个 ALCL 新药,也是第一个针对 cHL 和 PTCL 的一线治疗药物。
第二条新闻是,美国FDA批准荣昌生物ADC新药RC48(disitamab vedotin,商品名:爱地希)直接进入II期临床试验,适应证为HER2阳性局部晚期或转移性尿路上皮癌。
RC48是我国第一个进入临床研究的ADC药物。
再加上 4 月23 日 Immunomedics 公司的 ADC 药物 Sacituzumab govitecan 获批,1 月 20 日,第一三共的 Enhertu (DS-8201)获批,这两款ADC 都是潜在的重磅炸弹,业内预测,到2024 年,它们的销售额都有望突破 10 亿美金。
接连的好消息,也预示着 ADC 药物经过几十年的发展,终于要爆发了。
惊艳的临床数据2020 年 FDA 新获批的两款 ADC 无疑更具有代表性:Enhertu 是一种靶向HER2 的抗体药物偶联物(ADC),由曲妥珠单抗与依喜替康衍生物组成,用于治疗在转移性疾病中已接受过2 种或 2 种以上抗 HER2 药物治疗的 HER2 阳性、不可切除性或转移性乳腺癌成人患者。
上市新药厄达替尼(Erdafitinib)合成检索总结报告
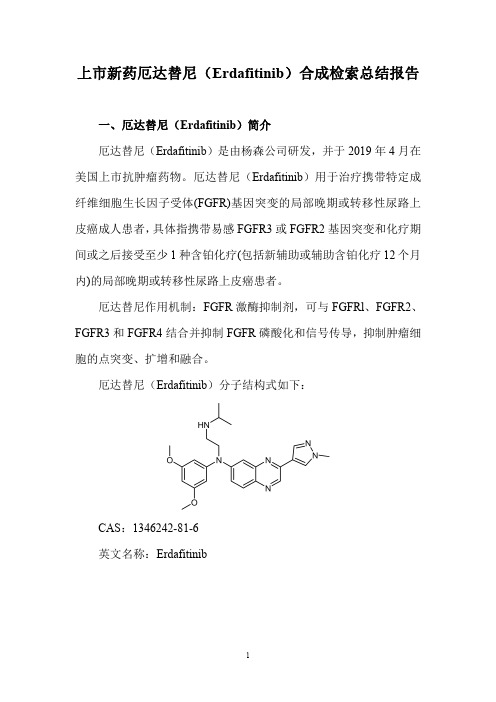
上市新药厄达替尼(Erdafitinib)合成检索总结报告一、厄达替尼(Erdafitinib)简介厄达替尼(Erdafitinib)是由杨森公司研发,并于2019年4月在美国上市抗肿瘤药物。
厄达替尼(Erdafitinib)用于治疗携带特定成纤维细胞生长因子受体(FGFR)基因突变的局部晚期或转移性尿路上皮癌成人患者,具体指携带易感FGFR3或FGFR2基因突变和化疗期间或之后接受至少1种含铂化疗(包括新辅助或辅助含铂化疗12个月内)的局部晚期或转移性尿路上皮癌患者。
厄达替尼作用机制:FGFR激酶抑制剂,可与FGFRl、FGFR2、FGFR3和FGFR4结合并抑制FGFR磷酸化和信号传导,抑制肿瘤细胞的点突变、扩增和融合。
厄达替尼(Erdafitinib)分子结构式如下:CAS:1346242-81-6英文名称:Erdafitinib二、厄达替尼(Erdafitinib)合成路线三、厄达替尼(Erdafitinib )合成检索总结报告(一)厄达替尼中间体2的合成序号实验步骤参考文献1To a suspension of 1,2-diaminobenzene 1(1equiv.)in ethanol (1mol/L)was added ethyl 2-oxoacetate (1.1equiv.).The mixture was stirred at reflux for 1h,then at room temperature overnight.The precipitated solid was filtered and washed with ethanol,then dried to give quinoxalinone 2.Carrer,Amandine;Brion,Jean-Daniel;Messaoudi,Samir;Alami,Mouad;Organic Letters ;vol.15;nb.21;(2013);p.5606-56092To a suspension of o-arylenediamine 1(4.0mmol,1.0equiv)and potassium carbonate (2.0equiv.)in ethanol (1mol/L)was added ethyl 2-oxoacetate (1.1equiv).The reaction mixture was stirred and heated at reflux in an oil bath for 12h,then at room temperature for 12h.Upon completion,the suspension was washed with ethanol,then filtered and dried to give quinoxalinone 2.Noikham,Medena;Kittikool,Tanakorn;Yotphan,Sirilata;Synthesis ;vol.50;nb.12;(2018);p.2337-2346Ethyl 2-oxoacetate (1.1equiv.)was added to a suspension of o -arylenediamine 1(4mmol,1equiv.)in ethanol (1mol/L).The reaction mixture was stirred andSumunnee,Ladawan;Pimpasri,Chaleena;Noikham,Medena;3heated at reflux in anoil bath for 1h,then at room temperature for 16h.Upon completion (as monitored byTLC),the precipitate was filtered and washed with ethanol,then dried to give quinoxalinone 2.Yotphan,Sirilata;Organic and Biomolecular Chemistry ;vol.16;nb.15;(2018);p.2697-27044To a stirred suspension of o-phenylenediamine (50g,462.9mmol)in ethanol(200ml),at rt was added a solution of ethyl glyoxalate in toluene (50;113ml_,555.48mmol)over a period of 45min.After heating to 45°C for 10h,the mixture was left at rt under stirring.The precipitate was filtered and the residue was washed with water and dried to give 1H-quinoxalin-2-one as an off-white powder (63g,93%).WO2011/26579;(2011);(A1)English(二)厄达替尼中间体3的合成序号实验步骤参考文献1To a solution of quinoxalin-2(lH)-one 2(54.64g,374mmol,1.0eq.)in HOAc (1000mL)was added a solution of Br 2(19.18mL,374mmol,1.0eq.)in HOAc (200mL)dropwise.The resulting mixture was stirred at rt for 12h,then poured into ice-water.The precipitate was collected by filtration and dried to afford 7-bromoquinoxalin-2(lH)-one 3as an off-white solid (74g,88%).NEUPHARMA,INC.;QIAN,Xiangping;ZHU,Yong-liang;WO2013/40515;(2013);(A1)2013/53384;(2013);(A1)English 2Quinoxalone 2(250g,1.7mol)is dissolved in acetic acid (4500mL).A mixture of acetic acid (988mL)and bromine (108mL,2.1mol)is added dropwise,and the mixture stirred at room temperature for 12hours,then heated to 60°C for 12hours.After cooling to room temperature,the reaction is filtered and the solid washed with water.The wet cake (500g)is then dissolved in 1500mL of methanol and heated to 60°C,then filtered and dried at 60°C to give 3in 85%yield CLAVIUS PHARMACEUTICALS,LLC;SAWYER,J.,Scott;(109pag.);WO2019/5241;(2019);(A1)English 3To a cooled 0°C solution of quinoxalinone 2(50g,342.2mmol)in acetic acid (800ml)was added in a dropwise manner a solution of bromine (32ml)in acetic acid (200ml_)over a period of 30min.Solids formed within the reaction upon addition of bromine,and the reaction was allowed to stir slowly for a further 90min.WO2016/97918;(2016);(A1)English。
印度抗癌药“大王”Natco入华,让所有人都能用上特药

印度抗癌药“大王”Natco入华,让所有人都能用上特药继西普拉、Strides两家印度药企之后,电影《我不是药神》中印度格列宁的原型厂家也要进中国市场了!看过电影《我不是药神》的小伙伴们都知道,其中的印度版格列宁的厂家Natdo 制药的原型就是印度药企Natco 制药,这家药企在印度推出了著名的抗癌神奇小药丸诺华格列卫的仿制药 VEENAT。
这家公司在印度推出了众多跨国药企的知名抗癌药品牌仿制药。
印度版抗癌药大王:以仿名天下Natco 制药(Natco Pharma)于 1981 年成立于印度安得拉邦,1984 年迁至海德拉巴正式开始运营。
这家药企最初的投资仅330万卢比(约33万RMB),20个员工,而目前已经成为拥有5000名员工,7个制造工厂及现代化研发实验室,具备新药开发能力的大厂。
这家公司提出的愿景是“让所有人都能用上特药”,从这也可以看出其主营业务就是仿制其他跨国药企的重磅特药,在印度市场主要是血液和实体肿瘤治疗领域、丙肝治疗领域的仿制药业务。
2003 年,Natco 制药推出多款知名药品品牌的印度版仿制药,包括诺华的抗癌药格列卫(伊马替尼)的仿制药品牌VEENAT、诺华的原研药择泰(唑来膦酸)的仿制药、阿斯利康易瑞沙仿制药GEFTINAT,以及氢溴酸西酞普兰、替莫唑胺等。
其后,Natco 制药又陆续上市更昔洛韦、培美曲塞、苯达莫司、阿那曲唑、拉帕替尼等药品仿制药,以及罗氏抗癌药特罗凯(厄洛替尼)、拜耳抗癌药多吉美(索拉非尼)、吉利德科学丙肝新药丙通沙(吉三代)印度版。
丙通沙/吉三代,大家都不陌生,可以治愈丙肝的靶向药,拯救了无数丙肝患者。
丙通沙/吉三代上市后的价格,众多患者可望而不可即。
美国上市时的价格:一个疗程(12周)的定价为74760美元。
以当前美元兑人民币汇率1:6.4计算,“吉三代”丙通沙在美国一个疗程3瓶的售价约为47.9万元。
丙通沙2018年5月30日在中国上市后,价格定为23200元一瓶,一个疗程是3瓶,售价大概是7万元左右。
培非格司亭

培非格司亭注射液|NEULASTA(PEGFILGRASTIM)2011-03-08 19:05:48 作者:新特药房来源:中国新特药网天津分站浏览次数:320 文字大小:【大】【中】【小】简介:BUSINESS WIRE 2002年2月1日美国加州THOUSAND OAKS消息, Amgen 公司(Nasdaq:AMGN)昨天宣布抗肿瘤化疗副作用新药Neulasta(TM) (pegfilgrastim)通过美国食品与药品管理局(FDA)的审批。
N eulasta在每个化 ...关键字:培非格司亭注射液Neulasta® (pegfilgrastim)is prescribed to reduce the risk of infection (initially marked b y fever) in patients with some tumors receiving strong chemotherapy that decreases the numbe r of infection-fighting white blood cells.Important product safety informationRuptured spleen (including fatal cases), a serious lung problem called acute respiratory dis tress syndrome, and sickle cell crises have been reported. Call your doctor or seek emergenc y care right away if you have abdominal or shoulder tip pain, shortness of breath, trouble b reathing, or a fast rate of breathing. In rare cases, serious allergic reactions can occur, causing shortness of breath, wheezing, dizziness, swelling around the mouth or eyes, fast pu lse, sweating, and hives. Sometimes these symptoms could come back within days after stoppin g treatment for the allergic reaction. If you start to have any of these symptoms, call your doctor or seek emergency care right away.In a clinical study, mild to moderate bone pain occurred in 31% of the patients taking Neula sta® and in 26% of the patients taking a placebo injection. In most cases, bone pain was con trolled with a non-narcotic pain reliever, such as acetaminophen. Other common side effects reported by patients in the study taking either Neulasta® or placebo were consistent with th e underlying cancer diagnosis and its treatment with chemotherapy, with the exception of bon e pain. If you have any questions about this information, be sure to discuss them with your doctorNeulasta(PEGFILGRASTIM) 完整处方说明书[附件:/uploadfile/article/uploadfile/201008/20100822100908528.pdf]【产地英文商品名】:NEULASTA-6mg/0.6ml/Syringe【原产地英文药品名】:PEGFILGRASTIM【中文参考商品译名】:纽拉思塔-6毫克/0.6毫升/支【中文参考药品译名】:培非格司亭【生产厂家中文参考译名】:安进【生产厂家英文名】:Amgen, Inc培非格司亭注射液|NEULASTA(PEGFILGRASTIM)咨询大剂量化疗后使用培非司亭不劣于非格司亭作者:李蕾来源:医学论坛网日期:2010-07-07此文章来源于意大利一项研究表明,在大剂量化疗(HDC)和自体外周血干细胞(PBSC)支持后使用培非司亭(PEG)对造血重建的益处不劣于非格司亭(FIL)。
O药(Opdivo)的彪悍人生:免疫疗法pd-1抑制剂从研发到临床
O药(Opdivo)的彪悍人生:免疫疗法pd-1抑制剂从研发到临床From bench to bed,是从事药物研发的科学家挂在嘴边的一句话,bench寓意实验室里长长的操作台,堆满各式各样的瓶瓶罐罐,bed则是医院里患者住院的病床,人来人往,忙忙碌碌,承载着生命的期许。
让一款诞生于实验室的概念和不起眼的分子变成可以用于临床治疗的药物,悬壶济世,这段历程需要10年、20年或者更长。
比如著名的青霉素,1928年,弗莱明(Alexander Fleming)在实验室培养皿中发现青霉素,1939年,将菌种提供给准备系统研究青霉素的英国病理学家弗洛里(Howard Walter Florey)和生物化学家钱恩(Chain Ernst Boris),1942年,美国制药企业开始大批量生产,1943年应用于二战欧洲战场,挽救无数士兵的生命。
1945年,弗莱明、弗洛里和钱恩因“发现青霉素及其临床效用”而共享诺贝尔生理学或医学奖。
可以说青霉素从实验室到临床应用用了14年时间。
我们再来看另外一个例子,1998年Andrew Fire 和 Craig C. Mello 发现了RNA干扰现象,并于2006年共享诺贝尔生理学或医学奖,2018年FDA批准第一个RNAi药物用于临床治疗,RNAi从实验室到临床应用,用了20年的时间。
至此,您可以计算PD-1抑制剂用了多少年?1992年发现PD-1基因,2014年PD-1抑制剂nivolumab获得日本厚生省批准用于治疗恶性黑色素瘤,从bench 到bed用了22年。
那让我们一起,用2位重要人物,3家制药企业,展现PD-1抑制剂(nivolumab)22年不平凡的历程。
PD-1基因发现阶段PD-1基因的研究成果1992年首次发表PD-1基因由日本京都大学本庶佑(HonjoTasuku)教授团队于1992年通过消减杂交技术首次发现,表明PD-1基因是免疫球蛋白超家族中的新基因,该基因的活化可能参与经典的程序性细胞死亡,并认为PD-1基因是细胞死亡的诱导者。
FDA批准依维莫司与依西美坦联合治疗乳腺癌
FDA批准依维莫司(Afinitor)与依西美坦(Aromasin)联合用药,治疗激素受体(hormone-receptor,HR)阳性而表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER2)阴性的晚期乳腺癌患者。
在美国,乳腺癌是导致女性癌症患者死亡的第二大元凶,预计今年会有226870人诊断患有乳腺癌患,39510人会因此而丧生。
FDA药物评估和研究中心血液及肿瘤产品主任Richard Pazdur说:“这是mTOR抑制剂类药物中,第一个获得批准用于治疗患激素受体阳性的晚期乳腺癌的绝经后妇女的药物。
”Afinitor获得FDA的批准过程如何呢?FDA通过对724名患有晚期乳腺癌的志愿者进行研究,评价了Afinitor的安全性及有效性。
这些参试者都是绝经后妇女,所患的乳腺癌都是雌激素受体阳性,HER2阴性。
她们都接受了佛隆或者瑞宁得治疗,将她们随机分为接受Afinitor 和Aromasin联合治疗,或者接受Aromasin和安慰剂联合治疗的两组。
治疗一直持续到出现严重的副作用或者肿瘤开始进展。
这项研究的主要观察结果为患者的肿瘤没有进展的时间为多久,或者患者的无症状存活时间为多久。
研究结果显示接受Afinitor和Aromasin联合治疗组患者疾病的平均肿瘤开始进展时间或死亡时间,比接受Aromasin和安慰剂联合治疗的患者组,晚4.6个月。
Afinitor 的副作用涉及食欲缺乏、腹泻、疲乏、皮疹、感染和口腔溃疡。
FDA强调,65岁以上的妇女,在接受治疗时需要严格监测,因为与年轻女性相比,她们较易产生严重的副作用。
Afinitor早已经被批准用于治疗在其他治疗方法干预后仍进展的晚期恶性肾细胞癌,进展性晚期胰脏源性神经内分泌肿瘤,肾血管肌脂肪瘤,不需要立即手术的结节性硬化综合症,以及不进行根治性手术的与结节性硬化综合症相关的室管膜下巨细胞星形细胞瘤的儿童及成年患者。
上市新药达克替尼(Dacomitinib)合成检索总结报告
上市新药达克替尼(Dacomitinib)合成检索总结报告一、达克替尼(Dacomitinib)简介达克替尼(Dacomitinib)是由辉瑞公司研发,并于2018年9月在美国上市,主要用于治疗表皮生长因子受体(EGFR)19号外显子缺失或21号外显子L858R突变的转移性非小细胞肺癌(NSCLC)。
达克替尼(Dacomitinib)是一种不可逆人表皮生长因子受体酪氨酸激酶抑制剂。
达克替尼(Dacomitinib)不良反应:腹泻,皮疹,甲沟炎,口腔炎,食欲减退,皮肤干燥,体重减轻,脱发,咳嗽和瘙痒。
达克替尼(Dacomitinib)分子结构式如下:CAS:1110813-31-4英文名称:Dacomitinib中文名称:达克替尼二、达克替尼(Dacomitinib)合成路线一三、达克替尼(Dacomitinib)合成路线二四、达克替尼(Dacomitinib )合成路线一检索总结报告(1)达克替尼(Dacomitinib )中间体2的合成合成方法实验步骤参考文献合成方法一Add 1.5L of concentrated sulfuric acid to a 5L reaction flask,stir for 20min in an ice bath,and add 100g (609.25mmol)of the compound of 1in batches.potassium nitrate (1218.5mmol)was added in portions and stirred for 1hour under ice bath.the reaction solution was gradually warmed to room temperature and stirred for 10h;After TLC monitoring,after the reaction was completed,the reaction solution was poured into ice water,the temperature was controlled at 0°C,a large amount of solid was precipitated,and suction filtration was carried out to obtain a cake.theCN109776514;(2019);(A)Chinesecake was added to 2Lof ethyl acetate to be beaten.filtering to obtain a filter cake,drying at 50°C to obtain a light yellow solid 112g (compound of 2,535.54mmol),mass yield 87.90%.合成方法二7-Fluoroquinazolin-4-ol 1(1g,6.0mmol)was dissolved in concentrated H 2SO 4(3mL)at 0°C.Concentrated HNO 3(3mL)was added dropwise with stirring in 15min.The mixture was heated to 100°C.for 3h,and poured into ice-water with stirring after cooled to room temperature.The precipitate was filtered out and recrystallized with HOAc to give 0.60g of 7-fluoro-6-nitroquinazolin-4-ol 2(38%).US2010/9958;(2010);(A1)English 合成方法三To the mixture of compound 1(50.0g,0.239mol),concentrated sulfuric acid (103mL),fuming nitric acid (105mL)was slowly added at 70°C,the reaction mixture then was stirred at 110°C for 2h.After completion of reaction as indicated by TLC,the reaction mixture was cooled to room temperature and the reaction mixture was slowly added to ice/water with vigorous stirring yielding a precipitate.The mixture was then filtered,dried to furnish 7-fluoro-6-nitroquinazolin-4(3H)-one 2as light yellow solid Bioorganic and Medicinal Chemistry ;vol.24;nb.7;(2016);p.1495-1503合成方法四50.0g of 7-fluoroquinazolin-4-one 1was slowly added to a solution of 103mL of concentrated sulfuric acid and 105mL of fuming nitric acid.The mixture was stirred at room temperature for 1h and then heated to 110°C for 3h.The reaction was completed,cooled to room temperature,The reaction solution was poured into a mixture of 1000mL of ice water and vigorously stirred.The filter cake was washed with 500mL of water.The dried cake was heated with 300mL of ethanol and heated to reflux for 30min.a yellowish solid,48.5g,7-fluoro-6-nitroquinazolin-4-one 2in a yield of 76.1%.CN106892907;(2017);(A)Chinese(2)达克替尼(Dacomitinib )中间体3的合成合成方法实验步骤参考文献合成方法The compound of 2(20g,96mmol),thionyl chloride (170ml),phosphorousoxy chloride (30ml)and N,N-dimethylformamide (1ml)were added into a reaction bottle and stirred.The resulting solution was heated to 100°C until the mixture was melted transparently,and then stirredWO2007/55514;(2007);(A1)English;Bioorganic and Medicinal。
默沙东的三大畅销药物
默沙东的三大畅销药物1. KeytrudaKeytrudaKeytrudaKeytruda是默沙东公司研发的一种免疫治疗药物,被广泛应用于多种癌症的治疗中,并取得了显著的疗效。
Keytruda的主要成分是一种叫做“pembrolizumab”的人源化抗PD-1抗体。
Keytruda通过阻断T细胞上的PD-1受体与癌细胞表面的PD-L1配体之间的结合,重新激活患者自身免疫系统,增强免疫细胞对癌细胞的杀伤能力。
由于其独特的作用机制和良好的耐受性,Keytruda在治疗多种肿瘤中取得了重要的突破。
目前,Keytruda已经获批用于治疗包括恶性黑色素瘤、非小细胞肺癌、头颈部鳞状细胞癌和转移性胃癌等多种肿瘤。
许多临床试验的结果表明,Keytruda在治疗这些癌症患者中,能够显著提高患者的生存率和生活质量。
2. JanuviaJanuviaJanuviaJanuvia是默沙东公司研发的一种口服药物,被广泛应用于2型糖尿病的治疗中。
Januvia的主要成分是一种叫做“sitagliptin”的二肽基肽酶-4(DPP-4)抑制剂。
Januvia通过抑制DPP-4酶的活性,延迟糖尿病患者肠道中肽类激素的降解,从而增加胰岛素的分泌和降低胰岛素耐受性。
Januvia的优点在于它可以与其他口服药物或胰岛素联合使用,并且保持血糖的稳定水平,减少低血糖的发生。
Januvia已经获得FDA批准用于单药或联合其他药物治疗2型糖尿病,并在全球范围内销售。
临床试验数据显示,Januvia能够显著降低糖尿病患者的血糖水平,并改善胰岛素抵抗。
3. GardasilGardasilGardasilGardasil是默沙东公司研发的一种疫苗,主要用于预防人类乳头瘤病毒(HPV)感染引起的子宫颈癌、外阴癌、阴道癌、肛门癌和生殖器疣。
Gardasil的主要成分是一种多价人乳头瘤病毒疫苗。
Gardasil疫苗通过激活人体免疫系统,促进针对HPV的免疫应答,从而达到预防相关疾病的目的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
美国自1995到2008年上市的抗癌新药(小木虫)作者: kuaile569(站内联系TA)收录: 2009-08-26 发布: 2009-08-26美国自1995到2008年上市的抗癌新药Drugs Approved in 2008Treanda (bendamustine hydrochloride) ; 治疗慢性淋巴细胞性白血病; Cephalon; Approved 2008 3月Drugs Approved in 2007Hycamtin (topotecan) ; 治疗小细胞肺癌晚期子宫颈癌卵巢癌 ,GlaxoSmithKline; Approved October 2007Ixempra (ixabepilone) ; 通过FDA的批准用作一线药物治疗晚期乳腺癌; Bristol Myers Squibb; October 2007Tykerb (lapatinib) ; 乳腺癌晚期新药 Tykerb,是葛兰素史克公司研制的。
临床试验显示,对于那些已对罗氏的赫赛汀(Herceptin)产生耐药性的HER2型乳癌患者,这种新药有很好的临床效果。
Torisel (temsirolimus) ; 晚期肾癌最新药物,是唯一上市的特异性抑制mTOR 激酶的药物,mTOR激酶是调节细胞增值、生长和细胞存活重要的蛋白质。
能够有效抑制和调节蛋白细胞增殖、细胞生长和细胞存活率,是目前第一剂用于治疗癌症的注射剂。
Tasigna (nilotinib hydrochloride monohydrate) ; 治疗慢性骨髓性白血病的新药 Novartis; 2007年10 月批准上市vista (raloxifene hydrochloride) ; 治疗和预防骨质疏松以及减少绝经期妇女乳腺癌的发生;Eli Lilly; 07年9 月上市。
Drugs Approved in 2006Sutent (sunitinib) ; 治疗肾细胞肿瘤和胃肠道间质肿瘤新药。
Pfizer生产; 2006年1月批准上市。
Sprycel(dasatinib) ; 用于治疗两种新的适应症:对伊马替尼等一线药物化疗不敏感的各期慢性粒细胞白血病(CML),以及对其他疗法无效或不能耐受的Ph 染色体阳性的急性淋巴细胞白血病(ALL)。
Vectibix (panitumumab) 协助治疗大肠直肠癌已扩散到其它部位的患者。
对肿瘤有减缓恶化的效用 (在某些病例甚至能缩小肿瘤)Drugs Approved in 2005Arranon (nelarabine) ; 治疗急性成淋巴细胞性白血病 T细胞淋巴瘤新药GlaxoSmithKline生产; 05年10 月。
Nexavar (sorafenib) ; 全球首个口服多激酶抑制剂,治疗晚期肾细胞癌的药物,Bayer/Onyx生产; 05年12 月。
Revlimid (lenalidomide) ; 治疗轻中度-1-risk 骨髓增生异常综合征合; Celgene生产; 2005年12月批准上市。
Abraxane ( PACLITAXEL PROTEIN-BOUND ) ; 美国制药伙伴公司(American Pharmaceutical Partners,APP)和美国生物科学(American BioScience)近日宣布,美国FDA批准了Abraxane用于治疗转移性乳腺癌的新药申请。
两家公司利用他们的专利纳米技术,把Abraxane的活性成分紫杉醇(Paclitaxel)和只有红细胞1%大小的纳米白蛋白颗粒结合在一起,从而避免了各种溶解可能。
Abraxane 是第一非溶解纳米白蛋白结合化疗药物,可以有效的利用白蛋白受体内在途径传输药物通过肿瘤新生血管内皮细胞壁。
与单纯紫杉醇相比,其作用时间长,副作用小。
Drugs Approved in 2004Alimta (pemetrexed for injection) ; 治疗恶性胸膜间皮瘤,li Lilly 生产; 2004年二月批准上市Avastin (bevacizumab) ; 治疗恶性直肠癌; Genentech生产; 2004年2月批准上市Erbitux (cetuximab) ; 治疗EGFR-表现的恶性结肠直肠癌; Imclone /Bristol-Myers Squibb生产; 2004年二月上市Sensipar (cinacalcet) ; 治疗继发性甲状旁腺功能抗进(甲状旁腺癌)引起的高血钙; Amgen生产; 2004年三月上市Clolar (clofarabine) ; 用于治疗小儿急性淋巴细胞性白血病; Genzyme; 生产; 2004年12月批准上市Tarceva (erlotinib, OSI 774) ; 用于治疗恶性,难治性非小细胞肺癌; Genentech, OSI Pharmaceuticals生产; 04年11Drugs Approved in 2003Emend (aprepitant) ; 治疗化疗病人的恶心,呕吐; Merck生产; 2003年3月批准上市Iressa (gefitinib) ; 治疗非小细胞肺癌的新药,AstraZeneca生产; 2003年5月批准上市Aloxi (palonosetron) ; 预防肿瘤化疗病人的恶心,呕吐 ; MGI Pharma / Helsinn Healthcare研发生产; 2003年8月UroXatral (alfuzosin HCl extended-release tablets);治疗良性前列腺增生的各种症状; Sanofi-Synthelabo生产; 2003年6月批准上市Velcade (bortezomib) ; 治疗至少接受过二种以上疗法的多发性骨髓瘤得病人; Millennium Pharmaceuticals生产; 2003年5月批准上市exxar ; 治疗CD20阳性,的小囊性非霍杰金氏淋巴瘤化疗复发的病人; Corixa 生产; 2003年6月批准上市Drugs Approved in 2002Eligard (leuprolide acetate) ; 前列腺癌抗癌新疗法用于前列腺癌的缓解治疗 ; Atrix Laboratories; 2002年 1 月批准上市 Eloxatin(oxaliplatin/5-fluorouracil/leucovorin); 用于结肠和直肠癌症的治疗 ; Sanofi-Synthelabo生产; 2002年8月批准上市 Faslodex (fulvestrant) ; 治疗激素受体阳性的代谢转移性乳腺癌; AstraZeneca生产; 02年4月批Gleevec ; 治疗血癌 ( 慢性骨髓性白血病) chronic myelogenous leukemia (CML) 非常有效,并对治疗胃肠基底细胞癌 (gastrointestinal stromal tumor) (GIST) 、前列腺癌等亦有明显效果 ; 由 Novartis 开发生产 ; 2002 年 2 月批准胃肠癌新适应症Neulasta ; 降低由于化疗引起的中性白细胞减少症而导致的感染机会 Amgen; 2002年1月批准上市SecreFlo (secretin) ; 用于胰腺功能诊断和治疗胃泌素肿瘤; Repligen; 2002年4月批准上市Zevalin (ibritumomab tiuxetan) ; 治疗非霍杰金氏淋巴肉瘤 ; IDEC Pharmaceuticals; 2002 年 2 月批准上市Zometa (zoledronic acid) ; 治疗多发性骨髓瘤实体肿瘤导致的骨坏死 ; Novartis; 2002 年 2 月批准上市Drugs Approved in 2001Campath ; 注射用药治疗B-细胞慢性淋巴性白血病; 由Berlex Laboratories 开发生产 ; 2001年5月批准上市Femara (letrozole) 片剂; 停经后妇女罹患转移性乳癌的第一线治疗药物; 由Novartis 开发生产 ; 01年1月Gleevec ; 治疗血癌 ( 慢性骨髓性白血病) chronic myelogenous leukemia (CML) 非常有效,并对治疗胃肠基底细胞癌 (gastrointestinal stromal tumor) (GIST) 、前列腺癌等亦有明显效果 ; 由Novartis 开发生产 ; 2001年5月批准上市Kytril (granisetron) Solution ; 化疗病人的恶心,呕吐; Hoffmann-La Roche 生产; 2001年6月批准上市Trelstar LA ; 肌肉注射针剂,老年前列腺癌症治疗; Debiopharm S.A.;生产; 2001年6月批准上市Xeloda ; 直肠结肠癌症口服化疗药; Hoffman-La Roche生产; 2001年5月批准上市Zometa (zoledronic acid) ; 用于恶性高血钙症的治疗For the treatment of hypercalcemia of malignancy; Novartis生产; 2001年8月批准上市Drugs Approved in 2000Mylotarg ( gemtuzumab ozogamicin) ; CD33 阳性的急性髓性白血病(AML); Wyeth生产; 2000年5月批准上市Trelstar Depot (Injectable Triptorelin Pamoate) ; 进行性前列腺癌姑息疗法 ; Debio Rechereche Pharmaceutique SA (c/o Target Research Associates)生产; 2000年6月批准上市Trisenox (arsenic trioxide) ; 一种含砷的药物,也就是我们俗称的砒霜,可以用来治疗一个致命性的罕见疾病─急性前骨随细胞性白血病,这是美国近百年来首次核准的砷疗法。
适应成年患者的复发/顽固型急性早幼粒细胞白血病治疗(APL)Cell Therapeutics 生产; 2000年9月批准上市Viadur (leuprolide acetate implant) ;用于进行性前列腺癌疼痛缓解 ; ALZA Corporation生产; 2000年3月批准上市Drugs Approved in 1999Aromasin Tablets; Exemestane Tablets, 25 mg; 乳癌患者改服 AROMASIN 更有可能保持癌症不复发 Pharmacia & Upjohn生产; 1999年10月批准上市Busulflex ; 合并用于白血病的综合治疗 ; Orphan Medical, Inc.生产; 1999年2月批准上市Doxil (doxorubicin HCl liposome injection); 治疗顽固性卵巢癌。
