第14章 非化学计量比化合物的合成2
第14章 第65讲 羧酸 羧酸衍生物(学生版)2025年高考化学一轮复习讲义(新人教版)

第65讲羧酸羧酸衍生物[复习目标] 1.掌握羧酸的结构与性质。
2.熟悉酯、油脂、酰胺的结构特点及相关性质。
3.掌握乙酸乙酯的实验室制法。
考点一羧酸1.羧酸的组成和结构(1)羧酸:由烃基(或氢原子)与羧基()相连而构成的有机化合物。
(2)通式一元羧酸的通式为R—COOH,饱和链状一元羧酸的分子通式:C n H2n O2(n≥1,n为整数)或C n H2n+1COOH(n≥0,n为整数)。
2.几种重要的羧酸物质结构性质特点或用途甲酸(蚁酸) 酸性,还原性(醛基)乙酸CH3COOH 无色、有强烈刺激性气味的液体,能与水互溶,具有酸性乙二酸(草酸) 酸性,还原性(+3价碳)苯甲酸(安息香酸) 它的钠盐常用作食品防腐剂3.羧酸的化学性质(1)弱酸性如乙酸是一种弱酸,其酸性比碳酸强,在水溶液中的电离方程式为CH3COOH CH3COO-+H+。
(2)取代反应①酯化反应:如CH3COOH和CH3CH218OH发生酯化反应的化学方程式为CH3COOH+CH3CH218OH浓硫酸△________________________________________________________。
注意 酯化反应的机理是“酸脱羟基醇脱氢”。
②与NH 3反应生成酰胺如CH 3COOH +NH 3――→△+H 2O 。
③α-H 取代如CH 3CH 2COOH +Cl 2――→催化剂△CH 3CHClCOOH +HCl 。
注意 在强还原剂LiAlH 4作用下,羧酸也可以发生还原反应,如CH 3CH 2COOH ――→LiAlH 4CH 3CH 2CH 2OH 。
1.乙酸、硬脂酸、油酸互为同系物( )2.乙醇能发生氧化反应,而乙酸不能发生氧化反应( ) 3.能与NaHCO 3溶液反应产生CO 2的有机物应含有羧基( )4.甲酸能发生银镜反应,能与新制的氢氧化铜反应生成砖红色沉淀( ) 5.甲酸、乙酸和石炭酸都属于羧酸( )一、羧酸的酸性1.分子式为C 5H 10O 2并能与饱和NaHCO 3溶液反应放出气体的有机物有(不含立体异构)( ) A .3种 B .4种 C .5种 D .6种2.有机物A 的结构简式是,下列有关A 的性质的叙述错误的是( )A .A 与金属钠完全反应时,两者物质的量之比是1∶3B .A 与氢氧化钠完全反应时,两者物质的量之比是1∶3C .A 能与碳酸钠溶液反应D .A 既能与羧酸反应,又能与醇反应醇、酚、羧酸中羟基活泼性比较羟基类型醇羟基酚羟基羧羟基比较项目氢原子活泼性―――→逐渐增强电离极难电离微弱电离部分电离酸碱性中性很弱的酸性弱酸性与Na反应反应放出H2反应放出H2反应放出H2与NaOH反应不反应反应反应与NaHCO3反应不反应不反应反应放出CO2与Na2CO3反应反应,生成酚钠和NaHCO3二、羧酸的酯化反应3.按要求书写酯化反应的化学方程式。
晶体中的点缺陷和面缺陷

(2)杂质缺陷(组成缺陷) ——外来原子进入晶格成为晶体中的杂质。 杂质原子进入晶体后,破坏了晶体中原子有规则的排列, 并且杂质原子周围的周期势场发生变化,而形成缺陷。 ※ 杂质原子可以取代原来的原子进入正常格点的位置, 形成置换型杂质;也可以进入晶格的间隙位置成为填隙 式杂质原子,即为间隙型杂质,如图。
热平衡态点缺陷:纯净和严格化学配比的晶体中,由于体系能量涨落而形
成的,浓度大小取决于温度和缺陷形成能。
非平衡态点缺陷:通过各种手段在晶体中引入额外的点缺陷,形态和数量
完全取决于产生点缺陷的方法,不受体系温度控制。
晶体中引入非平衡态点缺陷的方法:
快速冷却 低温,形成过饱和点缺陷 (1)淬火 :高温---------
1
缺陷分类
按作用范围和几何形状分:
1、点缺陷:零维缺陷,尺寸在一、二个原子大小的级别。 按点缺陷产生原因划分:热缺陷、杂质缺陷、非化学计 量结构缺陷:
2、线缺陷:一维缺陷,通常指位错。 3、面缺陷:二维缺陷,如:界面和表面等。
2
§4-1 热力学平衡态点缺陷
一.点缺陷及其分类
1、点缺陷 ——造成晶体结构的不完整性,仅局限在原子位置,称 为点缺陷。 如:理想晶体中的一些原子被外界原子所代替;晶格间隙中掺入 原子;结构中产生原子空位等都属点缺陷(缺陷尺寸在一两个原 子的大小范围)。
设:构成完整单质晶体的原子数为N;
TK时形成n个空位,每个空位的形成能为⊿h;
这个过程的自由能变化为⊿G,热焓变化为⊿H,熵变为 ⊿S; 则: ⊿G = ⊿H- T⊿S= n⊿h - T⊿S
11
其中熵变⊿S分为两部分:
①混合熵⊿Sc = klnw
(由微观状态数增加而造成),
k——波尔兹曼常数;w是热力学几率,指n个空位在 n+N个晶格位置不同分布时排列的总数目, w=(N+n)!/N!n! ②振动熵⊿S
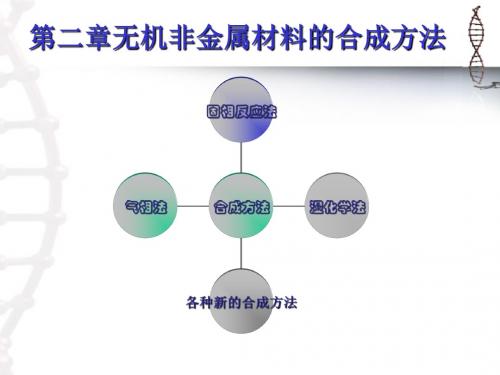
第二章 无机非金属材料的合成方法
CVD过程热力学
aAg bBg cCs dDg
At equilibrium, the change in Gibbs Free Energy is 0
Gr0 K a b exp kT x A xB xD
在CVD反应器中不断有原料输送进来,副产品被抽走,所以体系永远达不 到平衡状态。
3 化合物沉淀法
在溶液中沉淀出含两种或两种以上金属离子的复合金属化合物,通 过加热煅烧得到含两种以上金属离子的化合物粉体的方法。
2.3.1 化学沉淀法
优点: 晶粒细小,纯度高,化学活性好等。例如:
Fe( NO3 )2 Fe Fe
2
2
2 NO3
2
2OH Fe(OH ) 2
Water Droplets Coalesce To Form “Sheet”
Water Droplets Spread Out On Surface Due To Hydrophilicity Dirt Particles On Surface Picked Up in Water
Dirt Washed Down In “Sheet” of Water and Off Glass
氮化硅陶瓷的械破碎、磨细
固相反应特点
• 反应在两相界面进行 • 反应受物质扩散控制
• 反应受反应物质的粒径、比表面积、表面状态、
原料的历史、反应体系的气氛、温度等诸多因
素影响较大
优点
• 工艺简单、容易操作、产量高 • 生产成本低、适合工业化大批量生产
• 什么是湿化学法?
即在相对低的温度(室温)下,利用无机有机溶液化学反 应合成无机非金属材料 。
• 特点:
第二章晶体结构与晶体中的缺陷

第二章晶体结构与晶体中的缺陷内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构,用以掌握与本专业有关的各种晶体结构类型。
介绍了实际晶体中点缺陷分类;缺陷符号和反应平衡。
固熔体分类和各类固熔体、非化学计量化学化合物的形成条件。
简述了刃位错和螺位错。
硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。
这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4,非桥氧数由4减至0。
硅离子是高点价低配位的阳离子。
因此在硅酸盐晶体中,[SiO4]只能以共顶方式相连,而不能以共棱或共面方式相连。
表2-1列出硅酸盐晶体结构类型及实例。
表2-1 Array硅酸盐晶体的结构类型真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。
晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。
点缺陷根据产生缺陷的原因分类,可分为下列三类:(1)热缺陷(又称本征缺陷)热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。
弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。
肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(2)杂质缺陷(非本征缺陷)(3)非化学计量化学化合物为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。
表2-2 Kroger-Vink缺陷符号(以M2+X2-为例)缺陷反应方程式书写规则:(1)位置关系。
(2)质量平衡。
(3)电荷守恒。
热缺陷平衡浓度n/N:n/N=exp(-∆G t/2kT)其中n——TK时形成n个孤立空位;∆G t——热缺陷形成自由焓;h——波儿兹曼常数。
材料化学 第二章 缺陷与扩散

第二章 缺陷与扩散§2。
1 扩散的基本知识扩散系数与温度的关系可以用)exp()exp(00kThD kT g D D ∆-•=∆-•= 式2-1-1 来描述。
其中的h ∆为晶格中的原子从一个稳定位置移动到另一个相邻的稳定位置之间要克服的能垒。
扩散系数的单位是sec /2cm ,它反映了某物质在一定情况下扩散的难易程度。
反映扩散规律的基本公式为菲克第一和第二定律:菲克第一定律:C D J →→→∇•-=,式中的→J 是扩散通量,单位为sec)/(2•cm g 或sec)/(2•cm mol ;C 是扩散物质的浓度;负号表示扩散方向与浓度梯度方向相反。
第一定律适用于稳态扩散的情况,对三维扩散,)(zCD y C D x C D J z y x∂∂+∂∂+∂∂-=→;对一维扩散,xCD J x∂∂-=→。
菲克第二定律:A R C V C D tC +•∇•-••∇=∂∂→→)(2,描述了浓度随时间的变化规律。
式中右边的第一项表示直接和物质的扩散性质有关的影响;第二项表示体系运动的影响;第三项表示体系中化学反应的影响。
晶体中的扩散路径为: 1)表面扩散 2)晶界扩散 3)位错扩散 4)晶格扩散若用l d g s Q Q Q Q ,,,分别代表单独通过这四种路径扩散所需能量,用l d g s D D D D ,,,分别代表这四种扩散途径的扩散系数,则有:l d g s Q Q Q Q <<<,l d g s D D D D >>>。
可见扩散由1)到4)是由易到难的,故一般情况下晶体内的扩散以晶格扩散为控速环节。
§2。
2 扩散驱动力扩散的驱动力是体系中存在的化学位梯度。
从微观角度考虑:体系中的A 物质沿x 方向扩散时,作用在每一个原子上的力为:xG N F Aa ∂∂•-=1 式2-2-1 其中的A G 是体系中某位置A 原子的摩尔化学位,a N 是阿佛加德罗常数。
无机化学——反应中的质量关系和能量关系

PA=nA
RT V
PB=nB
RT V
P总=n总
RT V
PA =
P总
nA n总
xA
PB =
P总
nB n总
xB
xA xB =1
同温同压下气态物质的量与它的体积成正比,不难导出
VA = nA V总 n总
PA = nA P总 n总
PA VA P总 V总
第01章 反应中的质量和能量关系
《无机化学》学时分配
章
章节名称
学时 章
章节名称
学时
第1章 反应中的质量和能量 4 第9章 元素概论
2
第2章 反应的方向和限度
4 第10章 碱金属和碱土金属
2
第3章 酸碱反应和沉淀反应 4 第11章 卤素和氧族元素
4
第4章 氧化还原反应
4 第12章 氮族碳族硼族元素
4
11.7-11.13
12 第08章 配位化合物
11.14-11.20
13 第09章 元素概论
11.21-11.27
14 第10章 碱金属和碱土金属
11.28-12.4
15 第11章 卤素和氧族元素
12.5-12.11
16 第12章 氮族碳族硼族元素
12.12-12.18
17 第13章 过渡元和锕系元素
12.26-1.1
19 第15章 无机化学与生态环境
1.2-1.8
20 复习考试
1.9-1.22
学时 4 4 4 4 4 4 4 4 2 2 4 4 6 2 2
其它
单元测验 期中考试
单元测验 期末考试
第01章 反应中的质量和能量关系
第3章答案
2) (2)MgO 与 Cr2O3 的固溶度为有限
原因:结构类型不同 MgO 属于 NaCl 型结构,Cr2O3 属刚玉结构。
虽然
也不可能形成连续固溶体。
3-25 某种 NiO 是非化学计量的,如果 NiO 中 Ni3+/Ni2+=10-4,问每 1m3 中有多少载流子?
解:设非化学计量化合物为 NixO,
3-6 说明下列符号的含义:VNa,VNa',VCl˙,(VNa'VCl˙),CaK˙,CaCa,Ca i˙˙
解:钠原子空位;钠离子空位,带一个单位负电荷;氯离子空位,带一个单位正电荷;最邻近的 Na+空位、Cl-空位形成的缔合中心; Ca2+占据 K.位置,带一个单位正电荷;Ca 原子位于 Ca 原子位置上;Ca2+处于晶格间隙位置。
分类
形成原因 形成条件
缺陷反应
化学式
溶解度、缺陷浓度
热缺陷
肖特基 弗伦克尔
热起伏
T>0k
O
+
MM
Mi··+
无限,有限,置换, 固溶体
间隙
搀杂 溶解
大小,电负性, 电价,结构
非化学 计量化 合物
阳缺 阴间 阳间 阴缺
环境中气氛性 质和压力变化
MX 只受温度控制
MX
无:受温度控制 有:搀杂量<固溶度 受温 度控制 搀杂量>固溶度 受固溶 度控制
3-7 写出下列缺陷反应式:(l)NaCl 溶入 CaCl2 中形成空位型固溶体;(2)CaCl2 溶入 NaCl 中形成空位型固溶体;(3)NaCl 形成肖特 基缺陷;(4)Agl 形成弗伦克尔缺陷(Ag+进入间隙)。
合成化学第六章
4.
金属交换反应(双交换) 当两种多核金属化合物放在一起, 辐照或加热, 使M-M键均裂 → 其碎 片重新组合, 形成新的簇合物: M2Lm + M'2Ln ↔ 2MM'L
此方法在双核簇合物的制备上是十分有用的, 同时在某些多核化合物 的制备上也是可行的。
值得说明的是: 1. M-M, M’-M’: 键能相当(或断裂所需热量)相当时, 产率最高。 2. 在合成过程中当断裂一种簇合物的M-M键所需要的条件足以引起另 一种簇合物分解时, 产率最低。
§ 6.1.2 18电子规则和金属-金属的键数
每个过渡金属原子(M)参加成键的价层原子轨道有9个(5个d轨道, 1个s轨道和3个p轨道),在分子中每个过渡金属原子可以容纳18个价 电子以形成稳定的结构,此即18个电子规则。 M n 中n个金属原子之间互相成键,互相提供电子,M原子间成键的总 数可以用键数(b)表示。 b=1/2(18n-g) 式中g代表分子中与M n 有关的价电子总数,它包含三部分电子: 1.组成M n簇合物中n个M原子的价电子数; 2.配位体提供给n个M原子的电子数; 3.若簇合物带有电荷,则包括所带电荷数。
当用亚锡与Rh3+的氯络合物作用时,SnCl3-取代各种形式铑氯络合物水 分子和氯离子配体,生成不同颜色的Rh3+-Sn2+-Cl-簇合物。
二聚或多聚(可看成为特殊的取代反应)
hυ
+ CO
九羰基二铁
五羰基铁
Fe(CO)42-
十二羰基三铁
2.
加成反应(即插入反应) 其具体方法是将一种金属配合物加成到另一种金属配合物中, 且其关键是不引起金属 试剂失去配位体。 其反应机理与取代反应机理相似,但结果不同。
材料
第一章绪论1.基本概念材料化学:化学与材料科学两者结合,从分子水平到宏观尺度认识与控制结构与性能或功能的基本关系;是关于材料制备、加工和分析的化学,它的作用是改进材料的组成、结构以及合成方法,开发具有突出性能或特殊功能的新型材料。
2.材料的分类(1)按组成、结构特点分:金属材料、无机非金属材料、高分子材料、复合材料(2)按使用性能分:结构材料(主要利用材料的力学性能)功能材料(主要利用材料的物理和化学性能)(3)按状态分:单晶材料、多晶材料、非晶态材料、复合材料3.材料的构成要素当一种材料被创造、发现和生产出来时,该材料所表现出来的性质和现象是人们关心的中心问题,而材料的性质和现象取决于成分和各种层次上的结构,材料的结构又是合成和加工的结果,最终得到的材料制品必须能够、并且以经济和社会可以接受的方式完成某一指定的任务。
习题:1.什么是材料化学,应该从哪些角度来认识材料?2.你如何认识材料的结构与性能之间的关系?举例说明。
第二章材料化学的理论基础1.晶体的宏观特征:规则的几何外形、晶面角守恒、物理性质的各向异性、有固定的熔点。
2.晶体与非晶体之间的转化a 热力学:非晶态的吉布斯自由能高,是一种亚稳状态。
b 动力学:动力学上难以转化,(势垒高)如金刚石和石墨。
c 转化方法:机械能使晶体非晶化。
3.点阵:按连结任意两点所得向量进行平移后能够复原的一组点。
4.点阵的二个必要条件:(1)点数无限多;(2)各点所处环境完全相同。
5.平面点阵(晶面)指标(h k l)定义:一平面点阵在三个晶轴的倒易截数之比。
意义:用来标记一组互相平行且间距相等的平面点阵面与晶轴的趋向关系。
6.晶面间距d(hkl)定义:晶面指标为(h k l)的一组平面点阵中相邻的两平面点阵面间的垂直距离。
意义:每一种晶体物质都有一套特征d(hkl),是晶体物相分析的重要依据。
7.群:在一非空集合G中,当某种代数运算规定后,若集合同时满足封闭性、单位元素、逆元素、结合规律四个条件,则G构成一个群。
人教版高中化学必修二第五章《硫》练习题含答案
《硫》练习题含答案一、单选题1. 下列说法错误的是( )A. 单质硫是一种分子晶体,呈淡黄色B. 硫的化合物常存在于火山喷出的气体中和矿泉水里C. 单质硫难溶于水,微溶于酒精,易溶于四氯化碳D. 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫2. 通常条件下,下列物质能用化合反应制得的是( )A. Al(OH)3B. Fe(OH)3C. H 2SiO 3D. CuS3. 类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观事实。
下列各种类比推测的说法中正确的是( )A. 已知Fe 与CuSO 4溶液反应,推测Fe 与AgNO 3溶液也能反应B. 已知CaCO 3与稀硝酸反应生成CO 2,推测CaSO 3与稀硝酸反应生成SO 2C. 已知Na 与水反应生成NaOH ,推测Fe 与水蒸汽反应生成Fe(OH)3D. 已知Fe 与S 能直接化合生成FeS ,推测Cu 与S 可直接化合生成CuS4. 下列关于硫的说法不正确的是( )A. 试管内壁附着的硫可用二硫化碳溶解除去B. 游离态的硫存在于火山喷口附近或地壳的岩层里C. 单质硫既有氧化性,又有还原性D. 硫在过量纯氧中的燃烧产物是三氧化硫5. 单质硫与NaOH 溶液能发生自身的氧化还原反应,产物中有两种常见含硫元素的盐X 与Na 2SO 3,反应式可表示为。
下列说法错误的是( )A. X 是无氧酸盐B. X 是Na 2SC. X 、Na 2SO 3计量数之比为2:1D. Y 可能是氢气6. 在给定条件下,下列选项所示的物质间转化均能实现的是( ) A.B. Al →NaOH 溶液NaAlO 2→过量盐酸Al(OH)3C. Fe →盐酸FeCl 2→氯水FeCl 3D.7. 下列说法错误的是( )A. 残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去B. 硫单质与变价金属反应时一般生成低价态的金属硫化物C. 汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理D. 单质硫或含硫物质燃烧时,氧气少量时生成SO 2,氧气足量时生成SO 38. 下列有关硫及其化合物性质的说法中,正确的是( )A. 铜粉和硫粉混合加热可制得CuSB. 浓硫酸使胆矾变白是由于浓硫酸具有吸水性C. SO 2通入石蕊试液中,溶液颜色先变红,再褪色D. 久置酸雨酸性增强,原因是水的挥发9. 有关硫及其化合物的说法正确的是( )A. 粘在试管内壁上的硫单质,可用热的稀盐酸洗涤B. SO 2和Cl 2都有漂白性,将两种气体同时作用于湿润的有色布条,漂白效果更好C. 一定条件下,浓硫酸能与一些非金属单质(如碳、硫等)反应,体现强氧化性D. 由于浓硫酸具有强氧化性,所以不能用铝制容器装运10.下列物质中,不能由单质直接化合生成的是()①CuS②Fe2S3③SO3④H2S⑤FeCl2⑥CuCl2A. ①②③⑤B. ①②③④C. ①②④⑤D.①②③④⑤⑥11.下列说法不正确...的是()A. 液氯可以储存在钢瓶中B. 天然气的主要成分是甲烷的水合物C. 天然石英和水晶的主要成分都是二氧化硅D. 硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等答案和解析1.【答案】D【解析】【分析】本题考查含硫物质的性质,为高频考点,题目难度不大,注意常见元素化合物的性质,学习中注重相关基础知识的积累,本题注意硫的溶解性以及与氧气的反应。
