甲醇生产工艺原理
甲醇合成工艺PPT课件

淡水资源:相当世界人均的1/4,居世界第 110位
28
原油
冷凝水
LNG 海水 煤
铁矿石
25万吨
干气
催化裂化
催化裂解
燃料油1000万吨/ 聚年乙烯
乙烯 100万吨/年 其他化工产品
蒸汽
燃气发电
超临界发电
焦炉煤气
山西孝义
10
苏里格天然气公司
17
山东鲁西化工
25
山西原平
20
河北建滔
10
山东鲁南化肥厂
60
贵州贵化
20
旭阳焦化集团甲醇二期
10
河南延化化工有限责任公司 18
唐山中润公司二期
15
宁夏宝丰投资集团
20
山西兰花清洁能源公司
20
中煤能源
25
陕西榆林煤化科技新建
10
33
8.2甲醇的生产工艺原理
碳的氧化物与氢合成甲醇的反应式如下:
9
甲醇的化学性质
E 甲醇的羰基化制醋酸
甲醇与一氧化碳在250℃、50-70MPa下通过碘化钴均相 催化剂,或在180℃、3-4MPa下通过铑的碳基化合物为催 化剂(以碘为助催化剂),能合成醋酸。
CH3OH+ CO
CH3COOH
F 甲醇的脱水制二甲醚
活性氧化铝
2CH3OH
CH3OCH3+H2O
250 ℃
蒸气压 平均热 燃料种类 分子量 /MPa(60 值
℃) /kJ/kg
二甲醚 46.0 1.35 31450
液化气 56.6 1.92 45760
煤制甲醇工艺原理

煤制甲醇工艺原理煤制甲醇是一种重要的能源转化和化学品生产技术,通过煤炭转化为高附加值的甲醇产品。
其工艺原理主要包括煤气化、合成气制甲醇、甲醇的纯化和后处理等几个重要步骤。
首先是煤气化过程。
煤气化是指将煤炭在一定的氧量和蒸汽量的条件下进行高温热解的过程,生成一种高能焦炉气或合成气产品。
煤气化通常采用两类主要工艺,即固定床煤气化和流化床煤气化。
其中,流化床煤气化是目前广泛应用的技术,其基本原理是利用高温下的气固两相流体化特性,通过气体对固体颗粒形成悬浮状态,并通过气体流动将固体颗粒高速带动,使之具有流体特性。
这个过程能够有效地将固体煤转化为可燃的合成气。
其次是合成气制甲醇过程。
合成气制甲醇是利用煤气化产品中的合成气(一氧化碳和氢气的混合物)为原料,通过甲醇合成催化剂进行甲醇合成的过程。
甲醇合成催化剂通常是复杂的金属化合物,如铜和锌等。
甲醇合成反应是一个复杂的多步反应过程,其中一氧化碳和二氧化碳在合成气中被还原形成甲醇,并伴随着其他副反应,如甲醇的醚化和醋酸化等。
此外,合成气中的温度、压力、催化剂的选择和反应条件的控制等都对甲醇的产率和选择性有重要影响。
然后是甲醇的纯化过程。
由于合成气制甲醇过程中的产物中还含有一些杂质气体和液体,所以需要对甲醇进行纯化。
甲醇的纯化主要是通过蒸汽重整和吸附等技术进行。
蒸汽重整是利用蒸汽和甲醇的物理性质差异,通过分馏的方式将杂质去除,得到纯净的甲醇。
吸附则是利用吸附剂对甲醇和杂质进行选择性吸附分离,达到纯化的目的。
最后是甲醇的后处理过程。
甲醇的后处理主要是对甲醇进行脱水、脱硫和脱氮等处理,以满足不同应用领域对甲醇纯度和纯净度的要求。
其中,脱水是通过蒸汽和分馏等方式将甲醇中的水分去除;脱硫和脱氮则是通过吸附剂和脱硫剂将甲醇中的硫和氮等杂质去除。
这些后处理步骤能够提高甲醇的纯度和质量,以满足不同工业和化学领域的需求。
总结起来,煤制甲醇工艺的原理是通过煤气化将煤炭转化为合成气,然后将合成气经催化反应制得甲醇,最后通过纯化和后处理等步骤得到高纯度的甲醇产品。
甲醇的生产工艺

(1)生产原料-合成气的制备
合成气最先以固体燃料为原料,在常压或加压下气化, 用水蒸气和氧气与之反应,生产水煤气作甲醇合成或合成氨 的原料。20世纪50年代以来,原料结构发生了很大变化,以 气态烷烃、液体石油馏分为原料生产甲醇原料气,不论从工 程投资、能量消耗、生产成本来看都有明显的优越性,很快 得到发展。近年来,由于考虑到世界石油和天然气的贮藏量 远不及煤炭,由煤炭生产合成气的意义又重新受到重视。所 以,从根本上说,凡含有碳素的固体、液体和气体均可用作 合成气生产的原料。
2.反应压力
与副反应相比,合成甲醇的主反应是摩尔数减少最多 而平衡常数最小的反应,因此增加压力对提高甲醇的平 衡浓度和加快主反应速率都是有利的。反应压力越高, 甲醇生成量越多。但是增加压力要消耗能量,
而且还受设备强度限制,因此需要综合各项因素确定 合理的操作压力。用ZnO-Cr2O3催化剂时,反应温度高, 由于受平衡限制,必须采用高压,以提高其推动力。而 采用铜基催化剂时,由于其活性高,反应温度较低,反 应压力也相应降至5~10Mpa。
法。液体原料的水蒸气转化反应通式为: CnHm + n H2On CO + (n +m/2)H2 -Q 2.部分氧化法
液体原料通过部分氧化法来制取合成气,是利用 原料油在氧化炉内不完全燃烧提供高温热源,使烃 类碳氢化合物裂解,制得甲醇生产所需要的氢气和 一氧化碳。
c.固体原料制取合成气
固体原料成分以固定碳为主,主要指煤和 焦碳。固体原料在高温下通入水蒸气,生成 氢和一氧化碳等合成气。其反应主要包括碳 的氧化和水蒸气的分解两个部分。其主反应 为:
2CH3Cl + Ca(OH)2CaCl2 +2CH3OH CH3Cl + CH3OH CH3OCH3 + HCl CH3OCH3 + H2O 2CH3OH 在350℃,于流动系统中进行这一过程时,所得到的甲醇产率为67%,二 甲醚为33%。氯甲烷的转化率达98%。 尽管反应指标尚好,又是在常压下进行反应,工艺简单,但反应过程中 氯以氯化钙的形式消失,因此水解法价格昂贵,没有在工业上得到广泛 应用。
甲醇合成工艺

甲醇合成工艺甲醇合成第一节甲醇产品介绍一、物理性质甲醇是最简单的饱和一元醇,俗称“木精”、“木醇”,其分子式为CH3OH,分子量为32.04。
常温常压下,纯甲醇是无色透明、易燃、极易挥发且略带醇香味、刺激性气味的有毒液体。
甲醇能和水以任意比互溶,但不形成共沸物,能和多数常用的有机溶剂(乙醇、乙醚、丙酮、苯等)混溶,并形成恒沸点混合物。
甲醇能和一些盐如CaCl2、MgCl2等形成结晶化合物,称为结晶醇,如CaCl2?CH3OH、MgCl2?6CH3OH,和盐的结晶水合物类似。
甲醇能溶解多种树脂,但不能与脂肪烃类化合物互溶。
甲醇水溶液的密度随甲醇浓度和温度的增加而减小;甲醇水溶液的沸点随液相中甲醇浓度的增加而降低。
甲醇蒸汽和空气混合能形成爆炸性混合物,遇明火、高热能引起爆炸。
甲醇燃烧时无烟,其燃烧时显蓝色火焰。
与氧化剂接触发生化学反应或引起燃烧。
在火场中,受热的容器有爆炸危险,其蒸汽比空气重,能在较低处扩散到相当远的地方,遇明火会引起回燃,属危险性类别;试剂甲醇常密封保存在棕色瓶中置于较冷处。
甲醇有很强的毒性,口服5~10ml可以引起严重中毒,10ml以上造成失明,30ml以上可致人死亡。
甲醇属神经和血液毒物,它可以通过消化道、呼吸道和皮肤等途径进入人体,对中枢神经系统有麻醉作用;对视神经和视网膜有特殊选择作用,引起病变;可导致代谢性酸中毒,故空气中甲醇蒸汽的最高允许浓度为操作区5mg/m3,居民区0.5 mg/m3。
甲醇在常温下无腐蚀性,但对于铅、铝例外。
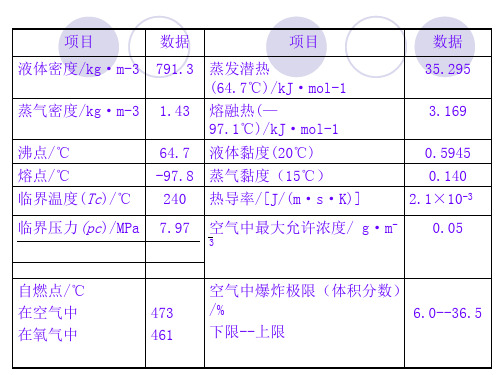
表一:甲醇物性参数表序号项目单位数值1 沸点(1.013×105Pa)℃ 64.5~64.72 凝固点℃ -97~-97.83 闪点℃ 12(闭口)~16(开口)4 自燃点℃ 473(空气中)~461(氧气中) 5相对密度(d20)(g/ml) 0.7915 6蒸汽压力(20℃)Pa 11825 蒸汽压力(21.2℃) Pa 133337 临界压力 MPa 7.95, 8 临界温度℃ 240 13 爆炸上限 % 36.5 8 爆炸下限 % 6 9 最小点火能量 MJ 0.216 10 相对分子量 32.04 表二:甲醇饱和蒸汽温度与压力平衡表(1mmHg = 133.322Pa)温度℃蒸汽压mmHg 温度℃蒸汽压mmHg 温度℃ 蒸汽压mmHg-67.4 0.102 20 96.0 130 6242-60.4 0.212 30 160 140 8071-54.5 0.378 40 260.5 150 10336-48.1 0.702 50 406 160 13027-44.4 0.982 60 625 170 16292-44.0 1 64.7 760 180 20089-40 2 70 927 190 24615-30 4 80 1341 200 29787-20 8 90 1897 210 35770-10 15.5 100 2621 220 425730 29.6 110 3561 230 5041410 54.7 120 4751 240 59660表三:精甲醇的质量国家标准甲醇质量标准GB338—2004检测项目指标优等品一等品合格品色度(铂—钴号)5 10 密度(20℃)g/cm3 0.791~0.792 0.791~0.793温度范围(101325Pa)℃ 64—65.5 沸程℃≤ 0.8 1 1.5高锰酸钾试验min≥ 50 30 20水混溶性试验 1:03 1:09 水份含量%≤ 0.1 0.15 酸度(以HCOOH)%计≤ 0.0015 0.003 0.005碱度(以NH3)%计≤ 0.0002 0.0008 0.0015 羰基化合物(HCHO)%≤ 0.002 0.005 0.01蒸发残渣含量%≤ 0.001 0.003 0.005 硫酸洗涤试验/铂—钴色号50 —乙醇的质量百分数% 供需双方协商表四:精甲醇的质量美国联邦规格AA标准:美国联邦规格AA级O-M-232E相对密度0.7928 馏程(101.325KPa)℃不大于1℃,并包括64.6±0.1℃纯度% 99.85酸度% 以醋酸计,最大为0.003醛酮% <0.003 KMnO4试验min >30 水份% <0.1不挥发物<0.001乙醇% <0.001 二、甲醇的化学性质甲醇不具酸性,也不具碱性,对酚酞和石蕊均呈中性。
煤制甲醇工艺原理

煤制甲醇工艺原理
煤制甲醇工艺是一种有效利用煤或油类等资源中含碳元素制取甲醇的技术,其基本原理和过程如下。
1. 煤解烃过程:借助空气将煤热解成气态碳氢烃,即燃气,得到混合气体CO、CO2和烃(CH4、C2H6、C3H8等);
2. 催化裂解:将混合气体提升至固定温度和压力,并喷入含有催化剂的反应器内进行催化反应,将各种烃分子裂化成较低烃分子以及水;
3. 转化:将裂解产生的较低烃分子通过自由基反应或期转化反应转化成甲醇;
4. 分离:将转化后的甲醇与裂解产生的水及其他烃气经过冷凝分离;
5. 精炼:将分离得到的混合物经过加热蒸发、塔式干法分离、乙二醇脱水精炼等步骤把甲醇从混合物中分离出来,得到满足用途要求的纯净甲醇产品。
煤制甲醇技术简单、造价低、运行成本少,可经济有效地利用煤类资源,以满足用甲醇的各种不同需求,在我国的甲醇勘探生产中具有重要的实用价值。
甲醇生产工艺与操作

甲醇生产工艺与操作甲醇(CH3OH)是一种无色、难燃的液体,是重要的工业原料和溶剂。
甲醇的生产工艺主要有合成气法、天然气法和余热法等。
下面简要介绍甲醇的生产工艺和操作。
1. 合成气法合成气法是目前甲醇生产中最常用的方法。
该方法是通过将天然气或煤转化为合成气(一氧化碳和氢气的混合物),再通过催化剂的作用,将合成气转化为甲醇。
合成气法的主要步骤包括气化、净化、合成、分离和净化等。
2. 天然气法天然气法是利用天然气作为原料生产甲醇的方法。
该方法在气化步骤中,直接利用天然气进行气化,生成合成气,然后经过合成、分离和净化等步骤得到甲醇。
天然气法相对于合成气法,减少了气化步骤,简化了工艺流程。
3. 余热法余热法是利用工业生产中产生的余热来生产甲醇的方法。
该方法在循环床和余热再利用等工艺条件下,通过将废气进行循环利用,使得废气中的有机物充分利用,生成合成气,再经过催化剂的作用转化为甲醇。
甲醇的生产操作包括原料准备、反应、分离、回收和净化等步骤。
1. 原料准备在甲醇生产过程中,对于不同的工艺,相应的原料也不同。
合成气法中,主要原料包括天然气和煤。
天然气法中,主要原料为天然气。
余热法则是利用工业生产中的余热进行甲醇生产。
2. 反应甲醇的合成反应主要通过催化剂的作用进行。
合成气与催化剂在适当的温度和压力条件下进行反应,生成甲醇。
3. 分离在反应后,需要对产物进行分离。
主要的分离操作包括冷凝分离和蒸馏分离。
通过降温,将甲醇从反应气体中分离出来。
4. 回收回收操作主要是对分离得到的甲醇进行回收利用。
通过蒸馏、过滤和再结晶等操作,将甲醇进行纯化。
5. 净化甲醇的净化操作主要是去除杂质。
通过吸附剂或催化剂的作用,去除甲醇中的杂质,提高甲醇的纯度。
总的来说,甲醇的生产工艺主要有合成气法、天然气法和余热法等方法,生产操作包括原料准备、反应、分离、回收和净化等步骤。
这些工艺和操作对于甲醇的生产具有重要意义,能够确保甲醇的质量和产量。
甲醇生产工艺流程.ppt课件
热导率/[J/(m·s·K)]
2.1×10-3
临界压力(pc)/MPa
7.97
空气中最大允许浓度/ g·m-3
0.05
自燃点/℃ 在空气中 在氧气中
473 461
空气中爆炸极限(体积分数)/% 下限--上限
6.0--36.5
2 化学性质 甲醇是最简单的饱和脂肪醇,具有脂肪醇的化学性能,其化学性很活泼,如氧化反应、氨化反应、酯化反应、羰基化反应、脱水反应、裂解反应等。 3 用途 ⑴碳一化工的支柱 甲醇是一种重要的基础原料,广泛用于制造各种有机化学品。 ⑵新一代燃料 甲醇是一种易燃液体,燃烧性能好,辛烷值高,抗爆性能好;而且甲醇是一种洁净染料,燃烧时无烟,它的燃烧速度快,放热快,热效率高,能减少排气污染。
甲醇的生产方法介绍
1、高压法 用一氧化碳与氢在高温(340~420℃)高压(30.0~50.0MPa)下用锌-铬氧化物作催化剂合成甲醇。 2、低压法 一氧化碳与氢气为原料在低压(5.0MPa)和275℃左右的温度下,采用铜基催化剂合成甲醇。低压法成功的关键是采用了铜基催化剂,铜基催化剂比锌-铬催化剂活性好得多,是甲醇合成反应能在较低的压力和温度下进行。
气体组成(CO-CO2-H2体积分数)/%
反应温度
碳转化率
CH3OH
CH4
0-30-70
250℃
11.0
0
2-28-70
68.3
0
4-26-70
56.5
0
6-24-70
55.1
0
8-22-70
54.4
0
10-20-70
40.5
0
20-10-70
22.6
2.8
甲醇生产的主要方法介绍

甲醇生产的主要方法介绍
一、熔盐法
熔盐法是利用氢氧化钠熔与乙醇互联反应生成醇挥发油和乙酸,最后再经过分离、水蒸气萃取或其他方法,把乙醇或其他醇从其中提取出来的一种工艺。
该法的工艺流程如下:首先,将氢氧化钠熔盐与乙醇反应,形成混合物;其次,把混合物加入水中,分离产物;然后,利用水蒸气萃取技术将乙醇从混合物中提取出来;最后,用活性炭进行吸附精馏,最终得到纯度较高的乙醇。
熔盐法的优点:1、工艺稳定,产出乙醇纯度较高;2、反应产生物含量低;3、操作简单,经济实惠。
二、纤维素糖法
纤维素糖法也称为水糖法,是利用纤维素糖发酵生产乙醇的一种方法。
纤维素糖发酵过程中,酵母或真菌产生醇酸类物质,可通过蒸馏精馏,将乙醇从混合物中提取出来。
该法的工艺流程如下:首先,将纤维素糖溶解于水中,形成糖水;其次,将糖水添加酵母,引发发酵反应,产生乙醇和乙酸;然后,将发酵液经过蒸馏精馏,分离出乙醇;最后,再用活性炭进行吸附精馏,得到纯度较高的乙醇。
纤维素糖法的优点是:1、原料和燃料来源丰富,可以使用稻米、玉米等农作物产生糖;2、可以大规模生产;3、投资成本低,经济实惠。
三、生物法
生物法是利用微生物将原料发酵产生乙醇的一种工艺方法。
生物法利用酵母或真菌将有机物,如蔗糖、淀粉、纤维素等,通过代谢转化为乙醇。
该法的工艺流程如下:首先,将原料液体糖液添加到发酵罐中,接种微生物;其次,经过混合、加热、加压等提高发酵速度,形成混合物;然后,经过水蒸气萃取技术将乙醇从混合物中提取出来;最后,用活性炭进行吸附精馏,得到纯度较高的乙醇。
生物法的优点:1、原料来源丰富,可以使用糖、麦芽、淀粉等有机物;2、生产成本低,效率高;3、乙醇产品的性能比其他法获得的乙醇要好。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲醇生产工艺原理
一氧化碳加氢为多方向反应,随反应条件及所用催化剂的不同,
可生成醇、烃、醚等产物,因而在甲醇合成过程中可能发生以下反应:
●主反应:CO+H2≒CH3OH+Q
CO2+3 H2≒CH3OH+H2O+Q
●副反应:CO+3H2≒CH4+H2O+Q
2CO+4H2≒C2H5OH(乙醇)+H2O+Q
2CO+4H2≒CH3OCH3(甲醚)+H2O+Q
一、甲醇合成反应影响因素有哪些?
1、温度
2、压力
3、空速
4、惰性气
5、CO2含量:CO2也能参加合成甲醇的反应,但对锌铬系催化
剂,对于铜系催化剂,CO2的作用比较复杂,即有动力学方面的作用,
还可能具有化学助剂的作用,归纳起来,其有利的方面为:
1)含有一定量的CO2可促进甲醇的提高
2)提高催化剂的选择性,可降低醚类等副反应的发生
3)可更有利于调节温度,防止超温,延长催化剂使用寿命
4)防止催化剂结炭
其不利方面:
1)与CO合成甲醇相比,每生成1kg甲醇多消耗0.7m3的H2
2)使粗醇中水含量增加,甲醇浓度降低
总之,在选择操作条件时,应权衡CO2作用的利弊。通常,在使
用初期,催化剂活性较好时,应适当提高原料气中CO2的浓度使合成
甲醇反应不致于过分剧烈,以得于床层温度的控制;在使用后期,可
适当降低原料气中的CO2浓度,促进合成甲醇反应的进行,控制与稳
定床层温度。
二、铜基甲醇催化剂还原方法有几种,优缺点?
铜基甲醇催化剂掺入使用前,必须用氢小心还原使其活化。其还
原过程是一个强放热反应,每消耗1%的H2,引起绝热漫长约28℃,
反应式如下:
CuO+H2=Cu+86.7kj/mol
在工作业上,可采用低氢和高氢还原两种方法。
低氢还原特点:床层温度便于控制,有利于提高催化剂的活性,
缺点:时间较长(80-100小时)。
高氢还原特点:还原时间较短40小时,缺点:操作必须十分细心
严格,稍有不慎,将引起催化剂床层剧烈超温,导致催化剂失活报废。
另外操作不当,催化剂强度易受到损害,造成催化剂部分粉化而引起
床层压差大。有文献认为,在高浓度氢气下,容易发生深度还原,使
CuO全部还原成金属铜而引起活性与选择性的下降。
三、何为醇净值?怎样进行估算?
甲醇合成塔出入品甲醇含量的差,被称为醇净值。一般用下列经
验公式进行估算:
△E=(T出-T入)/32×100%
