高二化学下学期第一次月考试题6
2022-2023学年内蒙古赤峰二中高二下学期第一次月考化学试题
2022-2023学年内蒙古赤峰二中高二下学期第一次月考化学试题1.化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言。
下列化学用语使用正确的是A.乙炔分子的比例模型:B.醛基的电子式:C.2-丁醇的结构简式:D.的结构式:2. 2021年诺贝尔化学奖授予BenjaminList和DavidMacMillan,以表彰他们对不对称有机催化的发展所做出的贡献。
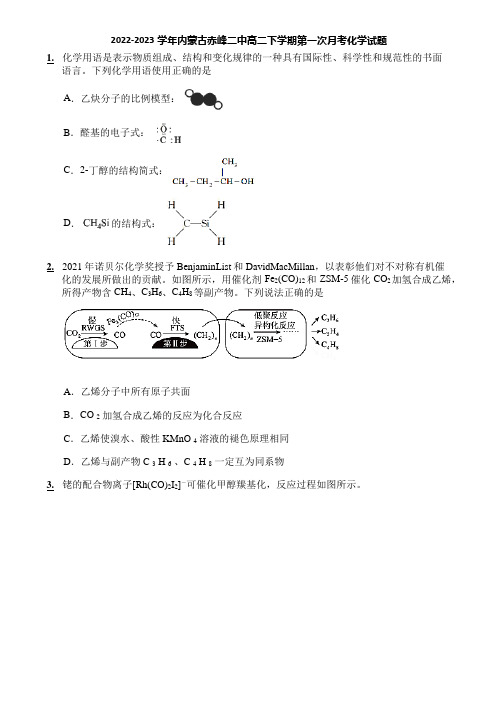
如图所示,用催化剂Fe2(CO)12和ZSM-5催化CO2加氢合成乙烯,所得产物含CH4、C3H6、C4H8等副产物。
下列说法正确的是A.乙烯分子中所有原子共面B.CO 2加氢合成乙烯的反应为化合反应C.乙烯使溴水、酸性KMnO 4溶液的褪色原理相同D.乙烯与副产物C 3 H 6、C 4 H 8一定互为同系物3.铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是A.CH 3 COI是反应中间体B.甲醇羰基化反应为CH 3 OH+CO=CH 3 CO 2 HC.反应过程中Rh的成键数目保持不变D.存在反应CH 3 OH+HI=CH 3 I+H 2 O4.利用下列装置进行实验,能达到实验目的的是A.图Ⅰ装置可制备固体B.图Ⅱ装置可测定中和反应的反应热C.图Ⅲ装置可实现铁上镀铜,a极为铜,电解质溶液可以是溶液D.图Ⅳ装置可检验1-溴丁烷和氢氧化钠乙醇溶液反应的产物5.在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是A.该反应进行到M点放出的热量大于进行到W点放出的热量B.T 2下,在0~t 1时间内,υ(Y)= mol/(L·min)C.M点的正反应速率υ 正大于N点的逆反应速率υ 逆D.M点时再加入一定量的X,平衡后X的转化率减小6.在EY沸石催化下,萘与丙烯反应主要生成二异丙基萘M和N。
2021-2022学年安徽省芜湖市南陵中学高二(下)第一次月考化学试卷(含答案解析)

2021-2022学年安徽省芜湖市南陵中学高二(下)第一次月考化学试卷1. 下列化学用语书写正确的是( )A. 甲基的电子式:B. 丙烯的键线式:C. 填充模型表示甲烷分子或四氯化碳分子D. 乙醇的结构式:2. 下列各化合物的命名中正确的是( )A. 3−甲基丁烷B. CH3−CH2−CH=CH23−丁烯C. 2,3,4−三甲基−2−乙基戊烷D. 3−甲基−1−戊烯3. 根据金属的活泼性不同,可以采用热分解法、热还原反应和电解法进行冶炼。
下列金属的冶炼可以采用热分解法的是( )A. 以MgCl2为原料冶炼MgB. 以Fe2O3为原料冶炼FeC. 以HgO为原料冶炼HgD. 以Al2O3为原料冶炼Al4. 下列有关物质的性质与用途正确且具有对应关系的是( )A. Ti−Fe合金室温下能大量、快速吸收H2,可用作储氢材料B. NaHCO3受热易分解,可用于治疗胃酸过多C. 生铁硬度大、延展性好,可用于制造机械D. 硫化橡胶弹性好、耐高温,适合制造轮胎5. 二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )A. 利用金属钠或金属钾B. 利用燃烧法C. 利用红外光谱法D. 利用核磁共振氢谱 6. 现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( ) A. 分液、萃取、蒸馏B. 萃取、蒸馏、分液C. 分液、蒸馏、萃取D. 蒸馏、萃取、分液7. 下列有关应用与物质性质没有关联的是( ) 选项 应用 性质A液氨可用作制冷剂 NH 3极易溶于水 B实验室用NH 4Cl 和Ca(OH)2共热制取NH 3 铵盐与强碱反应会放出氨 C工业上利用NO 2与H 2O 反应制HNO 3 NO 2与H 2O 反应会生成HNO 3和NO D 硝酸一般保存在棕色试剂瓶中 光照会使HNO 3分解A. AB. BC. CD. D8. 高纯度晶硅是典型的无机非金属材料,又称“半导体”材料。
2022-2023学年辽宁省鞍山市普通高中高二下学期第一次月考化学(A卷)试题

2022-2023学年辽宁省鞍山市普通高中高二下学期第一次月考化学(A卷)试题1.下列各组物质全部是强电解质的是A.H 2 SiO 3、HNO 3、HClO B.Ba(OH) 2、CH 3 COOH、C 2 H 5 OH C.H 2 SO 4、Ba(OH) 2、BaCl 2D.H 2 O、NH 3∙H 2 O、H 3 PO 42.已知25℃时有关弱酸的电离平衡常数如下表所示,则下列有关说法正确的是A.等物质的量浓度的各溶液pH关系为:B.醋酸溶液加水稀释,其电离程度先增大后减小C.NaCN中通入少量发生的化学反应为:D.的电离常数表达式:3.水存在电离平衡:H2O H++OH-,常温下,K w的数值为 1×10-14.下列说法不正确的是A.常温下,水电离出的c (H + )= c (OH - )=10 -7 mol·L -1B.向水中加入NaCl,H +与 Cl -结合生成 HCl,使水的电离平衡向正反应方向移动C.向水中加入HCl或者NaOH,水的电离平衡都向逆反应方向移动D.改变温度,K w也会发生改变4.常温下,pH=11的氢氧化钡溶液中,由水电离出的为A.B.C.D.5.量筒和滴定管所盛放液体的凹面,都在10 mL刻度,若都采用仰视读数,则前者比后者的读数A.大于B.小于C.等于D.不能比较6.锂电池是新一代高能电池,目前已研发出多种锂电池。
某种锂电池的总反应式为Li+MnO2 =LiMnO2,下列说法中正确的是A.Li是正极,MnO 2是负极B.放电时负极的反应:Li-e - =Li +C.放电时正极发生氧化反应D.电池放电时,能量转化率可达到100%7.如图用碳棒电解饱和食盐水的示意图,已知Na+向c极方向移动,则A.a极为正极B.c极附近溶液pH变大C.d极产生可燃性气体D.电解后n(Na + )变大8.当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,下列说法正确的是A.碳原子由基态变为激发态B.碳原子由激发态变为基态C.该过程将产生发射光谱D.碳原子要向外界环境释放能量9.某元素基态原子4s轨道上有1个电子,则该基态原子价电子排布不可能是()A.3p 6 4s 1B.4s 1C.3d 5 4s 1D.3d 10 4s 1 10.下列对电子排布式或轨道表示式书写的评价正确的是N原子的轨道表示式:O原子的轨道表示式:K原子的轨道表示式:的电子排布式:A.A B.B C.C D.D11.2种元素的基态原子电子排布式分别是:①,②,下列有关比较中正确的是A.第一电离能:②>①B.原子半径:②>①C.金属性:②>①D.最高正化合价:①>②12.下列关于NH、NH3、NH三种微粒的说法不正确的是A.三种微粒所含有的电子数相等B.三种微粒中氮原子的杂化方式相同C.三种微粒的空间构型相同D.键角大小关系:NH >NH 3 >NH13.下列物质性质的变化规律与分子间作用力无关的是A.、、、的熔、沸点逐渐降低B.HF、HCl、HBr、HI的热稳定性依次减弱C.、、、的熔、沸点逐渐升高D.、、、的沸点逐渐升高14.某同学在收到的信封上发现有收藏价值的邮票,便将邮票剪下来浸入水中,以去掉邮票背面的黏合剂。
高二下学期第一次月考化学试卷Word版含答案

高二-高二下学期第一次月考化学试题满分:100分时间:90分钟第I卷一、单选选择题(每题3分,共48分)1.清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。
其主要成分都是()A.碳氢化合物 B.碳水化合物 C.氢气 D.醇类2.下列描述中正确的是()A.氧化还原反应一定都是放热反应B.强酸与强碱反应都是放热反应C.放热反应的反应速率总是大于吸热反应的反应速率不同D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的H3.关于化学反应与能量的说法正确的是()A.化学键断裂需要吸收能量B.化学反应中能量变化的大小与反应物的质量多少无关C.在化学反应过程中反应物的总能量总是等于生成物的总能量D.放热反应都能自发进行,吸热反应需要在加热的条件下才能进行4.为了测定酸碱反应的中和热,计算时至少需要的数据是( )①酸的浓度和体积②碱的浓度和体积③比热容④反应后溶液的质量⑤生成水的物质的量⑥反应前后温度的变化⑦操作所需时间A.①②③⑥ B.①③④⑤ C.③④⑤⑥ D.全部5. 反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()①增加C的量②保持体积不变,充入N2使体系压强增大③将容器的体积缩小一半④保持压强不变,充入N2使容器体积变大A.①④B.②③C.①②D.②④6. 已知某化学反应的平衡常数表达式为K=平衡常数如表所示:t/℃700 800 830 1 000 1 200K 1.67 1.11 1.00 0.60 0.38下列有关叙述不正确的是()A.该反应的化学方程式是CO(g)+H2O(g)CO2(g)+H2(g)B.上述反应的正反应是放热反应C.若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态D.若平衡浓度符合下列关系式:= 1000℃7.把0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应3X(g)+Y(g)nZ(g)+2W(g),5min末已生成0.2molW,若测知以Z 表示的平均反应速率为0.01mol·L﹣1·min﹣1,则n是()A.2 B.4 C.1 D.38.已知下列反应的平衡常数:H2(g)+S(s)H2S(g),K1;S(s)+O2(g)SO2(g),K2.则反应:H2(g)+SO2(g)O2(g)+H2S(g)的平衡常数为()A.K1+K2 B.K﹣K2 C.K1×K2 D.9.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是()①混合气体的密度②容器内气体的压强③混合气体的总物质的量④B物质的量浓度.A.①②④B.②③C.②③④D.全部10.在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是()A.Z为0.3mol/L B.Y2为0.4mol/L C.X2为0.2mol/L D.Z为0.4mol/L11.已知反应X+Y===M+N为放热反应,下列对该反应的说法中正确的是() A.X的能量一定高于MB.Y的能量一定高于NC.X和Y的总能量一定高于M和N的总能量D.因该反应为放热反应,故不必加热就可发生12.已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-12C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1,H—H、O=O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )A.-118 B.+130 C.-332 D.+35013.已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5 kJ·mol-1①2C(s)+O2(g)===2CO(g) ΔH2=-221.0 kJ·mol-1②C(s)+O2(g)===CO2(g) ΔH3=-393.5 kJ·mol-1③则能表示汽车尾气转化的热化学方程式为( A )A.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1B.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=+746.5 kJ·mol-1C.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-1 493 kJ·mol-1D.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=+1 493 kJ·mol-114.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ·mol-1、1 411.0 kJ·mol-1和1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1C.-330 kJ·mol-1 D.+330 kJ·mol-115.下列说法或表示法正确的是( )A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多B.需要加热的反应说明它是吸热反应C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJD.1 mol S完全燃烧放热297.3 kJ,热化学方程式为S+O2===SO2ΔH=-297.3 kJ·mol-116.已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1;1 2H2SO4(浓)+NaOH(aq)===12Na2SO4(aq)+H2O(l)ΔH2=m,下列说法正确的是()A.上述热化学方程式中的计量数表示分子数 B.ΔH1>ΔH2C.ΔH2=-57.3 kJ·mol-1 D.|ΔH1|>|ΔH2|第二卷(非选择题)17.(12分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。
2020-2021学年河北省石家庄市某校高二下学期第一次月考_(化学)试卷(有答案)

2020-2021学年河北省石家庄市某校高二下学期第一次月考 (化学)试卷一、选择题1. 提出“杂化轨道理论”的科学家是()A.门捷列夫B.普鲁特C.玻尔D.鲍林2. 下列各组元素中不符合“对角线法则”的是()A.Li、MgB.C、PC.B、SiD.Be、Al3. 下列基态原子或离子的相关电子排布图正确的是()A.Fe3+的价电子:B.Cr原子的价电子:C.N原子的核外电子:D.S2−的L层电子:4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X同周期且基态原子均含有2个未成对电子。
Z的单质常温下为气体且价电子数和:W+X=Y+Z,下列有关说法正确的是()A.简单离子半径:X<YB.最高正价:X>WC.Y与Z形成的化合物为非电解质D.W、Z形成的二元化合物中可能同时含有σ键和π键5. 下列关于卤族元素单质及其化合物的结构与性质说法错误的是()A.相对分子质量:CH2Cl2>CH3Cl,因此熔沸点:CH2Cl2>CH3ClB.键长H−Br>H−Cl,因此稳定性:HCl>HBrC.单质氧化性F2>Cl2,因此F2可氧化水溶液中的Cl−D.非金属性:Cl>Br,因此含氧酸酸性:HClO4>HBrO46. 下列关于物质结构和性质的说法正确的是()A.BF3中的键角大于BF4−的键角B.CH3CN中σ键和π键的数目之比为4:3C.含氧酸酸性:HClO>HClO2D.CH3OH易溶于水的原因仅仅是因为CH3OH和水分子都是极性分子7. 反应SiHCl3(g)+H2(g)===Si(s)+3HCl(g)可用于纯硅的制备,下列说法正确的是()A.SiHCl3中Si原子的杂化方式为sp2杂化B.SiHCl3中Si元素的化合价为+2C.键长:Si−Si>C−C,故键能:Si−Si<C−CD.HCl易溶于水是因为HCl和水分子之间能形成氢键8. 已知X、Y元素同周期,且电负性X大于Y,下列说法一定错误的是()A.第一电离能:Y大于XB.气态氢化物的稳定性:Y大于XC.最高价含氧酸的酸性:X强于YD.X和Y形成化合物时,X显负价,Y显正价9. 已知HF沸点为19.5∘C,BF3沸点为−100∘C,HF+BF3===HBF4,下列有关说法错误的是()A.HBF4中B原子为sp3杂化B.BF3和HBF4分子中B最外层均为8e−稳定结构C.HBF4中存在配位键D.HF沸点高于BF3沸点的原因可能为HF分子之间存在氢键10. 根据价层电子对互斥理论,NCl3、SO2、SO3、BF3的气态分子中,中心原子价层电子对数不同于其他分子的是()A.NCl3B.SO2C.SO3D.BF311. 元素的基态气态原子得到一个电子形成气态−1价离子时所放出的能量称作第一电子亲和能(E),−1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如表所示。
浙江省平阳县万全综合高级中学2022-2023学年高二下学期第一次月考化学试题 (原卷版)

步骤二:通过仪器分析得知乙偶姻的相对分子质量为88。
步骤三:用核磁共振仪测出乙偶姻的核磁共振氢谱如图2,图中4个峰的面积比为1∶3∶1∶3。
14.由含硒废料(主要含 、 、 、 、 、 等)制取硒的流程如图1:
图1:
图2:
下列有关说法正确的是
A.“分离”的方法是蒸馏
B.“滤液”中主要存在的阴离子有: 、
C.“酸化”时发生的离子反应方程式为
D. 晶胞如图2所示,1个 晶胞中有16个 原子
15.下列叙述正确的是
A.某有机物燃烧后产物只有CO2和H2O,可推出的结论是有机物属于烃
A.电负性:
B.最高正价:
C.Q与M的化合物中可能含有非极性共价键
D.最高价氧化物对应水化物的酸性:
13.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知 和 的相对能量为0],下列说法不正确的是
A.
B.可计算 键能为
C.相同条件下, 的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:
(3)请说明为什么装置D不能放置在装置E后面?___________。
(4)装置F的作用是___________。
19.硅材料在生活中占有重要地位。请回答:
(1)Si(NH2)4分子 空间结构(以Si为中心)名称为___________,分子中氮原子的杂化轨道类型是___________。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是___________。
三台中学高二下学期第一次月考化学试题(原卷版)
秘密★启用前【考试时间:2023年3月29日上午10:40-12:00】高中2021级第四学期第一学月月考测试化学命题人:吴征兵审题人:李佳倩本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卡共2页。
满分100分,考试时间80分钟。
注意事项:1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色签字笔填写清楚,同时用2B 铅笔将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cr-52 Co-59第Ⅰ卷选择题(满分42分)一、选择题(每小题只有一个选项符合题意。
每小题3分,共42分)1. 化学与人类生活、生产息息相关。
下列说法错误的是A. 用纯碱溶液清洗油污,加热可增强去污力B. 可施加适量石膏(CaSO4)降低盐碱地(含较多Na2CO3)土壤的碱性C. 可以利用水解反应制备胶体D. 明矾可以水解,因此可用作自来水消毒2. 设N A为阿伏加德罗常数的值,下列说法正确的是A. pH=6的纯水中含有OH-的数目为10-8 N AB. 1L 0.1mol/L AlCl3溶液中含有Al3+数目为0.1N AC. 0.1mol熔融NaHSO4中含有的阳离子数为0.1N AD.含l mol NaHSO3的溶液中,n(H2SO3)+n(HSO)=1mol3. 下列各组物质中按强电解质、非电解质、弱电解质组合的是A. B.C. D.4. 25℃时,等物质的量浓度的下列四种溶液:①HCl 溶液 ②NaOH 溶液 ③溶液④溶液,其中水的电离程度按由大到小顺序排列的一组是A. ③>②=①>④B. ④>③>②>①C. ④>①=②>③D. ③>①>②>④5. 下列指定溶液中一定能大量共存的离子组是A. 含有大量的溶液中:、、、B. pH=l 的溶液中:、、、C. 水电离产生溶液中:、、、D. Na 2CO 3溶液中:、、、6. 下列有关实验原理,装置、操作的描述中正确的是ABCD溶液pH 的测定比较硫、碳、硅元素的非金属性强弱反应热的测定氨气的尾气吸收7. A. 硫酸氢钠溶液显酸性:B.溶液显碱性:C. 氨水显碱性:D. 碳酸氢钠溶液显碱性:8. 室温下三种稀酸:a.溶液,b.溶液,c.溶液。
2022-2023学年湖南省株洲市第一中学高二下学期第一次月考化学试题
2022-2023学年湖南省株洲市第一中学高二下学期第一次月考化学试题1.下列表示不正确的是B.乙醛的结构简式:CH 3 CHO A.乙烷的球棍模型:C.2,3─二甲基丁烷的键线式:D.乙炔的实验式(最简式):C 2 H 22. 1molN2H4(g)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ的热量,该反应的正确的热化学方程式为:A.N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(l) △H =-622kJ·mol -lB.N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(g) △H =-622kJ·mol -lC.N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(l) △H =+622kJ·mol -lD.N 2 H 4 (g)+O 2 (g)=N 2 (g)+2H 2 O(g) △H =+622kJ·mol -l3. 1940年科学家用a粒子轰击Bi发现了元素At,其反应为Bi +He→At+2n,则At的中子数为()A.85 B.126 C.127 D.2114.下列关于铜电极的叙述正确的是A.铜锌原电池中铜是负极B.用电解法精炼粗铜时粗铜作阴极C.在镀件上电镀铜时可用铜作阳极D.电解食盐水时铜作阳极5.下列变化中属于原电池反应的是A.铁锈可用稀盐酸洗去B.在空气中金属铝表面迅速被氧化形成保护膜C.红热的铁丝与水接触表面形成蓝黑色保护层D.在Fe与稀H 2 SO 4反应时,加几滴CuSO 4溶液,可加快H 2的产生6.《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳)。
“灰”的主要成分为M,下列有关M及其反应中能量变化的判断正确的是A.M为CaCO 3,M分解反应中的能量变化如图1B.M为CaCO 3,M分解反应中的能量变化如图2C.M为CaO,M与盐酸反应中的能量变化如图1D.M为CaO,M与盐酸反应中的能量变化如图27.短周期主族元素R、X、Y、Z的原子序数依次增大,Y原子最外层电子数等于最内层电子数的一半。
2022-2023学年四川省广安市第二中学校高二下学期第一次月考化学试题
2022-2023学年四川省广安市第二中学校高二下学期第一次月考化学试题1.化学与生产、生活及社会发展密切相关。
下列说法正确的是A.铁制品和铜制品均能发生析氢腐蚀和吸氧腐蚀B.明矾水解时产生具有吸附性的胶体粒子,可消除水中Cu 2+等重金属离子污染C.医用口罩“熔喷层”使用的是超细聚丙烯纤维,该纤维属于有机高分子材料D.垃圾分类中,陶瓷碎片属于可回收垃圾,果皮属于厨余垃圾,过期药品属于有害垃圾2.已知氯化铬的水合物为CrCl3·6H2O,其中铬元素的配位数是6,将含0.1 mol氯化铬的水溶液用过量稀硝酸银溶液处理时,只得到0.2 mol AgCl沉淀,则氯化铬溶于水中的含铬阳离子为A.Cr 3+B.[CrCl 2 (H 2 O)4 ] +C.[CrCl(H 2 O) 5 ] 2+D.[Cr(H 2 O) 6 ] 3+3.下列关于原子结构、原子轨道的说法正确的是A.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子B.在K能层中,有自旋相反的两条轨道C.s电子绕核运动,其轨道为球面,而p电子在纺锤形曲面上运动D.电子云直观地表示原子核外电子数目4.用催化还原,可以消除氮氧化物的污染。
例如:①②下列说法不正确的是A.若用标准状况下还原生成和水蒸气,放出的热量为173.4kJB.反应②中,当完全反应时转移的电子总数为1.60molC.反应①②转移的电子数相同D.由反应①可推知:5.在容积一定的密闭容器中,置入一定量的 NO(g)和足量C(s),发生反应 C(s)+2NO(g)CO2(g)+N2(g),平衡状态时 NO(g)的物质的量浓度c(NO)与温度T 的关系如图所示。
则下列说法中正确的是A.该反应的Δ H >0 B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1 < K2C.在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态D.在T2时,若反应体系处于状态D,则此时一定有v 正< v 逆6.下列说法错误的是A.杂化轨道可用于形成σ键或用于容纳未参与成键的孤电子对B.σ键和π键比例为7:1C.与互为等电子体,1mol 中含有的π键数目为2 N AD.已知反应N 2 O 4 (l)+2N 2 H 4 (l)=3N 2 (g)+4H 2 O(l),若该反应中有4molN-H键断裂,则形成的π键数目为3 N A7.下列说法中不正确的是A.加热到很高温度都难以分解,是因为水分子之间存在氢键B.葡萄糖分子(HOCH 2 -CHOH-CHOH-CHOH-CHOH-CHO)中的手性碳原子数为4C.含有π键的分子在反应时,π键是化学反应的积极参与者D.是V形,其A可能为杂化8.某模拟“人工树叶”电化学实验装置如下图所示,该装置能将和转化为和燃料()。
2022-2023学年广东省台山市第一中学高二下学期第一次月考化学试题
2022-2023学年广东省台山市第一中学高二下学期第一次月考化学试题1.下列说法不正确的是A.2,3-二甲基丁烷的键线式为B.乙烯的球棍模型:C.醛基:-COOH D.C 2 H 6和C 6 H 14互为同系物2.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5则下列有关比较中正确的是A.第一电离能:④>③>②>①B.原子半径:④>③>②>①C.电负性:④>③>②>①D.最高正化合价:④>③=②>①3.下列科学家所对应的理论或贡献正确的是①汤姆生:在研究阴极射线时发现原子中存在电子②徐光宪:在稀土金属串级萃取领域做出突出贡献③鲍林:在一个原子轨道里最多容纳2个电子且自旋相反④洪特:电子排布同一能级不同轨道时,基态原子总优先单独分占不同轨道且自旋相同⑤侯德榜:侯氏制碱法,制取NaOH⑥勒夏特列:提出工业合成氨的方法A.①②③④⑤⑥B.①②④C.②③④⑤D.①②⑤⑥4.下列叙述中正确的是A.NH 3、CO、CO 2都是极性分子B.CH 4、CCl 4都是含有极性键的非极性分子C.HF、HCl、HBr、HI的稳定性依次增强D.CS 2、H 2 O、C 2 H 2都是直线形分子5.下列有关晶体的叙述中,错误的是A.干冰晶体中,每个CO 2周围紧邻12个CO 2B.氯化钠晶体中,每个Cl —周围紧邻且距离相等的Cl —共有6个C.氯化铯晶体中,每个Cs +周围紧邻8个Cl —D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环有6个碳原子6.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是A.Na 2 O和SiO 2熔化B.Na和S熔化C.KCl和蔗糖熔化D.碘和干冰升华7.下列化学用语的表达正确的是A.氨气分子是平面三角形B.铍原子最外层电子的电子云图:C.价电子排布式为2s 2 2p 2和3s 2 3p 5的两原子能形成共价化合物D.基态铜原子价电子轨道表示式:8. X、Y、Z、W是原子序数依次增大的短周期不同主族元素,X的2p轨道有两个未成对电子,Y元素原子半径在同周期中最大,X与Y最外层电子数之和与Z的最外层电子数相等,W元素单质常温下是淡黄色固体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 湖北省宜昌市2016-2017学年高二化学下学期第一次月考试题 本试题卷共6页,二大题21小题。全卷满分100分,考试用时90分钟。 ★祝考试顺利★ 可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Ag-108 第Ⅰ卷(选择题 共48分) 1.生活中的下列现象与原子核外电子发生跃迁无关的是( ) A.焰色反应 B.节日里燃放的焰火 C.金属导线可以导电 D.夜空中的激光 2.下列事实不能用勒夏特列原理解释的是( ) A.开启啤酒瓶后,瓶中马上泛起大量泡沫 B.钢铁在潮湿的空气中容易生锈 C.实验室中常用排饱和食盐水的方法收集氯气 D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 3.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g) Y(g)+Z (s),以下不能作为反应达到平衡标志的是( ) A.X的分解速率是Y的消耗速率 的2倍 B.混合气体的压强不再变化 C.混合气体的密度不再变化 D.单位时间内生成lmolY的同时分解2mol X 4. 下列分子中,所有原子都满足最外层为8电子结构的是( ) A.BF3 B.PCl5 C.HCl D.CCl4 5.下列事实与氢键有关的是( ) A.水加热到很高温度都难以分解 B.水结成冰体积膨胀,密度变小 C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 D.HF、HCl、HBr、HI的热稳定性依次减弱 6.下列说法中正确的是( ) A.常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 2
C.含1mol硫酸的稀溶液与含1molBa(OH)2的稀溶液完全中和所放出的热量为中和热 D.在25℃、101KPa时,2mol 氢气的燃烧热是1mol 氢气的2倍 7.下列说法中正确的是( ) A.在气体单质分子中,一定含有σ键,可能含有π键 B.烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键 C.等电子体结构相似,化学性质相同 D.共价键的方向性决定了原子在形成分子时相互结合的数量关系
8.室温下,下列各组离子在指定溶液中,一定能大量共存的是( ) A.pH=1的溶液中:Na+、Fe2+、NO3﹣、SO42﹣ B.水电离出的c(H+)=1×10﹣12mol•L﹣1的溶液中:K+、Al3+、Cl﹣、SO42﹣ C.加入酚酞溶液显红色的溶液中:Na+、K+、HCO3﹣、Cl﹣ D.无色溶液中:K+、NH4+、Cl﹣、NO3﹣ 9.下列叙述中不正确的是( ) A.卤化氢分子中,卤素的非金属性越强,分子越稳定 B.以极性键结合的分子,不一定是极性分子 C.判断A2B或AB2型分子是极性分子依据是:具有极性键且分子构型不对称、键角小于180°的非直线形结构 D.非极性分子中,各原子间都应以非极性键结合
10.现有四种元素的基态原子的电子排布式如下: ①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p63s23p5. 则下列有关比较中,正确的是( ) A.电离能:③>①>② B.原子半径:③>②>① C.含氧酸的酸性:③>①>② D.电负性:③>①>② 11.对于可逆反应:2A(g)+B(g) 2C(g);△H<0,下列各图中正确的是( ) 3
12.关于原子轨道的说法正确的是( ) A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形 B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道 D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
13.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( ) A.铅蓄电池放电的正极电极反应式:PbO2+4H++2e﹣═Pb2++2H2O B.氢氧碱性燃料电池的负极反应式:O2+2H2O+4e﹣═4OH﹣ C.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu D.钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣═Fe2+ 14.在元素周期表中的某些元素之间存在着特殊的“对角线关系”,例如: Li~Mg、Be ~Al 、B ~Si相似等,下列说法不正确的是( ) A.氢氧化铍是两性氢氧化物 B.B、Si的电负性数值相似 C.Li和Mg的原子半径相近,且核外电子排布相近 D.Li在N2中燃烧能生成Li3N 15.常温时,Ksp[Mg(OH)2]=1.1×10﹣11,Ksp(AgCl)=1.8×10﹣10,Ksp(Ag2CrO4)=1.9×10﹣12 ,Ksp
(CH3COOAg)=2.3×10﹣3,下列叙述不正确的是( )
A.浓度均为0.2 mol•L﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 B.将0.001 mol•L﹣1的AgNO3溶液滴入0.001 mol•L﹣1的KCl和0.001 mol•L﹣1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 C.c(Mg2+)为0.11 mol•L﹣1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 16.常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是 4
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
第Ⅱ卷(非选择题 共52分) 17.(5分)常温下,下列四种溶液: ①0.10mol•L﹣1(NH4)2SO4 ②0.10mol•L﹣1 NH3•H2O ③0.10mol•L﹣1 CH3COONH4 ④0.10mol•L﹣1 NH4HSO4 请根据要求填空: (1)溶液①呈酸性,其原因是(用离子方程式表示): 。 (2)若将溶液②稀释10倍,则稀释后的溶液中c(OH﹣) 原来的十分之一(填“大于”、“小于”或“等于”)。 (3)实验测得溶液③的pH=7,则c(CH3COO﹣) c(NH4+)(填“>”、“<”或“=”)。 (4)上述四种溶液中,c(NH4+)由大到小的顺序为(填序号) 。 (5)将溶液②④混合,写出反应的离子方程式: 。 18.(12分)如表所示是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题: (1)请画出元素M的基态原子的价电子排布图________________________________。 (2)元素C、J形成的气态氢化物沸点更高的是________(填化学式),原因是 。 (3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是________(选填“极性”或“非极性”)分子。根据等电子原理:NO+2中氮原子的杂化类型是________,1 mol O2+2中含有π键的数目为________。 (4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp3杂化的分子有5
________(选填序号),CS2分子的空间构型是________。 (5)元素N可以形成分子式为N(NH3)5BrSO4、配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为 。 19.(8分)已知:O2(g)+2H2(g)=2H2O(g)△H=﹣483.6kJ•mol﹣1 C(s,石墨)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1 CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJ•mol﹣1 (1)请写出CO与水蒸汽反应的热化学方程式 。 6
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如下图,则0~4min的平均反应速率v(CO)= ,请计算此时的平衡常数K= 。 (3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。 ①表中3min~4min之间反应处于 状态;c1数值 0.08mol/L (填大于、小于或等于)。 ②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因 (填字母),表中5min~6min之间数值发生变化,可能的原因是 。(填字母) a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
20.(13分)电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答: (1)直流电源中,M为 极。 (2)Pt电极上生成的物质是 ,其质量为 g。 (3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶ ∶ ∶ 。 (4)AgNO3溶液的浓度(填“增大”、“减小”或“不变”。下同) ,AgNO3溶液的 pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH 。 (5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。 21.(14分)已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
时间/min CO H2O CO2 H2 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 c1 c2 c3 c3 4 c1 c2 c3 c3 5 0.116 0.216 0.084 6 0.096 0.266 0.104
