高考化学江苏卷真题 物质结构与性质专题
高考化学复习江苏高考化学考点预测试题:6物质结构与性质.docx

高中化学学习材料唐玲出品温馨提示:此套题为Word 版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
(45分钟 50分)1.(7分)(2012·江苏高考)一项科学研究成果表明,铜锰氧化物(CuMn 2O 4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO 3)2和Mn(NO 3)2 溶液中加入Na 2CO 3 溶液,所得沉淀经高温灼烧,可制得CuMn 2O 4。
①Mn 2+基态的电子排布式可表示为______________________________________。
②NO 3的空间构型是______________________________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO 被氧化为CO 2,HCHO 被氧化为CO 2 和H 2O 。
①根据等电子体原理,CO 分子的结构式为________________________。
②H 2O 分子中氧原子轨道的杂化类型为________________________。
③1 mol CO 2 中含有的σ键数目为________________________。
(3)向CuSO 4 溶液中加入过量NaOH 溶液可生成[Cu (OH)4]2-。
不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为________________________。
2.(7分)(2012·安徽高考)X 、Y 、Z 、W 是元素周期表前四周期中的常见元素。
其相关信息如下表:元素相关信息X X的基态原子L层电子数是K层电子数的2倍Y Y的基态原子最外层电子排布式为:ns n np n+2Z Z存在质量数为23,中子数为12的核素W有多种化合价,其白色氢氧化物在空气中会迅W速变成灰绿色,最后变成红褐色(1)W位于元素周期表第______周期第______族,其基态原子最外层有______个电子。
2021年高考化学复习 专题四 分子空间结构与物质性质练习(含解析)苏教版选修3

2021年高考化学复习专题四分子空间结构与物质性质练习(含解析)苏教版选修31.下列说法不正确...的是()A.活化分子具有比普通分子更高的能量B.参加反应的物质的性质是决定化学反应的重要因素C.反应物分子(或离子)间的每次碰撞是反应的先决条件D.增大反应物浓度,可增大活化分子的百分数,所以反应速率加快化合时,最难的是()。
2.从键能的角度来看,下列物质中与H2A.氟气 B.氮气 C.氯气 D.氧气3.人们在研究金星大气成分,发现金星大气中有一种称之为硫化羟(COS)类似,硫化羟是一种与生命密切相关的物质。
下列有的分子,其结构与CO2关COS的推测肯定不正确的是()A、COS属于离子化合物B、COS分子中,所有原子都满足8电子的稳定结构C、COS的结构式为O=C=SD、COS含有极性共价键的极性分子4.对SO2与CO2说法正确的是()A.都是直线形结构B.中心原子都采取sp杂化轨道C.S原子和C原子上都没有孤对电子D.SO2为V形结构, CO2为直线形结构5.下列关于CH3+、—CH3、CH3—三种微粒的说法正确的是()A.三种微粒都能独立稳定存在B.三种微粒的形状相同C.三种微粒中碳原子的杂化方式相同D.键角大小关系:CH3+ > CH3—6.原子数相同、电子总数相同的粒子,互称为等电子体。
硼元素可形成三个等电子体阴离子:BO2-、BC2m-和BN2n-,则m、n值为()A.5,3 B.2,4 C.3,1 D.1 ,27.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。
下列对此现象说法正确的是()A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+C.向反应后的溶液加入乙醇,溶液没有发生变化D.在[Cu(NH3)4]2+离子中,Cu2+提供孤电子对,NH3提供空轨道8.列各组微粒,不能互称为等电子体的是()A、NO2、NO2+、NO2-B、CO2、N2O、N3-C、CO32-、NO3-、SO3D、N2、CO、CN-9.居室是我们日常生活中最重要的场所。
2023年高考江苏卷化学真题(含解析)

2023年高考江苏卷化学真题学校:___________姓名:___________班级:___________考号:___________一、单选题1.我国提出2060年实现碳中和的目标,体现了大国担当。
碳中和中的碳是指A .碳原子B .二氧化碳C .碳元素D .含碳物质2.反应4222NH Cl NaNO NaCl N 2H O +=+↑+应用于石油开采。
下列说法正确的是A .4NH +的电子式为B .2NO -中N 元素的化合价为+5C .2N 分子中存在N N ≡键D .2H O 为非极性分子二、多选题三、单选题4.元素C 、Si 、Ge 位于周期表中ⅣA 族。
下列说法正确的是A .原子半径:()()()C Si Ge r r r >>B .第一电离能:()()()111C Si Ge <<I I I C .碳单质、晶体硅、SiC 均为共价晶体D .可在周期表中元素Si 附近寻找新半导体材料5.氢元素及其化合物在自然界广泛存在且具有重要应用。
11H 、21H 、31H 是氢元素的3A.该反应的ΔS<0B.该反应的平衡常数((CHcKc=A .反应()(22CO g 2H +B .4CH 的平衡选择性随着温度的升高而增加C .用该催化剂催化二氧化碳反应的最佳温度范围约为D .450℃时,提高n n 起始起始四、原理综合题14.2532V O WO /TiO -催化剂能催化3NH 脱除烟气中的NO ,反应为()()()()()32224NH g O g 4NO g 4N g 6H O g ++=+ 11632.4kJ mol H -∆=-⋅。
(1)催化剂的制备。
将预先制备的一定量的32WO /TiO 粉末置于80℃的水中,在搅拌下(3)废催化剂的回收。
回收2V O ①酸浸时,加料完成后,以一定速率搅拌反应。
提高钒元素浸出率的方法还有②通过萃取可分离钒和钨,在得到的钒酸中含有4412H V O 。
专题15 物质结构与性质综合题-三年(2022-2024)高考化学真题分类汇编(全国通用)(教师卷)

专题15物质结构与性质综合题考点命题趋势考点1物质结构与性质综合题在当前的旧高考中,"物质结构与性质"属于选择性考试内容,以综合性客观题形式出现,随着新课程的落实,"物质结构与性质"已成为选择性必修课程,将成为新高考的必考内容,在新高考中,部分卷区不再设置"物质结构与性质"综合题,而是将其考查分散到选择题和其他综合题当中。
纵观近年来高考真题,物质结构与性质综合题基本上考的都是最基本、最典型、最主干的知识点。
以下是高考时时常考的知识点:原子结构与元素的性质方面,如原子电子排布式,元素原子的性质;化学键与物质的性质方面,如杂化轨道类型,分子(离子)空间构型;分子间作用力与物质的性质方面;如晶胞判断与计算。
试题均建构在以教材为主的中学化学基础知识之上,没有偏离教材体系和考试说明的要求,试题基本保持稳定。
试卷并不能把所有的知识面全部覆盖,也不能保证重要知识点可能反复出现。
1.(2024·北京卷)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是_________。
②4SnCl 的Sn Cl —键是由锡的_________轨道与氯的3p 轨道重叠形成。
键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有_________个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是_________。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ︒,由于固体之间反应慢,未明显发生反应。
江苏高考化学专用物质结构与性质
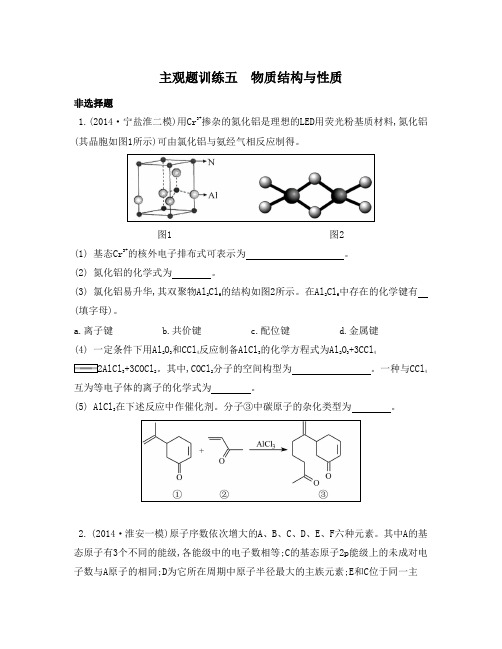
主观题训练五物质结构与性质非选择题1.(2014·宁盐淮二模)用Cr3+掺杂的氮化铝是理想的LED用荧光粉基质材料,氮化铝(其晶胞如图1所示)可由氯化铝与氨经气相反应制得。
图1 图2(1) 基态Cr3+的核外电子排布式可表示为。
(2) 氮化铝的化学式为。
(3) 氯化铝易升华,其双聚物Al2Cl6的结构如图2所示。
在Al2Cl6中存在的化学键有(填字母)。
a.离子键b.共价键c.配位键d.金属键(4) 一定条件下用Al2O3和CCl4反应制备AlCl3的化学方程式为Al2O3+3CCl43+3COCl2。
其中,COCl2分子的空间构型为。
一种与CCl4互为等电子体的离子的化学式为。
(5) AlCl3在下述反应中作催化剂。
分子③中碳原子的杂化类型为。
2. (2014·淮安一模)原子序数依次增大的A、B、C、D、E、F六种元素。
其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1) F原子基态的核外电子排布式为。
(2) 在A、B、C三种元素中,第一电离能由大到小的顺序是(用元素符号回答)。
(3) 元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是。
互为等电子体,则CAB-的结构式为。
(4) 由A、B、C形成的离子CAB-与AC2(5) 在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为。
(6) 由B、C、D三种元素形成的化合物晶体的晶胞如右图所示,则该化合物的化学式为。
3. (2014·扬州一模)一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1) 基态Ni2+的核外电子排布式为。
(2) 丁二酮肟组成元素中C、N、O的电负性由大到小的顺序为。
丁二酮肟分子中C原子轨道的杂化类型是。
(3) 元素Ni的一种碲(Te)化物晶体的晶胞结构如右图所示,则该化合物的化学式为。
【优化方案】江苏专用高考化学总复习 物质结构与性质专题二达标突破训练 苏教版选修

1.用价层电子对互斥理论预测NH 3和BF 3的立体结构,两个结论都正确的是( )A .直线形;三角锥形B .三角锥形;三角锥形C .直线形;平面三角形D .三角锥形;平面三角形解析:选D 。
NH 3中N 为中心原子,价电子数为5,H 为配体,价电子数为1,所以价层电子对数为5+1×32=4,即为,三角锥形;同理BF 3价层电子对数为3+32=3,即为,平面三角形。
2.(2011年福建龙岩一中高三月考)在乙烯分子中有5个σ键,一个π键,它们分别是( )A .sp 2杂化轨道形成σ键,未杂化的2p 轨道形成π键B .sp 2杂化轨道形成π键,未杂化的2p 轨道形成σ键C .C —H 之间是sp 2形成的σ键,C —C 之间是未参加杂化的2p 轨道形成π键D .C —C 之间是sp 2形成的σ键,C —H 之间是未参加杂化的2p 轨道形成π键解析:选A 。
乙烯分子的结构式为:,其中C 原子为sp 2杂化,三个sp 2杂化轨道均形成σ键,C 原子上剩下的两个2p 电子以“肩并肩”的形式形成π键,故A 项正确。
3.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )A .两种分子的中心原子杂化轨道类型不同,NH 3为sp 2型杂化,而CH 4是sp 3型杂化B .NH 3分子中N 原子形成三个杂化轨道,CH 4分子中C 原子形成四个杂化轨道C .NH 3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强D .氨气分子是极性分子而甲烷是非极性分子解析:选C 。
NH 3、CH 4都采用sp 3杂化形式,二者的不同在于NH 3杂化后的四个轨道中有三个成键,另有一个容纳孤电子对,而CH 4杂化后的四个轨道全部用于成键,这样会导致二者的空间构型有所不同。
4.下列过程与配合物的形成无关的是( )A .除去Fe 粉中的SiO 2可用强碱溶液B .向一定量的AgNO 3溶液中加入氨水至沉淀消失C .向Fe 3+溶液中加入KSCN 溶液D .向一定量的CuSO 4溶液中加入氨水至沉淀消失解析:选A 。
江苏省2021年高考化学二轮专题 15 物质结构与性质
江苏省2021年高考化学二轮专题 15 物质结构与性质姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分) (2018高一上·湖南期中) 以下对比错误的是()A . 热稳定性:H2O>H2SB . 原子半径:Na>MgC . 阴离子的还原性:I->Cl-D . 失电子能力:Na > K2. (2分) (2019高一上·上海期末) 下列变化中,不需要破坏化学键的是()A . 加热氯化铵B . 碘升华C . 食盐溶于水D . 氯化氢溶于水3. (2分) (2019·黄浦模拟) 金刚石的熔点为a℃,晶体硅的熔点为b℃,足球烯(分子式为C60)的熔点为c℃,三者熔点的大小关系是()A . a>b>cB . b>a>cC . c>a>bD . c>b>a.4. (2分)微粒间相互作用的能量:范德华力为a kJ•mol﹣1 ,化学键为b kJ•mol﹣1 ,氢键为c kJ•mol ﹣1 ,则一般情况下a、b、c的大小关系正确的是()A . a>b>cB . b>a>cC . c>b>aD . b>c>a5. (2分)下列5种烃:①2﹣甲基戊烷②2,2﹣二甲基丙烷③己烷④庚烷⑤戊烷,按它们的沸点由高到低的顺序排列正确的是()A . ①>②>③>④>⑤B . ②>③>⑤>④>①C . ④>③>②>①>⑤D . ④>③>①>⑤>②6. (2分)下列各组物质含有的化学键类型完全相同的是()A . HBr、CO2、NH3B . Na2O、Na2O2、Na2SC . NaCl、HCl、H2OD . NaOH、CaCl27. (2分)下图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为acm,氯化铯的相对分子质量为M , NA为阿伏加德罗常数,则氯化铯晶体密度是()A . g/cm3B . g/cm3C . g/cm3D . g/cm3二、综合题 (共8题;共78分)8. (9分) (2015高三上·泰兴期中) 我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.(1)蓝色无水CoCl2在潮湿的空气中逐渐变为粉红色,这一性质用在做干燥剂的硅胶中和制备显隐墨水,Co2+基态的电子排布式可表示为________.(2)钴的配合物很多,对钴的配合物的立体化学也研究得很多,例如,分子式为Co(NH3)5BrSO4有两种配合物,一种是红色的[CoSO4 (NH3)5]Br,另一种是紫色的[Co(NH3)5Br]SO4.①NH3分子中氮原子的杂化轨道类型为________;②N、O、S第一电离能由大到小的顺序为________;③写出一种与SO42﹣互为等电子体的分子的化学式为________;④1mol[Co(NH3)5Br]2+中含有σ键的数目为________.(3)元素Co的一种氧化物晶体的晶胞结构如图所示,则该化合物的化学式为________.9. (7分) (2019高二下·长春月考) 有A,B,C,D,E,F六种元素,已知:①它们位于三个不同短周期,核电荷数依次增大②B与F同主族.③B、C分别都能与D按原子个数比1:1或1:2形成化合物.④A、E分别都能与D按原子个数比1:1或2:1形成化合物.⑤E元素的电离能数据如下(kJ•mol-1):(1)写出只含有A,B,D,E四种元素的一种无水盐的化学式________。
2019全国高考化学真题深度解析:(Ⅰ、Ⅱ、Ⅲ、江苏卷)物质结构与性质试题
2019全国高考(Ⅰ、Ⅱ、Ⅲ、江苏卷)物质结构与性质试题深度解析35.(2019全国Ⅰ卷)[化学—选修3:物质结构与性质](15分)在普通铝中加入少量Cu 和Mg ,后形成一种称为拉维斯相的MgCu 2微小晶粒,其分散在Al 中可使得铝材的硬度增加,延展性减小,形成所谓"坚铝",是制造飞机的主要材料。
回答下列问题:(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_____________(填标号)。
A 、[Ne]B 、[Ne] C 、[Ne]D 、[Ne] (2)乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是____________、____________________。
乙二胺能与Mg 2+、Cu 2+等金属离子形成稳定环状离子,其原因是___________________________,其中与乙二胺形成的化合物稳定性相对较高的是______________________(填“Mg 2+”或“Cu 2+”)。
(3)一些氧化物的熔点如下表所示:解释表中氧化物之间熔点差异的原因__________________________________________。
(4)图(a )是MgCu 2的拉维斯结构,Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu 。
图(b )是沿立方格子对角面取得的截图。
可见,Cu 原子之间最短距离x=___________pm ,Mg 原子之间最短距离y=______________pm 。
设阿伏加德罗常数的值为N A ,则MgCu 2的密度是________________g •cm -3(列出计算表达式)。
【答案】(1)A(a ) (b )(2)sp 3、 sp 3。
乙二胺的两个N 提供孤对电子给金属离子形成配位键,从而形成环状稳定结构;Cu 2+(3)Li 2O 、MgO 为离子晶体,P 4O 6、SO 2为分子晶体,晶格能:MgO >Li 2O ,分子间作用力(相对分子质量):P 4O 6>SO 2。
高考化学《物质结构与性质》模块命题重点与特点分析
“ 不等 比恒压加加 ( 或减减) 适用于恒温恒压 法”
下 起始 原料 不成 比例 的不 等效 平 衡 ,加加 法 ” 按 原 “ 先 平 衡 的 比例 加 人 ( 常 是 其 中一 种 物 质 加 入 的 量 不 通 够 ) 其 与原 平 衡 达 到 等 效 , 后 再 把 不 够 的量 加 进 使 然
把 容器 的体 积 变 为 原来 的 体 积 , 即压 强 减 小 , 衡 向 平
逆 反 应 方 向 移 动 , 致 P 1 的 物 质 的 量 小 于 导 C
0 2 mo . . 1
1 21 0 0年高考 模块 命题概 况
2 )不等 比恒 压加加 ( 减减 ) 或 法
物质 结构 理论 是高 考化 学 的 重要 组 成部 分 , 是 也 高 考试题 中的热 点亮点 之一 .0 0 高考 试题 不 论是 21 年
、
一
B 均 加倍 ; D 均减 少 lmo l
10 0
1 5
陕西 )
l 题
作答.
选 项 A、 B中三 者 在 恒 温 恒压 下 的 比例 仍 然 解析 为 2 1 2 与题 中比例一致 , : :, 与原平衡等效 , 平衡 不移 动 . 选项 C可设 想 为 分 2步 加 入 , 1次 加 第 入 1to A、. l 1to C, 衡 不移 动 , 2 l 05mo B、 l 平 o o 第 次 再 加入 0 5to B( 法 与 一 次性 同 时各 加 入 1to . l 此 o l o 等 效 )增加 了 反 应 物 的 浓 度 , 衡 向右 移 动. 项 D , 平 选 可 设想 为分 2步 减 去 , 1 减 去 1to 0 5to 第 次 l o A、 . l o B、 o 此 时平 衡 不移 动 , 2次 再 减 去 0 5to lt l o C, 第 。 l o B 此法 与一 次 性 同 时各 减 去 1mo 等效 )减 小 了反 ( l , 应 物 的浓 度 , 平衡 向左 移动 .
2023年高考化学真题完全解读(江苏卷)
2023年高考真题完全解读(江苏卷)2023年江苏高考化学卷在传承“宽基础、厚实践、重能力”风格中有发展,平稳中蕴新意。
试卷考查的知识内容基础、全面而不失新颖与创新,化学试卷保持了以往的命题风格,在化学基础知识中融合对考生学习方法和思维能力的考查、关注对考生学科素养的培养与提高。
整体呈现据标立本、紧密联系生产生活实际、紧跟学科前沿的风格,融合考查学生的化学学科必备知识、基本技能和学科核心素养,化学试题突出能力立意、突出学科特点、突出核心素养、突出创新能力的鲜明特色,有利于发挥高考的导向功能,有利于推进化学新课程教学改革。
试题主要特点如下:一、立足基础,考查主干知识试题突出了对中学化学核心基础知识、基本技能、基本观点和基本方法的考查。
考查学生对基础知识的掌握,对基本概念的理解。
掌握元素基础知识是能力提升的前提和保障,试卷中考查内容涵盖高中化学重要的元素化合物知识、基本概念与理论、化学基础实验技能和化学计算,覆盖了《考试大纲》中所要求掌握基础知识的90%以上。
部分试题命制素材直接源于教材,如第3题考查课本中学生熟悉的NH 4+的电子式、NO 2-中N 元素的化合价、N 2分子中存在N ≡N 键、H 2O 为非极性分子;第6题考查实验室制取Cl 2的实验原理及装置;第4题的微粒半径大小的比较、电离能变化规律、晶体类型判断;第8题氮及其化合物的转化过程中的变化、融合在工业流程分析及实验室制备少量NH 3原理。
对核心主干知识不仅仅是体现在记忆层面,还将考查对其的在具体问题解决过程中的理解和应用水平。
第10题是以金属硫化物(M x S y )催化反应为载体,考查反应的ΔS 、平衡常数、氧化还原反应、化学平衡等核心主干知识;第11题聚焦一些重要元素及其化合物间的转化,探究0.1mol·L -1 FeSO 4溶液的性质;第16题实验室模拟“镁法工业烟气脱硫”并制备MgSO 4·H 2O ,融合在工业流程分析、反应原理综合、实验及探究试题中进行考查,考查了调整溶液pH 对对物质转化行为的影响,以获得目标产物的思路方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学江苏卷真题 物质结构与性质专题
试题部分
2008年高考化学江苏卷
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。
其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子
与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同
族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配
位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,
回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为___________▲___________。
(2)B的氢化物的分子空间构型是___________▲___________。其中心原子采取
___________▲___________杂化。
(3)写出化合物AC2的电子式___________▲___________;一种由B、C组成的化合物与
AC2互为等电子体,其化学式为___________▲___________。
(4)E的核外电子排布式是___________▲___________,ECl3形成的配合物的化学式为
___________▲___________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该
反应的化学方程式是___________▲___________。
2009年高考化学江苏卷
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,
催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、A1等元素。写出基态Zn原子的核外电子排布式
___________▲___________。
(2)根据等电子原理,写出CO分子的结构式___________▲___________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应
生成Cu2O沉淀。
① 甲醇的沸点比甲醛的高,其主要原因是___________▲
___________;甲醛分子中碳原子轨道的杂化类型为___________▲
___________。
② 甲醛分子的空间构型是___________▲___________;1 mol甲醛分子中σ键的
数目为___________▲___________。
③ 在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为___________▲
___________。
2010年高考化学江苏卷
乙炔是有机合成工业的一种原料。工业上曾用2CaC与水反应生成乙炔。
(1) 2CaC中22C与22O互为等电子体,22O的电子式可表示为___________▲___________;
1mol 22O中含有的键数目为___________▲___________。
(2)将乙炔通入32[()]CuNHCl溶液生成22CuC,红棕色沉淀。Cu基态核外电子排布式为
___________▲___________。
(3)乙炔与氢氰酸反应可得丙烯腈。丙烯腈分子中碳原子轨道
杂化类型是___________▲___________;分子中处于同一直线上的原子数目最多为
___________▲___________。
2CaC晶体的晶胞结构与NaCl晶体的相似(如右图所示),但2
CaC
晶体中含有的中
哑铃形22C的存在,使晶胞沿一个方向拉长。2CaC晶体中1个2Ca周围距离最近的
22C
数目为___________▲___________。
2011年高考化学江苏卷
.原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子
基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的
电子,W的原子序数为29。
回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为___________▲
___________,1mol Y2X2含有σ键的数目为___________▲
___________。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因
是___________▲___________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电
子体,元素Z的这种氧化物的分子式是___________▲
___________。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该
氯化物的化学式是___________▲___________,它可与浓盐酸发生非氧化还原反应,生成配
合物HnWCl3,反应的化学方程式为___________▲___________。
2012年高考化学江苏卷
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和
甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经
高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为___________▲___________。
②NO3- 的空间构型是___________▲___________(用文字描述)。
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2 和H2O。
①根据等电子体原理,CO 分子的结构式为___________▲___________。
②H2O 分子中O 原子轨道的杂化类型为___________▲___________。
③1 mol CO2 中含有的σ键数目为___________▲___________。
向CuSO4 溶液中加入过量NaOH 溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-
的结构可用示意图表示为___________▲___________。
2013年高考化学江苏卷
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元
素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 ▲ 。
②该化合物的化学式为 ▲ 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 ▲ 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
▲ 。
(4)Y 与Z 可形成
YZ2-
①YZ2-的空间构型为 ▲ (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: ▲ 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目
为 ▲ 。
参考答案
2008年高考化学江苏卷
(1)C<O<N ;(2)三角锥形 ;sp3 ;(3) ;N2O
(4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1); [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
2009年高考化学江苏卷
(1)1s22s22p63s23p63d104s2或[Ar]3dl04s2 (2)C≡O(或)
(3)①甲醇分子之间形成氢键 sp2杂化 ②平面三角形 3NA ③ 4
2010年高考化学江苏卷
(1) 2NA
(2)1s22s22p63s23p63d10
(3)sp杂化 sp2杂化 3
(4)4
2011年高考化学江苏卷
(1)sp杂化
3mol或3×6.2×10 个
(2)NH3分子存在氢键
(3)N2O
(4)CuCl
CuCl+2HCl=H2CuCl3 (或CuCl+2HCl=H2[CuCl3])
2012年高考化学江苏卷
(1)①1s22s22p63s23p63d5(或[Ar]3d5) ②平面三角形
(2)①C≡O ②sp3 ③2×6. 02×1023个(或2 mol)
(3)
2013年高考化学江苏卷
(1)①4 ②
ZnS
(2)
sp
3
(3)水分子与乙醇分子之间形成氢键
(4)① 正四面体 ②CCl4 或SiCl4 等
(5)16 mol 或16伊6. 02×1023个
