工业制硫酸
硫酸工业制法

硫酸工业制法
硫酸工业制法是利用自然资源制造许多化学产品的一个非常重要的工业过程。
它是一种将硫和酸碱反应,并在高温下生成硫酸的制法。
这种过程可以制造出大量综合材料,如铝硅复合材料,磷酸钙粉末,烟灰,和硫酸盐。
硫酸工业制法的步骤相当简单,包括硫的提取,酸的导入和充气两个阶段。
首先,要从自然界中提取硫,这就是把煤、矿物或者天然气中的硫单独提取出来。
一旦这个过程完成,硫将需要搅拌和氧化,使它能够发生反应,然后也就是酸的导入,也可以用于氧化硫。
在充气过程中,需要将产生的反应物搅拌均匀,最后在高温下再加热。
硫酸工业制法在把硫酸制成产品方面也发挥了重要作用。
它能够把硫酸分解成多种不同的化学反应,使其能够生成不同的化合物,从而制备出不同类型的产品,如磷酸钙、硫酸盐和铝硅复合材料等。
硫酸工业制法对于环境也是有利的。
它能把对环境有害的化学物质,如二氧化硫和一氧化碳等,分解成有用的产品;此外,它也可以减少废水排放和节约能源,从而减少对环境的危害。
硫酸工业制法在普遍应用承受了极大的便利,因此受到广泛的重视,是当今化学产品制造的重要方法。
有经验的专业人员必须按照一定的规则,控制和协调活动,确保制作的质量和安全,确保硫酸工业制法的顺利实施。
工业制硫酸接触室中发生的化学方程式

工业制硫酸接触室中发生的化学方程式全文共四篇示例,供读者参考第一篇示例:工业制硫酸接触室是一种重要的化工设备,用于生产硫酸。
在接触室中,硫氧化物和氧气进行反应,生成硫酸。
这个过程是一个重要的化学反应,关于工业制硫酸接触室中发生的化学方程式,我们可以从一些基础的化学知识来解释。
让我们来看一下硫酸的化学式,硫酸的化学式为H2SO4。
硫氧化物是制备硫酸的一种原料,主要包括二氧化硫和三氧化硫。
硫酸是一种非常重要的化工原料,广泛用于制药、农业、电力、化肥等不同领域。
在工业制硫酸接触室中,主要的化学反应是硫氧化物与氧气发生氧化反应,生成硫酸。
这个反应可以用以下的化学方程式来表示:SO2(g) + 1/2 O2(g) → SO3(g)在第一步反应中,硫氧化物(如二氧化硫SO2)与氧气(O2)发生氧化反应,生成三氧化硫(SO3)。
在第二步反应中,三氧化硫(SO3)与水(H2O)反应,生成硫酸(H2SO4)。
这两个反应都是放热反应,需要一定的温度和压力条件才能进行。
工业制硫酸接触室通常会提供适当的温度和压力,以促进反应的进行。
还需要适量的催化剂来加速反应速率,常用的催化剂包括铜、铁等金属。
工业制硫酸接触室的运行过程中需要注意控制反应条件,以提高硫酸的产率和质量。
硫酸是一种强酸,具有很强的腐蚀性,生产过程中需要注意安全措施,防止产生危险的化学反应或意外事故。
工业制硫酸接触室中发生的化学方程式可以用简单的公式来表示,但实际操作过程中需要严格控制反应条件,确保生产的硫酸符合质量要求。
硫酸是一种重要的工业化学品,广泛应用于各个领域,对于工业发展和生活水平的提高都起到了重要作用。
第二篇示例:工业制硫酸接触室中发生的化学方程式是有关二氧化硫和氧气反应生成硫酸的过程。
在工业生产中,制备硫酸是一种非常重要的化学反应,因为硫酸在工业生产中起着非常关键的作用。
在这个过程中,二氧化硫气体通过一个接触器中与氧气反应,生成硫酸。
这个过程是一个关键的步骤,下面我们来详细了解一下这个过程。
工业制硫酸流程及原理

工业制硫酸流程及原理工业制硫酸是一项重要的化学工程,作为化工原料之一,制硫酸的应用广泛,尤其是在肥料、染料、石化、制药等领域具有重要作用。
工业制硫酸的流程及原理,是我们进行化学工程操作和生产过程中必须掌握的基本内容。
一、硫磺净化硫磺是制硫酸的主要原料之一,但硫磺中都含有一定量的杂质,如砷、锑、铅、铜等金属杂质,以及一些有毒的氧化物和酸性化合物。
因此,在工业制硫酸流程中需要对硫磺进行净化,以保证最终产品的质量和稳定性。
净化硫磺的主要方法有蒸馏法、溶解法和氧化法等。
二、硫磺燃烧经过净化处理后的硫磺将被送入燃烧炉中进行燃烧反应。
燃烧反应需要控制反应温度、氧气含量和污染物排放,以保证反应的稳定性和高效性。
三、SO2氧化燃烧炉中产生的气体中含有大量的SO2,需要进行氧化处理以生成SO3。
氧化过程中,一般采用稀硫酸和空气进行双重氧化反应。
SO2和空气经过反应生成SO3,反应物中的碳、铁等金属杂质会继续被氧化成为氧化物。
四、硫酸吸收生成的SO3气体将被送入硫酸吸收塔中,并与浓硫酸进行接触吸收。
SO3气体在吸收过程中与硫酸生成硫酸酐,同时释放出大量的热量,因此需要通过冷却器来降低反应的温度。
五、热力学计算在工业制硫酸的流程中,需要对各个环节的热量、物质平衡进行计算和调整。
热力学的计算和分析可以帮助我们合理地控制反应条件和操作参数,提高整个工艺生产效率和节约能源,同时也能保证产品质量和稳定性。
工业制硫酸的流程及原理,是化学工程领域中最为基础和重要的知识之一。
通过对硫磺净化、燃烧、氧化、吸收等过程进行理论探究和实践操作,我们可以掌握工业制硫酸的技术原理和工艺流程,提高我们的化学工程生产能力和实践操作能力。
工业制浓硫酸化学方程式

工业制浓硫酸化学方程式
工业制浓硫酸是一项重要的化学工艺,其化学方程式如下所示:2SO2(g) + O2(g) → 2SO3(g)。
SO3(g) + H2O(l) → H2SO4(l)。
这两个方程描述了工业制造浓硫酸的两个关键步骤。
首先,二
氧化硫和氧气在催化剂的作用下反应生成三氧化硫。
然后,三氧化
硫与水反应生成硫酸。
这个化学过程是通过联系高温、高压和催化
剂来实现的。
工业制造浓硫酸的化学方程式背后是复杂的工艺流程和设备。
这项工艺不仅需要高效的反应器和分离装置,还需要严格的控制和
监测。
在工业生产中,安全性和环保性也是至关重要的考虑因素。
浓硫酸是许多化学工业过程的重要原料,它被用于制造肥料、
塑料、纺织品和其他化学品。
因此,工业制造浓硫酸的化学方程式
不仅代表着一种化学反应,更代表着现代工业生产中不可或缺的一环。
工业制硫酸方案

工业制硫酸方案引言工业制硫酸是一种重要的化工工艺,广泛应用于许多工业领域,例如化肥生产、金属冶炼和废水处理等。
本文将介绍一种常见的工业制硫酸方案,包括硫矿的选矿与制酸过程。
硫矿的选矿硫矿的种类硫矿是指含有高浓度硫元素的矿石,常见的硫矿主要有黄铁矿、白铁矿和黄铜矿等。
在工业制硫酸的过程中,选择适合的硫矿对于提高产量和质量至关重要。
选矿工艺硫矿的选矿工艺一般包括破碎、磨矿、浮选等步骤。
首先,将原始硫矿经过破碎和磨矿处理,得到合适的矿石颗粒大小;然后,采用浮选工艺将硫矿与杂质分离,得到富含硫的硫精矿。
制酸过程硫矿的烧结硫精矿通过烧结工艺转化为硫酸。
烧结是将硫精矿加热至一定温度,使硫精矿中的硫元素氧化为二氧化硫气体的过程。
烧结炉是常用的设备,硫矿与空气在炉内进行反应,生成二氧化硫气体。
二氧化硫的净化二氧化硫气体中常含有一定的杂质,如尘埃和氧气等。
这些杂质会影响后续的反应产物质量和设备运行。
因此,需要对二氧化硫气体进行净化处理。
净化二氧化硫气体的常用方法是采用干法洗涤和湿法洗涤。
干法洗涤一般使用碱液吸附气体中的杂质,湿法洗涤则是通过水洗涤将杂质溶解掉。
选择适合的净化方法取决于具体的要求和硫矿的特性。
硫酸的制备经过净化的二氧化硫气体可以进一步用于硫酸的制备。
硫酸通常采用接触法制备,具体步骤如下:1.将净化后的二氧化硫气体经过压缩处理,以提高反应速率和减少空间占用。
2.将压缩后的二氧化硫气体与氧气在催化剂存在下进行反应,生成三氧化硫。
3.三氧化硫与水反应生成硫酸。
硫酸的制备工艺一般较为成熟,而且可以根据需要进行优化或改良,以提高产量和降低能耗。
结论工业制硫酸是一种复杂的化工工艺,涉及到选矿、烧结、气体净化和硫酸制备等多个过程。
这些过程都需要合理的工艺控制和设备支持,以确保硫酸的质量和产量达到预期的要求。
希望本文所介绍的工业制硫酸方案能对相关领域的从业人员提供参考和帮助。
工业制硫酸反应方程式

工业制硫酸反应方程式引言硫酸是一种广泛应用于工业生产和实验室的重要化学品。
它是一种无色、无臭的液体,具有强酸性。
硫酸的制备方法有很多种,其中工业制硫酸反应方程式是最常用的一种方法之一。
本文将详细介绍工业制硫酸反应方程式的原理、条件和具体步骤。
工业制硫酸反应方程式的原理工业制硫酸的反应方程式是一种氧化还原反应。
具体来说,硫酸的制备是通过将硫磺或硫化物氧化为二氧化硫,然后再将二氧化硫进一步氧化为三氧化硫,最后与水反应生成硫酸的过程。
反应方程式如下所示:2 SO2 + O2 → 2 SO3SO3 + H2O → H2SO4在这个反应过程中,二氧化硫和氧气首先反应生成三氧化硫。
然后,三氧化硫与水反应生成硫酸。
整个过程是一个连续的反应链,需要适当的温度、压力和催化剂的存在。
工业制硫酸反应方程式的条件工业制硫酸的反应条件如下: - 温度:反应温度通常在400-500°C之间,这是为了保证反应速率和产率的最优化。
- 压力:反应压力通常在1-2 atm之间,这是为了保持反应体系的稳定性和安全性。
- 催化剂:反应需要催化剂的存在,常用的催化剂有铁、钒等金属催化剂。
工业制硫酸反应方程式的步骤工业制硫酸的反应步骤如下: 1. 原料准备:将硫磺或硫化物作为反应的原料,将其加入反应釜中。
2. 氧化反应:加热反应釜,使硫磺或硫化物与氧气反应生成二氧化硫。
这个过程需要控制温度和压力。
3. 催化反应:将二氧化硫和氧气进一步反应,生成三氧化硫。
催化剂的存在可以加速这个反应。
4. 吸收反应:将三氧化硫与水反应,生成硫酸。
这个过程需要控制温度和压力,并且需要适当的吸收剂来吸收生成的硫酸。
5. 分离与纯化:将反应产物进行分离和纯化,得到高纯度的硫酸。
工业制硫酸反应方程式的应用工业制硫酸的反应方程式是制备硫酸的重要方法,硫酸在工业生产中有广泛的应用,包括但不限于以下几个方面: - 化肥生产:硫酸是制造化肥的重要原料,可以用于制造磷酸二氢铵、硫酸铵等化肥。
硫酸工业制法方程式

硫酸工业制法方程式嘿,朋友们,今天咱们来聊聊硫酸工业制法的方程式,那可就像一场奇妙的化学魔术表演呢!首先,制造硫酸的第一步就像是打开魔法大门的钥匙,是制取二氧化硫。
这时候,硫铁矿(主要成分是FeS₂)就像一个充满宝藏的小星球,被我们开采利用啦。
它和氧气一起反应,方程式是4FeS₂ + 11O₂ =高温=2Fe₂O₃ + 8SO₂。
你看,这个反应就像是一场盛大的派对,硫铁矿和氧气疯狂地跳舞,然后就产生了二氧化硫这个“小调皮”。
接着呢,二氧化硫这个小家伙还得经过进一步的加工。
它要被送到接触室里,就像被送去魔法学校深造一样。
在这里,它会和氧气再次相遇,在催化剂五氧化二钒(V₂O₅)的帮助下,它们又发生了奇妙的反应。
2SO₂ + O₂⇌ 2SO₃,这个反应啊,就像是两个人在催化剂这个月老的牵线下,紧紧地结合在了一起,变成了三氧化硫。
然后呢,三氧化硫这个新生成的家伙可不能直接就成为硫酸。
它就像一个半成品的小怪兽,得经过处理才行。
它要被送到吸收塔里面,这里就像是它的改造工厂。
三氧化硫会和水发生反应,SO₃ + H₂O = H₂SO₄,这就像是小怪兽终于被驯服,变成了我们想要的硫酸,大功告成啦!你要是把这个过程想象成一场游戏,那每个方程式就是一个通关的关卡。
从硫铁矿开始,它就像游戏的初始道具,经过和氧气的第一次反应,就像通过了第一关,得到了二氧化硫这个“小奖励”。
然后二氧化硫和氧气的反应是第二关,产生三氧化硫这个更厉害的“装备”。
最后三氧化硫和水的反应就是最终关卡,得到了硫酸这个“终极大奖”。
这硫酸工业制法的方程式啊,就像是化学世界里的一套神秘咒语。
每个元素都是咒语里的一个魔法字符,按照特定的顺序组合起来,就能产生神奇的效果。
如果说化学是一个大魔法盒,那硫酸的工业制法就是这个魔法盒里一颗璀璨的明珠。
而且啊,这些反应就像一场接力赛。
硫铁矿和氧气先跑第一棒,产生二氧化硫;二氧化硫和氧气接过第二棒,变成三氧化硫;最后三氧化硫和水冲刺最后一棒,生成硫酸。
硫酸的工业制法
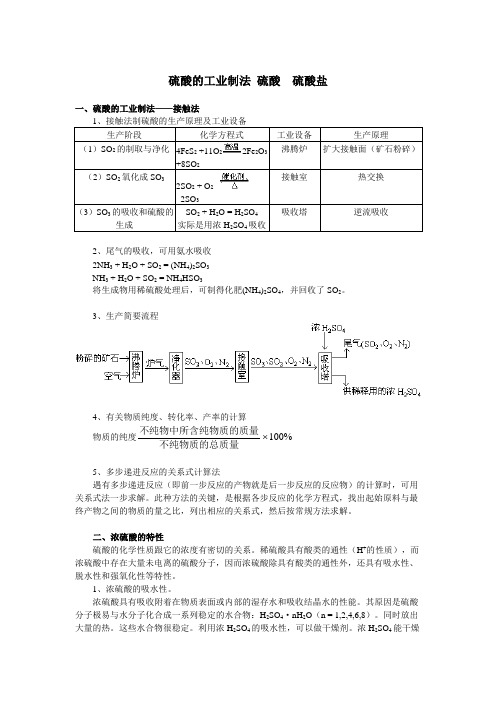
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工业制硫酸
1.原料:主要有硫铁矿、(或者硫磺)、空气、有色金属冶炼的烟气、石膏等。
2.生产流程
(1)SO2的制取 (设备:沸腾炉)
①原料为硫黄:S+O2 =====点燃SO2, ②原料为硫铁矿:4FeS+11O2=====高温8SO2+2Fe2O3。
(2)SO2的催化氧化 (设备:接触室):
2SO2+O2 催化剂 2SO3
(3)SO3的吸收 (设备:吸收塔): SO3+H2O===H2SO4。注意:工业上用98%的浓
硫酸吸收SO3 ,这样可避免形成酸雾并提高吸收效率。
3.三废的利用
(1)尾气吸收
废气中的SO2用氨水吸收,生成的(NH4)2SO4作化肥,SO2循环使用。
SO2+2NH3+H2O===(NH4)2SO3或SO2+NH3+H2O===NH4HSO3
(NH4)2SO3+H2SO4===(NH4)2SO4+SO2↑+H2O或2NH4HSO3+H2SO4===(NH4)2SO4+2SO2↑+2H2O
(2)污水处理
废水可用Ca(OH)2中和,发生反应为SO2+Ca(OH)2===CaSO3↓+H2O。
(3)废渣的处理
作水泥或用于建筑材料;回收有色金属等综合利用。
4.反应条件: 2SO2+O2 催化剂 2SO3 放热 可逆反应(低温、高压会提升转化率)
转化率、控制条件的成本、实际可能性。 即选:400℃~500℃,常压,五氧化二钒
(V2O5 )作催化剂。
5.以黄铁矿为原料生产硫酸的工艺流程图如下:
人工固氮技术——合成氨
1.反应原理
N2+3H2 催化剂 高温高压 2NH3 ΔH<0
反应特点:(1)该反应为可逆反应。(2)正反应为气体体积减小的反应。(3)正反应为
放热反应。
2.条件的选择
结合反应的三个特点及实际生产中的动力,材料设备,成本等因素,得出合成氨的适宜
条件是:(1)压强:20MPa~50MPa ; (2)温度:500℃ ; (3)催化剂:铁触媒 ;(4)循环
操作:反应混合气通过冷凝器,使氨液化并分离出来,N2、H2再通过循环压缩机送入合成塔。
3.生产流程
(1)造气
①N2:可用分离液态空气获得。
②H2: a.利用焦炭制取:C+H2O=====高温CO+H2
b.利用CH4制取:CH4+H2O=====高温CO+3H2
(2)净化:原料气净化处理,防止催化剂中毒。
(3)合成:N2和H2通过压缩机进入合成塔并发生反应。
(4)三废的利用
①废气:主要有H2S,SO2和CO2等。采用直接氧化法、循环法处理,CO2作为生产尿素和
碳铵的原料。
②废水:主要含氰化物和氨,分别采用不同的方法处理。
③废渣:主要含炭黑和煤渣,可作建筑材料或用作肥料的原料。
工业制纯碱
1.原料
氨碱法(又叫索尔维法):食盐、氨气、石灰石(经煅烧生成生石灰和二氧化碳)。
联合制碱法(又叫侯式制碱法):食盐、氨气、二氧化碳(合成氨厂的废气)。
2.主要反应原理
二者基本相同:
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
2NaHCO3=====△Na2CO3+CO2↑+H2O
3.生产过程
第一步:二者基本相同;将NH3通入饱和食盐水形成氨盐水,再通入CO2生成NaHCO3沉
淀,经过滤、洗涤得到NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有NH4Cl和NaCl
的溶液。
第二步:氨碱法:NaHCO3分解放出的CO2 (2NaHCO3=====△Na2CO3+CO2↑+H2O)、滤液(含
NH4Cl)与石灰乳混合加热产生的氨气回收循环使用[CaO+H2O===Ca(OH)2、
2NH4Cl+Ca(OH)2=====△CaCl2+2NH3↑+2H2O]。
联合制碱法:在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化
铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。此时滤出氯化铵沉淀后所得的
滤液,已基本上是氯化钠的饱和溶液,可循环使用。
4.综合评价
(1)氨碱法:①优点:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧
化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
②缺点:原料食盐的利用率低,大约70%~74%,其余的食盐随CaCl2溶液作为废液被抛
弃;过程中产生了没多大用途且难以处理的CaCl2。
(2)联合制碱法:使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多
的纯碱。另外它综合利用了合成氨厂的二氧化碳和碱厂的氯离子,同时生产出两种可贵的产
品——纯碱的氯化铵;过程中不生成没多大用途、又难以处理的CaCl2,减少了对环境的污
染,并且大大降低了纯碱和氮肥的成本,充分体现了大规模联合生产的优越性。
【典型例题】 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合
制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
___________________ _;
(2)写出“联合制碱法”有关反应的化学方程式:_____________________________;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同
________________________________;
【答案】
(1) Ca(OH)2+2NH4Cl===CaCl2+2NH3↑+2H2O,该反应的CaCl2中的Cl-来源于NaCl,Ca
2+
来源于CaCO3,产生无用的CaCl2,降低了NaCl的利用率。
(2)NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl ; 2NaHCO3=====△Na2CO3+CO2↑+H2O
(3) “联合制碱法”中的CO2来源于合成氨厂,“氨碱法”中的CO2来源于石灰石.
