天津大学 化工分离工程 教案 习题和解答
天津大学版 化工原理下册课后答案

第七章传质与分离过程概论1.在吸收塔中用水吸收混于空气中的氨。
已知入塔混合气中氨含量为 5.5%(质量分数,下同),吸收后出塔气体中氨含量为0.2%,试计算进、出塔气体中氨的摩尔比、。
解:先计算进、出塔气体中氨的摩尔分数和。
进、出塔气体中氨的摩尔比、为由计算可知,当混合物中某组分的摩尔分数很小时,摩尔比近似等于摩尔分数。
2. 试证明由组分A和B组成的双组分混合物系统,下列关系式成立:(1)(2)解:(1)由于故(2)故3. 在直径为0.012 m、长度为0.35 m的圆管中,CO气体通过N2进行稳态分子扩散。
管内N2的温度为373 K,总压为101.3 kPa,管两端CO的分压分别为70.0 kPa和7.0 kPa,试计算CO的扩散通量。
解:设 A-CO; B-N2查附录一得4. 在总压为101.3 kPa,温度为273 K下,组分A自气相主体通过厚度为0.015 m的气膜扩散到催化剂表面,发生瞬态化学反应。
生成的气体B离开催化剂表面通过气膜向气相主体扩散。
已知气膜的气相主体一侧组分A的分压为22.5 kPa,组分A在组分B中的扩散系数为1.85×10-5 m2/s。
试计算组分A和组分B的传质通量和。
解:由化学计量式可得代入式(7-25),得分离变量,并积分得5. 在温度为278 K的条件下,令某有机溶剂与氨水接触,该有机溶剂与水不互溶。
氨自水相向有机相扩散。
在两相界面处,水相中的氨维持平衡组成,其值为0.022(摩尔分数,下同),该处溶液的密度为998.2 kg/m3;在离界面5 mm的水相中,氨的组成为0.085,该处溶液的密度为997.0 kg/m3。
278 K时氨在水中的扩散系数为1.24×10–9 m2/s。
试计算稳态扩散下氨的传质通量。
解:设 A-NH3;B-H2O离界面5 mm处为点1、两相界面处为点2,则氨的摩尔分数为,点1、点2处溶液的平均摩尔质量为溶液的平均总物质的量浓度为故氨的摩尔通量为6. 试用式(7-41)估算在105.5 kPa、288 K条件下,氢气(A)在甲烷(B)中的扩散系数。
化工原理天津大学版化上下册习题问题详解

化工原理课后习题1.某设备上真空表的读数为 13.3×103 Pa,试计算设备内的绝对压强与表压强。
已知该地区大气压强为 98.7×103 Pa。
解:由绝对压强 = 大气压强–真空度得到:设备内的绝对压强P绝 = 98.7×103 Pa -13.3×103 Pa=8.54×103 Pa设备内的表压强 P表 = -真空度 = - 13.3×103 Pa2.在本题附图所示的储油罐中盛有密度为 960 ㎏/㎥的油品,油面高于罐底 6.9 m,油面上方为常压。
在罐侧壁的下部有一直径为 760 mm 的圆孔,其中心距罐底 800 mm,孔盖用14mm的钢制螺钉紧固。
若螺钉材料的工作应力取为39.23×106 Pa ,问至少需要几个螺钉?分析:罐底产生的压力不能超过螺钉的工作应力即P油≤σ螺解:P螺 = ρgh×A = 960×9.81×(9.6-0.8) ×3.14×0.762150.307×103 Nσ螺 = 39.03×103×3.14×0.0142×nP油≤σ螺得 n ≥ 6.23取 n min= 7至少需要7个螺钉3.某流化床反应器上装有两个U 型管压差计,如本题附图所示。
测得R1 = 400mm , R2 = 50 mm,指示液为水银。
为防止水银蒸汽向空气中扩散,于右侧的U 型管与大气连通的玻璃管内灌入一段水,其高度R3= 50 mm。
试求A﹑B两处的表压强。
分析:根据静力学基本原则,对于右边的U管压差计,a–a′为等压面,对于左边的压差计,b–b′为另一等压面,分别列出两个等压面处的静力学基本方程求解。
解:设空气的密度为ρg,其他数据如图所示a–a′处 P A + ρg gh1 = ρ水gR3 + ρ水银ɡR2由于空气的密度相对于水和水银来说很小可以忽略不记即:P A = 1.0 ×103×9.81×0.05 + 13.6×103×9.81×0.05= 7.16×103 Pab-b′处 P B + ρg gh3 = P A + ρg gh2 + ρ水银gR1P B = 13.6×103×9.81×0.4 + 7.16×103=6.05×103Pa4. 本题附图为远距离测量控制装置,用以测定分相槽内煤油和水的两相界面位置。
化工原理(天津大学)下册课后习题答案.

化工原理(天津大学下册课后习题参考答案第五章蒸馏1. 已知含苯 0.5(摩尔分率的苯 -甲苯混合液,若外压为 99kPa ,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例 1-1附表。
t(℃ 80.1 85 90 95 100 105x 0.962 0.748 0.552 0.386 0.236 0.11解:利用拉乌尔定律计算气液平衡数据查例 1-1附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压 P B *, P A *,由于总压 P = 99kPa,则由 x = (P-PB */(PA *-P B * 可得出液相组成,这样就可以得到一组绘平衡 t-x 图数据。
以 t = 80.1℃为例 x =(99-40 /(101.33-40 = 0.962同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当 x = 0.5时,相应的温度为 92℃2. 正戊烷(C 5H 12和正己烷(C 6H 14的饱和蒸汽压数据列于本题附表,试求 P = 13.3kPa下该溶液的平衡数据。
温度 C5H 12 223.1 233.0 244.0 251.0 260.6 275.1 291.7 309.3 K C6H 14 248.2 259.1 276.9 279.0 289.0 304.8 322.8 341.9 饱和蒸汽压 (kPa 1.3 2.6 5.3 8.0 13.3 26.6 53.2 101.3 解:根据附表数据得出相同温度下 C 5H 12(A 和 C 6H 14(B 的饱和蒸汽压以 t = 248.2℃时为例,当 t = 248.2℃时 PB * = 1.3kPa查得 P A *= 6.843kPa得到其他温度下 A ¸B 的饱和蒸汽压如下表t(℃ 248 251 259.1 260.6 275.1 276.9 279 289 291.7 304.8 309.3P A *(kPa 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.20089.000101.300 P B *(kPa 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250 利用拉乌尔定律计算平衡数据平衡液相组成以 260.6℃时为例当 t= 260.6℃时 x = (P-PB */(PA *-P B *=(13.3-2.826 /(13.3-2.826 = 1平衡气相组成以 260.6℃为例当 t= 260.6℃时 y = PA *x/P = 13.3×1/13.3 = 1同理得出其他温度下平衡气液相组成列表如下t(℃ 260.6 275.1 276.9 279 289x 1 0.3835 0.3308 0.0285 0y 1 0.767 0.733 0.524 0根据平衡数据绘出 t-x-y 曲线3. 利用习题 2的数据,计算:⑴相对挥发度; ⑵在平均相对挥发度下的 x-y 数据, 并与习题 2 的结果相比较。
天津大学化工原理第18讲过滤(之三)离心分离

常速:K<3000 ;高速:K =3000~50000 ; 超高速:K >50000 3、区别旋风分离器 离心机是由设备(转鼓)本身旋转而产生的离心力,而旋
风(或旋液)分离器无转动部分,是由被分离的混合物以切线
方向进入设备引起的旋转运动产生离心力。
4、分类:根据分离方式,可分为:过滤式、沉降式和分离式。
连续生产。 缺点:由于刮切卸料, 使颗料破碎严重,对于必
须保持晶粒完整的物料不
宜采用。
3、活塞推料离心机 滤渣由一个往复运
料浆
动的活塞推送器脉动地
推送出来。 适于分离浓度适中 并能很快脱水和失去流
动性的悬浮液。
优点:颗粒破碎程度小。 缺点:对悬浮液的浓度较敏感。
滤液 洗水 滤渣
4、管式高速离心机 分离因数: 15000~60000 转速n: 8000~50000r/min
R
2 P rvu b 对不可压缩滤饼: R rvuR qe a
对可压缩滤饼:
2 P1s r 'vuR r 'vuRqe a b
3、先恒速后恒压过滤
V
2
VR2 2Ve V VR KA2 R
2 或: q 2 qR 2qe (q qR ) K R
2.568 4 2 60 0.35 A 0.125) 0.01A 0.321m3 / min 8 10 A ( A 2.568
得:
A=2.771m2
2.568 n 0.93r / min 2.771
[例1] 用具有10个框的BMS20/830-20板框压滤机恒压过滤
解:(1)过滤面积 A=0.83×0.83×2×10=13.78m2
化工原理下(天津大学版)习题答案

化工原理下(天津大学版)习题答案第五章蒸馏1.已知含苯0.5(摩尔分率)的苯-甲苯混合液,若外压为99kPa,试求该溶液的饱和温度。
苯和甲苯的饱和蒸汽压数据见例1-1附表。
t(℃)80.1 85 90 95 100 105x 0.962 0.748 0.552 0.386 0.2360.11解:利用拉乌尔定律计算气液平衡数据查例1-1附表可的得到不同温度下纯组分苯和甲苯的饱和蒸汽压P B*,P A*,由于总压P = 99kPa,则由x = (P-P B*)/(P A*-P B*)可得出液相组成,这样就可以得到一组绘平衡t-x图数据。
以t = 80.1℃为例x =(99-40)/(101.33-40)= 0.962同理得到其他温度下液相组成如下表根据表中数据绘出饱和液体线即泡点线由图可得出当x = 0.5时,相应的温度为92℃2.正戊烷(C5H12)和正己烷(C6H14)的饱和蒸汽压数据列于本题附表,试求P = 13.3kPa下该溶液的平衡数据。
温度C5H12223.1 233.0 244.0 251.0 260.6 275.1 291.7 309.3K C6H14 248.2 259.1 276.9 279.0 289.0 304.8 322.8 341.9饱和蒸汽压(kPa) 1.3 2.6 5.3 8.0 13.3 26.6 53.2 101.3解:根据附表数据得出相同温度下C5H12(A)和C6H14(B)的饱和蒸汽压以t = 248.2℃时为例,当t = 248.2℃时P B* = 1.3kPa查得P A*= 6.843kPa得到其他温度下A?B的饱和蒸汽压如下表t(℃) 248 251 259.1 260.6 275.1 276.9 279 289 291.7 304.8 309.3P A*(kPa) 6.843 8.00012.472 13.30026.600 29.484 33.42548.873 53.200 89.000101.300P B*(kPa) 1.300 1.634 2.600 2.826 5.027 5.300 8.000 13.300 15.694 26.600 33.250利用拉乌尔定律计算平衡数据平衡液相组成以260.6℃时为例当t= 260.6℃时x = (P-P B*)/(P A*-P B*)=(13.3-2.826)/(13.3-2.826)= 1平衡气相组成以260.6℃为例当t= 260.6℃时y = P A*x/P = 13.3×1/13.3 = 1 同理得出其他温度下平衡气液相组成列表如下t(℃) 260.6 275.1 276.9 279 289x 1 0.3835 0.3308 0.0285 0y 1 0.767 0.733 0.524 0 根据平衡数据绘出t-x-y曲线3.利用习题2的数据,计算:⑴相对挥发度;⑵在平均相对挥发度下的x-y数据,并与习题2 的结果相比较。
第三章化工原理_修订版_天津大学_
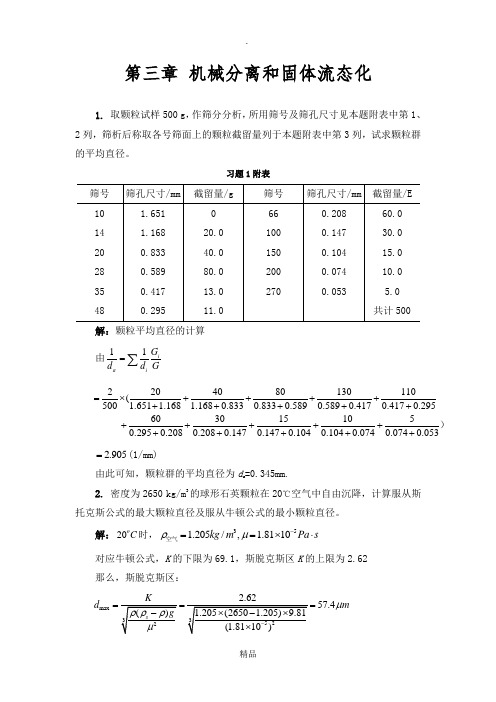
第三章 机械分离和固体流态化1. 取颗粒试样500 g ,作筛分分析,所用筛号及筛孔尺寸见本题附表中第1、2列,筛析后称取各号筛面上的颗粒截留量列于本题附表中第3列,试求颗粒群的平均直径。
习题1附表解:颗粒平均直径的计算 由11ia i G d d G=∑ 2204080130110(500 1.651 1.168 1.1680.8330.8330.5890.5890.4170.4170.2956030151050.2950.2080.2080.1470.1470.1040.1040.0740.0740.053=⨯+++++++++++++++++++ )2.905=(1/mm)由此可知,颗粒群的平均直径为d a =0.345mm.2. 密度为2650 kg/m 3的球形石英颗粒在20℃空气中自由沉降,计算服从斯托克斯公式的最大颗粒直径及服从牛顿公式的最小颗粒直径。
解:20C o 时,351.205/, 1.8110kg m Pa s ρμ-==⨯⋅空气对应牛顿公式,K 的下限为69.1,斯脱克斯区K 的上限为2.62 那么,斯脱克斯区:max 57.4d mμ===min 1513d m μ==3. 在底面积为40 m 2的除尘室内回收气体中的球形固体颗粒。
气体的处理量为3600 m 3/h ,固体的密度3/3000m kg =ρ,操作条件下气体的密度3/06.1m kg =ρ,黏度为2×10-5 P a·s。
试求理论上能完全除去的最小颗粒直径。
解:同P 151.例3-3在降尘室中能被完全分离除去的最小颗粒的沉降速度u t , 则 36000.025/4003600s t V u m s bl ===⨯ 假设沉降在滞流区,用斯托克斯公式求算最小颗粒直径。
min17.5d um ===核算沉降流型:6min 517.5100.025 1.06R 0.0231210t et d u ρμ--⨯⨯⨯===<⨯假设合理。
化工原理第二版天津大学贾绍义_夏清版课后习题答案

化工原理课后习题答案(夏清、贾绍义主编.化工原理.天津大学出版社,2011.)第一章流体流动2.在本题附图所示的储油罐中盛有密度为 960 ㎏/㎥的油品,油面高于罐底 6.9 m,油面上方为常压。
在罐侧壁的下部有一直径为 760 mm 的圆孔,其中心距罐底 800 mm,孔盖用14mm的钢制螺钉紧固。
若螺钉材料的工作应力取为39.23×106 Pa ,问至少需要几个螺钉?分析:罐底产生的压力不能超过螺钉的工作应力即P油≤σ螺解:P螺 = ρgh×A = 960×9.81×(9.6-0.8) ×3.14×0.762150.307×103 Nσ螺 = 39.03×103×3.14×0.0142×nP油≤σ螺得 n ≥ 6.23取 n min= 7至少需要7个螺钉3.某流化床反应器上装有两个U 型管压差计,如本题附4. 本题附图为远距离测量控制装置,用以测定分相槽内煤油和水的两相界面位置。
已知两吹气管出口的距离H = 1m,U管压差计的指示液为水银,煤油的密度为820Kg/㎥。
试求当压差计读数R=68mm时,相界面与油层的吹气管出口距离h。
分析:解此题应选取的合适的截面如图所示:忽略空气产生的压强,本题中1-1´和4-4´为等压面,2-2´和3-3´为等压面,且1-1´和2-2´的压强相等。
根据静力学基本方程列出一个方程组求解解:设插入油层气管的管口距油面高Δh在1-1´与2-2´截面之间P1 = P2 + ρ水银gR∵P1 = P4,P2 = P3且P3 = ρ煤油gΔh , P4 = ρ水g(H-h)+ ρ煤油g(Δh + h)联立这几个方程得到ρ水银gR = ρ水g(H-h)+ ρ煤油g(Δh + h)-ρ煤油gΔh 即ρ水银gR =ρ水gH + ρ煤油gh -ρ水gh 带入数据1.0³×10³×1 - 13.6×10³×0.068 = h(1.0×10³-0.82×10³)h= 0.418m5.用本题附图中串联U管压差计测量蒸汽锅炉水面上方的蒸气压,U管压差计的指示液为水银,两U管间的连接管内充满水。
天津大学版 化工原理下册课后答案

第七章传质与分离过程概论1.在吸收塔中用水吸收混于空气中的氨。
已知入塔混合气中氨含量为 5.5%(质量分数,下同),吸收后出塔气体中氨含量为0.2%,试计算进、出塔气体中氨的摩尔比、。
解:先计算进、出塔气体中氨的摩尔分数和。
进、出塔气体中氨的摩尔比、为由计算可知,当混合物中某组分的摩尔分数很小时,摩尔比近似等于摩尔分数。
2. 试证明由组分A和B组成的双组分混合物系统,下列关系式成立:(1)(2)解:(1)由于故(2)故3. 在直径为0.012 m、长度为0.35 m的圆管中,CO气体通过N2进行稳态分子扩散。
管内N2的温度为373 K,总压为101.3 kPa,管两端CO的分压分别为70.0 kPa和7.0 kPa,试计算CO的扩散通量。
解:设 A-CO; B-N2查附录一得4. 在总压为101.3 kPa,温度为273 K下,组分A自气相主体通过厚度为0.015 m的气膜扩散到催化剂表面,发生瞬态化学反应。
生成的气体B离开催化剂表面通过气膜向气相主体扩散。
已知气膜的气相主体一侧组分A的分压为22.5 kPa,组分A在组分B中的扩散系数为1.85×10-5 m2/s。
试计算组分A和组分B的传质通量和。
解:由化学计量式可得代入式(7-25),得分离变量,并积分得5. 在温度为278 K的条件下,令某有机溶剂与氨水接触,该有机溶剂与水不互溶。
氨自水相向有机相扩散。
在两相界面处,水相中的氨维持平衡组成,其值为0.022(摩尔分数,下同),该处溶液的密度为998.2 kg/m3;在离界面5 mm的水相中,氨的组成为0.085,该处溶液的密度为997.0 kg/m3。
278 K时氨在水中的扩散系数为1.24×10–9 m2/s。
试计算稳态扩散下氨的传质通量。
解:设 A-NH3;B-H2O离界面5 mm处为点1、两相界面处为点2,则氨的摩尔分数为,点1、点2处溶液的平均摩尔质量为溶液的平均总物质的量浓度为故氨的摩尔通量为6. 试用式(7-41)估算在105.5 kPa、288 K条件下,氢气(A)在甲烷(B)中的扩散系数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.1.1 最小分离功分离的最小功表示了分离过程耗能的最低限。
最小分离功的大小标志着物质分离的难易程度,实际分离过程能耗应尽量接近最小功。
图 7-1 连续稳定分离系统由热力学第一定律:(7-1)和热力学第二定律(对于等温可逆过程):(7-2)得到等温下稳定流动的分离过程所需最小功的表达式:( 7-3 )即或表示为自由能的形式:( 7-4 )或表示为逸度的形式:( 7-7 )一、分离理想气体混合物对于理想气体混合物:(7-8) 对于由混合物分离成纯组分的情况:( 7-9 )在等摩尔进料下,无因次最小功的最大值是 0.6931 。
对于分离产品不是纯组分的情况:过程的最小分离功等于原料分离成纯组分的最小分离功减去产品分离成纯组分所需的分离功。
[例7-1]二、分离低压下的液体混合物( 7-10 )对于二元液体混合物分离成纯组分液体产品的情况:( 7-11 )可见,除温度以外,最小功仅决定于进料组成和性质,活度系数大于 1 的混合物比活度系数小于 1 的混合物需较小的分离功。
当进料中两组分不互溶时,—W min,T =0 。
[例7-2][例7-3]7.1.2 非等温分离和有效能当分离过程的产品温度和进料温度不同时,不能用自由能增量计算最小功,而应根据有效能来计算。
有效能定义:有效能是温度、压力和组成的函数。
稳态下的有效能平衡方程:( 7-18 )等当功:( 7-19 )系统的净功(总功):( 7-20 )过程可逆时,可得最小分离功:( 7-21a )该式表明,稳态过程最小分离功等于物流的有效能增量。
7.1.3 热力学效率和净功消耗分离过程的热力学效率:系统有效能的改变与过程所消耗的净功之比。
(7-22)普通精馏操作(图 7-2)过程所消耗的净功:图 7-2 普通精馏塔(7-23)实际分离过程,热力学效率必定小于 1 。
试求20 ℃ 、 101.3kPa 条件下,将 lkmol 含苯 44% (摩尔)的苯-甲苯溶液分离成纯组分产品所需的最小分离功。
解:苯一甲苯溶液可视为理想溶液,g i =1 ,在等温、等压下将 lkmol 含苯 44% 的苯一甲苯溶液分离成纯组分所需的最小分离功为:[例7-1]环境温度为 294.4K ,压力 101.3kPa ,在该环境条件下将流率为 600 kmol/h 的丙烯 - 丙烷的混合气体,连续分离成相同温度、压力下的产品。
已知混合气体中含丙烯 0.60 (摩尔分数)。
分离要求为:①产品为纯丙烯和纯丙烷;②含丙烯 99%( 摩尔 ) 和含丙烷 95% (摩尔)的两个物流。
确定所需最小功。
解:这两个组分在分子结构上相似,且压力为常压,故进料和产品均可看作理想气体。
①此物系可以认为是理想气体的混合物,由式( 7-9 )得,②首先通过物料衡算计算出分离所得两个产品的流率为:含丙烯 99%( 摩尔 ) 的产品流率 351.0 kmol/h ;含丙烷 95% (摩尔)的产品流率 249.0 kmol/h 。
由式( 7-8 )得,可见,分离成非纯产品时所需最小功小于分离成纯产品时所需最小功。
在环境温度为 294.4K ,压力为 101.3kPa 的条件下分离流率为 24898kmol/h 的甲醇 - 水混合液体。
原料中含甲醇 58.07 %(摩尔)所得产品为:含甲醇 99.05% (摩尔)的富甲醇产品和含甲醇 1.01% (摩尔)的废水。
确定过程需要的最小功。
解:根据 Van Laar 方程计算液相活度系数,;式中 M 代表甲醇, W 代表水。
计算所得活度系数如下:组分活度系数 g原料富甲醇产品废水甲醇 1.08 1.00 1.75水 1.20 1.57 1.00通过物料衡算计算出两个产品的流率为:含甲醇 99.05%( 摩尔 ) 的产品流率 14491 kmol/h ;含甲醇 1.01% (摩尔)的废水流率 10407 kmol/h 。
计算最小功时,可将式( 7-10 )分解为一个理想溶液部分和一个由于与理想溶液的偏差而产生的过剩部分之和,最终方程为,( 7-12 )代入数据得,可见,由于该物系与理想溶液呈正偏差,使得最小功比理想溶液的减小 18.6% 。
7.2.1 精馏塔的多股进料和侧线采出一、多股进料图 7-3 两种不同浓度进料的精馏流程两段进料一塔式分离过程的操作线更接近于平衡线,各平衡级传质和传热的推动力减少,精馏过程的热力学效率得以提高,减少了有效能损失。
然而由于精馏段操作斜率减小,回流比减小,所需塔板数增加。
图 7-4 精馏塔 McCabe-Thiele 图二、侧线塔以分离三组分混合物为例,若其中某一个组分的含量很少或者对组分之间的切割要求不严格,则采用侧线塔代替两个相邻的常规塔,可降低基建投资和操作费用。
侧线出料位置:若第一个塔是 A/BC 切割塔,则改用侧线出料时,侧线出料位置在进料板之下;若第一个塔为 AB/C 切割塔,则侧线出料位置在进料板之上。
砍掉原第二塔。
考察由 C 2 馏分生产聚合级乙烯的精馏系统的分离流程。
原料为脱乙烷塔顶馏分,其中含乙炔0.72%(mol),而聚合级乙烯的主要指标为: C 2 H 4 含量不低于99.95%;C 2 H 2 含量不高于5×10 -6 。
为了使乙炔含量合格,必须首先对脱乙烷塔塔顶出料中乙炔用催化加氢的方法脱除,加氢反应器出口物料的组成为:CH4C2H4C2H6流率, kmol/h 14.66 2097.11 744.36组成,摩尔 % 0.51 73.43 26.06乙烯塔操作压力为 2.0MPa,在该操作条件下:,解:(1)设若采用乙烯塔侧线出料的流程(附图1),用式(7-25)计算乙烯产品中甲烷的最小含量:在侧线出料中还有 C 2 H 6 ,其含量在 0.02%-0.04%左右,乙烷和甲烷相加已达到0.1%左右,因此,用侧线塔的方法不能满足聚合级乙烯规格的要求,必须用两个常规塔:加氢反应器出口物料先进入第二脱甲烷塔,脱除甲烷后再进入乙烯精馏塔分离乙烯和乙烷,见附图 2。
例 7-5 附图 1 带侧线乙烯精馏塔例 7-5 附图 2 第二脱甲烷流程经平衡级计算,两个塔的主要计算结果和消耗的能量见附表 1。
(2)若经过工艺改进,使加氢反应器出口物料的组成为:CH 4 C 2 H 4 C 2 H 6 流率, kmol/h 3.69 2111.6 729.77 组成,摩尔 % 0.13 74.22 25.65在这种情况下,若直接采用乙烯塔侧线出料,乙烯产品中 CH 4 最低含量能降低到:因此,用侧线塔的方案是可行的。
经平衡级严格计算得到带侧线的乙烯精馏塔的计算结果见附表 1。
例 7-6附表1 乙烯精馏系统常规与侧线塔方案比较项目常规塔方案侧线塔方案第二脱甲烷塔乙烯精馏塔带侧线的乙烯精馏塔塔顶组成: CH 4 % C 2 H 4 % 24.3875.62 99.955.6594.34侧线组成: C 2 H 4 %CH 4 %99.95塔釜组成: CH 4 % 0.03 1.00回流比43.54 3.32 4.31塔顶出料流量, kmol/h 56.3 2048.62 60.44侧线出料流量, kmol/h 2048.62冷凝器物料温度,K 237 242 239冷剂温度,K 230 230 230热负荷,10 6 kW 22.307 82.343 85.340功耗 (1) , kW 4945 18255 18920再沸器物料温度,K 253 266 266冷剂温度,K 273 273 273热负荷,10 6 kW 10.285 68.479 62.250功耗 (2) , kW -864 -5757 -5233总功耗, kW 16579 13687注 :(1)230K的冷量功耗按221.7kW/10 6 kW计;(2)再沸器的冷量回收,每10 6 kW相当于84kW。
由附表 1所列数据可知,采用侧线出料的乙烯精馏塔代替第二脱甲烷塔和乙烯塔,节省功耗2892KW.h,占原方案功耗的17.4%。
7.2.2 热泵精馏7.3.1 分离方法的选择和分离顺序数多组分混合物的分离有多个可能的分离流程方案。
图 7-15 三元混合物简单精馏塔分离(a) 产品组分相对挥发度递降的顺序 (b) 产品组分相对挥发度递增的顺序对 C 个组分的物系,欲分离成 C 个基本纯的产品,需要 C-1 个塔,可组合成的流程方案数为:(7-27)若要用一种以上的分离方法,则分离所需总顺序数 S 为:( T :分离方法数)。
选择分离方法的探试规则:①选择具有较大分离因子的分离过程。
②尽量避免极端的过程条件。
③当分离过程需要多个分离级时,应优先选择平衡分离过程而不选择速度控制过程。
④当分离因子相同时,选择能量分离剂而不选择质量分离剂。
⑤选择分离方法时首先考虑采用精馏,只有在精馏方案被否定后才考虑其他分离方案。
表 7-3 影响分离因子的物质性质分子性质受影响的分离过程举例分子性质受影响的分离过程举例分子量精馏,蒸发,气相扩散偶极矩、极性萃取、吸附分子形状吸附,结晶分子电负荷电除法、电除雾分子体积吸附化学活性化学吸收、反应精馏通过外加功将热量自低位传至高位的系统称为热泵系统。
精馏塔的热泵主要有两种形式:( 1)闭式热泵:用外界的工作介质为冷剂,液态冷剂在冷凝器中蒸发,使塔顶物料冷凝。
汽化后的冷剂进入压缩机升压,然后在压缩机出口压力下在再沸器将热量传递给塔釜物料,本身冷凝成液体,如此循环不已。
塔内物料与制冷系统的工质两者之间是封闭的系统。
图 7-5 闭式热泵1—精馏塔,2—冷凝器,3—再沸器,4—压缩机,5—节流阀。
图 7-6 开式热泵图7-7制冷循环的压焓图1—精馏塔,2—冷凝器,3—再沸器,4—压缩机,5—节流阀。
(2)开式热泵:以过程本身的物料为制冷系统的工作介质。
其中一种形式是以塔釜物料为工质,在冷凝器汽化,取消再沸器,如图7-6a所示。
另一种形式是以塔顶物料为工质,在再沸器冷凝,取消冷凝器,见图7-6b。
7.2.3 设置中间冷凝器和中间再沸器的精馏增设中间再沸器,把再沸器加热量分配到塔的下段,或者设置中间冷凝器,把冷凝器热负荷分配到塔的上段,都可以取得节省能量的效果。
图 7-8 二级再沸、二级冷凝精馏塔7.2.4精馏系统的热集成一、多效精馏①加压—常压;②加压—减压;③常压—减压;④减压—减压。
两效精馏操作所需热量与单塔精馏相比,可以减少 30~40% 。
图 7-9 多效精馏的基本流程简单精馏塔应设有一个再沸器和一个冷凝器,如果能用物流直接传热来提供热量,则可砍掉再沸器和(或)冷凝器,实现热耦合。
热耦合精馏在热力学上是最理想的流程结构,即可节省设备投资,又可节省能耗。
所以,这种方式受到广泛注意和大量研究。
但是,至今热耦合精馏并未在工业中获得广泛应用,这是由于在操作中使主、副塔之间气液分配保持设计值是较困难的;分离难度越大,其对气液分配偏离的灵敏度越大,操作越难稳定。
