原子结构模型发展史
浙教版科学八年级下册2.3原子结构的模型-第1课时(28张)

二、原子结构
问题:原子核内的质子和中子由什么粒子构 成的呢?
实验证明,质子和中子是由更小 的微粒“夸克”构成。
有关夸克的结构和性质仍有探索和研究中……
二、原子结构
核外电子
原
质子
子 原子核
中子
夸克
思考与讨论 为什么说原子的质量集中在原子核上,为什么原子呈电中性?
质子 用高能粒子去撞击原子核,看看能不能得到更小的粒子。
不是所有原子的原子核内都有中子。
说原子的质量主要集中在原子核上
在原子中,带正电的质子数等于带负电的核外电子数,所以呈电中性
反粒子:
如正电子、负质子都是反粒子。 它们跟通常所说的电子、质子 相比较,质量相等但电性相反。
符号: 质子数(Z)+中子数(N)=质量数(A)
质子: Z 中子: N 质量数:A
英国物理学家汤姆生 (J.J.Thomson ,1856~1940)
萄干那样镶嵌在其中。
1911年卢瑟福用α粒子(一种带正电的微粒)去轰击金属箔,
1911年卢瑟福用α粒子(一种带正电的微粒)去轰击金属箔,实验发现:大多数α粒子能 穿过金属箔,少数α粒子发生较大角度的偏转或被反弹回去.
α粒子散射实验
核式结构模型
4.玻尔原子模型 (1913年)
分层模型
5.现代原子模型 (1927年)
电子云模型
英国化学家道尔顿 (J.Dalton , 1766~1844) 提出近代原子学说
道尔顿原子模型: 原子是坚实的、不可再分的实心球。
1897年,汤姆森发现了原子内有带负电
的电子。而原子是呈电中性的,他认为
新知导入 水是由水分子构成的,水分子是由氢原子和氧原子构成的
+
原子结构模型的五个阶段

原子结构模型的五个阶段原子结构模型的五个阶段,真的是一个挺有趣的话题!咱们都知道,原子就像是物质的基石,真心不可小觑。
想想古希腊那个时候,人们都觉得世界是由一些基本的东西构成的,这些小东西就叫“原子”。
老亚里士多德和他的朋友们,觉得这个小家伙是无穷无尽的,永远分割不完。
他们的想法简单又天真,像小孩子在沙滩上玩耍,只顾着堆沙堡,完全不知道沙子其实是由无数颗粒组成的。
不过,这个想法在当时真的是画龙点睛,给了后来的人一些启示。
到了19世纪初,咱们的朋友道尔顿(Dalton)站出来了。
他像是个科学界的魔术师,把原子变得更有趣。
他提出,每种元素都有自己的原子,这些原子就像不同的角色,每个角色都有自己的性格和特点。
比如,氢原子就像个活泼的小家伙,而氧原子则是个稳重的老大哥。
道尔顿的模型就像一部经典的电影,每个角色都有自己的戏份,缺了谁都不行。
虽然他的想法有点儿简单,但那时候的科学家们可乐坏了,原来世界是这么简单的嘛!然后,咱们要提到那个炸裂的时刻——汤姆森(Thomson)发现了电子!哇,这可真是个大新闻。
汤姆森就像是打开了一个潘多拉的盒子,揭示了原子的秘密。
他发现,原子里面还有一些小小的负电荷的粒子,这就是电子。
他的“葡萄干布丁模型”把原子比作一块布丁,电子就像布丁里的葡萄干,漂浮在布丁中。
想象一下,吃一块美味的布丁,嘴里咬到小葡萄干,嘿嘿,那感觉可真不错!不过,这个模型也是有点问题的,后来又有人说,这样不够严谨,毕竟布丁里可不能光是葡萄干呀!再后来,那个著名的卢瑟福(Rutherford)出现了。
他就像个探险家,冲进原子内部,发现了更多的秘密。
卢瑟福的金箔实验真是个神奇的故事,他用粒子轰击金箔,结果发现大部分粒子竟然能穿过去,只有少数被反弹。
他心里一惊,原来原子里有个密集的小核心,我们称之为原子核。
原子就像个迷你太阳系,核子像个太阳,电子则在周围像行星一样旋转。
想象一下,宇宙间的星星都在围绕着太阳转,这样的画面真让人神往!咱们得提到波尔(Bohr)模型。
原子结构模型的演变

金属Na、Mg分别与非金属单质O2、 Cl2发生反应,生成氧化物和氯化物, 填写下面表格,写出其化学式。
化学式:NaCl Na2O MgO MgCl2
元素
化合价
原子最外 得失电子 层电子数 数
Na
ห้องสมุดไป่ตู้+1
1
失1e-
Mg
(3)某粒子具有还原性,且这种粒子失去2 个电子以后变成原子,这个粒子的符号是 ___S_2_- _
第三单元
人类对原子结构的认识
目标要求: 1.了解原子结构模型发展的五个阶段。 2.掌握原子结构示意图。 3.掌握电子排布规律。 4.了解元素化合价与电子得失关系。
一.原子结构模型的演变
原子结构模型是科学家根据自己的认识,对原子结 构的形象描摹。一种模型代表了人类对原子结构 认识的一个阶段。人类认识原子的历史是漫长的, 也是无止境的。
下面介绍的几种原子结构模型,简明而又形 象地表示出了人类对原子结构认识逐步深化的演 变过程。
1.道尔顿原子模型(1803年)
①物质都是由原子构成的; ②原子是微小的不可分割的实心球体; ③同种元素的各种原子的性质和质量都相同 理论依据:元素化合时具有确定的质量比
道尔顿的“原子实心球体模型”
2.汤姆生原子模型(1904年) 原子是一个平均分布着正电荷的球体,其 中镶嵌着许多电子,中和了正电荷,从而 形成了中性原子。
①电子只能在一些特定的轨道上运行; ②电子在特定轨道上运行时,不发射也不
吸收能量; ③当电子从一个具有较高能量的轨道跃迁
到具有低能量的轨道时,就要发射出能 量,反之吸收能量。
5.电子云模型(1927年—1935年)
原子结构模型的演变

构模型。
一、原子结构模型的演变
4.卢瑟福的带核原子结构模型:
英国物理学家 卢瑟福 根据α—粒子散射现象,指 出原子是由 原子核 和 核外电子 构成的, 原子核 带正 电荷,位于 原子中心 ,它几乎集中了原子的全部质量, 电子 带负电荷,在原子核周围空间作高速运动,就像行星 环绕太阳运转一样。
一、原子结构模型的演变
He、Ne、Ar为稀有气体,常以单原子分子的单质存 在,表现出化学性质很不活泼,很难与其它元素化合。
原子结构示意图:
He
+2 2
Ne
+10 2 8
Ar
+18 2 8 8
钠离子的形成
钠原子 钠离子
Na
失一个电子
Байду номын сангаас
Na+
Na — e
Na+
氯离子的形成
氯原子 氯离子
- 得一个电子
Cl+ e-
Cl-
—
+
5.丹麦物理学家玻尔的轨道原子结构模型。
丹麦物理学家玻尔指出,电子在原子核外 空间内稳定的 轨道 上绕核作 高速 运动。
一、原子结构模型的演变
6.电子云模型(现代原子结构学说)
现代科学家根据微观世界的波粒二象性规律, 提出用 量子力学 的方法描述核外电子运动。
模型 年代 依据 主要 内容 问题
道尔顿 1803
a-m=b+n
a= b+m-n
课堂练习3: 2.有X,Y,Z三种元素,X原子核内无中子,Y原 子的第三个电子层上有3个电子,Z原子最 外层电子数是其电子层数的3倍.试判断 X____,Y____,Z____. 并画出其原子结构 示意图______, _____, _____.这三种元素 所组成的化合物的化学式为_______.
原子结构的发展史ppt课件

A. +2、-2
B. +6、-2
C. +4、-4
D. +2、-6B
;.
40
反馈练习
3、已知最外层电子数相等的元素的原子有相似的化学性质。氧元素原子核外电子分层
排布示意图:
下列原子中,与氧原子的化学性质相似的是( )
D
;.
41
反馈练习
4、核电荷数小于或等于18的元素中,原子的最外层电子数是内层电子总数一半的元素
原子论
+
=
分子原
+
=
子论
;.
11
汤姆生的原子结构模型
“葡萄干面包式”
1897年,汤姆生发现原子中存在电子,用实验方法测出电子的质量,并确定了质荷 比
正电荷均匀地分布在原子之中,电子则散布在正电荷之中。
;.
12
;.
13
科学探究
体积很小相 对质量为4的 带正电粒子
1911年卢现瑟象福:通过实验推断出: 1、原子大1部、分大是部空分的α粒。子穿过薄的金箔 2、中间有2一、个极几少乎数集α粒中子了好所象有打原在子坚的硬质的量东且西体上积,很完小全的反粒弹子回—来—。原子核。 3、电子随3意、地少围数绕α粒着子一穿个过带薄正的电金荷箔的时很,小发的生原了子偏核转运。转。
+11 2 8 1
+17 2 8 7
;.
37
原子结构与元素性质的关系
(1)金属元素原子最外层一般少于4个电子,在反应中易失去电子, 形成与稀有气体元素原子相同的电子层排布的阳离子(稳定结构)。 (2)非金属元素原子最外层一般超过4个电子,在反应中易得到电子, 形成与稀有气体元素原子相同的电子层排布的阴离子(稳定结构)。 (3)原子核在反应中不发生变化,原子的最外层电子数可能发生变化, 元素的化学性质取决于原子的最外层电子。 元素化合价与得失电子数目的关系: (1)金属元素为正化合价,失去电子的数目即为化合价的数值。 (2)非金属元素既可以为正化合价也可以为负化合价,活泼非金属元 素的最低负化合价的数值即为得到电子的数目。 元素化合价与最外层电子数目的关系: ①活泼金属元素化合价=__原子最外层电子数 ②非金属元素的最低价=_原子最外层电子数-8
人类对原子结构的认识——原子结构模型的演变

人类对原子结构的认识——原子结构模型的演变人类对原子结构的认识是一个逐步演变的过程。
从古希腊时期开始,人们对原子的概念就存在一定的认识,但是直到近代才逐渐了解原子的真正本质和结构。
本文将从古希腊时期的原子概念开始,主要介绍原子结构模型的演变过程,包括汤姆逊模型、卢瑟福模型和波尔模型,直到现代的量子力学模型。
古希腊时期,由于实验条件的限制,人们对原子的概念还比较朦胧。
古代哲学家德谟克利特首次提出“原子”的概念,原子是构成世界万物的最基本单位,它们具有不可分割的性质。
然而,这仅仅是一种哲学上的假设,没有经过科学实验的验证。
到了19世纪末,随着科学实验技术的进步,科学家对原子的理解逐渐深入。
在这个时期,英国科学家约翰·道尔顿提出了道尔顿原子论。
他认为,所有物质都是由不可分割的小颗粒(道尔顿原子)构成的,每种物质由不同类型的原子组成。
这个理论为解释化学反应和元素周期性表提供了重要的基础。
然而,到了20世纪初,科学家们发现了一些无法用道尔顿原子论解释的实验现象。
1904年,英国物理学家汤姆逊提出了汤姆逊模型,也被称为“葡萄干糕布模型”。
他认为,原子是一个正电荷球体,而电子则均匀地分布在球体内部,就像葡萄干糕布一样。
这个模型解释了电子的存在和负电荷,但没有考虑到原子中的正电荷分布。
1909年,英国物理学家卢瑟福进行了著名的金箔散射实验,这个实验改变了人们对原子结构的认识。
实验结果表明,大部分α粒子通过金箔而无明显偏转,但一小部分α粒子发生了大角度的散射。
基于这个实验结果,卢瑟福提出了卢瑟福模型,也被称为“太阳系模型”。
他认为,原子是由一个小而密集的带正电荷的核心,以及围绕核心运动的电子组成。
这个模型解释了实验结果,卢瑟福还通过核和电子的质量和电荷比计算出了核的大小。
然而,卢瑟福模型仍然存在一些问题。
根据经典电磁理论,一个加速的电子应该会辐射能量并从核中坠落,但事实上我们并没有看到这种现象。
为了解决这个问题,1913年,丹麦物理学家尼尔斯·波尔提出了波尔模型。
卢瑟福原子模型1

揭开原子核内部结构的一种科学方法:
用高能量的粒子撞击、打碎核的方法进行研究。
原子电中性的原因:原子核所带的正电荷与核 外电子所带的负电荷电量大小相等、电性相反。
想一想:氧原子中有8个电子,那么原子核 所带的正电荷数为 8 个。
三、揭开原子核的秘密:
1、揭开原子核内部结构的一种科学方法:
用高能量的粒子撞击核的方法进行研究。
2、原子核的结构: 质子
原子核
中子
如:一种氧原子的原子核就由 8个质子和8个中子构成的
1.道尔顿原子模型 (1803年) 2.汤姆生原子模型 (1897年) 实心球模型 西瓜模型 (枣糕模型)
3.卢瑟福原子模型 (1911年)
4.玻尔原子模型 (1913年) 5.现代原子模型 (1927年)
核式结构模型
分层模型 电子云模型
英国化学家道尔顿 (J.Dalton , 1766~1844)
经测定:质子带正电(一个质子带一个单位的正电荷)
中子不带电
2、原子核的结构: 质子 (每个质子带一个单位的正电荷) 原子核
(+)
中子
思考:氧原子核内有8个质子,则氧原子核带几个单 位的正电荷呢? 8个单位的正电荷(+8) 核电荷数:原子核所带的电荷数
核电荷数=质子数
几个重要概念: 1. 核电荷数:原子核所带的电荷数。 2. 质子数:原子核内质子所带的正电荷数。 3. 中子数:原子核内中子的数目。 4. 核外电子数:原子核外电子所带的负电荷数。
思考:
原子种类 氢原子
在一个原子中哪些项目的数目总是相等的?
核电荷数 1 质子数 1 中子数 0 核外电子数 1
氦原子
碳原子 氮原子 铝原子
2
原子结构模型的演变
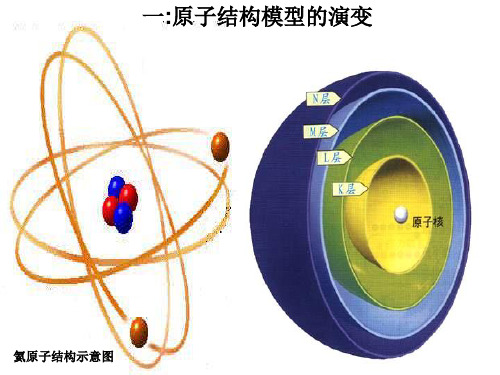
7
3、原子核外电子排布规律 ① 能量最低原理:先排K层,排满K层后再排L层. ②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过 2个)
次外层最多只能容纳18个电子(K层为次外层时不能超 过2个
倒数第三层最多只能容纳32个电子
注意:多条规律必须同时兼顾。
精选ppt课件
8
失去电子
+12 2 8 2
+12 2 8
Mg
Mg2+
得到电子
+8 2 6
+8 2 8
O
O2-
精选ppt课件
9
结 论 1、活泼金属元素易失电子变为带正电荷的
阳离子
Mg 失 2e-
Mg2+(带2个单位正电荷)
2、活泼非金属元素易得电子变为带负电 荷的阴离子
O 得 2e-
O2(- 带2个单位负电荷)
12
问题解决
①金属最外层电子数﹤4时,易失去电子
原子
(化合价=+失去的电子数目)
②非金属最外层电子数≥4时,易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去 或得到的电子数目(失为正,得为负)
精选ppt课件
13
小结:
1 原子结构模型的演变 道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数 目和该原子的最外层电子数目,推断其氧化物和氯化物中 元素的化合价,将结果填入下表: 一些元素的原子得失 电子的情况
元素
Na Mg O Cl
化合价
+1 +2 -2
-1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子结构模型发展史
河北省河间市第一中学陈之普
(1)1808年,道尔顿模型:原子是一个坚硬的小球。
英国自然科学家约翰·道尔顿提出了世界上第一个原子的理论模型。
他的理论主要有以下三点:
①原子都是不能再分的粒子;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。
虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家努力的方向,化学真正从古老的炼金术中摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。
(2)1897年,汤姆逊模型:原子是一个带正电荷的球,电子镶嵌在里面,原子好似一块“葡萄干布丁”。
“葡萄干布丁”模型由汤姆逊提出,是第一个存在着亚原子结构的原子模型。
汤姆逊在发现电子的基础上提出了原子的“葡萄干布丁”模型。
汤姆逊认为:
①电子是平均分布在整个原子上的,就如同散布在一个均匀的带正电荷的海洋之中,它们的负电荷与那些正电荷相互抵消;②在受到激发时,电子会离开原子,产生阴极射线。
汤姆逊的学生卢瑟福的α粒子轰击金箔实验(散射实验),否认了“葡萄干布丁”模型的正确性。
(3)1911年,卢瑟福模型:原子的大部分体积是空的,电子按照一定轨道围绕着一个带正电荷的很小的原子核运转。
行星模型是由卢瑟福提出的,以经典电磁学为理论基础,主要内容有:
①原子的大部分体积是空的;②原子的中心有一个很小的原子核;③原子的全部正电荷在原子核内,且几乎全部质量集中在原子核内部;带负电的电子在核空间进行绕核运动。
(4)1913年,玻尔模型:电子不是随意占据在原子核的周围,而是在固定的层面上运动,当电子从一个层面跃迁到另一个层面时,原子便吸收或释放能量。
为了解释氢原子线状光谱这一事实,玻尔在行星模型的基础上提出了核外电子分层排布的原子结构模型。
玻尔原子结构模型的基本观点是:
①原子中的电子在具有确定半径的圆周轨道上绕原子核运动,不辐射能量。
②在不同轨道上运动的电子具有不同的能量,且能量是量子化的,轨道能量值依n(1,2,3……)的增大而升高,n称为量子数。
而不同的轨道则分别被命名为K(n=1)、L(n=2)、
M(n=3)、N(n=4)、O(n=5)……。
③当且仅当电子从一个轨道跃迁到另一个轨道时,才会辐射或吸收能量。
如果辐射或吸收的能量以光的形式表现并被记录下来,就形成了光谱。
(5)20世纪20年代以来,现代模型(电子云模型):电子绕核运动形成一个带负电荷的云团,在一个确定电子的时刻不能精确测定电子的确切位置。
